Page Not Found | European Lung Foundation
Sorry about that! Something went a little wrong there and we’ve encountered some kind of problem.
You can either click «Back» in your browser and try again, choose something else from the menu, or drop us a line to let us know there’s a problem.
Alternatively, we’ve had a look around the site for what you seem to be looking for and have found the following results:
По вашему запросу ничего не найдено. Попробуйте ввести похожие по смыслу слова, чтобы получить лучший результат.
Our projects
AirPROM
AirPROM (Airway Disease Predicting Outcomes through Patient Specific Computational Modelling) brings together experts and current research to build a computational model of the lung as a new way of characterising asthma and COPD. (Website in English)
DRAGON
DRAGON will use artificial intelligence (AI) and machine learning to deliver a decision support system for precise coronavirus diagnosis using CT scanning.

A full project website will be available in early 2021. See below for information about the work packages, project partners and how to get involved.EARIP
Bringing together experts to define how to reduce asthma deaths and hospitalisations across Europe. A ‘roadmap’ of priorities for clinicians, researchers, industry, and patient groups will be used to persuade EU funding policy makers to invest in asthma.
Healthy Lungs for Life
Healthy Lungs for Life is one of the largest ever lung health campaigns, raising awareness of the importance of healthy lungs through a full range of events, projects and promotional activities.
Four themes are highlighted as part of the campaign: breathing clean air, quitting smoking, vaccination and being active.SmokeHaz
SmokeHaz is a collaboration between the European Respiratory Society (ERS), European Lung Foundation (ELF) and the UKCTAS.
 The organisations joined forces to provide a website aimed at policy makers focused on the respiratory health hazards associated with smoking.
The organisations joined forces to provide a website aimed at policy makers focused on the respiratory health hazards associated with smoking.U-BIOPRED
A large scale public-private research initiative. Information and samples from more than 1,000 adults and children are being used to learn more about different types of asthma to ensure better diagnosis and treatment for each person. (Website in English)
Lung cancer patient priorities
FRESH AIR
FRESH AIR is an EU Horizon 2020 project which aims to improve the health of people at risk of or suffering from chronic lung conditions in countries where resources are limited, such as Uganda, Vietnam, the Kyrgyz Republic and Greece. By training local healthcare professionals in these countries, FRESH AIR will introduce effective actions for preventing, diagnosing and treating lung conditions. Smoke and indoor pollution are specific areas that the project will focus on.

3TR
3TR is the largest IMI project yet, focussing on diseases autoimmune, inflammatory and allergic diseases including COPD and asthma. The project aims to provide insights into mechanisms of response and non-response to treatment across different diseases.
Рак легких: лечение заболевания | Клиника Рассвет
Быстрый переход
Рак легких стоит на первом месте по заболеваемости злокачественными опухолями в России у мужчин и на третьем у женщин.
В то же время рак легких занимает первое место в структуре смертности населения (В РФ в 2017 году заболело 62175 человек и погибло 50186 человек). Такая же статистика наблюдается во всем мире. Это означает, что проблемы скрининга, ранней диагностики и лечения рака легких актуальны в России как нигде. Этим во многом обусловлены те успехи, которые наблюдаются у нас в последние годы.
Три ключевых факта профилактики и предотвращения заболевания раком легких:
- Наибольший «вклад» в распространенность рака легких внесло курение, являющееся главной причиной развития рака легких (и одной из важных причин ряда других злокачественных опухолей).

- Смертность от рака легких в последнее время постепенно снижается в развитых странах, во многом благодаря снижению курящего населения и популяризации здорового образа жизни.
- Существует эффективный скрининг рака легких. В странах, где он имеется (в России, к сожалению, пока нет), по последним данным снижает смертность от этого заболевания у пациентов с высоким риском на 44%, то есть у лиц старше 55 лет, курящих более 30 лет по пачке в день. Если быть точнее, то у мужчин на 26%, а у женщин до 61% на основании завершившегося исследования NELSON.
Разновидности рака легких
Рак легких принципиально подразделяется на две большие группы:
- Немелкоклеточный рак легких (НМРЛ)
- Мелкоклеточный рак легких
Это важное разделение, так как говоря простым языком, это совершенно разные заболевания. Мелкоклеточный рак, форма относительно не частая, встречающаяся примерно в 10% всех случаев рака легких.
Немелкоклеточный рак легких включает в себя наиболее часто встречаемые формы аденокарцинома, плоскоклеточный рак, и более редко встречаемый крупноклеточный рак. Также среди опухолей легких редко встречаются карциноид, лимфома и другие опухоли, рассматриваемые отдельно.
Диагностика рака легких
Диагностика рака легких, помимо стандартных обследований, включающих анализы крови и оценку общего состояния пациента, состоит из следующих процедур:
- Лучевых методов диагностики – (КТ грудной клетки и брюшной полости с в/в контрастированием, в ряде случаев при определенных симптомах может понадобиться МРТ головного мозга).
- Эндоскопических методов диагностики – бронхоскопии, во время которой может быть выполнена биопсия.
- Хирургических методов диагностики, включающих трансторакальную биопсию под УЗ или КТ–контролем.
- Медиастиноскопиии.
- Радионуклидной диагностики, включающей остеосцинтиграфию и ПЭТ – КТ.

Учитывая последние достижения в лечении крайне важным является патоморфологическая диагностика, включающая гистологическое, иммуногистохимическое и молекулярно–генетическое исследования для определения морфологического подтипа.
Лечение рака легких
Лечение рака легких включает в себя хирургическое лечение, химиотерапию, иммунотерапию и лучевую терапию, а также их комбинации.
Объем и последовательность лечения определяются с учетом распространенности заболевания, морфологического подтипа и состояния здоровья пациента. Тактика определяется на мультидисциплинарном консилиуме с участием химиотерапевта, радиотерапевта и хирурга.
Рекомендации врача-онколога клиники Рассвет по раку легких
В отделении онкологии клиники Рассвет проводится современная химиотерапия и иммунотерапия рака легких, а также весь спектр диагностики, включая биопсию и современную патоморфологическую диагностику.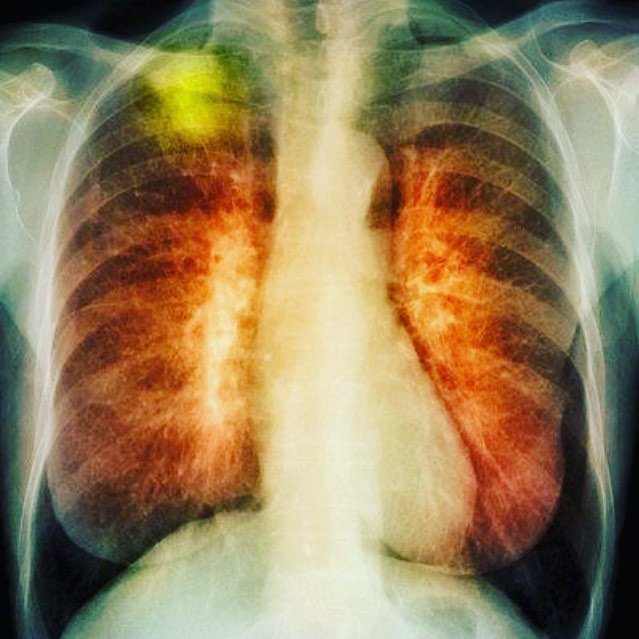
Также мы работаем в партнерстве с центром лучевой терапии, что позволяет нам проводить облучение на современных линейных ускорителях Varian True Beam.
Современная таргетная терапия может осуществляться даже у очень ослабленных пациентов, а наша команда специалистов проводит всю необходимую сопроводительную терапию.
Автор:
Рак лёгких | Заболевание. Факторы риска. Симптомы рака лёгких
Рак лёгкого – это злокачественная опухоль. Злокачественная – потому, что она мешает организму правильно работать и может быть опасна для жизни. Различают два основных вида заболевания: мелкоклеточный и немелкоклеточный рак лёгкого. Свои названия они получили из-за различий в строении опухоли.
Клетки мелкоклеточного рака лёгкого меньше здоровых клеток. Врачам важно отличить именно этот вид рака от остальных, потому что его лечение отличается. А остальные раки – плоскоклеточный, аденокарцинома – объединяют под единым термином: немелкоклеточный рак лёгкого.
А остальные раки – плоскоклеточный, аденокарцинома – объединяют под единым термином: немелкоклеточный рак лёгкого.
Рак лёгких занимает второе место по распространённости среди злокачественных опухолей (на первом месте – рак молочной железы). А для мужчин рак лёгкого на по распространённости первом месте. Заболевание редко встречается до 40 лет, чаще всего его обнаруживают в возрасте около 70.
Причина рака лёгкого
Как и любой другой рак, рак лёгких вызван «поломкой» в нормальном процессе роста и развития клеток. В конкретном случае нарушается процесс образования клеток, которые выстилают бронхи и лёгкие.
Точная причина «поломок» неизвестна. Однако известны факторы, которые увеличивают риск развития рака легкого.
Вот факторы риска:
- курение (активное и пассивное) – увеличивает вероятность рака легких в 15 раз по сравнению с никогда не курившими людьми! 72% рака легкого вызвана курением
- работа с асбестом и другими химикатами (мышьяк, хром, никель, сажа, смола), длительное воздействие ионизирующего излучения (радона в шахтах).
 Вредная работа вызывает 13% рака легкого.
Вредная работа вызывает 13% рака легкого. - загрязнение атмосферного воздуха. Вызывает 8% рака легкого
- радиолучевая терапия на область груди в прошлом
- наличие рака лёгких в прошлом (это риск рецидива)
- возраст старше 65 лет
Как снизить риск рака легких.
Важнее всего – отказаться от курения и постараться снизить воздействие других факторов, если они есть.
Новые в лечении рака легких
Учёные-онкологи из Российского онкологического научного центра им. Н.Н. Блохина РАМН поделились сенсационной новостью. Разработанная ими новейшая технология позволяет намного эффективнее лечить больных раком лёгкого. Аналогов в мире нет.
Суть в том, что учёные теперь могут создавать портрет каждой конкретной опухоли, раскрывая все её индивидуальные черты. С онкологичеcким заболеванием сложно бороться из-за его непредсказуемости – может замереть на годы или вдруг погубить за считанные месяцы. Но оказалось – нет, предсказать реально. И даже подобрать особое для каждого случая лечение. Это доказали российские онкологи.
Но оказалось – нет, предсказать реально. И даже подобрать особое для каждого случая лечение. Это доказали российские онкологи.
О новом подходе рассказал Константин Лактионов, д. м. н., руководитель отделения клинических биотехнологий.
Не ждать, а лечить
Константин Константинович, зачастую онкологи говорят: сделали всё возможное, а болезнь повела себя непредсказуемо.
К. Л.: – Сегодня такого быть не должно. По крайней мере, в отношении рака лёгкого. У нас в руках есть метод, который позволяет с максимальной точностью предсказать, будет ли болезнь быстро прогрессировать и давать метастазы или пациент выздоровеет после операции. До сих пор при I-II стадиях рака лёгкого в первую очередь рассматривали возможность его хирургического удаления. Но примерно каждый четвёртый всё равно погибал из-за развития метастазов. Почти 20 лет нам понадобилось, чтобы в этом разобраться. Мы разработали методику, позволяющую с математической точностью предсказывать судьбу конкретного больного, т. е. дающую врачам возможность понять и опередить болезнь. Более того, изучив опухолевый материал, предложить лечение не по шаблону, а подходящее конкретному человеку. Сегодня зачастую назначают просто те препараты, которые есть в данной клинике.
е. дающую врачам возможность понять и опередить болезнь. Более того, изучив опухолевый материал, предложить лечение не по шаблону, а подходящее конкретному человеку. Сегодня зачастую назначают просто те препараты, которые есть в данной клинике.
Высшая правда
И даже самые современные лекарства показаны не всем?
К. Л.: – Да. Недавно появились таргетные (от англ. target – «цель») препараты. И эти лекарства начали в регионах назначать всем подряд. Да, они почти вдвое (с 40-45 до 80-90%) повышают эффективность терапии. Но только если в опухоли есть клетки, несущие мутации, заставляющие её неконтролируемо расти. Если мутации не выявлены, назначать их бесполезно. И пока доктор и больной поймут, что лечение неэффективно, будут потеряны драгоценные 3-4 месяца. А стоит таргетная терапия в разы выше стандартной химиотерапии. К слову, те самые мутации чаще выявляются у некурящих больных раком лёгкого. У курильщиков в 90% случаев развивается другой рак, спровоцированный никотином. И в этом есть какая-то высшая правда: именно опухоли «некурильщиков» мы научились наиболее эффективно лечить.
И в этом есть какая-то высшая правда: именно опухоли «некурильщиков» мы научились наиболее эффективно лечить.
Могут ли в регионах воспользоваться новой технологией?
К. Л.: – Безусловно. После биопсии или операции кусочек опухоли заливают в парафин и отправляют к нам на исследование. По результатам молекулярно-генетического анализа формируется индивидуальный биологический паспорт опухоли, отражающий агрессивность течения заболевания и чувствительность опухоли к разным химиопрепаратам. Мы даём рекомендации, нужно ли дополнять операцию лекарствами и какими. Так что если, не дай бог, с вами или близкими случилась беда, перед началом лечения обязательно поговорите о такой возможности со своим лечащим врачом.
Можно узнать, кто заболеет?
К. Л.: – Наверняка пока нет. Поэтому всем желательно раз в год проходить диспансеризацию, в том числе рентген лёгких. К сожалению, у 75% пациентов рак лёгкого выявляется на III-IV стадиях, ведь болезнь долгое время может протекать бессимптомно или проявляться неспецифически – слабостью, кашлем, высокой температурой, потерей веса, иногда кровохарканьем. Человека могут долго лечить от пневмонии, туберкулёза, забывая о том, что за этим может скрываться злокачественная опухоль. Главное – не заниматься самолечением, а обратиться к специалистам.
Человека могут долго лечить от пневмонии, туберкулёза, забывая о том, что за этим может скрываться злокачественная опухоль. Главное – не заниматься самолечением, а обратиться к специалистам.
Онкология
Категория: Здоровье от «А» до «Я».
Что такое рак легких?
Рак легких ежегодно уносит миллионы жизней — больше, чем любое другое онкологическое заболевание. Ему подвержены не только курильщики. И вопреки бытующему мнению о неизлечимости рака, рак легких можно не только вылечить, но и предотвратить. Резкий скачок заболеваемости раком легких случился в 40-х годах прошлого столетия, когда в моду вошло курение. Через двадцать лет произошел новый скачок — сексуальная революция причислила к рядам курильщиков и, как следствие, болеющих раком легких колоссальное количество женщин.
Общие сведения
Рак легких обычно начинается с развития злокачественной опухоли в бронхах (их насчитывается более 20 видов). По мере роста она трансформируется в рак легкого. По типу рак легких может быть немелкоклеточным и мелкоклеточным. Немелкоклеточный рак легких имеет три подвида: плоскоклеточный рак легких, аденокарцинома, крупноклеточный рак. Могут также встречаться смешанные типы рака. К счастью, это бывает редко. Немелкоклеточный рак легких. Плоскоклеточный рак легкого развивается в клетках центральных бронхов, самых больших ветках бронхиального дерева. Почти треть заболеваний раком легких — это плоскоклеточный рак, причем мужчины болеют им чаще женщин. Кроме того, плоскоклеточный рак легко излечим на ранних стадиях, так как он имеет медленные темпы роста и не почти не дает метастазов в другие органы. Аденокарцинома — самый распространенный тип рака легких, почти 40% всех случаев заболеваний раком легких приходится на него.
По мере роста она трансформируется в рак легкого. По типу рак легких может быть немелкоклеточным и мелкоклеточным. Немелкоклеточный рак легких имеет три подвида: плоскоклеточный рак легких, аденокарцинома, крупноклеточный рак. Могут также встречаться смешанные типы рака. К счастью, это бывает редко. Немелкоклеточный рак легких. Плоскоклеточный рак легкого развивается в клетках центральных бронхов, самых больших ветках бронхиального дерева. Почти треть заболеваний раком легких — это плоскоклеточный рак, причем мужчины болеют им чаще женщин. Кроме того, плоскоклеточный рак легко излечим на ранних стадиях, так как он имеет медленные темпы роста и не почти не дает метастазов в другие органы. Аденокарцинома — самый распространенный тип рака легких, почти 40% всех случаев заболеваний раком легких приходится на него.
В последние годы число заболевших им увеличивается в основном за счет некурящих женщин. Аденокарцинома чаще всего развивается между легкими и стенкой грудной клетки, что делает обнаружение данного вида рака на ранних стадиях затруднительным. Крупноклеточный рак. Получил свое название из-за клеток, легко различимых под микроскопом. Типичное место развития — вдоль внешних краев легких. Число заболевших — 10–15% от всех случаев. К несчастью, данный вид рака имеет высокую тенденцию к метастазированию в соседние с легкими лимфоузлы и другие органы, что на поздних стадиях делает его практически неизлечимым. Мелкоклеточный рак легких. Мелкоклеточный рак легких – самая агрессивная форма рака из всех существующих. Его также называют раком овсяного зерна — из-за того, что по форме его клетки напоминают овсяное зерно. Как и плоскоклеточный рак, он развивается в основном в центральных каналах бронхов. Увы, на ранних стадиях он не выдает себя никакими симптомами и не может быть диагностирован. У 75% болеющих этим типом рака легкого он был диагностирован лишь на этапе метастазирования. Метастазирует он в мозг, печень, костные ткани, характеризуется крайне высокими темпами роста, плохо поддается лечению.
Крупноклеточный рак. Получил свое название из-за клеток, легко различимых под микроскопом. Типичное место развития — вдоль внешних краев легких. Число заболевших — 10–15% от всех случаев. К несчастью, данный вид рака имеет высокую тенденцию к метастазированию в соседние с легкими лимфоузлы и другие органы, что на поздних стадиях делает его практически неизлечимым. Мелкоклеточный рак легких. Мелкоклеточный рак легких – самая агрессивная форма рака из всех существующих. Его также называют раком овсяного зерна — из-за того, что по форме его клетки напоминают овсяное зерно. Как и плоскоклеточный рак, он развивается в основном в центральных каналах бронхов. Увы, на ранних стадиях он не выдает себя никакими симптомами и не может быть диагностирован. У 75% болеющих этим типом рака легкого он был диагностирован лишь на этапе метастазирования. Метастазирует он в мозг, печень, костные ткани, характеризуется крайне высокими темпами роста, плохо поддается лечению.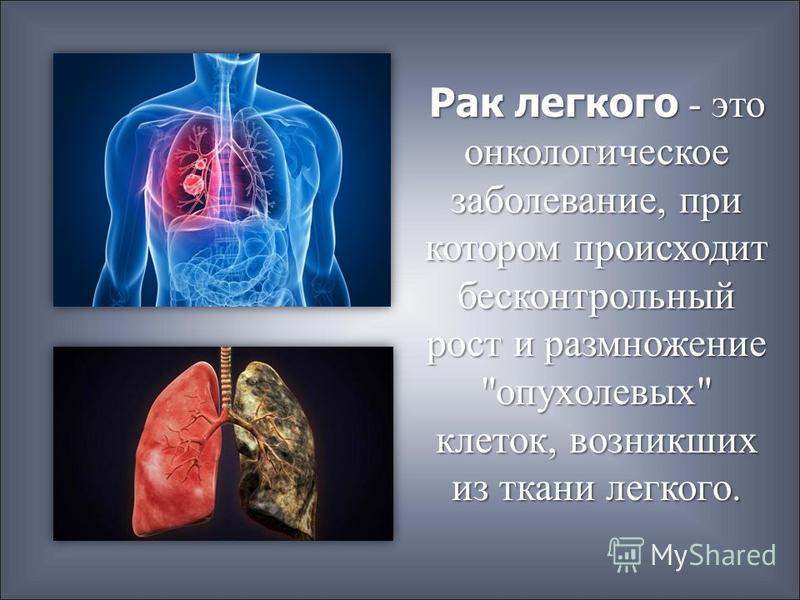 От мелкоклеточного рака легких умирают более 1 млн человек в год.
От мелкоклеточного рака легких умирают более 1 млн человек в год.
Почему он появляется
В 85% случаев рак легких связан с генетической предрасположенностью и патологическим пристрастием к табакокурению. Так, недавние исследования американских ученых доказали, что риск заболеть раком легких тем выше, чем более человек к этому предрасположен. Им даже удалось идентифицировать некоторые генетические качества, делающие человека более восприимчивым к канцерогенным веществам, содержащимся в табачном дыме.
К оглавлению
Профилактика рака легкого. Отказ от курения.
Смертность от рака легкого снижается во всех развитых странах. Однако в России этот показатель все еще высок. В России смертность от этой нозологии начала снижаться с первой половины 90-х годов прошлого века и уменьшилась более чем в 1,5 раза (с 75 до 45 случаев на 100 тыс. населения). Во многих регионах России смертность от рака легкого у мужчин выше, чем в большинстве стран мира. Женская смертность от рака легкого в России все еще очень низка, так как российские женщины начали курить значительно позже, чем мужчины. В России курение является причиной смерти в 90% всех случаев рака легкого у мужчин. Число случаев рака легкого у женщин, причиной которого является курение, невелико. В странах же, где женщины начали курить раньше, курение является причиной 65—75% случаев рака легкого. К другим факторам риска относятся воздействие радона в жилых помещениях, профессиональные факторы, канцерогенные вещества, образующиеся в результате горения твердых видов топлива, особенности питания. Риск рака легкого, связанный с воздействием этих факторов, выше у курящих, чем у некурящих.
Женская смертность от рака легкого в России все еще очень низка, так как российские женщины начали курить значительно позже, чем мужчины. В России курение является причиной смерти в 90% всех случаев рака легкого у мужчин. Число случаев рака легкого у женщин, причиной которого является курение, невелико. В странах же, где женщины начали курить раньше, курение является причиной 65—75% случаев рака легкого. К другим факторам риска относятся воздействие радона в жилых помещениях, профессиональные факторы, канцерогенные вещества, образующиеся в результате горения твердых видов топлива, особенности питания. Риск рака легкого, связанный с воздействием этих факторов, выше у курящих, чем у некурящих.
В онкологии различают три вида профилактики: первичную, вторичную и третичную. Под первичной профилактикой понимают систему мер, направленных на предотвращение заболевания путем устранения причин его возникновения. К наиболее распространенным мерам первичной профилактики, которая должна быть доминирующей, относятся пропаганда здорового образа жизни и питания, пропаганда вреда курения и употребления алкоголя, снижение воздействия канцерогенных веществ, лечение хронических заболеваний (хронические неспецифические заболевания легких, хронический бронхит, пневмокониозы, туберкулез), на фоне которых значительно возрастает риск развития злокачественных опухолей.
К вторичной профилактике относят совокупность мер, направленных на пресечение или ослабление уже возникшего в организме патологического процесса и предупреждение на этом фоне тяжелых и прогностически неблагоприятных заболеваний. Иными словами, вторичная профилактика призвана остановить течение болезни на ранней стадии. Типичным представителем вторичной профилактики являются социальные скрининговые программы (маммографический скрининг рака молочной железы, цитологический скрининг рака шейки матки, лечение полипов толстой кишки).
Кроме того, существует понятие третичной профилактики рака, предусматривающее использование методов раннего выявления прогрессирования опухолевого процесса после завершения первичного лечения.
Скрининг (англ. Screening, от screen — просеивать, сортировать, отбирать) определяют как массовое обследование населения с целью выявления лиц с наличием определенного заболевания при отсутствии клинических симптомов. Morrison A. (1992) определил понятие «скрининг», как обследование не имеющей симптомов популяции с целью выявления рака в более ранней стадии, чем при отсутствии скрининга. Основной целью онкологического скрининга является снижение смертности больных, а непосредственным результатом — обнаружение рака на доклиническом его проявлении. Именно поэтому скрининг не является диагностической процедурой, когда уже существуют клинические признаки болезни. Одной из главных задач скрининга считается формирование контингентов (групп риска), имеющих наибольшую вероятность заболевания и подлежащих диагностическим исследованиям с целью отбора лиц, действительно являющихся носителями данной патологии.
Morrison A. (1992) определил понятие «скрининг», как обследование не имеющей симптомов популяции с целью выявления рака в более ранней стадии, чем при отсутствии скрининга. Основной целью онкологического скрининга является снижение смертности больных, а непосредственным результатом — обнаружение рака на доклиническом его проявлении. Именно поэтому скрининг не является диагностической процедурой, когда уже существуют клинические признаки болезни. Одной из главных задач скрининга считается формирование контингентов (групп риска), имеющих наибольшую вероятность заболевания и подлежащих диагностическим исследованиям с целью отбора лиц, действительно являющихся носителями данной патологии.
В 1970-е годы была изучена возможность диагностики доклинических форм рака легкого на основе анкетирования с целью выявления факторов риска, рентгенографии грудной клетки и цитологического исследования мокроты. Эти исследования совпали с повсеместным распространением табачной продукции. Однако даже такой комплексный подход к организации скрининговой программы с целью снижения смертности от рака легкого не оказался эффективным.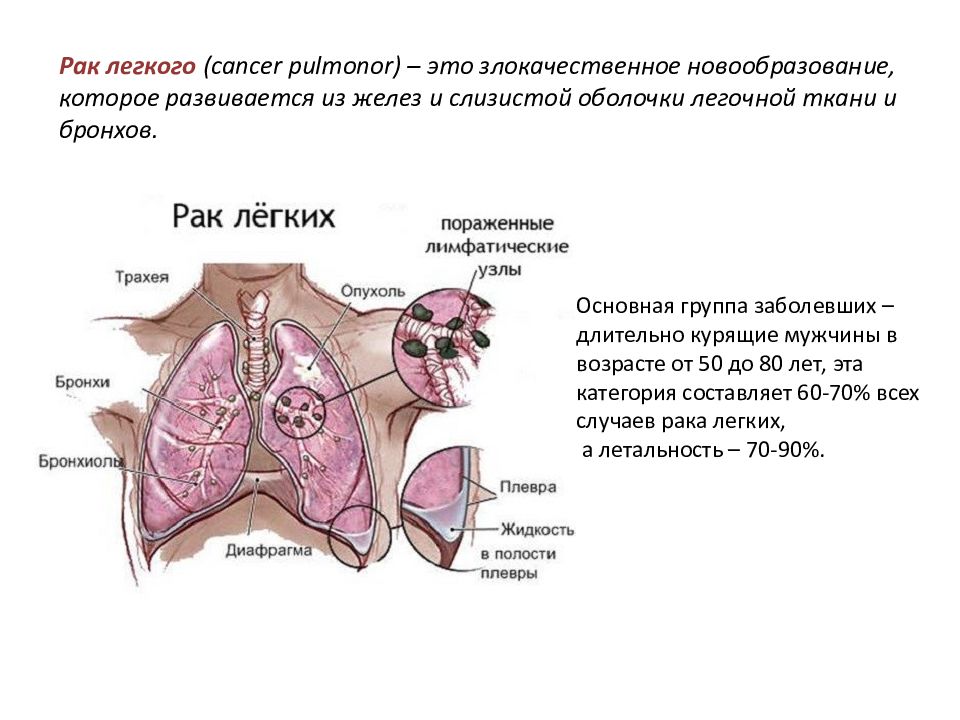 В настоящее время изучается скрининг рака легкого с использованием низкодозовой спиральной компьютерной томографии (эффективная доза – 0,2–1,0 мЗв) в группах риска, что сохраняет жизнь 5 мужчин и 100 женщин на 10 тыс. человек, прошедших его.
В настоящее время изучается скрининг рака легкого с использованием низкодозовой спиральной компьютерной томографии (эффективная доза – 0,2–1,0 мЗв) в группах риска, что сохраняет жизнь 5 мужчин и 100 женщин на 10 тыс. человек, прошедших его.
Одними из самых предотвращаемых хронических заболеваний являются онкологические заболевания. Одной из основных предотвращаемых причин онкологических заболеваний является курение. Табак убивает около 5 млн. человек ежегодно. Успешная борьба с курением позволит предотвратить около 30% онкологических заболеваний, т.е. ежегодно спасать 2 млн. жизней. Табак – единственный товар народного потребления, убивающий большинство своих потребителей. Ежегодно человечество выкуривает около 5600 млрд сигарет. Табак содержит более 4000 химических соединений, 60 из которых являются канцерогенами, в том числе N-нитрозамин (TSNA – Tobacco Specific N-Nitrosamines).
Некоторые из соединений обладают раздражающим действием. Табачный дым содержит следующие соединения, присутствующие в промышленных продуктах.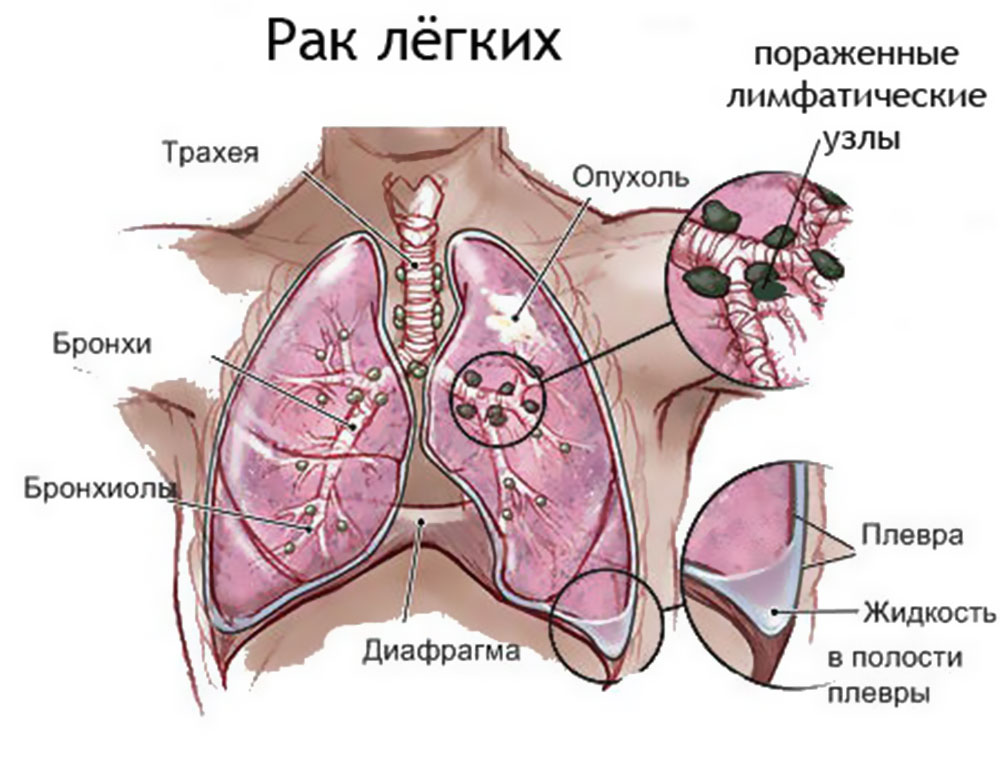
Вредные соединения табачного дыма и их присутствие в промышленных продуктах
(The Tobacco Atlas, Second Edition, American Cancer Society, 2006)
Ацетон Краски
Бутан Топливо для зажигалок
Винилхлорид Пластмассы
ДДТ Инсектицид
Кадмий Автомобильные аккумуляторы
Метанол Ракетное топливо
Мышьяк Инсектицид
Никотин Различные яды
Пропиленгликоль Антифриз
Толуол Промышленный растворитель
Угарный газ Автомобильные выхлопы
Фенол Дезинфектант для туалетов
Формальдегид Раствор для фиксации биоптатов
Цианистый водород (синильная кислота) Газ, используемый в газовой камере
За последние 50 лет произошли значительные изменения качественного состава сигарет. Концентрация смолы в табачном дыме снизилась с 35 мг на одну сигарету в 1950-х годах, до 10-12 мг в конце прошлого века. Вероятно, это привело к снижению риска возникновения рака легкого, связанного с табакокурением. В случае прекращения курения повышенный риск формирования индуцированного курением рака легкого заметно снижается. Положительный эффект проявляется уже в течение 5 лет после отказа от табакокурения, и со временем эта тенденция только улучшается. Через 15 лет после отказа от курения риск возникновения рака легкого приближается к аналогичному показателю среди некурящих, но не достигает его, если человек курил менее 20 лет назад. По мере того, как многие отказываются от табакокурения, среди заболевших раком легкого возрастает доля бывших курильщиков. Риск возникновения злокачественной опухоли зависит от общего числа выкуренных сигарет, что можно отразить в показателе количества пачек в годах. Смертность от рака легкого начинает заметно возрастать после 10 пачек-лет.
Положительный эффект проявляется уже в течение 5 лет после отказа от табакокурения, и со временем эта тенденция только улучшается. Через 15 лет после отказа от курения риск возникновения рака легкого приближается к аналогичному показателю среди некурящих, но не достигает его, если человек курил менее 20 лет назад. По мере того, как многие отказываются от табакокурения, среди заболевших раком легкого возрастает доля бывших курильщиков. Риск возникновения злокачественной опухоли зависит от общего числа выкуренных сигарет, что можно отразить в показателе количества пачек в годах. Смертность от рака легкого начинает заметно возрастать после 10 пачек-лет.
Систематическое курение табака сопровождается становлением и формированием двух основных клинических разновидностей курения: привычки к курению и табачной зависимости. Привычка к курению наблюдается у 7% лиц, курящих табак. Данная разновидность не сопровождается возникновением патологического влечения к курению, определяется только симптомами измененной реактивности организма на вдыхание табачного дыма и после оказания краткосрочной психотерапевтической помощи человек практически самостоятельно прекращает курение. Табачная зависимость официально зарегистрирована в Международной классификации болезней 10 пересмотра в рубрике F1 – Психические расстройства и расстройства поведения, связанные с (вызванные) употреблением психоактивных веществ, в подрубрике F1х.2 – Синдром зависимости; а также F17.3х – Синдром отмены табака; F17.0х – Острая интоксикация, вызванная употреблением табака (острая никотиновая интоксикация). Клиническая картина табачной зависимости включает как симптомокомплекс патологического влечения к табаку, так и динамический ряд гетерономных симптомов и синдромов, патогенетически связанных с преморбидными особенностями личности, в форме аффективных и мыслительных расстройств.
Табачная зависимость официально зарегистрирована в Международной классификации болезней 10 пересмотра в рубрике F1 – Психические расстройства и расстройства поведения, связанные с (вызванные) употреблением психоактивных веществ, в подрубрике F1х.2 – Синдром зависимости; а также F17.3х – Синдром отмены табака; F17.0х – Острая интоксикация, вызванная употреблением табака (острая никотиновая интоксикация). Клиническая картина табачной зависимости включает как симптомокомплекс патологического влечения к табаку, так и динамический ряд гетерономных симптомов и синдромов, патогенетически связанных с преморбидными особенностями личности, в форме аффективных и мыслительных расстройств.
До возникновения у человека никотиновой зависимости употребление любых видов табачной продукции (сигарет, сигар, папирос) на протяжении последних 12 месяцев приводит к нарушениям как в физической (кашель), так и в психической (раздражительность) сферах деятельности. Табакокурение часто подвергается общественной критике и особенно у несовершеннолетних связано с различными негативными социальными последствиями. Однако социальные последствия не являются непосредственным фактором, оказывающим вред физическому здоровью. На этапе привычки человек еще способен самостоятельно и легко прекратить табакокурение, так как физической зависимости от никотина на данном этапе ещё не сформировалось. Длительное табакокурение приводит к формированию зависимости от никотина примерно у 90% курильщиков. При этом у большинства курильщиков довольно скоро развивается и психологическая зависимость. Никотин вызывает выраженную физическую зависимость, сравнимую с наркотической. Возвращение к курению сигарет после периода воздержания приводит к ускоренному проявлению признаков физической зависимости, поскольку она сохраняется даже без активного курения. Синдром отмены никотина проявляется уже через 3-4 часа после отказа от курения. Его проявления достигают пика к 24-28 часам после отмены. Как правило, после отмены табака наблюдаются следующие поведенческие реакции и симптомы: страстное желание покурить, неугомонность; чувство недомогания или слабость; дисфория; раздражительность и нетерпимость, чувство тревоги или беспокойство; бессонница; повышенный аппетит; сильный кашель; головная боль, затруднения концентрации внимания.
Однако социальные последствия не являются непосредственным фактором, оказывающим вред физическому здоровью. На этапе привычки человек еще способен самостоятельно и легко прекратить табакокурение, так как физической зависимости от никотина на данном этапе ещё не сформировалось. Длительное табакокурение приводит к формированию зависимости от никотина примерно у 90% курильщиков. При этом у большинства курильщиков довольно скоро развивается и психологическая зависимость. Никотин вызывает выраженную физическую зависимость, сравнимую с наркотической. Возвращение к курению сигарет после периода воздержания приводит к ускоренному проявлению признаков физической зависимости, поскольку она сохраняется даже без активного курения. Синдром отмены никотина проявляется уже через 3-4 часа после отказа от курения. Его проявления достигают пика к 24-28 часам после отмены. Как правило, после отмены табака наблюдаются следующие поведенческие реакции и симптомы: страстное желание покурить, неугомонность; чувство недомогания или слабость; дисфория; раздражительность и нетерпимость, чувство тревоги или беспокойство; бессонница; повышенный аппетит; сильный кашель; головная боль, затруднения концентрации внимания. Выраженность описанных поведенческих реакций и симптомов обычно снижается через 2-3 недели, но повышенный аппетит в сочетании со сниженной концентрацией внимания, могут оставаться в течение нескольких месяцев. Поскольку никотин является веществом, к которому развивается привыкание, при сокращении числа выкуриваемых сигарет или при переходе на так называемые «легкие» сигареты, можно изменить манеру курения с целью максимально эффективного всасывания никотина в организме, что достигается, например, более глубоким затягиванием. Никотин оказывает воздействие на центральную нервную систему за счет сродства к никотиновому подтипу рецепторов ацетилхолина – основного нейромедиатора ЦНС. Примерно 25% никотина, попадающего в организм при курении, поступает в кровоток и уже через 15 секунд проникает в головной мозг. Таким образом, по скорости воздействия на мозг никотин сопоставим с наркотическими средствами, вводимыми в организм внутривенно. Одной из особенностей, обуславливающих возникновение пристрастия к табаку, является высокая скорость его распада (50% за 2 часа).
Выраженность описанных поведенческих реакций и симптомов обычно снижается через 2-3 недели, но повышенный аппетит в сочетании со сниженной концентрацией внимания, могут оставаться в течение нескольких месяцев. Поскольку никотин является веществом, к которому развивается привыкание, при сокращении числа выкуриваемых сигарет или при переходе на так называемые «легкие» сигареты, можно изменить манеру курения с целью максимально эффективного всасывания никотина в организме, что достигается, например, более глубоким затягиванием. Никотин оказывает воздействие на центральную нервную систему за счет сродства к никотиновому подтипу рецепторов ацетилхолина – основного нейромедиатора ЦНС. Примерно 25% никотина, попадающего в организм при курении, поступает в кровоток и уже через 15 секунд проникает в головной мозг. Таким образом, по скорости воздействия на мозг никотин сопоставим с наркотическими средствами, вводимыми в организм внутривенно. Одной из особенностей, обуславливающих возникновение пристрастия к табаку, является высокая скорость его распада (50% за 2 часа). Данная особенность приводит к возникновению желания закурить повторно, что и поддерживает формирование зависимости. При потреблении никотина нарушается работа отделов головного мозга, чувствительных к ацетилхолину. С их физиологической деятельностью связаны такие психологические состояния, как настроение, интеллектуальная работоспособность, мышечный тонус, работа внутренних органов, сексуальная потенция у мужчин и характер менструального цикла у женщин; состояние кожи и всех её дериватов потовых, сальных желёз, волосяного покрова; работа сердечно-сосудистой системы. Организм человека борется с состоянием чрезмерного возбуждения никотином за счет уменьшения выработки эндогенного медиатора, ацетилхолина, и снижения чувствительность к нему нейронов. Чем дольше и чаще человек курит, тем сильнее подавляется выработка эндогенного ацетилхолина и снижается чувствительность к нему нервных клеток. Вместе с потерей чувствительности и снижением выработки медиатора соответствующие отделы мозга теряют и свой нормальный физиологический тонус.
Данная особенность приводит к возникновению желания закурить повторно, что и поддерживает формирование зависимости. При потреблении никотина нарушается работа отделов головного мозга, чувствительных к ацетилхолину. С их физиологической деятельностью связаны такие психологические состояния, как настроение, интеллектуальная работоспособность, мышечный тонус, работа внутренних органов, сексуальная потенция у мужчин и характер менструального цикла у женщин; состояние кожи и всех её дериватов потовых, сальных желёз, волосяного покрова; работа сердечно-сосудистой системы. Организм человека борется с состоянием чрезмерного возбуждения никотином за счет уменьшения выработки эндогенного медиатора, ацетилхолина, и снижения чувствительность к нему нейронов. Чем дольше и чаще человек курит, тем сильнее подавляется выработка эндогенного ацетилхолина и снижается чувствительность к нему нервных клеток. Вместе с потерей чувствительности и снижением выработки медиатора соответствующие отделы мозга теряют и свой нормальный физиологический тонус. Таким образом, чтобы обеспечить себе удовлетворительное настроение и работоспособность организму требуется очередная доза никотина. Такая тяга- важнейшая составная часть психической зависимости от табака, хотя в её основе-зависимость нейромедиаторная, физическая. Нейромедиаторная зависимость от никотина-суть общей физической зависимости от табака. Чтобы оценить степень этой зависимости, необходимо учитывать происходящие нарушения нервной трофики. У курильщиков центры мозга, чувствительные к никотину, находятся в угнетённом состоянии, поэтому веществ, необходимых для поддержания нормальной физиологической функции тканей, образуется недостаточно. В результате курения во многих тканях и органах наблюдается нервная дистрофия, а на её фоне возникает предрасположенность к различным заболеваниям. Нарушения нервной трофики при табакокурении весьма разнообразны. Поэтому реальная зависимость от “никотиновой розги” гораздо сильнее, чем это может показаться на первый взгляд. Табачная зависимость-это хроническая рецидивирующая болезнь, требующая в большинстве случаев длительного поддерживающего повторного лечения.
Таким образом, чтобы обеспечить себе удовлетворительное настроение и работоспособность организму требуется очередная доза никотина. Такая тяга- важнейшая составная часть психической зависимости от табака, хотя в её основе-зависимость нейромедиаторная, физическая. Нейромедиаторная зависимость от никотина-суть общей физической зависимости от табака. Чтобы оценить степень этой зависимости, необходимо учитывать происходящие нарушения нервной трофики. У курильщиков центры мозга, чувствительные к никотину, находятся в угнетённом состоянии, поэтому веществ, необходимых для поддержания нормальной физиологической функции тканей, образуется недостаточно. В результате курения во многих тканях и органах наблюдается нервная дистрофия, а на её фоне возникает предрасположенность к различным заболеваниям. Нарушения нервной трофики при табакокурении весьма разнообразны. Поэтому реальная зависимость от “никотиновой розги” гораздо сильнее, чем это может показаться на первый взгляд. Табачная зависимость-это хроническая рецидивирующая болезнь, требующая в большинстве случаев длительного поддерживающего повторного лечения. Лица с зависимостью от никотина, не могут прекратить курение самостоятельно даже тогда, когда осознанно принимают это решение. Доказано, что частота самостоятельного отказа от курения у зависимых лиц не превышает 5%. Они нуждаются в помощи врача и фармакологической терапии, направленной на уменьшение проявлений синдрома отмены. Около 90% взрослых курильщиков пытаются прекратить курить самостоятельно. Причиной этого обычно являются проблемы со здоровьем, забота о здоровье семьи или будущем ребенке, желание быть примером для детей, освобождение от зависимости, давление окружающих и желание улучшить свой внешний вид. В тоже время около 70% отказавшихся от табакокурения возвращаются к пагубной привычке, как правило, в течение 3-х месяцев. После 3 неуспешных самостоятельных попыток прекратить курение рекомендуется обратиться за психотерапевтическим и лекарственным лечением зависимости от никотина. Отказ от курения в 10 раз эффективнее при помощи медицинских работников чем без них. Нелекарственное лечение включает многочисленные программы отказа от курения, основанные на когнитивной и поведенческой психотерапии.
Лица с зависимостью от никотина, не могут прекратить курение самостоятельно даже тогда, когда осознанно принимают это решение. Доказано, что частота самостоятельного отказа от курения у зависимых лиц не превышает 5%. Они нуждаются в помощи врача и фармакологической терапии, направленной на уменьшение проявлений синдрома отмены. Около 90% взрослых курильщиков пытаются прекратить курить самостоятельно. Причиной этого обычно являются проблемы со здоровьем, забота о здоровье семьи или будущем ребенке, желание быть примером для детей, освобождение от зависимости, давление окружающих и желание улучшить свой внешний вид. В тоже время около 70% отказавшихся от табакокурения возвращаются к пагубной привычке, как правило, в течение 3-х месяцев. После 3 неуспешных самостоятельных попыток прекратить курение рекомендуется обратиться за психотерапевтическим и лекарственным лечением зависимости от никотина. Отказ от курения в 10 раз эффективнее при помощи медицинских работников чем без них. Нелекарственное лечение включает многочисленные программы отказа от курения, основанные на когнитивной и поведенческой психотерапии. К видам лекарственной терапии никотиновой зависимости, эффективность которых доказана клиническими исследованиями, относят заместительную никотиновую терапию, антидепрессанты, прежде всего бупропион, и применение частичных (парциальных агонистов) никотиновых рецепторов, прежде всего, препарата варениклин.
К видам лекарственной терапии никотиновой зависимости, эффективность которых доказана клиническими исследованиями, относят заместительную никотиновую терапию, антидепрессанты, прежде всего бупропион, и применение частичных (парциальных агонистов) никотиновых рецепторов, прежде всего, препарата варениклин.
Для того чтобы выбрать правильный способ отказа от курения, необходимо определить степень никотиновой зависимости. Она вычисляется по ежедневному количеству выкуриваемых сигарет или по биохимическим показателям, получаемым в лабораторных условиях. С достаточной точностью можно узнать стадию привыкания к табаку при помощи опросника Фагерштрема (Хорна).
Дыхательные упражнения. Используются как заместительная терапия, для уменьшения физиологической и психологической зависимости от табака. Дыхательные упражнения являются наиболее безопасным вспомогательным средством и подходят даже курильщикам с большим стажем. Они делятся на два типа-успокаивающий и мобилизующий.
Упражнения выполняются в темпе, при котором один счет равняется одной секунде. Первая цифра означает продолжительность вдоха, вторая-выдоха. В скобках приведена продолжительность паузы.
Успокаивающее дыхание
4 _ 4 _ (2), 4 _ 5 _ (2), 4 _ 6 _ (2), 4 _ 7 _ (2), 4 _ 8 _ (2),
4 _ 8 _ (2), 5 _ 8 _ (2), 6 _ 8 _ (3), 7 _ 8 _ (2), 8 _ 8 _ (4),
8 _ 8 _ (4), 7 _ 8 _ (3), 6 _ 7 _ (3), 5 _ 6 _ (2), 4 _ 5 _ (2)
Мобилизующее дыхание
4 _ (2) _ 4, 5 _ (2) _ 4, 6 _ (3) _ 4, 7 _ (3) _ 4, 8 _ (4) _ 4,
8 _ (4) _ 4, 8 _ (4) _ 5, 8 _ (4) _ 6, 8 _ (4) _ 7, 8 _ (4) _ 8,
8 _ (4) _ 8, 8 _ (4) _ 7, 7 _ (3) _ 6, 6 _ (3) _ 5, 5 _ (2) _ 4.
Если эти упражнения трудно выполнять, можно прибегнуть к, так называемому, «собачьему» дыханию через рот в быстром темпе, без глубоких вдохов. В течение нескольких минут это упражнение устраняет напряжение гортани, диафрагмы, а также эмоциональные проявления абстиненции (синдрома отмены).
Акупунктура. Древние медицинские практики также успешно используются для борьбы с курением. Иглоукалывание проводится курсами из 3-5 сеансов по 30 минут. По некоторым сведениям применение данного способа воздействия в 60-70% случаев приводит к отказу от курения. Единственная трудность-перед сеансом акупунктуры пациент 8-10 часов не должен курить. Естественно, для курильщиков с сильной никотиновой зависимостью это практически невыполнимое условие, поэтому данное средство подходит тем, кто набрал менее 4-х баллов по опроснику Хорна.
Иглоукалывание проводится курсами из 3-5 сеансов по 30 минут. По некоторым сведениям применение данного способа воздействия в 60-70% случаев приводит к отказу от курения. Единственная трудность-перед сеансом акупунктуры пациент 8-10 часов не должен курить. Естественно, для курильщиков с сильной никотиновой зависимостью это практически невыполнимое условие, поэтому данное средство подходит тем, кто набрал менее 4-х баллов по опроснику Хорна.
С помощью никотиновой заместительной терапии обеспечивается адекватная замена никотина табака после прекращения курения для устранения синдрома отмены. Это лечение необходимо лицам, которые выкуривают более 20-ти сигарет ежедневно, а также тем, кто выкуривает первую сигарету в течение 30-ти минут после пробуждения, и лицам, уже имевшим неудачные попытки бросить курить (сильное влечение к сигаретам впервую неделю отмены). В настоящее время используют следующие виды никотиновой заместительной терапии:
пластырь, аэрозоли для интраназального (спрэй) или перорального (ингалятор) введения, жевательная резинка, сублингвальные таблетки и леденцы с никотином.
Полный курс лечения никотиновой зависимости длится от 6 до 12 мес. Многие курильщики полностью отказываются от табакокурения после повторных (двух-трех) курсов лечения. Сочетание заместительной терапии с психологической поддержкой или психотерапией, пособиями по самопомощи, повышает частоту отказа от курения. Жевательные резинки рекомендуют к применению в разовой дозе, составляющей 2-4 мг (по 1-2 жевательной резинке) каждые 1-2 ч в течение дня или до 15 резинок в сутки в течение 3 месяцев, затем дозу постепенно снижают до 2-4 мг в сутки и затем отменяют вовсе. Максимальная продолжительность применения 6 месяцев. Для лиц с выраженной зависимостью от никотина выпускаются жевательные резинки с удвоенной дозой (не 2, а 4 мг). Пластырь поддерживает постоянный уровень никотина в крови и незаметен под одеждой, но вызывает раздражение кожи. Пластырь после удаления защитной фольги необходимо прикрепить на чистый сухой участок неповреждённой кожи без волос и удерживать в течение 10—20 с ладонью. Аппликацию его проводят 1 раз в сутки и оставляют на коже в течение суток. Терапию рекомендуют начинать с применения пластыря с меньшим количеством никотина. Применение в течение 16или 24 ч одинаково эффективно на протяжении 8 недель. Продолжительность курса лечения не более 3 мес. Формы для ингаляции применяют при возникновении острого желания закурить для предотвращения рецидива потребления сигарет. Ингалятор по форме напоминает сигарету, и больше подходит тем, кого привлекает ритуал курения. С помощью интраназального аэрозоля никотин быстро попадает в организм, прерывая острые риступы желания закурить. Рекомендуют также сочетать пластырь, поддерживающий фоновую концентрацию никотина в крови, с интраназальным аэрозолем, который будет быстро повышать ее при остро возникающем желании. При использовании заместительной терапии преимуществ у постепенного уменьшения суточных доз никотина по сравнению с его резкой отменой нет. Противопоказаниями для использования никотиновой заместительной терапии являются нестабильная стенокардия, острый инфаркт миокарда, тяжёлые аритмии, недавно перенесённый инсульт, эрозивно-язвенные нарушения ЖКТ в стадии обострения, беременность, грудное вскармливание, возраст до 18 лет и старше 85 лет.
Аппликацию его проводят 1 раз в сутки и оставляют на коже в течение суток. Терапию рекомендуют начинать с применения пластыря с меньшим количеством никотина. Применение в течение 16или 24 ч одинаково эффективно на протяжении 8 недель. Продолжительность курса лечения не более 3 мес. Формы для ингаляции применяют при возникновении острого желания закурить для предотвращения рецидива потребления сигарет. Ингалятор по форме напоминает сигарету, и больше подходит тем, кого привлекает ритуал курения. С помощью интраназального аэрозоля никотин быстро попадает в организм, прерывая острые риступы желания закурить. Рекомендуют также сочетать пластырь, поддерживающий фоновую концентрацию никотина в крови, с интраназальным аэрозолем, который будет быстро повышать ее при остро возникающем желании. При использовании заместительной терапии преимуществ у постепенного уменьшения суточных доз никотина по сравнению с его резкой отменой нет. Противопоказаниями для использования никотиновой заместительной терапии являются нестабильная стенокардия, острый инфаркт миокарда, тяжёлые аритмии, недавно перенесённый инсульт, эрозивно-язвенные нарушения ЖКТ в стадии обострения, беременность, грудное вскармливание, возраст до 18 лет и старше 85 лет. Было показано, что эффективность никотиновой заместительной терапии ниже, чем у варениклина — парциального агониста никотиновых рецепторов. Прием антидепрессантов повышает частоту отказа от курения, тогда как транквилизаторы мало влияют на этот показатель. В тоже время курильщикам, у которых развиваются тревога и депрессия, показаны транквилизаторы и антидепрессанты. Курение и склонность к депрессии часто связаны клинически, что обусловлено как генетической предрасположенностью, так и нейрохимическим действием никотина. Антидепрессанты снижают проявления депрессии и увеличивают частоту отказа от табака. Бупропион, препарат из группы атипичных антидепрессантов, замедляющий захват нейронами норадреналина и дофамина, эффективен в терапии никотиновой зависимости. Бупропион пролонгированного действия в таблетках разрешен к применению в качестве средства, облегчающего отказ от курения, в связи с его высокой эффективностью: повышение частоты отказа от курения в 2,73 раза по сравнению с плацебо.
Было показано, что эффективность никотиновой заместительной терапии ниже, чем у варениклина — парциального агониста никотиновых рецепторов. Прием антидепрессантов повышает частоту отказа от курения, тогда как транквилизаторы мало влияют на этот показатель. В тоже время курильщикам, у которых развиваются тревога и депрессия, показаны транквилизаторы и антидепрессанты. Курение и склонность к депрессии часто связаны клинически, что обусловлено как генетической предрасположенностью, так и нейрохимическим действием никотина. Антидепрессанты снижают проявления депрессии и увеличивают частоту отказа от табака. Бупропион, препарат из группы атипичных антидепрессантов, замедляющий захват нейронами норадреналина и дофамина, эффективен в терапии никотиновой зависимости. Бупропион пролонгированного действия в таблетках разрешен к применению в качестве средства, облегчающего отказ от курения, в связи с его высокой эффективностью: повышение частоты отказа от курения в 2,73 раза по сравнению с плацебо. Применение бупропиона повышает эффективность заместительной никотиновой терапии. Флуоксетин, антидепрессант из группы селективных ингибиторов обратного захвата серотонина, также эффективен при отказе от курения. Поскольку увеличение веса является одной из проблем бросивших курить, флуоксетин, снижающий аппетит, может помочь в решении данной проблемы. Для коррекции веса также рекомендуются щадящая диета и активные физические упражнения.
Применение бупропиона повышает эффективность заместительной никотиновой терапии. Флуоксетин, антидепрессант из группы селективных ингибиторов обратного захвата серотонина, также эффективен при отказе от курения. Поскольку увеличение веса является одной из проблем бросивших курить, флуоксетин, снижающий аппетит, может помочь в решении данной проблемы. Для коррекции веса также рекомендуются щадящая диета и активные физические упражнения.
Профилактические мероприятия следует начинать в младшем школьном возрасте, т.к. именно в этом возрасте дети обычно пробуют курить. Обсуждать вред курения в 9-м классе, когда у многих учащихся уже имеется табачная зависимость, поздно. Дети должны быть активными организаторами и участниками программ по борьбе с курением. Медицинские работники должны принимать активное участие в организации программ по отказу от курения. В борьбе с курением должны активно участвовать средства массовой информации. При адекватной борьбе с курением мы сможем добиться улучшения состояния здоровья трудоспособного населения и предупредить сокращение населения РФ.
С.С. Пертин, заведующий поликлиническим отделением ГОБУЗ «Областной клинический онкологический диспансер», врач-онколог
Мелкоклеточный рак легкого
ГУ РОНЦ им. Н.Н.Блохина РАМН, Москва
М.Б. Бычков, Э.Н. Дгебуадзе, С.А. Большакова
В настоящее время ведутся исследования новых методов терапии при МРЛ. С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия.
Рак легкого является одним из наиболее распространенных онкологических заболеваний в мире. Немелкоклеточная (НМРЛ) и мелкоклеточная (МРЛ) формы рака легкого встречаются в 80-85% и 10-15% случаев, соответственно [41].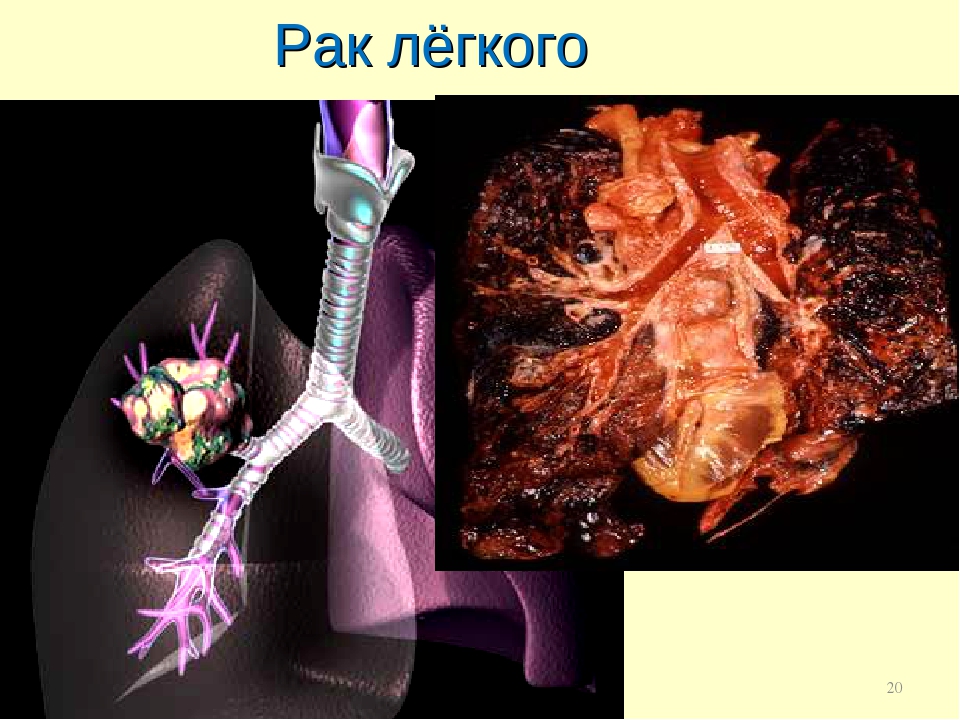 Как правило, мелкоклеточная его форма чаще всего встречается у курящих и очень редко у некурящих больных.
Как правило, мелкоклеточная его форма чаще всего встречается у курящих и очень редко у некурящих больных.
МРЛ относится к наиболее злокачественно текущим опухолям и характеризуется коротким анамнезом, быстрым течением, имеет тенденцию к раннему метастазированию. Мелкоклеточный рак легкого является опухолью, высокочувствительной к химиотерапии, при этом у большинства пациентов можно получить объективный эффект. При достижении полной регрессии опухоли проводится профилактическое облучение головного мозга, что позволяет уменьшить риск отдаленного метастазирования и увеличить уровень общей выживаемости [4].
При диагностике МРЛ особое значение имеет оценка распространенности процесса, определяющая выбор терапевтической тактики. После морфологического подтверждения диагноза (бронхоскопия с биопсией, трансторакальная пункция, биопсия метастатических узлов) проводится компьютерная томография (КТ) грудной клетки и брюшной полости, а также КТ или магнитно-резонансная томография (МРТ) головного мозга (с контрастированием) и сканирование костей.
В последнее время появились сообщения о том, что позитронно-эмиссионная томография позволяет дополнительно уточнить стадию процесса.
При МРЛ, как и при других формах рака легкого, используется стадирование по международной системе TNM, однако большинство больных МРЛ уже имеют на момент установления диагноза III-IV стадию заболевания, в связи с этим до настоящего времени не потеряла свое значение классификация, согласно которой различают локализованную и распространенную формы заболевания.
При локализованной стадии МРЛ опухолевое поражение ограничено одним гемитораксом с вовлечением в процесс регионарных ипсилатеральных лимфатических узлов корня и средостения, а также и ипсилатеральных надключичных лимфатических узлов, когда технически можно выполнить облучение с использованием одного поля.
Распространенной стадией заболевания считается процесс, когда опухолевое поражение не ограничено одним гемитораксом, с наличием контралатеральных лимфогенных метастазов или опухолевого плеврита.
Стадия процесса, определяющая терапевтические возможности, является основным прогностическим фактором при МРЛ [1].
Прогностические факторы:
1. Степень распространенности процесса: у больных с локализованным процессом (не выходящим за пределы грудной клетки) достигаются лучшие результаты при химиолучевой терапии.
2. Достижение полной регрессии первичной опухоли и метастазов: отмечается существенное увеличение длительности жизни и имеется возможность полного выздоровления.
3. Общее состояние больного: пациенты, начинающие лечение в хорошем состоянии, имеют более высокую эффективность лечения, большую выживаемость, чем пациенты в тяжелом состоянии, истощенные, с выраженными симптомами болезни, гематологическими и биохимическими изменениями.
Принципы терапии мелкоклеточного рака легкого
Оперативное лечение показано только при ранних стадиях МРЛ (T1-2N0—1).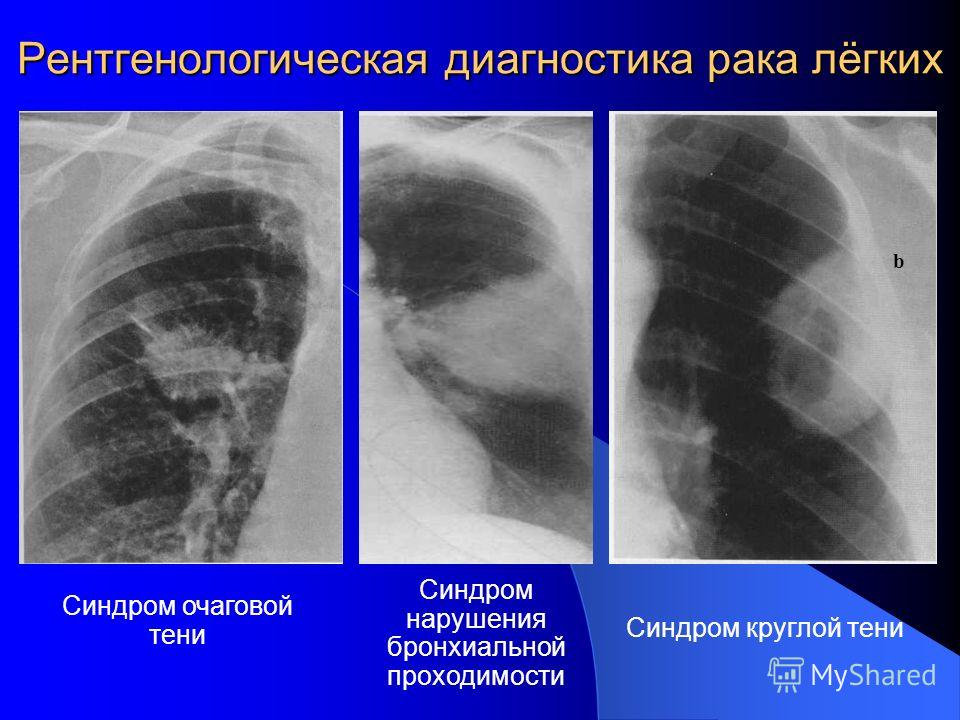 Оно должно дополняться послеоперационной полихимиотерапией (4 курса). У данной группы больных 5-летняя выживаемость составляет 39% [33].
Оно должно дополняться послеоперационной полихимиотерапией (4 курса). У данной группы больных 5-летняя выживаемость составляет 39% [33].
Лучевая терапия приводит к регрессии опухоли у 6080% пациентов, однако в самостоятельном виде она не увеличивает продолжительность жизни из-за появления отдаленных метастазов [9].
Химиотерапия является краеугольным камнем лечения МРЛ. Среди активных препаратов следует отметить: цик- лофосфан, доксорубицин, винкристин, этопозид, топотекан, иринотекан, паклитаксел, доцетаксел, гемцитабин, винорельбин. Их эффективность в монотерапии колеблется от 25 до 50% [23, 35]. В табл. 1 представлены схемы современной комбинированной химиотерапии МРЛ.
Лечение больных с локализованной формой МРЛ
Эффективность современной терапии данной формы МРЛ колеблется от 65% до 90%, с полной регрессией опухоли у 45-75% больных и медианой выживаемости 1824 мес [15, 38]. Больные, начавшие лечение в хорошем общем состоянии (PS 0-1) и ответившие на индукционную терапию, имеют шансы на 5-летнюю безрецидивную выживаемость.
При локализованной форме МРЛ проводится химиотерапия (ХТ) по одной из вышеуказанных схем (2-4 курса) в сочетании с лучевой терапией (ЛТ) на область первичного очага, корня легкого и средостения с подведением суммарной очаговой дозы 30-45 Гр (50-60 Гр по изоэффекту) [6, 7, 37]. Начало лучевой терапии должно быть максимально приближено к началу химиотерапии, т.е. лучше всего ЛТ начинать либо на фоне проведения 1-2 курсов химиотерапии, либо после проведения оценки эффективности лечения двух курсов ХТ.
Больным, у которых достигнута полная ремиссия, рекомендуется проведение профилактического облучения головного мозга в суммарной дозе 30 Гр в связи с высоким риском (до 70%) метастазирования в головной мозг [4].
Медиана выживаемости больных с локализованной формой МРЛ при использовании комбинированного лечения составляет 16-24 мес, при этом 2-летняя выживаемость равна 40-50%, 5-летняя — 10%. У группы больных, начавших лечение в хорошем общем состоянии, возможности достижения 5-летней выживаемости составляют 25% [15, 38].
Лечение больных с распространенной формой МРЛ
У таких больных основным методом лечения является комбинированная химиотерапия в тех же режимах, а облучение проводится только по специальным показаниям. Общая эффективность химиотерапии составляет 70%, но полная регрессия достигается только у 20% больных [15]. В то же время, выживаемость пациентов при достижении полной регрессии опухоли достоверно выше, чем при получении частичной регрессии, и приближается к выживаемости больных с локализованной формой МРЛ.
Таблица №1.
Схемы современной комбинированной химиотерапии МРЛ
| Препараты | Схема химиотерапии | Интервал между курсами |
| ЕР
Цисплатин Этопозид | 80 мг/м2 внутривенно в 1-й день 120 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в 3 нед |
| CDE
Циклофосфамид Доксорубицин Этопозид | 1000 мг/м2 внутривенно в 1-й день 45 мг/м2 внутривенно в 1-й день 100 мг/м2 внутривенно в 1,2,3-й дни или 1,3,5-й дни | 1 раз в 3 нед |
| CAV
Циклофосфамид Доксорубицин Винкристин | 1000 мг/м2 внутривенно в 1-й день 50 мг/м2 внутривенно в 1-й день 1,4 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| AVP
Нимустин (CCNU) Этопозид Цисплатин | 2-3 мг/кг внутривенно в 1-й день 100 мг/м2 внутривенно в 4,5,6-й дни 40 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в 4-6 нед |
| CODE
Цисплатин Винкристин Доксорубицин Этопозид | 25 мг/м2 внутривенно в 1-й день 1 мг/м2 внутривенно в 1-й день 40 мг/м2 внутривенно в 1-й день 80 мг/м2 внутривенно в 1,2,3-й дни | 1 раз в неделю в течение 8 нед |
| TC
Паклитаксел Карбоплатин | 135 мг/м2 внутривенно в 1-й день AUC 5 мг/м2 внутривенно в 1-й день | 1 раз в 3-4 нед |
| TP
Доцетаксел Цисплатин | 75 мг/м2 внутривенно в 1-й день 75 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| IP
Иринотекан Цисплатин | 60 мг/м2 внутривенно в 1,8,15-й дни 60 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
| GP
Гемцитабин Цисплатин | 1000 мг/м2 внутривенно в 1,8-й дни 70 мг/м2 внутривенно в 1-й день | 1 раз в 3 нед |
При метастатическом поражении костного мозга, отдаленных лимфатических узлов, при метастатическом плеврите основным методом лечения является химиотерапия. При метастатическом поражении лимфатических узлов средостения с синдромом сдавления верхней полой вены целесообразно применять комбинированное лечение (химиотерапию в сочетании с лучевой). При метастатическом поражении костей, головного мозга, надпочечников методом выбора является лучевая терапия. При метастазах в головной мозг лучевая терапия в суммарной очаговой дозе (СОД) 30 Гр позволяет получить клинический эффект у 70% больных, причем, у половины из них регистрируется полная регрессия опухоли по данным КТ [4]. В последнее время появились сообщения о возможности использования системной химиотерапии при метастазах в головной мозг. В табл. 2 представлена современная тактика лечения различных форм МРЛ.
При метастатическом поражении лимфатических узлов средостения с синдромом сдавления верхней полой вены целесообразно применять комбинированное лечение (химиотерапию в сочетании с лучевой). При метастатическом поражении костей, головного мозга, надпочечников методом выбора является лучевая терапия. При метастазах в головной мозг лучевая терапия в суммарной очаговой дозе (СОД) 30 Гр позволяет получить клинический эффект у 70% больных, причем, у половины из них регистрируется полная регрессия опухоли по данным КТ [4]. В последнее время появились сообщения о возможности использования системной химиотерапии при метастазах в головной мозг. В табл. 2 представлена современная тактика лечения различных форм МРЛ.
Терапевтическая тактика при рецидиве МРЛ
Несмотря на высокую чувствительность к химиотерапии и лучевой терапии МРЛ, это заболевание имеет высокий уровень рецидивов, в таком случае выбор препаратов для химиотерапии второй линии зависит от уровня ответа на первую линию лечения, длительности безрецидивного промежутка и от локализации метастатических очагов.
Принято различать больных с чувствительным рецидивом МРЛ, т.е. имевших в анамнезе полный или частичный эффект от первой линии химиотерапии и наличием прогрессирования не менее чем через 3 мес после окончания индукционной химиотерапии. В этом случае, возможно, повторно использовать схему лечения, на фоне которой выявлен эффект. Существуют пациенты с рефрактерным рецидивом, т.е. когда отмечается прогрессирование заболевания в процессе первой линии химиотерапии или менее чем через 3 мес после ее окончания. Прогноз заболевания у больных МРЛ особенно неблагоприятен для пациентов с рефрактерным рецидивом — в этом случае медиана выживаемости после диагностики рецидива не превышает 3-4 мес. При наличии рефрактерного рецидива целесообразно применение ранее не использовавшихся цитостатиков и/или их комбинаций.
В последнее время изучаются и уже используются новые препараты в терапии МРЛ, к ним относятся гемцитабин, топотекан, винорельбин, иринотекан, таксаны, а также таргетные препараты.
Гемцитабин. Гемцитабин является аналогом деокситидина и относится к пиримидиновым антиметаболитам. По данным исследования Y. Cornier и соавт., его эффективность в монотерапии составила 27%, по результатам датского исследования уровень общей эффективности составляет 13% [8]. Поэтому стали изучать комбинированные режимы химиотерапии с включением гемцитабина. В итальянском исследовании проводилось лечение по схеме PEG (гемцитабин, цисплатин, этопо- зид), при этом уровень объективной эффективности составил 72%, однако отмечена высокая токсичность [10]. London Lung Group опубликовали данные рандомизированного исследования III фазы по прямому сравнению двух схем лечения GC (гемцитабин + цисплатин) и РЕ. Различий в медианах выживаемости не было получено, здесь также отмечен высокий уровень токсичности схемы GC [20].
Топотекан. Топотекан — это водорастворимый препарат, являющийся полусинтетическим аналогом камптотецина, он не обладает перекрестной токсичностью с другими цитостатиками, использующимися при лечении МРЛ. Результаты некоторых исследований отмечают его эффективность и при наличии резистентных форм заболевания [3, 11, 13, 39, 40]. Также в этих работах выявлена хорошая переносимость топотекана, характеризующаяся управляемой некумулятивной миелосупрессией, низким уровнем негематологической токсичности и значительным уменьшением клинических проявлений заболевания [2, 12, 29, 30]. Использование топотекана во второй линии терапии МРЛ одобрено приблизительно в 40 странах мира, включая США и Швейцарию.
Результаты некоторых исследований отмечают его эффективность и при наличии резистентных форм заболевания [3, 11, 13, 39, 40]. Также в этих работах выявлена хорошая переносимость топотекана, характеризующаяся управляемой некумулятивной миелосупрессией, низким уровнем негематологической токсичности и значительным уменьшением клинических проявлений заболевания [2, 12, 29, 30]. Использование топотекана во второй линии терапии МРЛ одобрено приблизительно в 40 странах мира, включая США и Швейцарию.
Винорельбин. Винорельбин является полусинтетическим винкаалкалоидом, который участвует в предотвращении процессов деполимеризации тубулина. По данным некоторых исследований, уровень ответа при монотерапии винорельбином составляет 17% [16, 21]. Было также выявлено, что комбинация винорельбина и гемцитабина является достаточно эффективной и обладает невысоким уровнем токсичности. В работе J.D. Hainsworth и соавт. уровень частичной регрессии составил 28% [19]. Несколько исследовательских групп оценивали эффективность и токсический профиль комбинации карбоплатина и винорельбина [18, 24]. Полученные данные указывают на то, что эта схема активно работает при мелкоклеточном раке легкого, однако, токсичность ее довольно высока, в связи с чем, необходимо определить оптимальные дозы для вышеуказанной комбинации.
Полученные данные указывают на то, что эта схема активно работает при мелкоклеточном раке легкого, однако, токсичность ее довольно высока, в связи с чем, необходимо определить оптимальные дозы для вышеуказанной комбинации.
Таблица №2.
Современная тактика лечения МРЛ
| Локализованный процесс | Распространенный процесс |
|
1. Химиотерапия
Схема ЕР: этопозид + цисплатин Схема CAV: циклофосфамид+ доксорубицин+ винкристин
2. Лучевая терапия
Ранняя одновременно с 1-м или 2-м курсом ХТ Поздняя — с 3-м курсом ХТ Суммарная доза ЛТ — 45 Гр
3. При наличии полной регрессии
Проводится профилактическое облучение головного мозга — СОД 30 Гр
|
1.
Схемы EP, CAV или CDE (4-6 курсов)
2. Лучевая терапия
Проводится на отдельные очаги поражения
|
Иринотекан. Основываясь на результатах исследования II фазы Japan Clinical Oncology Group начали рандомизированное исследование III фазы JCOG-9511 по прямому сравнению двух схем химиотерапии цисплатин + иринотекан (PI) и цисплатин + этопозид (РЕ) у ранее нелеченных пациентов с МРЛ [27]. В первой комбинации доза иринотекана составила 60 мг/м2 в 1, 8-й и 15-й дни, цисплатина — 60 мг/м2 в 1-й день каждые 4 нед, во второй комбинации цисплатин вводили в дозе 80 мг/м2, этопозид — 100 мг/м2 в 1-3-й дни, каждые 3 нед. Всего в первой и второй группе было проведено по 4 курса химиотерапии. В работу планировалось включить 230 больных, однако, набор был остановлен после проведения предварительного анализа полученных результатов (n=154), так как выявлено достоверное увеличение выживаемости в группе, получающей лечение по схеме PI (медиана выживаемости равна 12,8 против 9,4 месяцев, соответственно).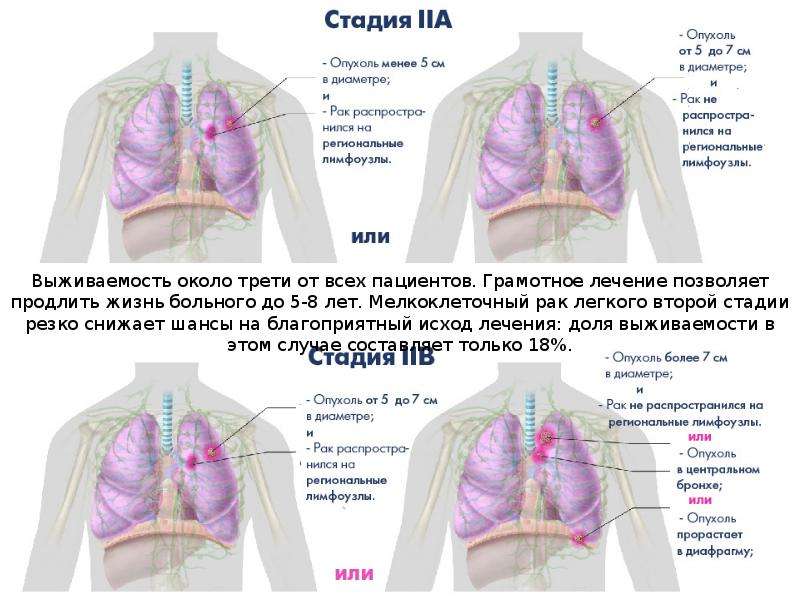 Однако следует отметить, что только 29% больных, рандомизированных в группу PI, смогли получить необходимую дозу препаратов. По данным этого исследования, схема PI была признана в Японии стандартом лечения локализованной формы МРЛ. В связи с небольшим количеством пациентов данные этой работы необходимо было подтвердить.
Однако следует отметить, что только 29% больных, рандомизированных в группу PI, смогли получить необходимую дозу препаратов. По данным этого исследования, схема PI была признана в Японии стандартом лечения локализованной формы МРЛ. В связи с небольшим количеством пациентов данные этой работы необходимо было подтвердить.
Поэтому в Северной Америке было начато исследование III фазы [32]. С учетом уже имеющихся результатов дозы препаратов были редуцированы. В схеме PI доза цисплатина составила 30 мг/м2 в 1-й день, иринотекана — 65 мг/м2 в 1-й и 8-й дни 3-недельного цикла. Что касается токсичности, то диарея IV степени не была зарегистрирована, предварительные данные по эффективности ожидаются.
Таксаны. В работе J.E. Smyth и соавт. проводилось изучение эффективности доцетаксела 100 мг/м2 в монотерапии у ранее леченных больных (n=28), объективная эффективность составила 25% [32].
В исследование ECOG включено 36 ранее нелеченных пациентов с МРЛ, которые получали паклитаксел 250 мг/м2в виде 24-часовой инфузии каждые 3 нед [14]. При этом уровень частичной регрессии составил 30%, в 56% случаев была зарегистрирована лейкопения IV степени. Однако интерес к этому цитостатику не ослабевал, в связи с чем, в США было начато Intergroup Study, где изучалась комбинация паклитаксела с этопозидом и цисплатином (ТЕР) или карбоплатином — (ТЕС) [26]. В первой группе химиотерапия проводилась по схеме ТЕР (паклитаксел 175 мг/м2 в 1-й день, этопозид 80 мг/м2 в 1-3-й дни и цисплатин 80 мг/м2 в 1-й день, при этом обязательным условием было введение колониестимулирующих факторов с 4-го по 14-й дни), в схеме РЕ дозы препаратов были идентичными. Более высокий уровень токсичности наблюдался в группе ТЕР, к сожалению, различий в медиане выживаемости не было получено (10,4 против 9,9 месяцев).
При этом уровень частичной регрессии составил 30%, в 56% случаев была зарегистрирована лейкопения IV степени. Однако интерес к этому цитостатику не ослабевал, в связи с чем, в США было начато Intergroup Study, где изучалась комбинация паклитаксела с этопозидом и цисплатином (ТЕР) или карбоплатином — (ТЕС) [26]. В первой группе химиотерапия проводилась по схеме ТЕР (паклитаксел 175 мг/м2 в 1-й день, этопозид 80 мг/м2 в 1-3-й дни и цисплатин 80 мг/м2 в 1-й день, при этом обязательным условием было введение колониестимулирующих факторов с 4-го по 14-й дни), в схеме РЕ дозы препаратов были идентичными. Более высокий уровень токсичности наблюдался в группе ТЕР, к сожалению, различий в медиане выживаемости не было получено (10,4 против 9,9 месяцев).
M. Reck и соавт. представили данные рандомизированного исследования III фазы, в котором в одной группе изучалась комбинация ТЕС (паклитаксел 175 мг/м2 в 4-й день, этопозид в 1-3-й дни в дозе 125 мг/м2 и 102,2 мг/м2пациентам с I-IIffi и IV стадией заболевания, соответственно, и карбоплатин AUC 5 в 4-й день), в другой группе — CEV (винкристин 2 мг в 1-й и 8-й дни, этопозид с 1го по 3-й день в дозе 159 мг/м2 и 125 мг/м2 больным с I- ШВ и IV стадией и карбоплатин AUC 5 в 1-й день) [28]. Медиана общей выживаемости составила 12,7 против 10,9 месяцев, соответственно, однако, полученные различия недостоверны (р=0,24). Уровень токсических реакций был приблизительно одинаков в обеих группах. По данным других исследований, аналогичных результатов не получилось, так что на сегодняшний день препараты таксанового ряда редко применяются при лечении мелкоклеточного рака легкого.
Медиана общей выживаемости составила 12,7 против 10,9 месяцев, соответственно, однако, полученные различия недостоверны (р=0,24). Уровень токсических реакций был приблизительно одинаков в обеих группах. По данным других исследований, аналогичных результатов не получилось, так что на сегодняшний день препараты таксанового ряда редко применяются при лечении мелкоклеточного рака легкого.
В терапии МРЛ исследуются новые направления лекарственного лечения, имеющие тенденцию к переходу от неспецифических лекарственных средств к так называемой таргетной терапии, направленной на определенные гены, рецепторы, ферменты. В ближайшие годы именно характер молекулярно-генетических нарушений будет определять выбор лекарственных схем лечения у больных МРЛ.
Таргетная терапия
Таргетная терапия aHmu-CD56. Известно, что клетки мелкоклеточного рака легкого экспрессируют CD56 [25]. Он экспрессируется периферическими нервными окончаниями, нейроэндокринными тканями, миокардом. Для подавления экспрессии CD56 были получены конъюгированные моноклональные антитела N901-bR. В I фазе исследования приняли участие пациенты (n=21) с рецидивом МРЛ, им в течение 7 дней проводилась инфузия препарата [31]. В одном случае была зарегистрирована частичная регрессия опухоли, длительность которой составила 3 мес. В работе British Biotech (I фаза) изучали моноклональные антитела mAb, которые конъюгируются в токсин DM1. DM1 ингибирует полимеризацию тубулина и микротрубочек, что приводит к смерти клетки. Исследования в этой области продолжаются.
Для подавления экспрессии CD56 были получены конъюгированные моноклональные антитела N901-bR. В I фазе исследования приняли участие пациенты (n=21) с рецидивом МРЛ, им в течение 7 дней проводилась инфузия препарата [31]. В одном случае была зарегистрирована частичная регрессия опухоли, длительность которой составила 3 мес. В работе British Biotech (I фаза) изучали моноклональные антитела mAb, которые конъюгируются в токсин DM1. DM1 ингибирует полимеризацию тубулина и микротрубочек, что приводит к смерти клетки. Исследования в этой области продолжаются.
Талидомид. Имеется мнение о том, что рост солидных опухолей зависит от процессов неоангиогенеза. С учетом роли неоангиогенеза в росте и развитии опухолей разрабатываются препараты, направленные на прекращение процессов ангиогенеза.
Например, талидомид был известен как лекарственное средство против бессонницы, который впоследствии перестал применяться в связи с наличием у него тератогенных свойств. К сожалению, механизм его антиангиогенного действия не известен, однако, талидомид блокирует процессы васкуляризации, индуцированные фактором роста фибробластов и эндотелиальным фактором роста [5]. Во II фазе исследования 26 больным с ранее нелеченным МРЛ было проведено 6 курсов стандартной химиотерапии по схеме РЕ, а затем в течение 2 лет они получали лечение талидомидом (100 мг в день) с минимальным уровнем токсичности [22]. У 2 пациентов зарегистрирована ПР, у 13 — ЧР, медиана выживаемости составила 10 мес, 1-летняя выживаемость — 42%. С учетом полученных многообещающих результатов решено начать исследования III фазы по изучению талидомида.
К сожалению, механизм его антиангиогенного действия не известен, однако, талидомид блокирует процессы васкуляризации, индуцированные фактором роста фибробластов и эндотелиальным фактором роста [5]. Во II фазе исследования 26 больным с ранее нелеченным МРЛ было проведено 6 курсов стандартной химиотерапии по схеме РЕ, а затем в течение 2 лет они получали лечение талидомидом (100 мг в день) с минимальным уровнем токсичности [22]. У 2 пациентов зарегистрирована ПР, у 13 — ЧР, медиана выживаемости составила 10 мес, 1-летняя выживаемость — 42%. С учетом полученных многообещающих результатов решено начать исследования III фазы по изучению талидомида.
Ингибиторы матриксной металлопротеиназы. Металлопротеиназы являются важными ферментами, участвующими в неоангиогенезе, основной их ролью является участие в процессах ремоделирования ткани и продолженного роста опухоли. Как выяснилось, инвазия опухоли, а также ее метастазирование зависят от синтеза и высвобождения этих ферментов опухолевыми клетками.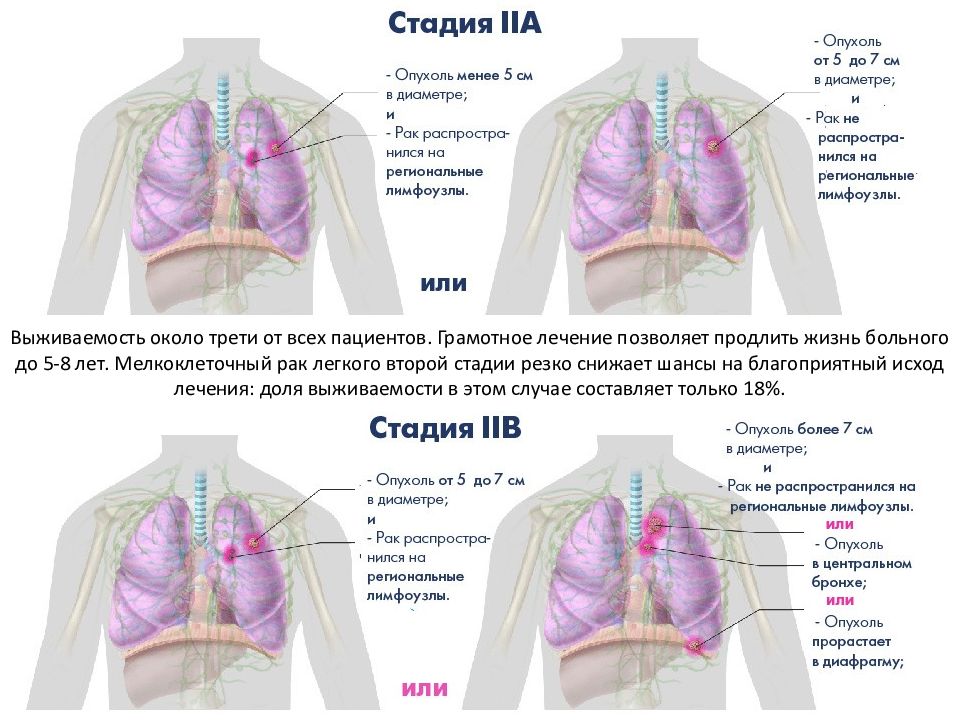 Некоторые ингибиторы металлопротеиназ уже синтезированы и опробованы при мелкоклеточном раке легкого, как, например, маримастат (British Biothech) и BAY12-9566 (Bayer).
Некоторые ингибиторы металлопротеиназ уже синтезированы и опробованы при мелкоклеточном раке легкого, как, например, маримастат (British Biothech) и BAY12-9566 (Bayer).
В большом исследовании по изучению маримастата участвовало более 500 больных с локализованной и диссеминированной формами мелкоклеточного рака легкого, после проведения химиотерапии или химиолучевого лечения одной группе пациентов назначали маримастат (10 мг 2 раза в день), другой — плацебо [34]. Увеличения выживаемости получить не удалось. В работе по изучению BAY12-9566 в группе изучаемого препарата было отмечено уменьшение выживаемости, поэтому исследования ингибиторов металлопротеиназы при МРЛ были прекращены.
Также при МРЛ проводили изучение препаратов, ингибирующих рецепторы тирозинкиназы (гефитиниб, иматиниб) [17]. Только при исследовании иматиниба (гливек) были получены обещающие результаты, в связи с чем, продолжаются работы в этом направлении.
Таким образом, в заключение следует еще раз подчеркнуть, что в настоящее время ведутся исследования новых методов терапии при МРЛ. С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия. В этом обзоре представлены результаты некоторых исследований, в которых отражены данные химиотерапии и таргетной терапии. Таргетные препараты обладают новым механизмом действия, что дает основание надеяться на возможность более успешного лечения такого заболевания, как мелкоклеточный рак легкого.
С одной стороны, разрабатываются новые схемы и комбинации с меньшим уровнем токсичности и большей эффективностью, с другой стороны, изучаются новые препараты. Основной целью проводимых исследований является увеличение выживаемости пациентов и уменьшение частоты рецидивов. Необходимо продолжить изучение эффективности новых препаратов с новым механизмом действия. В этом обзоре представлены результаты некоторых исследований, в которых отражены данные химиотерапии и таргетной терапии. Таргетные препараты обладают новым механизмом действия, что дает основание надеяться на возможность более успешного лечения такого заболевания, как мелкоклеточный рак легкого.
Литература
1. Бычков М.Б. Мелкоклеточный рак легкого. Руководство по химиотерапии опухолевых заболеваний / Под ред. Н.И. Переводчиковой. — М., 2005. — P. 203-208.
2. Anzai H., Frost P., Abbuzzese J.L. Synergistic cytotoxicity with combined inhibition of topoisomerase (Topo) I and II // Proc. Amer. Assoc. Cancer. Res. — 1992. — Vol. 33. — P. 431.
Amer. Assoc. Cancer. Res. — 1992. — Vol. 33. — P. 431.
3. Ardizzoni A., Hansen H, Dombernowsky P. et al. Topotecan, a new active drug in the second-line treatment of small-cell lung cancer: a phase II study in patients with refractory and sensitive disease. The European Organization of Research and Treatment of Cancer Early Clinical Studies Group and New Drug Development Office, and the Lung Cancer Cooperative Group // J. Clin. Oncol. — 1997. — Vol. 15. — P. 2090-2096.
4. Auperin A., Arriagada R., PignonJP. et al. Prophylactic cranial irradiation for patients with non-small cell lung cancer in complete remission. Profilactic Cranial Irradiation Collaborative Group // New Engl. J. Med. — 1999. — Vol. 341. — P. 476-484.
5. Bauer KS, Dixon S.C., Figg W.D. et al. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species0dependent // Biochem. Pharmacol. — 1998. — Vol. 55. — P. 1827-1834.
6. Bleehen NM, Girling DJ, Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). I: survival and prognostic factors. Medical Research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1150-1156.
Bleehen NM, Girling DJ, Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). I: survival and prognostic factors. Medical Research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1150-1156.
7. Bleehen N.M., Girling D.J., Machin D. et al. A randomized trial of three or six courses of etoposide cyclophosphamide methotrexate and vincristine or six courses of etoposide and ifosfamide in small cell lung cancer (SCLC). II: quality of life. Medical research Council Lung Cancer Working Party // Brit. J. Cancer. — 1993. — Vol. 68. — P. 1157-1166.
8. Cormier Y., EisenhauerE, MuldalA et al. Gemcitabine is an active new agent in previously untreated extensive small cell lung cancer (SCLC). A study of National Cancer Institute of Canada Clinical Trials Group // Ann. Oncol. — 1994. — Vol.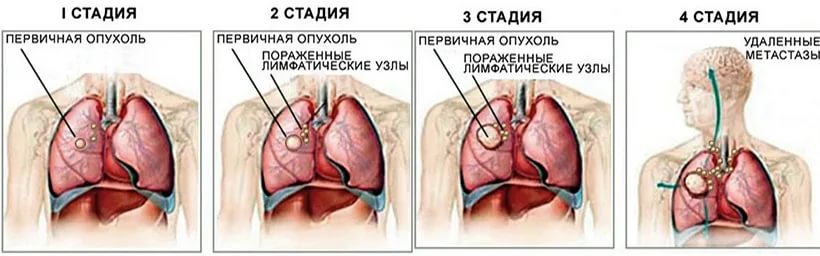 5. — P. 283-285.
5. — P. 283-285.
9. Cullen M, Morgan D, Gregory W. et al. Maintenance chemotherapy for anaplastic small cell carcinoma of the bronchus: a randomized, controlled trial // Cancer Chemother. Pharmacol. — 1986. — Vol. 17. — P. 157-160.
10. De Marinis F, Migliorino MR, Paoluzzi L. et al. Phase I/II trial of gemcitabine plus cisplatin and etoposide in patients with small-cell lung cancer // Lung Cancer. — 2003. — Vol. 39. — P- 331-338.
11. Depierrie A., von PawelJ., Hans K et al. Evaluation of topotecan (Hycamtin TM) in relapsed small cell lung cancer (SCLC). A multicentre phase Ii study // Lung Cancer. — 1997. — Vol. 18 (Suppl. 1). — P. 35.
12. Dowlati A, Levitan N., Gordon NH. et al. Phase II and pharmacokinetic/pharmacodynamic trial of sequential topoi- somerase I and II inhibition with topotecan and etoposide in advanced non-small-cell lung cancer // Cancer Chemother. Pharmacol. — 2001. — Vol. 47. — P. 141-148.
47. — P. 141-148.
13. Eckardt J, Gralla R., Pallmer M.C. et al. Topotecan (T) as second-line therapy in patients with small cell lung cancer (SCLC): a phase II study // Ann. Oncol. — 1996. — Vol. 7 (Suppl. 5). — P. 107.
14. Ettinger DS, Finkelstein DM, Sarma RP. et al. Phase Ii study of paclitaxel in patients with extensive-disease small-cell lung cancer: an Eastern Cooperative Oncology Group study // J. Clin. Oncol. — 1995. — Vol. 13. — P. 1430-1435.
15. Evans W.K., Shepherd Fa, Feld R et al. VP-16 and cisplatin as first-line therapy for small-cell lung cancer // J. Clin. Oncol. — 1985. — Vol. 3. — P. 1471-1477.
16. Furuse K., Kubota K., Kawahara M. et al. Phase II study of vinorelbine in heavily previously treated small cell lung cancer. Japan Lung Cancer Vinorelbine Group // Oncology. — 1996. — Vol. 53. — P. 169-172.
17. Gamou S., Hunts J, Harigai H. et al. Molecular evidence for lack of epidermal growth factor receptor gene expression in small cell lung carcinoma cells // Cancer Res. — 1987. — Vol. 47. — P. 2668-2673.
— 1987. — Vol. 47. — P. 2668-2673.
18. Gridelli C., Rossi A., Barletta E. et al. Carboplatin plus vinorelbine plus G-CSF in elderly patients with extensive-stage small¬cell lung cancer: a poorly tolerated regimen. Results of a multicenter phase II study // Lung Cancer. — 2002. — Vol. 36. — P. 327-332.
19. Hainsworth JD, Burris III HA, ErlandJB. et al. Combination chemotherapy with gemcitabine and vinorelbine in the treatment of patients with relapsed or refractory small cell lung cancer: a phase II trial of the Minnie Pearl Cancer Research Network // Cancer. Invest. — 2003. — Vol. 21. — P. 193-199.
20. James L.E., Rudd R., Gower N. et al. A phase III randomized comparison of gemcitabine/carboplatin (GC) with cisplatin/ etoposide (PE) in patients with poor prognosis small cell lung cancer (SCLC) // Proc. Amer. Clin. Oncol. — 2002. — Vol. 21. — Abstr. 1170.
21. Jassem J., Karnicka-Mlodkowska H.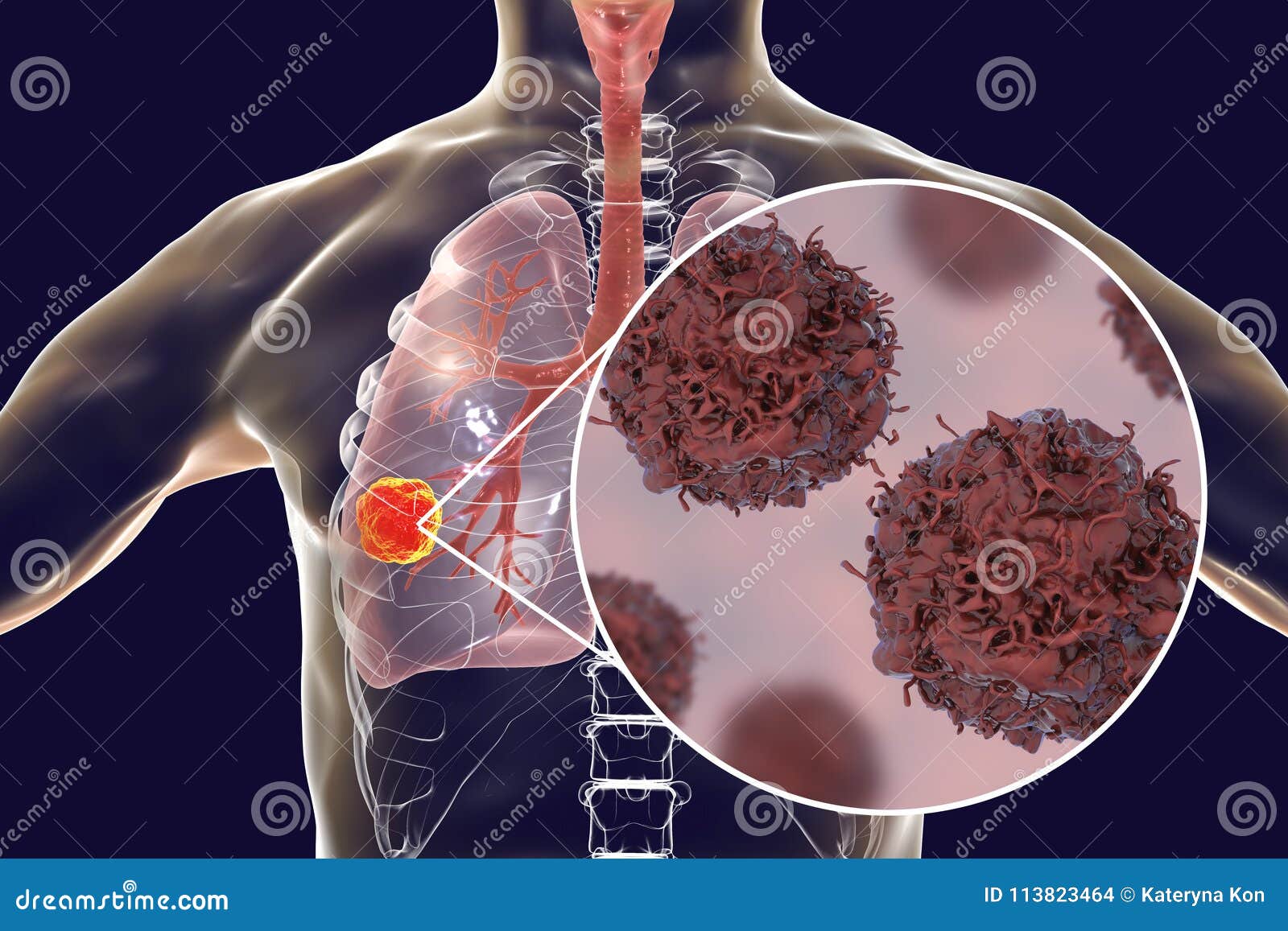 , van Pottelsberghe C. et al. Phase II study of vinorelbine (Navelbine) in previously treated small cell lung cancer patients. EORTC Lung Cancer Cooperative Group // Europ. J. Cancer. — 1993. — Vol. 29A. — P. 1720-1722.
, van Pottelsberghe C. et al. Phase II study of vinorelbine (Navelbine) in previously treated small cell lung cancer patients. EORTC Lung Cancer Cooperative Group // Europ. J. Cancer. — 1993. — Vol. 29A. — P. 1720-1722.
22. Lee SM.,JamesLE,Mohmmaed-Ali V. et al. A phase II study of carboplatin/etoposide with thalidomide in small cell lung cancer (SCLC) // Proc. Amer. Soc. Clin. Oncol. — 2002. — Vol. 21. — Abstr. 1251.
23. Lowebraun S., BartolucciA., Smalley RV. et al. The superiority of combination chemotherapy over single agent chemo¬therapy in small cell lung cancinoma // Cancer. — 1979. — Vol. 44. — P. 406-413.
24. Mackay HJ, O’Brien M, Hill S. et al. A phase II study of carboplatin and vinorelbine in patients with poor prognosis small cell lung cancer // Clin. Oncol. — (R. Coll. Radiol.). — 2003. — Vol. 15. — P. 181-185.
25. Moolenaar CE, Muller EJ., Schol DJ. et al. Expression of neural cell adhesion molecule-related sialoglycoprotein in small cell lung cancer and neuroblastoma cell lines H69 and CHP-212 // Cancer. Res. — 1990. — Vol. 50. — P. 1102-1106.
Res. — 1990. — Vol. 50. — P. 1102-1106.
26. Niell H.B., Herndon J.E., Miller AA et al. Final report of a randomized phase III Intergroup trial of etoposide (VP-16) and cisplatin (DDP) with or without paclitaxel (TAX) and G-CSP in patients with extensive stage small cell lung cancer (ED-SCLC) // Lung Cancer. — 2003. — Vol. 41 (Suppl. 2). — S. 81.
27. Noda K., Nishiwaki Y., KawaharaM. et al. Irinitecan plus cisplatin compared with etiposide plus cisplatin for extensive small-cell lung cancer // New Engl. J. Med. — 2003. — Vol. 346. — P. 85-91.
28. Reck M, von Pawel J., Macha HN. et al. Randomized phase III trial of paclitaxel etoposide, and carboplatin versus carboplatin, and vincristine in patients with small-cell lung cancer // J. Natl. Cancer. Inst. — 2003. — Vol. 95. — P. 1118-1127.
29. Rinaldi D., Lorman N., BrierreJ. et al. A phase I-II trial of topotecan and gemcitabine in patients with previously treated, advanced non-small cell lung cancer (LOA-3) // Cancer. Invest. — 2001. — Vol. 19. — P 467-474.
Invest. — 2001. — Vol. 19. — P 467-474.
30. Rinaldi D., Lorman N., Brierre J. et al. A phase II trial of topotecan and gemcitabine in patients with previously treated, advanced nonsmall cell lung carcinoma // Cancer. — 2002. — Vol. 95. — P. 1274-1278.
31. Roy D.C., Ouellet S., Le Houillier et al. Elimination of neuroblastoma and small-cell lung cancer cells with an antineural cell adhesion molecule immunotoxin // J. Natl. Cancer. Inst. — 1996. — Vol. 88. — P. 1136-1145.
32. Sandler A, Langer C., BunnJrPA. et al. Interim safety analysis of irinotecan and cisplatin combination chemotherapy for previously untreated extensive small cell lung cancer // Proc. Amer. Soc. Clin. Oncol. — 2003. — Vol. 22. — Abstr. 2537.
33. Seifter EJ, Ihde D.C. Therapy of small cell lung cancer: a prospective on two decades of clinical research // Semin. Oncol. — 1988. — Vol. 15. — P. 278-299.
34. Shepherd FA, Giaccone G, Seymour L. et al. Prospective, randomized, double-blind, placebo-controlled trial of marim- astat after response to first-line chemotherapy in patients with small-cell lung cancer: a trial of national Cancer. Institute of Canada — Clinical Trials Group and European Organization for Research and Treatment of Cancer // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4434-4439.
Shepherd FA, Giaccone G, Seymour L. et al. Prospective, randomized, double-blind, placebo-controlled trial of marim- astat after response to first-line chemotherapy in patients with small-cell lung cancer: a trial of national Cancer. Institute of Canada — Clinical Trials Group and European Organization for Research and Treatment of Cancer // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4434-4439.
35. Smith I.E, Evans BD. Carboplatin (JM8) as a single agent in combination in the treatment of small cell lung cancer // Cancer. Treat. Rev. — 1985. — Vol. 12 (Suppl. A). — P. 73-75.
36. Smyth JF, Smith IE, Sessa C. et al. Activity of docetaxel (Taxotere) in small cell lung cancer. The Early Clinical Trials Group of EORTC // Europ. J. Cancer. — 1994. — Vol. 30A. — P. 1058-1060.
37. Spiro S.G., Souhami RL, Geddes D.M. et al. Duration of chemotherapy in small cell lung cancer: a Cancer Research Campaign trial // Brit. J. Cancer. — 1989. — Vol. 59. — P. 578-583.
— 1989. — Vol. 59. — P. 578-583.
38. Sundstrom S., Bremenes RM, Kaasa S. et al. Cisplatin and etoposide regimen is superior to cyclophosphamide. Epirubi- cin, and vincristine regimen in small-cell lung cancer: results from randomized phase III trial with 5 year’follow-up // J. Clin. Oncol. — 2002. — Vol. 20. — P. 4665-4672.
39. von PawelJ., DepierreA., Hans K. et al. Topotecan (Hycamtin TM) in small cell lung cancer (SCLC) after failure of first line therapy: multicentre phase II study // Europ. J. Cancer. — 1997. — Vol. 33. (Suppl. 8). — P. S229.
40. von Pawel J, Schiller J.H., Shepherd FA et al. Topotecan versus cyclophosphamide, doxorubicin, and vincristine for the treatment of recurrent small-cell lung cancer // J. Clin. Oncol. — 1999. — Vol. 17. — P. 658-667.
41. Wu AH, Henderson B.E., Thomas D.C. et al. Secular trends in histologic types of lung cancer // J. Natl. Cancer. Inst. — 1986. — Vol. 77. — P. 53-56.
— Vol. 77. — P. 53-56.
Поступила в редакцию 16.11.2005 г.
10 распространенных причин рака легких
ИЗОБРАЖЕНИЙ ПРЕДОСТАВЛЕНЫ:
1) Getty Images
2) Getty Images
3) USGS.GOV
4) Getty Images
5) Getty Images
6) Getty Images
7) Getty Images
8) Getty Images
9) Getty Images
apache.org/xalan»> 10) Getty ImagesИСТОЧНИКОВ:
Национальный институт рака: «Пассивное курение и рак.”
Американское онкологическое общество: «Всемирная организация здравоохранения: загрязнение наружного воздуха вызывает рак».
Национальный институт рака: «Воздействие асбеста и риск рака».
Американское онкологическое общество: «Радон и рак».
Notadori, J. Chest Journal , октябрь 2006 г.
Американское онкологическое общество: «Факторы риска мелкоклеточного рака легких».
Bandera, E. Эпидемиология рака, биомаркеры и профилактика , август 2001 г.
Эпидемиология рака, биомаркеры и профилактика , август 2001 г.
Siu, S. Chest Journal , октябрь 2011 г.
Американское онкологическое общество: «Лучевая терапия».
Американское онкологическое общество: «Как лучевая терапия влияет на риск повторного рака?»
Американская ассоциация онкологических исследований: «Высокий гликемический индекс связан с повышенным риском рака легких».
Мелкноян, С. Эпидемиология рака, биомаркеры и профилактика , март 2016 г.
Американская диабетическая ассоциация: «Гликемический индекс и диабет.”
Американская ассоциация онкологических исследований: «Высокий гликемический индекс связан с повышенным риском рака легких».
Американское онкологическое общество: «Вирусы, которые могут привести к раку».
Klein, F. Рак легкого , июль 2009 г.
Slatore, C. Журнал клинической онкологии , март 2010 г.
Breast Cancer.org «Гормональная заместительная терапия может повысить риск рака легких».
Рак легкого — немелкоклеточный: Введение
НА ЭТОЙ СТРАНИЦЕ: Вы найдете основную информацию об этом заболевании и частях тела, на которые оно может повлиять.Это первая страница руководства Cancer.Net по немелкоклеточному раку легких. Используйте меню для просмотра других страниц. Думайте об этом меню как о дорожной карте для этого полного руководства.
Рак легких ежегодно поражает более 200 000 американцев. Хотя курение сигарет является основной причиной, любой может заболеть раком легких. Рак легких всегда поддается лечению, независимо от размера, местоположения, распространился ли рак и насколько далеко он распространился.
Рак легких всегда поддается лечению, независимо от размера, местоположения, распространился ли рак и насколько далеко он распространился.
Поскольку рак легких связан с курением, пациенты могут чувствовать, что они не получат особой поддержки или помощи, потому что считают, что другие будут думать, что их поведение вызвало болезнь.Правда в том, что у большинства курильщиков не развивается рак легких, и не все люди, у которых диагностирован рак легких, курят. Рак легких — болезнь, от которой может пострадать любой. Фактически, большинство людей, которые сегодня болеют раком легких, либо бросили курить несколько лет назад, либо никогда не курили.
О легких
Когда человек вдыхает, легкие поглощают кислород из воздуха и доставляют кислород в кровоток для доставки к остальному телу. Поскольку клетки организма используют кислород, они выделяют углекислый газ.Кровоток переносит углекислый газ обратно в легкие, и углекислый газ покидает тело при выдохе человека.
Легкие содержат много разных типов клеток. Большинство клеток легких — это эпителиальные клетки. Клетки эпителия выстилают дыхательные пути и вырабатывают слизь, которая смазывает и защищает легкие. Легкое также содержит нервные клетки, клетки, производящие гормоны, клетки крови и структурные или поддерживающие клетки.
Большинство клеток легких — это эпителиальные клетки. Клетки эпителия выстилают дыхательные пути и вырабатывают слизь, которая смазывает и защищает легкие. Легкое также содержит нервные клетки, клетки, производящие гормоны, клетки крови и структурные или поддерживающие клетки.
О немелкоклеточном раке легкого
Существует 2 основных классификации рака легких: мелкоклеточный рак легкого и немелкоклеточный рак легкого (НМРЛ).К этим 2 типам относятся по-разному. Это руководство содержит информацию о НМРЛ. Узнайте больше о мелкоклеточном раке легких в другом руководстве. Этот сайт также предлагает отдельное руководство по нейроэндокринным опухолям легких.
НМРЛ начинается, когда здоровые клетки в легких изменяются и выходят из-под контроля, образуя массу, называемую опухолью, поражением или узелком. Опухоль легкого может начаться в любом месте легкого. Опухоль может быть злокачественной или доброкачественной. Как только злокачественная опухоль легких растет, она может выделять раковые клетки.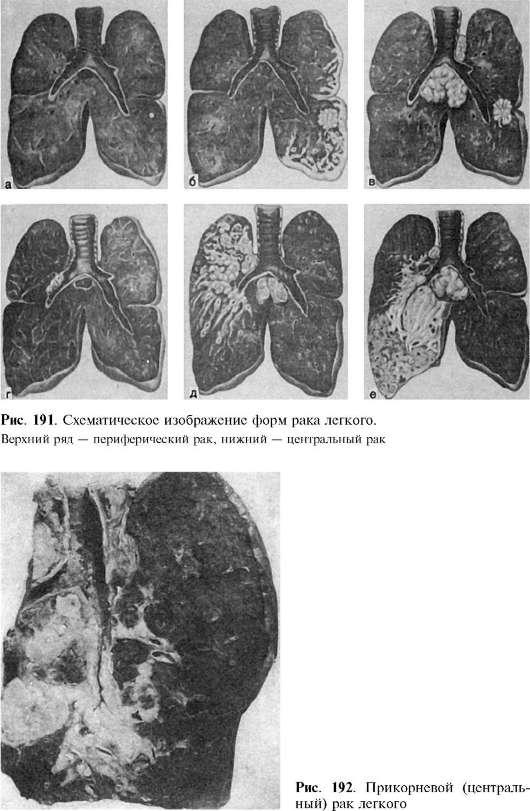 Эти клетки могут уноситься с кровью или плавать в жидкости, называемой лимфой, которая окружает ткань легких. Лимфа течет по трубкам, называемым лимфатическими сосудами, которые стекают в сборные станции, называемые лимфатическими узлами.
Эти клетки могут уноситься с кровью или плавать в жидкости, называемой лимфой, которая окружает ткань легких. Лимфа течет по трубкам, называемым лимфатическими сосудами, которые стекают в сборные станции, называемые лимфатическими узлами.
Лимфатические узлы — это маленькие органы в форме бобов, которые помогают бороться с инфекцией. Они расположены в легких, центре грудной клетки и в других частях тела. Естественный поток лимфы из легких направлен к центру грудной клетки, что объясняет, почему рак легких часто распространяется первым.Когда раковая клетка попадает в лимфатический узел или в отдаленную часть тела через кровоток, это называется метастазированием.
Типы НМРЛ
NSCLC начинается в эпителиальных клетках. Для врачей важно различать рак легких, который начинается в плоских клетках, от рака легких, который начинается в других клетках. Эта информация используется для определения вариантов лечения.
Ваш врач определит, какой у вас тип НМРЛ, на основании того, как рак выглядит под микроскопом. Различные типы НМРЛ:
Различные типы НМРЛ:
- Нормальная легочная ткань
- Легкое — аденокарцинома
- Плоскоклеточный рак легких
Изображения использованы с разрешения Колледжа американских патологов.
Ищете больше введения?
Если вы хотите получить более подробную информацию, изучите эти связанные элементы. Обратите внимание, что по этим ссылкам вы попадете в другие разделы на Cancer.Net:
Следующий раздел в этом руководстве — Статистика .Это помогает объяснить количество людей, у которых диагностирован НМРЛ, и общие показатели выживаемости. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Рак легких — Здоровье легких A-Z
О раке легких
Основные факты о раке легких
- Рак легких — второй по распространенности рак среди мужчин и женщин.
- Немелкоклеточный рак легкого (НМРЛ) составляет от 80% до 90% всех случаев рака легких каждый год.

- На мелкоклеточный рак легкого (МРЛ) ежегодно приходится от 10% до 20% всех случаев рака легкого.
- Курение — причина номер один рака легких.
Рак легких — второй по распространенности рак среди мужчин и женщин. Рак относится к процессу, при котором аномальные клетки бесконтрольно разрастаются. Рак легкого трудно диагностировать на ранних стадиях, поэтому важно обратиться к пульмонологу — врачу, специально обученному для диагностики и лечения заболеваний легких, — как только вы подозреваете проблему. После диагностики рака легких ваш пульмонолог соберет команду специалистов, чтобы у вас был полный спектр новейших вариантов лечения.Вместе эти медицинские эксперты могут выбрать лучшее лечение для вашего конкретного типа рака легких.
Как рак легких влияет на организм
Различные виды рака легких часто по-разному влияют на организм. Лечение зависит от типа рака и стадии рака. Стадия указывает на то, насколько широко распространен рак в вашем теле. Это в одной области легкого или распространилось? Стадия рака легких имеет решающее значение, потому что лечение может варьироваться в зависимости от стадии.
Это в одной области легкого или распространилось? Стадия рака легких имеет решающее значение, потому что лечение может варьироваться в зависимости от стадии.
Стадия рака легких также влияет на прогнозируемый исход болезни — ее прогноз . Люди с раком более низкой стадии, где рак более локализован, как правило, имеют лучшие результаты, чем люди с раком поздней стадии.
Понимая, где находится рак легких, как и где он распространяется, ваша медицинская бригада может составить специальный план лечения для вас.
Типы рака легких
NSCLC представляет от 80% до 90% всех случаев рака легких каждый год.НМРЛ бывает трех типов:
- Аденокарцинома, наиболее распространенный тип НМРЛ
- Плоскоклеточная карцинома, на долю которой приходится около 25% случаев НМРЛ
- Крупноклеточная карцинома, на которую приходится около 10% случаев НМРЛ
SCLC составляет от 10% до 20% всех случаев рака легких каждый год. Опухоли SCLC имеют тенденцию расти быстрее, чем опухоли NSCLC. Эти опухоли изначально могут быть более чувствительными к химиотерапии.
Опухоли SCLC имеют тенденцию расти быстрее, чем опухоли NSCLC. Эти опухоли изначально могут быть более чувствительными к химиотерапии.
Что вызывает рак легких?
Курение
Курение по-прежнему остается главной причиной рака легких.Фактически, курение также является причиной многих других видов рака. По оценкам Американского онкологического общества, от 80% до 85% всех случаев рака легких в Соединенных Штатах связаны с курением, включая людей, бросивших курить.
Любой вид курения увеличивает риск рака легких. Сигареты, сигары и трубки связаны с раком легких. Курение марихуаны также может увеличить риск, особенно у молодых людей. Пассивное курение также увеличивает риск.По оценкам, пассивное курение является причиной более 3000 случаев смерти от рака легких среди некурящих взрослых.
Генетические причины
Исследователи узнают, что определенные генетические мутации связаны с раком легких. Мутации — это изменения в генах, которые заставляют их работать не так, как их «нормальные» версии. Люди, у которых есть эти мутировавшие гены, могут с большей вероятностью заболеть раком легких. Наличие одного из этих генов может быть причиной того, что некоторые некурящие заболевают раком легких.
Мутации — это изменения в генах, которые заставляют их работать не так, как их «нормальные» версии. Люди, у которых есть эти мутировавшие гены, могут с большей вероятностью заболеть раком легких. Наличие одного из этих генов может быть причиной того, что некоторые некурящие заболевают раком легких.
Прочие причины
Другие вредные вещества могут вызывать рак легких, включая радон и асбест. Радон — это природный невидимый радиоактивный газ без запаха и вкуса. Люди, подвергшиеся воздействию высоких уровней радона, с большей вероятностью заболеют раком легких. Фактически, облучение радоном является основной причиной рака легких у некурящих.
Воздействие асбеста, вещества на минеральной основе, которое когда-то использовалось для изоляции и строительства зданий, может вызвать рак легких, особенно у курильщиков.Загрязнение воздуха также связано с раком легких.
Навигация по раку легкого
Инфографика о раке легких
О биопсии при раке легкого
Рак легких — второй по распространенности вид рака среди мужчин и женщин. Это когда аномальные клетки легких выходят из-под контроля. Рак легкого сложно диагностировать на ранних стадиях. Важно обратиться к пульмонологу — врачу, специально обученному для диагностики и лечения заболеваний и состояний легких, — как только вы подозреваете проблему.
Это когда аномальные клетки легких выходят из-под контроля. Рак легкого сложно диагностировать на ранних стадиях. Важно обратиться к пульмонологу — врачу, специально обученному для диагностики и лечения заболеваний и состояний легких, — как только вы подозреваете проблему.
Это руководство по обучению пациентов, инфографика и другие сопутствующие материалы щедро поддерживаются Lungevity, Go2Foundation и Обществом торакальных хирургов.
Фактов о раке легких — Regional Cancer Care Associates
Рак легких является не только вторым по распространенности типом рака как для мужчин, так и для женщин, он также является причиной большинства смертей, связанных с раком, в США. Американское онкологическое общество сообщает, что только в 2018 году , по оценкам, будет диагностировано 234 030 новых случаев рака легких.Предполагается, что из них выживут примерно 79 980 пациентов. Эта статистика доказывает, насколько важно для пациентов получить доступ к наилучшей возможной помощи, и жители Нью-Джерси, Мэриленда и Коннектикута могут получить именно это в Regional Cancer Care Associates (RCCA).
Типы рака легкого
Рак легкого начинается, когда в легком (ах) развиваются и начинают расти аномальные клетки. В конце концов, они могут превратиться в злокачественную опухоль. Хотя большинство видов рака легких начинаются именно так, не все они имеют одинаковые характеристики.Существует три различных типа рака легких:
- Немелкоклеточный рак легкого (НМРЛ) — НМРЛ является наиболее распространенным типом рака легких у взрослых американцев, на который приходится около 85% всех случаев. Подтипы включают аденокарциному, плоскоклеточную карциному и крупноклеточную карциному.
- Мелкоклеточный рак легкого (SCLC) — Второй по распространенности тип рака легкого — SCLC. Он имеет тенденцию быстро расти, но обычно хорошо поддается лечению химиотерапией.
- Карциноидная опухоль легкого — Редкая опухоль легкого, карциноидная опухоль легких составляет менее 5% всех случаев рака легкого.
 Обычно он растет медленнее, чем другие типы, и почти никогда не распространяется или метастазирует в другие области тела.
Обычно он растет медленнее, чем другие типы, и почти никогда не распространяется или метастазирует в другие области тела.
Каковы признаки и симптомы?
Иногда даже самые, казалось бы, тривиальные симптомы, такие как непрекращающийся кашель или боль в плече, могут указывать на рак легких. Некоторые пациенты сообщают, что чувствуют себя очень плохо, в то время как другие почти не испытывают ничего необычного. Несмотря на то, что все случаи индивидуальны, некоторые из наиболее распространенных признаков рака легких включают:
- Кашель, продолжающийся несколько недель за раз
- Боль в груди, плече или спине
- Охриплость голоса
- Чувство одышки
- Резкое дыхание
- Рецидивирующий бронхит или пневмония
- Кашель с кровью
- Кровь в мокроте или слизи
После того, как рак прогрессирует и распространяется на другие части тела, пациенты могут также испытывать потерю аппетита и нежелательный вес потеря, сгустки крови, необычное кровотечение, отек шеи или лица, потеря памяти, головные боли, боли в костях или суставах, усталость и / или неустойчивая походка.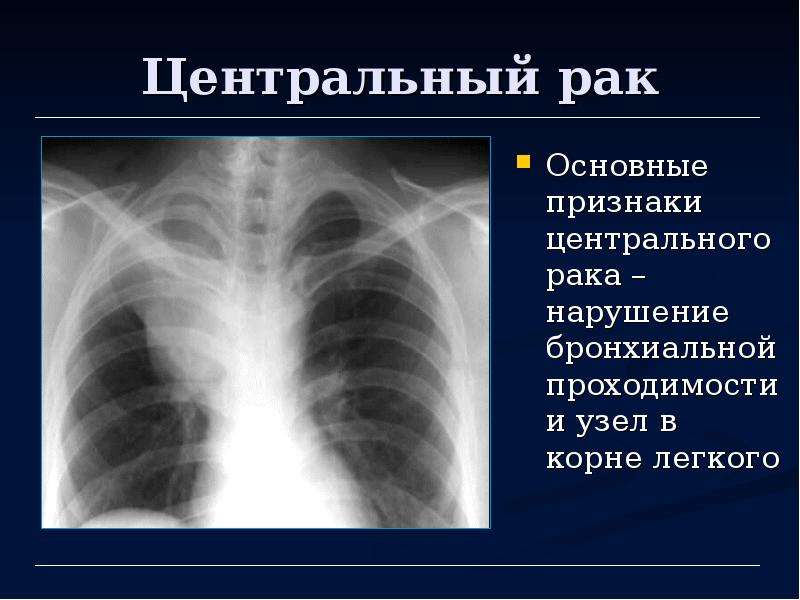
Некоторые пациенты склонны игнорировать свои симптомы или относить их к другим заболеваниям, но чем раньше вы поговорите со своим врачом о любых новых симптомах, тем лучше. Рак легких обычно диагностируется после проведения компьютерной томографии или ПЭТ в сочетании с метаболическим тестированием.
Факторы риска рака легких
Курение табака, безусловно, является основной причиной рака легких. Фактически, около 87% всех случаев рака легких в США могут быть связаны с курением.Однако, даже если вы бросите курить или никогда не курили, у вас все равно может развиться рак легких.
Помимо курения, к другим факторам риска относятся:
- Воздействие пассивного курения
- Рубцы на легких, вызванные туберкулезом
- Семейный анамнез рака легких
- Некоторые генетические мутации
- Воздействие асбеста, радона, радиации, мышьяка, уран, бериллий, винилхлорид, хроматы никеля, угольные продукты, горчичный газ, хлорметиловые эфиры, бензин и / или выхлопные газы дизельного топлива
Варианты лечения пациентов с раком легких
В зависимости от типа рака легких у вас и на какой стадии он прогрессировал, варианты лечения будут разными.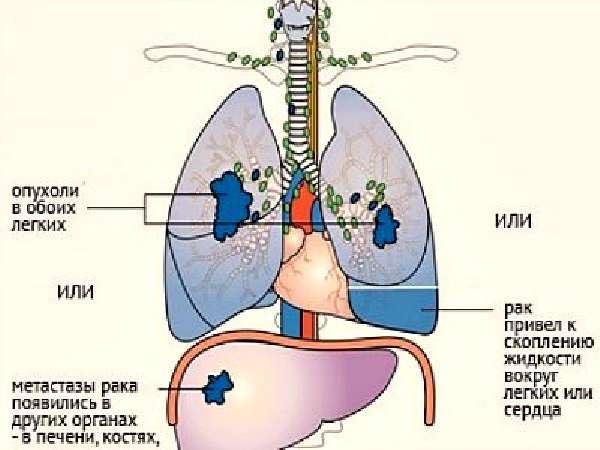 От агрессивной химиотерапии и лучевой терапии до духовного консультирования и йоги — путешествия двух пациентов с раком легких могут сильно отличаться друг от друга. Что бы ни рекомендовал ваш врач, знайте, что вы получаете доступ к современной помощи от RCCA.
От агрессивной химиотерапии и лучевой терапии до духовного консультирования и йоги — путешествия двух пациентов с раком легких могут сильно отличаться друг от друга. Что бы ни рекомендовал ваш врач, знайте, что вы получаете доступ к современной помощи от RCCA.
Некоторые распространенные варианты лечения рака легких могут включать передовые методы таргетной терапии и иммунотерапии. Пациенты также могут иметь право участвовать в клинических испытаниях, где они получат ранний доступ к последним инновациям.Пациентам с раком легких в RCCA также предоставляется комплексная паллиативная помощь и комплексная помощь, чтобы вы чувствовали себя комфортно и всегда получали поддержку. Решая каждую новую задачу, вы можете быть уверены, что попадете в надежные руки.
Доверьтесь RCCA
Получите эмоциональную, психологическую, физическую и финансовую поддержку, в которой вы и ваша семья нуждаетесь, в компании Regional Cancer Care Associates. Наш подход, ориентированный на пациента, помогает нашей команде удовлетворять уникальные потребности каждого пациента. Команда онкологов, медсестры и вспомогательный персонал обладают многолетним опытом, чтобы помочь пациентам победить в битве с раком легких.
Команда онкологов, медсестры и вспомогательный персонал обладают многолетним опытом, чтобы помочь пациентам победить в битве с раком легких.
Если ваше путешествие только начинается или вы готовы исследовать новые возможности, свяжитесь с RCCA сегодня. Вы можете связаться с нами по телефону (844) 346-7222 или назначить консультацию в ближайшем к вашему городу отделении RCCA, чтобы вас увидели как можно скорее.
Рак легкого 101 | Lungcancer.org
Что такое рак легких?
Рак легкого — это неконтролируемый рост аномальных клеток в одном или обоих легких.Эти аномальные клетки не выполняют функции нормальных клеток легких и не развиваются в здоровую ткань легких. По мере роста аномальные клетки могут образовывать опухоли и мешать работе легких, которые снабжают организм кислородом через кровь.
Генетическая основа рака легких
Все клетки в организме содержат генетический материал, называемый дезоксирибонуклеиновой кислотой (ДНК) . Каждый раз, когда зрелая клетка делится на две новые клетки, ее ДНК точно дублируется.Ячейки — это копии исходной ячейки, идентичные во всех отношениях. Таким образом, наши тела постоянно пополняются. Старые клетки отмирают, и следующее поколение заменяет их.
Каждый раз, когда зрелая клетка делится на две новые клетки, ее ДНК точно дублируется.Ячейки — это копии исходной ячейки, идентичные во всех отношениях. Таким образом, наши тела постоянно пополняются. Старые клетки отмирают, и следующее поколение заменяет их.
Рак начинается с ошибки или мутации в ДНК клетки. . Мутации ДНК могут быть вызваны нормальным процессом старения или факторами окружающей среды, такими как сигаретный дым, вдыхание волокон асбеста и воздействие газообразного радона.
Исследователи обнаружили, что для создания клетки рака легкого требуется серия мутаций .Прежде чем стать полностью злокачественными, клетки могут быть предраковыми, поскольку имеют некоторые мутации, но при этом нормально функционируют как клетки легких. Когда клетка с генетической мутацией делится, она передает свои аномальные гены двум новым клеткам, которые затем делятся на четыре клетки с ошибками в их ДНК и так далее. С каждой новой мутацией клетка ткани легкого становится все более мутированной и может не так эффективно выполнять свою функцию, как клетка легкого. На более поздней стадии заболевания некоторые клетки могут уйти от исходной опухоли и начать расти в других частях тела.Этот процесс называется метастазами , а новые отдаленные участки называются метастазами .
На более поздней стадии заболевания некоторые клетки могут уйти от исходной опухоли и начать расти в других частях тела.Этот процесс называется метастазами , а новые отдаленные участки называются метастазами .
Первичный и вторичный рак легкого
Первичный рак легких начинается в легких. Раковые клетки — это аномальные клетки легких. Иногда у людей рак перемещается из другой части тела или метастазируют в легкие. Это называется вторичным раком легких, потому что легкие являются вторичным местом по сравнению с первоначальным первичным местом расположения рака.Так, например, клетки рака молочной железы, которые попали в легкие, не являются раком легких, а скорее метастатическим раком молочной железы, и для них потребуется лечение, назначенное от рака молочной железы, а не рака легких.
Симптомы »
, почему это не только «болезнь курильщика».
Рак легких на подъеме: почему это не только «болезнь курильщика».

Самым распространенным предубеждением вокруг рака легких является то, что это «болезнь курильщика».Этот стереотип особенно беспокоит Саида Хансариниа, доктора медицины, торакального хирурга из больницы Пьемонт, Атланта, поскольку он ограничивает осведомленность общественности об этом заболевании. В то время как другие виды рака — молочной железы, простаты и толстой кишки — широко используются в информационных кампаниях и усилиях по сбору средств, раку легких обычно уделяется меньше внимания, несмотря на высокий уровень смертности.
Доктор Хансариния надеется избавиться от этой стигмы, особенно с учетом того, что заболеваемость раком легких у некурящих и женщин растет.«Это очень интересное мнение о том, что уровень смертности от рака легких в Соединенных Штатах растет», — говорит он.
«Это пугающая цифра, потому что, по оценкам, более 160 000 человек умрут от рака легких в Соединенных Штатах. Это 28 процентов всех смертей от рака ». В то время как число случаев рака легких растет среди женщин и некурящих, у мужчин наблюдается стабилизация.
В то время как число случаев рака легких растет среди женщин и некурящих, у мужчин наблюдается стабилизация.
Это, вероятно, связано с просвещением, осведомленностью и сокращением курения, — говорит д-р Хансариния. Есть два типа рака легких: мелкоклеточный и немелкоклеточный.Мелкоклеточный рак к моменту выявления часто бывает метастатическим и часто считается неоперабельным.
Немелкоклеточный рак легкого делится на три отдельные категории: аденокарцинома, плоскоклеточная карцинома и крупноклеточная карцинома. «Плоскоклеточная карцинома чаще всего ассоциируется с курильщиками, но есть много людей, которые курят и заболевают не плоскоклеточным раком легких — это может быть аденокарцинома или крупноклеточная карцинома», — отмечает доктор Хансариниа.
По мере роста числа случаев методы скрининга остаются ограниченными
«Печально то, что уровень заболеваемости раком легких у некурящих женщин растет, и у нас нет веских причин, [почему] для этого», — говорит он. «К сожалению, в настоящее время нет хороших исследований или тестов для оценки пациента, потому что существует риск облучения их от компьютерной томографии или рентгеновских лучей. Основываясь на долгосрочных исследованиях, рентген грудной клетки сам по себе не является хорошим скрининговым обследованием для выявления рака легких. Меня всегда это волновало «.
«К сожалению, в настоящее время нет хороших исследований или тестов для оценки пациента, потому что существует риск облучения их от компьютерной томографии или рентгеновских лучей. Основываясь на долгосрочных исследованиях, рентген грудной клетки сам по себе не является хорошим скрининговым обследованием для выявления рака легких. Меня всегда это волновало «.
Он говорит, что пассивное курение и облучение радоном могут играть определенную роль в развитии рака легких, но многие пациенты, которые редко подвергались воздействию, все еще могут болеть раком легких. «К сожалению, пациенты, у которых диагностирован рак легких, имеют общую стигматизацию — это может быть связано с их поведением», — сказал докторХансариния объясняет. «Что нам нужно сделать, так это забыть об этой стигме и начать смотреть на рак номер один в Соединенных Штатах. После болезней сердца рак легких — самый крупный убийца в Соединенных Штатах ».
На самом деле, по его словам, количество пациентов, ежегодно умирающих от рака легких, превышает количество смертей от рака толстой кишки, груди, простаты и поджелудочной железы вместе взятых. «Это несправедливо по отношению к той группе пациентов, которые не курили», — говорит д-р Хансариния. «Мы должны бороться с болезнью, а не со стигмой.”
«Это несправедливо по отношению к той группе пациентов, которые не курили», — говорит д-р Хансариния. «Мы должны бороться с болезнью, а не со стигмой.”
Для получения дополнительной информации о раке легких щелкните здесь.
Необходимо записаться на прием к врачу из Пьемонта? Экономьте время, бронируйте онлайн.
Обзор рака легких | Американская ассоциация исследований рака
Существует две основные формы рака легких — мелкоклеточный рак легкого и немелкоклеточный рак легкого.
Существует несколько типов немелкоклеточного рака легкого, для которых характерны различные виды раковых клеток.Раковые клетки каждого типа растут и распространяются по-разному. Наиболее распространенными типами немелкоклеточного рака легкого являются плоскоклеточный рак, который начинается в тонких плоских плоскоклеточных клетках; крупноклеточная карцинома; и аденокарцинома, которая начинается в клетках, выстилающих альвеолы.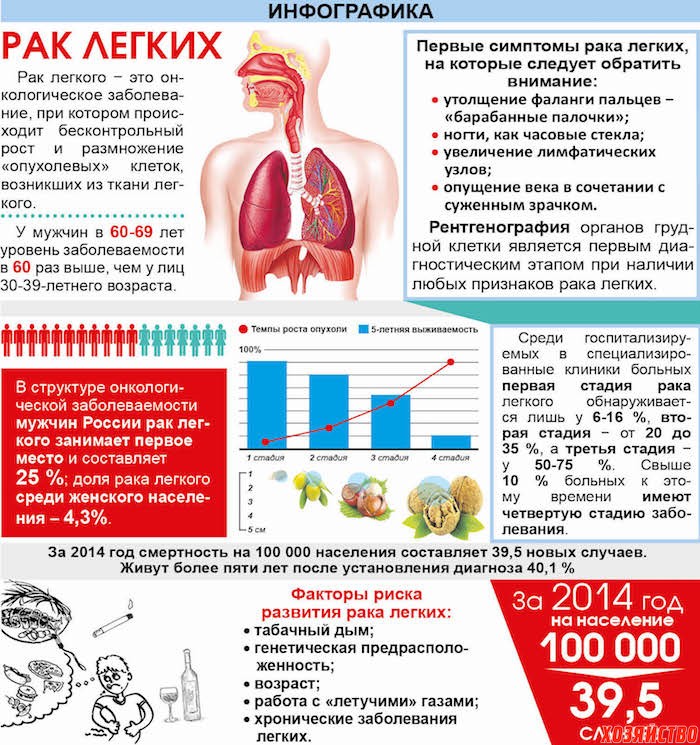 Другими менее распространенными типами немелкоклеточного рака легких являются: плеоморфная, карциноидная опухоль, карцинома слюнной железы и неклассифицированная карцинома.
Другими менее распространенными типами немелкоклеточного рака легких являются: плеоморфная, карциноидная опухоль, карцинома слюнной железы и неклассифицированная карцинома.
Существует два типа мелкоклеточного рака легкого — мелкоклеточная карцинома, также называемая раком овса, и комбинированная мелкоклеточная карцинома.
Согласно оценкам Программы надзора, эпидемиологии и конечных результатов Национального института рака (SEER), в 2020 году в США у 228 820 пациентов будет диагностирован рак легких и бронхов, а 135 720 пациентов умрут от этого заболевания. показатель для этих видов рака составляет 20,5 процента.
Курение сигарет, трубки или сигар — наиболее частая причина рака легких. К другим факторам риска рака легких относятся пассивное курение, семейный анамнез рака легких, лечение лучевой терапией груди или груди, воздействие асбеста, хрома, никеля, мышьяка, сажи или смолы на рабочем месте, и облучение радоном.Когда курение сочетается с другими факторами риска, увеличивается риск рака легких.

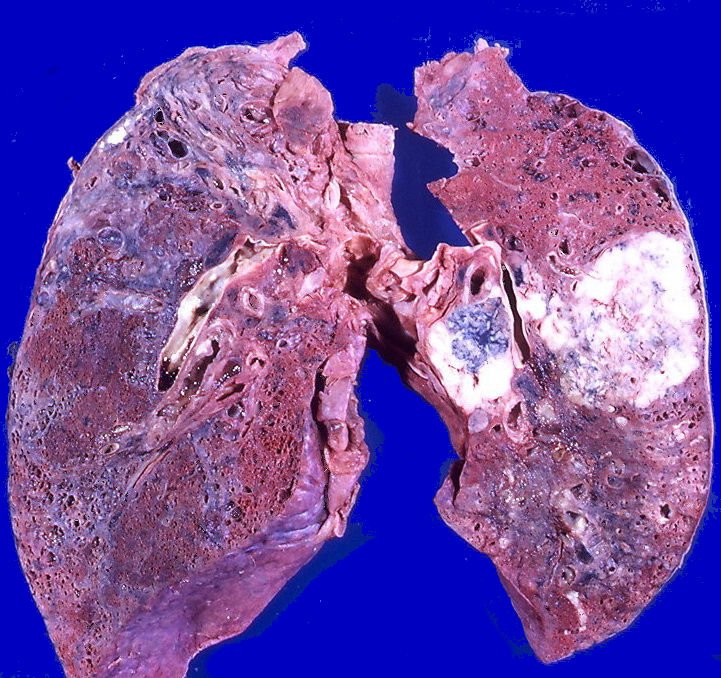 The organisations joined forces to provide a website aimed at policy makers focused on the respiratory health hazards associated with smoking.
The organisations joined forces to provide a website aimed at policy makers focused on the respiratory health hazards associated with smoking.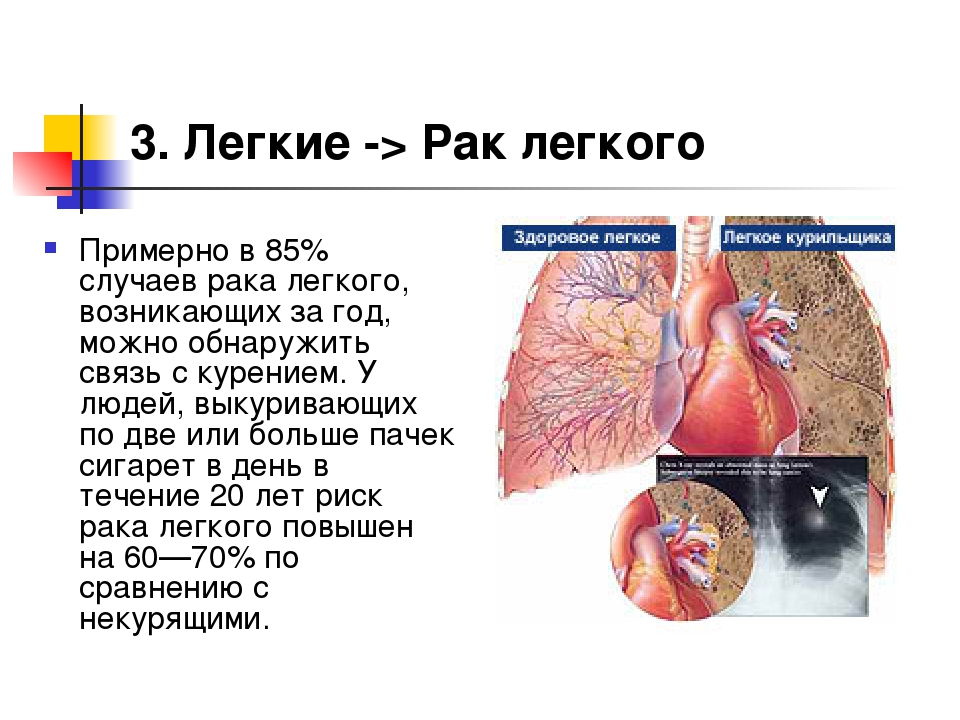


 Вредная работа вызывает 13% рака легкого.
Вредная работа вызывает 13% рака легкого. Химиотерапия
Химиотерапия
 Обычно он растет медленнее, чем другие типы, и почти никогда не распространяется или метастазирует в другие области тела.
Обычно он растет медленнее, чем другие типы, и почти никогда не распространяется или метастазирует в другие области тела.