Курильщиков предупредили о повышенном риске пневмонии
В мировых СМИ появилась противоречивая информация о том, как курение сочетается с воздействием коронавируса на легкие человека. Одни источники сообщают, что никотин якобы защищает клетки от поражения вирусом. Другие, напротив, утверждают, что наиболее тяжелые поражения легких как раз возникают у курильщиков.
Какое из этих утверждений верное? На этот и другие вопросы «РГ» ответила руководитель Федерального центра профилактики и контроля потребления табака НМИЦ терапии и профилактической медицины Минздрава России, кандидат медицинских наук Маринэ Гамбарян.
Маринэ Генриевна, так кто все-таки прав?
Маринэ Гамбарян: Давно доказано, что курильщики подвержены повышенному риску респираторных заболеваний. В мартовском номере журнала Tobacco Induced Diseases («Заболевания, вызванные табаком») опубликован систематический обзор «COVID-19 и курение». В нем проанализированы пять исследований о пациентах, инфицированных COVID-19.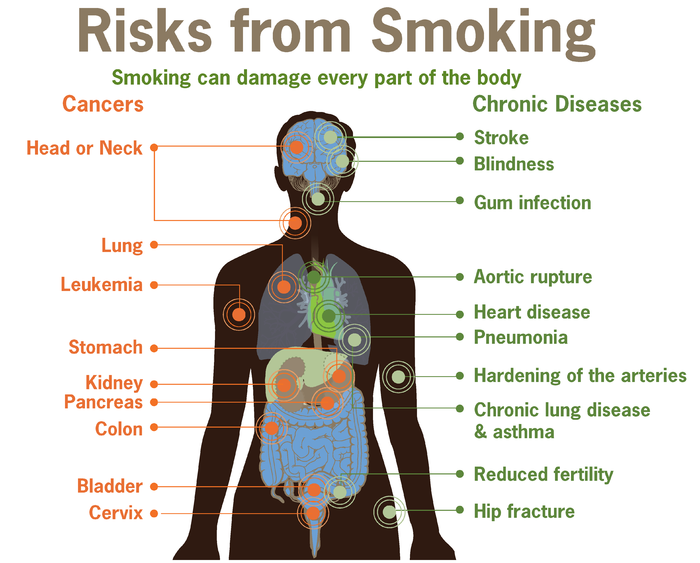 Отмечено, что доля нынешних и бывших курильщиков оказалась наиболее высокой среди тех пациентов, которым требовались реанимация, искусственная вентиляция легких, а также среди тех, кто умер.
Отмечено, что доля нынешних и бывших курильщиков оказалась наиболее высокой среди тех пациентов, которым требовались реанимация, искусственная вентиляция легких, а также среди тех, кто умер.
Китайские ученые, изучившие 78 пациентов с COVID-19, показали, что риск развития пневмонии у курильщиков на 14 процентов выше по сравнению с некурящими. Ученые единодушны: при всеобщей обеспокоенности по поводу пандемии, самое правильное — отказаться от курения: помимо пользы для здоровья своего и своих близких, это поможет умерить разгул SARS-CoV-2 в мире.
Вы советуете отказаться от курения именно сейчас, когда мы на самоизоляции, что многим дается довольно нелегко. Не ухудшит ли это психологическое состояние тех, кто курит?
Маринэ Гамбарян: Согласна, период самоизоляции — беспрецедентное испытание для всех, не только для курильщиков. Все СМИ и соцсети полны советов, как пережить этот период и не унывать. За месяц многие уже приспособились к новому состоянию, и оно для курильщиков, как и для всех, совсем другое, нежели обычное.
Привычный уклад жизни курильщиков подразумевает определенные действия, связанные с табаком. Например, когда неприятности на работе, первое, что делает курильщик, — бросается на улицу покурить. Многие курильщики привыкли к совместным перерывам (перекурам) с коллегами, сигарете после обеда, привыкли курить за рулем автомобиля и закуривать, едва садясь в него и т.д. Сейчас этот уклад жизни резко изменился, в нем нет привычных действий и передвижений и так называемых триггеров — то есть провоцирующих факторов. Правда, возможно, появились другие, и надо постараться не привязывать их к курению, не решать свои трудности с помощью сигареты, тем более что это бесполезно.
К тому же, нередко курильщик живет вместе с родными и близкими, которых нельзя подвергать воздействию табачного дыма. В подъездах теперь курить запрещено, и если даже курить у окна или на балконе, дым все равно поступает в комнату. А это значит, что близкие курильщика подвергаются воздействию вторичного и третичного курения.
Про пассивное курение мы все слышали, а это что за виды курения?
Маринэ Гамбарян: Вред вторичного курения — то есть вдыхания табачного дыма теми, кто находится рядом с курящим человеком, — давно доказан. Сами представители табачной отрасли еще в начале 80-х годов прошлого века установили, что вторичный дым с бокового потока в 2-4 раза более токсичен, чем дым основного потока сигареты, а его конденсат — в 2-6 раз более канцерогенен, чем конденсат дыма основного потока. Пассивное курение может вызвать сердечно-сосудистые заболевания, рак легкого, хронические бронхиты, бронхиальную астму и пневмонии у ни в чем не повинных людей. Это особенно опасно для детей, и может стать причиной внезапной детской смерти на первом году жизни, частых респираторных инфекций, в том числе пневмоний, отитов, утяжелять бронхиальную астму и т.д.
К тому же вторичный дым никуда не исчезает, содержащиеся в нем вредные соединения оседают и надолго остаются на стенах, коврах, обивке салона автомобилей, поверхностях мебели и предметов — это и называют третичным дымом. Он от 6 до 12 раз более токсичен, чем «свежий» вторичный дым. Современные исследования доказали, что в результате реакции поверхностно связанного никотина — основного компонента третичного дыма — с азотистой кислотой образуются канцерогенные табак-специфические нитрозамины (TSN), а при реакции с озоном — токсичные альдегиды. Сегодня известно, что третичного дыма недопустимо много в помещениях, где принято курение. Он содержит множество мутагенов и канцерогенов, то есть веществ, вызывающих рак. И также особо опасен для детей. Многие исследования показали, что при воздействии третичного дыма концентрация его компонентов — метаболитов никотина, акролеина и др. — гораздо выше в организме детей, чем у взрослых. Это вызывает поражения ДНК, может вызвать генетические и эпигенетические мутации, приводящие к развитию злокачественных новообразований.
Он от 6 до 12 раз более токсичен, чем «свежий» вторичный дым. Современные исследования доказали, что в результате реакции поверхностно связанного никотина — основного компонента третичного дыма — с азотистой кислотой образуются канцерогенные табак-специфические нитрозамины (TSN), а при реакции с озоном — токсичные альдегиды. Сегодня известно, что третичного дыма недопустимо много в помещениях, где принято курение. Он содержит множество мутагенов и канцерогенов, то есть веществ, вызывающих рак. И также особо опасен для детей. Многие исследования показали, что при воздействии третичного дыма концентрация его компонентов — метаболитов никотина, акролеина и др. — гораздо выше в организме детей, чем у взрослых. Это вызывает поражения ДНК, может вызвать генетические и эпигенетические мутации, приводящие к развитию злокачественных новообразований.
В пятницу, 8 мая, руководитель Федерального центра профилактики и контроля потребления табака НМИЦ терапии и профилактической медицины Минздрава России, кандидат медицинских наук Маринэ Гамбарян расскажет, каким должен быть алгоритм отказа от курения.
Табакокурение и внебольничная пневмония | Титова О.Н., Суховская О.А., Куликов В.Д.
Статья посвящена вопросам диагностики, клинической картины и лечения внебольничной пневмонии у курящих пациентов
Влияние табачного дыма на органы дыхания
Табакокурение (ТК) является основной причиной предотвратимой смертности и фактором риска развития различных заболеваний легких и дыхательных путей [1, 2].
Табачный дым вызывает морфологические изменения в эпителии слизистой бронхов с потерей ресничек, гипертрофией слизистых и увеличением бокаловидных клеток. В дыхательных путях возникает воспалительная реакция с активацией макрофагов и нейтрофилов, высвобождением протеаз, запускается выброс цитокинов. Это, в свою очередь, может сделать эпителий слизистой бронхов более чувствительным к инфекции [3-5]. Кроме того, в настоящее время известно, что компоненты табачного дыма ингибируют некоторые из ключевых функций врожденного и адаптивного иммунного ответа, изменяют ответ Toll-подобных рецепторов [6, 7], нарушают регуляцию NF-κB [3], пролиферацию CD4-лимфоцитов [5] и фагоцитоз [8]. Во многих работах продемонстрировано, что курение табака повышает восприимчивость к бактериальной инфекции [9, 10].
Во многих работах продемонстрировано, что курение табака повышает восприимчивость к бактериальной инфекции [9, 10].
Дыхательные пути и легкие постоянно подвергаются воздействию различных микроорганизмов, но в норме имеют достаточные защитные механизмы для предотвращения микробной инвазии (эффективный клиренс слизистой оболочки, целостность эпителиального барьера, альвеолярные макрофаги, которые распознают и фагоцитируют вторгающиеся микроорганизмы, и т. д.). Любой сбой этих механизмов может привести к распространению микроорганизмов в бронхах и ткани легких, вызывая внебольничную пневмонию (ВП), которая остается одной из основных причин смертности от болезней органов дыхания [11-13]. Внебольничной считают пневмонию, резвившуюся вне стационара либо диагностированную в первые 48 ч с момента госпитализации [12].
Факторы риска развития ВП
Одним из факторов риска ВП считается ТК вследствие различных причин, в т. ч. наличия хронической обструктивной болезни легких (ХОБЛ) у курящих пациентов, ослабления местного и системного иммунитета. Определить удельный вес ТК в развитии ВП достаточно трудно, поскольку в зарубежных исследованиях ТК связано с более низким социально-экономическим статусом, плохим питанием, повышенным потреблением алкоголя и сниженной физической активностью, которые также являются факторами риска ВП [14, 15], а отечественных исследований по этому вопросу практически нет.
Определить удельный вес ТК в развитии ВП достаточно трудно, поскольку в зарубежных исследованиях ТК связано с более низким социально-экономическим статусом, плохим питанием, повышенным потреблением алкоголя и сниженной физической активностью, которые также являются факторами риска ВП [14, 15], а отечественных исследований по этому вопросу практически нет.
ТК повышает риск развития ВП, и в ряде работ этот риск связан с продолжительностью употребления табака и числом выкуриваемых в день сигарет. В частности, в работе, опубликованной в 2019 г., риск ВП у выкуривающих 20 и более сигарет в день составил 3,3 (95% доверительный интервал (95% ДИ): 2,35-4,63) [9]. В то же время исследование в Кении (2017) продемонстрировало двукратное увеличение рисков развития ВП у курящих по сравнению с никогда не курившими, но не выявило корреляционной связи с показателем пачко/лет, а также с пассивным ТК [16].
Риски развития ВП у курящих зависят и от сопутствующих заболеваний: курящие больные ХОБЛ имели в 5 раз выше риски развития ВП по сравнению с курящими группы контроля (отношение шансов (ОШ) 4,94; 95% ДИ: 4,65-5,26), а экс-курящие больные ХОБЛ С в 4,26 раза по сравнению с аналогичной группой контроля [17].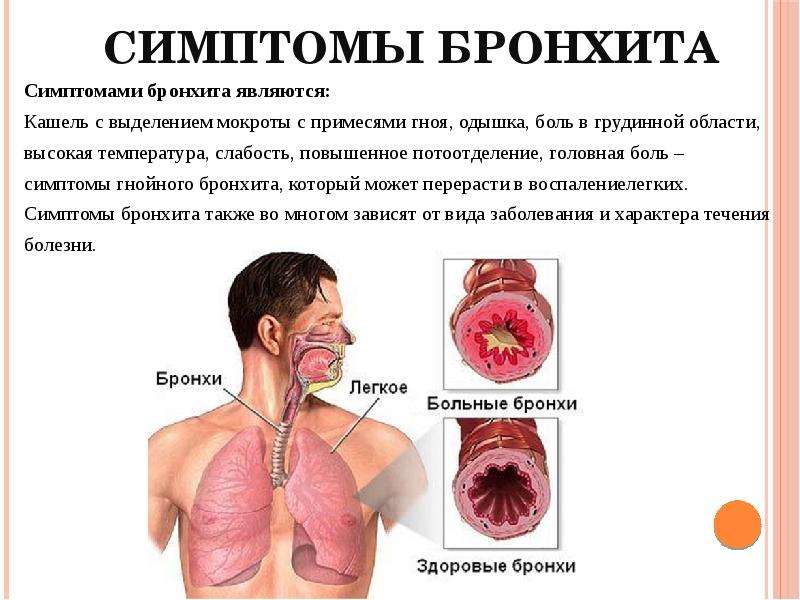
Влияние активного ТК было продемонстрировано в исследованиях изменений клиренса и фагоцитоза Streptococcus pneumoniae в легких [18], ингибирования антипневмококковой активности некоторых антимикробных пептидов врожденного иммунитета [19, 20]. Таким образом, курение табака ухудшает иммунитет к инфекции, особенно к S. pneumoniae.
Данные о влиянии ТК на прогноз ВП противоречивы. Так, в ряде исследований 1994-2007 гг. была выявлена более высокая смертность у курильщиков с пневмонией (ОШ=1,6; 95% ДИ: 1,3-1,9), исследование 2014 г. в Испании показало, что курение было независимым фактором риска смерти в течение 30 дней (ОШ=5,0; 95% ДИ: 1,8-13,5) [21-23]. Когортное исследование 1580 взрослых в Швеции выявило увеличение атрибутивного риска смертности при пневмонии (вызванной S. pneumoniae) на 14,9%, при этом с возрастом риск смерти увеличивался, т. к. возраст коррелировал с увеличением атрибутивного риска (независимо от других факторов): от 1,3% в возрасте до 45 лет и до 26,1% в возрасте старше 85 лет [24].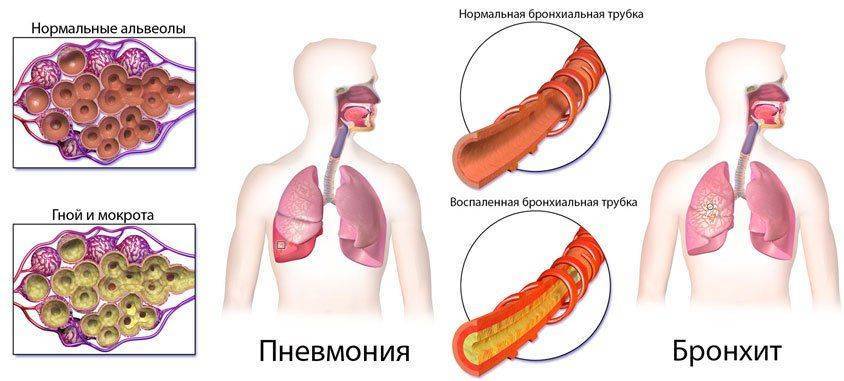 В то же время метаанализы ряда исследований не обнаружили ассоциации ТК и прогноза ВП. Хотя у курящих с ВП было диагностировано больше сопутствующих заболеваний, им чаще требовалась более интенсивная терапия, тем не менее смертность в группах курящих и некурящих была сходной [25, 26].
В то же время метаанализы ряда исследований не обнаружили ассоциации ТК и прогноза ВП. Хотя у курящих с ВП было диагностировано больше сопутствующих заболеваний, им чаще требовалась более интенсивная терапия, тем не менее смертность в группах курящих и некурящих была сходной [25, 26].
Исследование в Испании (1041 больной ВП) продемонстрировало, что ТК было независимым фактором риска септического шока при пневмококковой пневмонии (ОШ=2,11; 95% ДИ: 1,02-4,34). Риски развития септического шока у курящих были ниже, чем при приеме кортикостероидной терапии (ОШ=4,45), но различия с некурящими были достоверны (р=0,044) [27]. Принимая во внимание все эти данные, мы можем сделать вывод об ухудшении прогноза пневмококковой пневмонии у активных курильщиков.
Менее частой является ВП, вызванная Legionella pneumophila. В 2013 г. 51% случаев всех заболеваний были вызваны Legionella longbeachae, 28% С L. pneumophila, 21% С Legionella spp. [24]. Среди факторов риска этого заболевания С ТК: у тех, кто курил более 10 лет, риск развития заболеваний, обусловленных Legionella spp. , составил 14,7 (95% ДИ: 3,7-58,4) [24]. Этот повышенный риск связан в т. ч. с трудностью эрадикации микроорганизма из бронхиального дерева из-за ухудшения состояния слизистой оболочки дыхательных путей и нарушения функции ресничек, вызванных табачным дымом.
, составил 14,7 (95% ДИ: 3,7-58,4) [24]. Этот повышенный риск связан в т. ч. с трудностью эрадикации микроорганизма из бронхиального дерева из-за ухудшения состояния слизистой оболочки дыхательных путей и нарушения функции ресничек, вызванных табачным дымом.
Табакокурение и развитие сопутствующих заболеваний
ТК способствует развитию заболеваний, которые являются факторами риска ВП. Табачный дым вызывает широкий спектр местных повреждений, отрицательно влияющих на вентиляцию легких и газообмен, что приводит к различным клиническим проявлениям, включая одышку, кашель, гипоксемию и гиперкапнию. Исследование 167 человек, курящих на протяжении более 10 лет и считающих себя здоровыми, показало, что признаки хронического бронхита были у большинства обследованных (67%), 24% имели начальные, а 15% С выраженные нарушения проходимости дыхательных путей [28].
Результаты научных исследований влияния табачного дыма на развитие ХОБЛ, бронхиальной астмы, рака легкого достаточно полно проанализированы как в зарубежной, так и в отечественной литературе. Наличие ХОБЛ повышает риски развития пневмонии [29Р31]. При обследовании 14 494 пациентов в США расчетные риски развития ВП у больных ХОБЛ были в 2,79 раза выше (95% ДИ: 1,426-5,471) по сравнению с лицами без ХОБЛ [30]. Смертность от пневмонии у больных ХОБЛ (данные по больным Дании и Германии) была достоверно выше, чем у больных без ХОБЛ: 16,0% против 11,3%, р=0,04 [31]. Курящие больные ХОБЛ имели сходные с некурящими больными ХОБЛ риски развития ВП, в то время как отсутствие ХОБЛ увеличивало риски развития ВП у курящих в 1,23 раза (95% ДИ: 1,13-1,34) по сравнению с некурящими [17].
Наличие ХОБЛ повышает риски развития пневмонии [29Р31]. При обследовании 14 494 пациентов в США расчетные риски развития ВП у больных ХОБЛ были в 2,79 раза выше (95% ДИ: 1,426-5,471) по сравнению с лицами без ХОБЛ [30]. Смертность от пневмонии у больных ХОБЛ (данные по больным Дании и Германии) была достоверно выше, чем у больных без ХОБЛ: 16,0% против 11,3%, р=0,04 [31]. Курящие больные ХОБЛ имели сходные с некурящими больными ХОБЛ риски развития ВП, в то время как отсутствие ХОБЛ увеличивало риски развития ВП у курящих в 1,23 раза (95% ДИ: 1,13-1,34) по сравнению с некурящими [17].
Риски пневмонии значительно увеличиваются с возрастом больных, при этом для пациентов старшего и пожилого возраста характерна мультиморбидная патология. Присоединение к ХОБЛ сердечно-сосудистых заболеваний (ССЗ) увеличивает частоту ВП [32], при этом известно, что ТК является причиной развития ССЗ [1]. Даже выкуривание 1 сигареты в день увеличивает риски развития ССЗ в 1,48 раза у мужчин (95% ДИ: 1,30-1,69) и в 1,57 раза у женщин (95% ДИ: 1,29-1,91) [33].
Инфекции верхних дыхательных путей также являются фактором риска ВП. И ТК влияет на восприимчивость к вирусной инфекции [34, 35], оказывая супрессивное воздействие на эпителий дыхательных путей, альвеолярные макрофаги, дендритные клетки, естественные киллеры, одновременно приводя к системной хронической активации нейтрофилов [34]. Повышенная восприимчивость к вирусной инфекции также наблюдалась у курильщиков и тех, кто вынужден вдыхать окружающий табачный дым [36]. Изучение случаев госпитализации по поводу гриппа в Испании (728 случаев) показало, что ТК увеличивало риск госпитализации в 1,32 раза (95% ДИ: 1,04-1,68). Эффективность противогриппозной вакцинации составила 21% (95% ДИ: С2; 39) у курящих и экс-курящих, в то время как у некурящих С 39% (95% ДИ: 22-52) [35].
Американское научное общество инфекционных заболеваний и Американское торакальное общество рекомендуют курящим больным, госпитализированным по поводу ВП, отказ от употребления табака и пневмококковую вакцину [37], поскольку у активных курильщиков наблюдаются более низкие показатели иммунитета против гриппа и пневмококка по сравнению с бывшими курильщиками и некурящими [38].
Еще одним, менее известным фактором риска развития ВП являются заболевания пародонта, которые чаще встречаются у лиц, потребляющих табак [39, 40]. Исследования в США выявили, что курящие в 4 раза чаще имели заболевания пародонта (ОШ=3,97; 95% ДИ: 3,20-4,93), чем некурящие. При этом имелся дозозависимый эффект, и риск развития заболеваний увеличивался с увеличением числа выкуриваемых в день сигарет: лица, выкуривающие менее 10 сигарет в день, имели заболевания пародонта в 1,9-4,1 раза чаще, чем некурящие, т. е. ОШ=2,79, а при потреблении более 30 сигарет в день ОШ повышался до 5,88 (95% ДИ: 4,03-8,58). При отказе от сигарет риски снижались с 5,88 до 3,22 при продолжительности абстиненции до 2 лет. Через 11 лет после отказа от ТК риски заболеваний пародонта были сопоставимы с таковыми у некурящих: ОШ=1,15 [40]. Заболевания пародонта были ассоциированы с болезнями органов дыхания: пневмонией (ОШ=2,6; 95% ДИ: 2,2-5,7), туберкулезом легких, абсцессом легкого, раком легкого [41]. В исследовании японских ученых (2018) показано, что среди 19 775 пациентов с заболеваниями пародонта смертность от пневмонии была выше у курящих [42].
В исследовании японских ученых (2018) показано, что среди 19 775 пациентов с заболеваниями пародонта смертность от пневмонии была выше у курящих [42].
Пассивное курение
Пагубно влияет на здоровье не только активное, но и пассивное ТК. Исследования показывают, что пассивное ТК приводит к повышенному риску респираторных инфекций и пневмонии. Повреждения дыхательного эпителия, соединительной ткани и сосудистого эндотелия, вызванные табачным дымом, могут возникать даже при низких концентрациях дыма, вызывая различные заболевания и нарушения [43], что может быть важным фактором риска развития ВП у пассивных курильщиков. Большинство опубликованных работ, рассматривающих влияние окружающего табачного дыма на развитие пневмонии, посвящены детскому возрасту или выполнены на экспериментальных моделях. В одной из работ (2019) среди никогда не куривших риск развития пневмонии при пассивном ТК составил 1,06 (95%ДИ: 1,02-1,10) [44].
С патофизиологической точки зрения прекращение курения является целесообразным при всех формах ВП. Пока нет надежных данных о том, как меняется прогноз у пациентов ВП, бросивших курить. В одной из работ показано, что риск заболевания ВП значительно уменьшается при отказе от ТК: через 5 лет он снижается на 50% [45]. Исследование в Японии продемонстрировало, что после отказа от ТК риски ВП снижались с 1,6 у активных курильщиков до 0,7 (95% ДИ: 0,5-1,0) у экс-курильщиков, что было сопоставимо с некурящими [46].
Пока нет надежных данных о том, как меняется прогноз у пациентов ВП, бросивших курить. В одной из работ показано, что риск заболевания ВП значительно уменьшается при отказе от ТК: через 5 лет он снижается на 50% [45]. Исследование в Японии продемонстрировало, что после отказа от ТК риски ВП снижались с 1,6 у активных курильщиков до 0,7 (95% ДИ: 0,5-1,0) у экс-курильщиков, что было сопоставимо с некурящими [46].
Наиболее эффективным методом отказа от ТК является сочетание поведенческой поддержки и лечения. Из лекарственных препаратов в Российской Федерации зарегистрированы варениклин, никотинзаместительная терапия и цитизин, доказана их эффективность, особенно в сочетании с когнитивно-поведенческой терапией [47]. Исследование лечения никотиновой зависимости у больных ВП показало, что применение варениклина и телефонного консультирования позволило повысить шансы остаться некурящими в 7,29 раза (95% ДИ: 2,15-24,77) и улучшило качество жизни, связанное со здоровьем (согласно вопроснику SF-36) [48]. Учитывая, что ухудшение состояния здоровья повышает мотивацию к отказу от ТК, необходимо начинать лечение никотиновой зависимости и оказывать помощь в отказе от потребления табака при первом же обращении пациента за медицинской помощью.
Учитывая, что ухудшение состояния здоровья повышает мотивацию к отказу от ТК, необходимо начинать лечение никотиновой зависимости и оказывать помощь в отказе от потребления табака при первом же обращении пациента за медицинской помощью.
Заключение
Воздействие табака приводит к различным изменениям дыхательных путей, возникновению воспалительной реакции, повышает восприимчивость организма к инфекции. Показано, что риски развития пневмонии и ее исход чаще всего ухудшаются у курящих пациентов. Кроме того, употребление табака может способствовать развитию заболеваний, которые также являются факторами риска ВП и смертельного исхода, таких как ХОБЛ, вирусные инфекции, ССЗ, пародонтоз и др. Необходимо предлагать курящим пациентам отказаться от ТК и в случае необходимости назначать соответствующее лечение. Наиболее эффективным методом лечения никотиновой зависимости является сочетание когнитивно-поведенческой и лекарственной терапии.
.
Курение нарушает иммунитет бронхов / Новости города / Сайт Москвы
17 ноября отмечается Международный день отказа от курения, а 16-го прошёл Всемирный день борьбы против хронической обструктивной болезни лёгких (ХОБЛ). Это так называемая болезнь курильщиков. В Москве зарегистрировано около 200 тысяч больных ХОБЛ. Кроме того, в столице около 170 тысяч астматиков, а пневмонией болеют примерно 13,5 тысячи человек в год.
Это так называемая болезнь курильщиков. В Москве зарегистрировано около 200 тысяч больных ХОБЛ. Кроме того, в столице около 170 тысяч астматиков, а пневмонией болеют примерно 13,5 тысячи человек в год.
Главный пульмонолог Департамента здравоохранения Москвы Андрей Белевский рассказал в интервью mos.ru о том, как в столице лечат лёгочные заболевания, чем помогут курильщикам городские центры здоровья и можно ли защититься от пневмонии с помощью прививки.
— Андрей Станиславович, 16 ноября — Всемирный день борьбы против хронической обструктивной болезни лёгких. Какие мероприятия запланированы в Москве?
— В городских медицинских организациях с 17 по 19 ноября будут проходить дни здоровья. В поликлиниках состоятся встречи с пульмонологами, будут работать школы здоровья для больных ХОБЛ и бронхиальной астмой.
Кстати, в этом году Всемирный день борьбы с ХОБЛ совпадает с Международным днём отказа от курения. Поэтому все желающие смогут также пройти тестирование на степень никотиновой зависимости и проконсультироваться у специалистов кабинетов отказа от курения.
Также в центрах здоровья при поликлиниках можно будет пройти спирометрию — измерение функции лёгких. Большая общегородская конференция «ХОБЛ — сегодня и завтра» начнёт работу 21 ноября в здании Правительства Москвы на Новом Арбате. Для медицинского сообщества в округах состоятся конференции с участием врачей-пульмонологов.
Хроническая обструктивная болезнь легких — это, как правило, болезнь курильщиков
— То есть из бесплатной диагностики будет доступна только спирометрия?
— А большего для выявления ХОБЛ не нужно. Функция лёгких — это то, что страдает при всех подобных заболеваниях. Самым первым признаком проблемы становится затруднённое дыхание.
— А как лечат ХОБЛ?
— ХОБЛ — это, как правило, болезнь курильщиков. Лечить её трудно, так как многие пациенты обращаются к врачу очень поздно. ХОБЛ по сути своей является сочетанием хронического бронхита и эмфиземы лёгких. Хронический бронхит приводит к сужению просвета дыхательных путей, лёгкие получают меньше воздуха. А эмфизема приводит к уменьшению полезной площади лёгких, которая участвует в газообмене.
Можно курить десятилетиями, кашлять по утрам, но списывать это на кашель курильщика. И пациент обращается к врачу только тогда, когда у него начинается тяжёлая одышка. А на этой стадии, к сожалению, лекарственное лечение уже не даёт полного эффекта
Проще говоря, как реакция на курение у человека развивается воспаление, которое разрушает лёгкие и бронхи. Но разрушение это происходит очень медленно, болезнь может развиваться годами, оставаясь так и не замеченной человеком. Пациента мучает одышка при небольших физических нагрузках, может появляться кашель в ночные и утренние часы.
— То есть ярко выраженных симптомов нет?
— Да, это так. Можно курить десятилетиями, кашлять по утрам, но списывать это на кашель курильщика. И пациент обращается к врачу только тогда, когда у него начинается тяжёлая одышка. А на этой стадии, к сожалению, лекарственное лечение уже не даёт полного эффекта. Основное лечение ХОБЛ — это приём бронхорасширяющих средств.
— Какие лёгочные заболевания наиболее распространены в Москве?
— Это и хроническая обструктивная болезнь лёгких, и бронхиальная астма. А из острых болезней наиболее распространена пневмония. Список справедлив не только для Москвы — это самые распространённые заболевания дыхательных путей во всём мире. Если обобщить, то вся пульмонология в основном направлена на лечение трёх болезней — астмы, бронхита и пневмонии.
На мой взгляд, сильной вспышки вирусных инфекций в этом сезоне быть не должно
— Сколько человек болеет у нас в городе?
— Зарегистрированных больных ХОБЛ около 200 тысяч, астматиков около 170 тысяч. Каждый год заболеваемость ХОБЛ и астмой растёт на один-два процента. А что касается пневмонии, ею ежегодно болеют примерно 13,5 тысячи человек.
— В прошлом году были распространены формы гриппа, которые достаточно быстро приводили к осложнениям в виде пневмонии. В этом сезоне ожидать того же самого?
— Этот вопрос, скорее, к инфекционисту или к эпидемиологу, чем к пульмонологу. Но, на мой взгляд, сильной вспышки вирусных инфекций в этом сезоне быть не должно.
— Как не получить осложнения тем, кто всё-таки заболел гриппом?
— Рекомендация только одна — необходимо вовремя начать лечение, обратиться к врачу при первых же симптомах болезни. И кстати, не стоит забывать о вакцинации, она продолжается в городских поликлиниках до конца ноября.
— Пики вирусных и лёгочных заболеваний совпадают? Это осенне-зимний период?
— Да, совпадают, но это, скорее, зимне-весенний период. Эти заболевания часто взаимосвязаны: вирусная инфекция буквально тащит за собой пневмонию.
Курение нарушает иммунитет бронхов, а алкоголь — иммунитет всего организма
— Расскажите про группы риска. Кто обычно болеет тяжёлой формой воспаления лёгких?
— Тяжелее всего пневмония протекает у пожилых людей, у пациентов с хроническими заболеваниями, с сахарным диабетом, с ВИЧ-инфекцией и онкологическими заболеваниями. То есть это те люди, у которых защита организма по разным причинам нарушена и микроб не встречает должного сопротивления.
— Большой город можно отнести к факторам риска для возникновения заболеваний лёгких?
— Многолюдная городская среда не влияет прямо на возникновение воспаления лёгких или появление хронических заболеваний лёгких. Но среда мегаполиса может стать источником инфекции, которая может привести к этим осложнениям. Конечно, во время вспышек респираторных заболеваний и гриппа желательно избегать массового скопления людей и ограничить пребывание в общественных местах.
И конечно, стоит сделать противопневмококковую вакцинацию. Эта прививка не столь востребована, как прививка от гриппа. Сейчас во врачебном сообществе идёт серьёзное обсуждение такого вида вакцинации и вырабатывается стратегия по более широкому её распространению
— А какую профилактику стоит провести перед зимним сезоном, чтобы уберечь бронхи и лёгкие?
— Нужно вести здоровый образ жизни, как бы банально ни звучал этот совет. Необходимо заниматься физическими упражнениями и закаливанием, не стоит курить и злоупотреблять алкоголем. Дело в том, что курение нарушает иммунитет бронхов, а алкоголь — иммунитет всего организма и вызывает микроаспирацию (засасывание желудочного содержимого в дыхательные пути. — Прим. mos.ru) в ночное время. И конечно, стоит сделать противопневмококковую вакцинацию. Эта прививка не столь востребована, как прививка от гриппа. Сейчас во врачебном сообществе идёт серьёзное обсуждение такого вида вакцинации и вырабатывается стратегия по более широкому её распространению.
— Это платная прививка?
— Нет, она бесплатна, и её можно сделать в поликлиниках города. Пока в Москве от пневмококковой инфекции ежегодно прививаются лишь несколько тысяч человек.
Больше всего реабилитация нужна пациентам с ХОБЛ. Им требуется физическая нагрузка. Несмотря на одышку и протесты пациентов, врачи ставят их на беговую дорожку, дают гантели в руки — тренируют мускулатуру. Это, кстати, универсальное противовоспалительное средство и помощь в восстановлении при любых болезнях лёгких
— Расскажите, а каковы последние достижения в области лечения лёгочных болезней?
— Появился препарат, который помогает лечить тяжёлые формы астмы. Это моноклональные антитела против иммуноглобулина Е. Белок иммуноглобулин Е имеет решающее значение при тяжёлом течении болезни. Когда пациентам обычные лекарства почти не помогают, им вводят моноклональные антитела, которые связывают иммуноглобулин Е и выводят его из организма. Это позволяет изменить течение заболевания. Но такое лечение очень дорогое.
— Кто-то получает его бесплатно?
— Департамент здравоохранения при поддержке Правительства Москвы запустил специальную программу для пациентов с тяжёлыми формами астмы. Ежегодно из бюджета города на неё выделяются средства. Специалисты-пульмонологи выбирают участников программы согласно медицинским показаниям пациентов.
— Расскажите про достижения в области трансплантации лёгких.
— Сама по себе трансплантация лёгких — это уже прорыв и большое достижение для нашей медицины. Всего четыре года назад такие операции в Москве не проводили. Пересаживали почки, печень, сердце, но не лёгкие. Инициаторами проведения трансплантаций лёгких стали глава НИИ пульмонологии Федерального медико-биологического агентства Александр Чучалин и директор института Склифосовского Могели Хубутия. Пока институт Склифосовского чуть ли не единственное место в России, где пересаживают лёгкие. На сегодняшний день там проведено 45 уникальных операций.
— А как проходит реабилитация пациентов, перенёсших заболевание лёгких, или тех, кто прошёл через операцию?
— Больше всего реабилитация нужна пациентам с ХОБЛ. Им требуется физическая нагрузка. Несмотря на одышку и протесты пациентов, врачи ставят их на беговую дорожку, дают гантели в руки — тренируют мускулатуру. Это, кстати, универсальное противовоспалительное средство и помощь в восстановлении при любых болезнях лёгких. Лёгкие тоже тренируются во время физических упражнений — поступает большое количество воздуха, наступает гипервентиляция, альвеолы раскрываются.
Для многих, кто перенёс заболевание лёгких, хорошей реабилитацией и тренировкой становится ходьба на свежем воздухе, только проходить в день нужно не менее четырёх километров.
Если говорить об универсальных реабилитационных программах, то их нет. Это большая проблема во всём мире. Лучшей реабилитацией и профилактикой становится здоровый образ жизни, придерживаться которого должен каждый. Тем более что в последние годы в Москве развиваются парковые зоны, появляются площадки для занятий спортом на свежем воздухе, велосипедные дорожки летом, катки и лыжные трассы — зимой. Я бы советовал именно такое — активное и спортивное восстановление здоровья лёгких и всего организма.
Жизнь после пневмонии
О том, как проходит процесс восстановления и какие требуются лечебные мероприятия в ходе онлайн-вебинара рассказали главный внештатный специалист по профилактической медицине Министерства здравоохранения Челябинской области Ольга Агеева и врач-пульмонолог Татьяна Цветкова.
Татьяна Цветкова отметила, что после перенесенной пневмонии, вирусной или бактериальной, пациенты не сразу возвращаются в привычный ритм жизни: их беспокоит слабость, утомляемость, раздражительность, а иногда и депрессивные состояния. При этом специалист подчеркнула, что одним из грозных осложнений болезни является легочный фиброз, когда на легочной ткани образуются рубцы, что приводит к нарушениям дыхательной функции. Поэтому восстановительные процессы медики стараются начать как можно раньше.
«Восстановление после пневмоний – процесс не быстрый. Поэтому, чтобы вернуться к прежнему состоянию нужно приложить определенные усилия. Процесс медицинской реабилитации пациента с пневмонией начинается уже в стационаре: врач назначает какие-то мероприятия, с пациентом занимаются специалист ЛФК и массажист», — рассказывает Татьяна Цветкова.
Реабилитация продолжается и после выписки из стационара, но уже под наблюдением участкового терапевта. При этом важно учитывать, что процесс займет как минимум месяц-два. И здесь уже чрезвычайно важно активное, осознанное участие самого человека. Основными звеньями процесса дальнейшего восстановления являются дыхательная гимнастика и комплексы упражнений лечебной физкультуры.
«Дыхательная гимнастика направлена на то, чтобы восстановить функцию дыхательной системы, улучшить проходимость бронхов, увеличить эластичность легочной ткани, а также предотвратить возникновение фиброзных изменений легочной ткани, улучшить работу и выносливость дыхательных мышц, сердца, других органов и, в конечном счете, увеличить толерантность организма к физическим нагрузкам – это конечная цель», – добавляет врач-пульмонолог.
Видеоролики с комплексами упражнений размещены на сайте Челябинского центра медицинской профилактики.
Реабилитация после пневмонии также предполагает отказ от курения – легкие и без сигарет испытывают огромную нагрузку.
Отметим, что вирусы и бактерии, которые могут вызвать пневмонию также передаются воздушно-капельным путем. Поэтому, чтобы обезопасить свое здоровье, особенно в период пандемии, необходимо также носить маски в местах массового скопления людей, социальной дистанции и других санитарно-эпидемиологических норм.
Депздрав предупредил любителей кальяна о высокой токсичности дыма и риске развития рака легких
Увлечение кальяном не менее вредно для здоровья, чем курение сигарет, оно может привести к серьезным заболеваниям. Об этом сообщил заведующий Центром профилактики и лечения табакокурения и нехимических зависимостей Московского научно-практического центра наркологии столичного департамента здравоохранения Олег Кутушев.
Комментируя миф об относительной безопасности кальяна, врач отметил, что при сеансе длительностью в 45 минут курильщик потребляет больше угарного газа, чем при выкуривании пачки сигарет. Он подчеркнул, что вред для потребителей кальянов доказан многочисленными медицинскими исследованиями.
«Они документально подтверждают у курильщиков кальяна повышение сердечного ритма и кровяного давления, другие вредные острые сердечно-сосудистые эффекты, нарушение функции легких и переносимости физических нагрузок, увеличение возникновения воспаления легких, обмороки и острые отравления угарным газом. Систематические обзоры исследований указывают на значительные связи между курением кальяна и раком легких. Более поздние данные свидетельствуют о возможных связях с раком ротовой полости, пищевода, желудка и мочевого пузыря, а также с хронической обструктивной болезнью легких, сердечно-сосудистыми заболеваниями, инсультами. Дым при курении кальяна также токсичен, как и при курении сигарет», – сказал Олег Кутушев.
Врач отметил, что курильщики кальяна по сравнению с любителями сигарет подвергаются гораздо большему воздействию угарному газа (СО), значительно большему воздействию полициклических ароматических углеводородов (ПАУ), аналогичному воздействию никотина.
Олег Кутушев также развенчал миф о том, что сменный мундштук для кальяна поможет избежать риск заражения инфекциями.
«Кальян, как правило, курят в компаниях. Значит, велика вероятность заражения инфекционными заболеваниями: гепатитом, туберкулезом, герпесом. Передатчиком в данном случае может быть не кто-то из знакомой компании, а человек, который курил этот кальян до вас. Передача бактерий идет не из насадки, которую в приличных заведениях выдают каждому гостю, а из трубки. Именно здесь и в колбе кальяна обитают микробы. Дезинфицировать составные части кальяна в условиях кафе или ресторана достаточно сложно. В итоге получается, что человек покурил кальян, заразился, предположим, гепатитом, а узнал об этом спустя несколько лет», – добавил врач.
Переход с сигарет на кальян не означает, что курильщик избавился от зависимости, отметил Олег Кутушев.
«Это наивное представление. На самом деле произошло замещение способа доставки никотина в организм. Разница между кальяном и сигаретами в том, что сигареты курятся краткосрочно, а кальян — минимум около часа. Таким образом, на организм оказывается длительное вредное воздействие. За этот период курильщиком поглощается значительно больше дыма и никотина, чем от сигареты. Вероятность развития зависимости не меньше, чем от сигарет», – сказал он.
Если кальян расположен в непроветриваемом помещении, то добавляется вредный эффект пассивного курения, добавил Олег Кутушев.
Источник: АГН «Москва»
Кальян: мифы и реальность — Грайворонская психиатрическая больница
В этом году лето не балует нас теплой погодой. Гуляя прохладным вечером, хочется зайти в кафе и выпить чашку горячего чая. Однако, зачастую, в небольшом уютном помещении тебя встречает удушливо сладкий запах дыма и табака. И ты понимаешь, что попал в заведение, где хозяева предлагают к услугам посетителей кальян. Курить кальян стало модным несколько лет назад в нашей стране. Его преподносят как некий тренд. Кальянные заведения открываются один за другим. Большинство потребителей кальяна это молодые люди, которые по незнанию или под воздействием рекламы наивно полагают, что кальян безопасен для здоровья. Мало кто задумывается, как кальян влияет на здоровье. Что будет с организмом даже после нескольких затяжек?
Всемирной организацией здравоохранения были проведены многосторонние исследования, результаты которых развеют мифы о безопасности кальяна.
Миф 1. Табак, используемый в кальяне безопасен, так как, проходи через воду, очищается от вредных веществ.
По данным Всемирной организации здравоохранения анализ кальямного дыма выявил наличие канцерогенных веществ, таких как нитрозамиы, полициклические ароматические углеводороды, формальдегид, бензол и токсических веществ: оксид азота и тяжелые металлы. Кроме того, само сжигание угля, применяемого в кальяне, генерирует высокие уровни окиси углерода. Эти токсичные вещества имеют отношение к возникновению заболеваний сердца и легких, приводят к развитию рака.
Самым опасным среди них является бензапирен. Именно он в сочетании с угарным газом разрушает легкие, провоцирует стремительный рост раковых образований и приводит к быстрой смерти. Обследование курильщиков кальянов выявило, что через три года курения кальяна состояние их легочной ткани на 10 лет опережает паспортный возраст.
Курильщики кальянов находятся в зоне риска тех же заболеваний, что и обычные курильщики. Это:
— рак полости рта;
— рак легких;
— рак желудка;
— рак пищевода;
— снижение функции легких;
— импотенция;
— снижение способности к деторождению;
— ослабление зрения.
Исследования документально подтверждают у курильщиков кальяна повышение сердечного ритма и кровяного давления, другие вредные острые сердечно-сосудистые эффекты, нарушение функции легких и переносимости физических нагрузок, увеличение возникновения воспаления легких, обмороки и острые отравления угарным газом.
Нахождение в обществе курителей кальяна приравнивается к пассивному курению, оказывая действие, равносильное пребыванию в помещении, задымлённом сигаретой. При этом добавляются продукты сгорания древесного угля, используемого в качестве горючего вещества для кальяна, в виде окиси углерода и других химических соединений.
Миф 2. При использовании кальяна человек поглощает меньше токсических веществ.
Исследования показали, что в результате курения кальяна курильщики подвергаются значительному воздействию токсических соединений.
Кальянный табак фасуют в коробочки по 50 грамм, каждая из которых содержит 25 мг никотина. Этого количества достаточно для заправки четырех кальянов. Обычный математический подсчет показывает, что на каждого человека приходится 6,25 мг никотина.
Чтобы прогнать дым через воду, курильщики кальяна делают глубокий вдох, заполняя самые крохотные альвеолы легких влажным табаком, который содержит никотин, угарный газ, соли тяжелых металлов и канцерогены. В течение часа курильщик кальяна совершает от 40 до 200 глубоких затяжек, и при каждой из них в его легкие поступает около литра дыма.
Миф 3. Курение кальяна не вызывает зависимости.
Привыкание к кальяну в настоящее время значительным образом недооценивается. Никотин — это вещество, содержащееся в табаке, вызывающее зависимость. Он в значительных количествах присутствует и в кальянном дыме.
Водный фильтр удерживает часть никотина, но не гарантирует безопасность курения, а след-но курение кальяна вызывает привыкание.
Часто в кальяне вместо воды используются алкогольные напитки. Пары спирта через легкие поступают непосредственной в кровь, что со временем может привести к алкогольной зависимости.
Миф 4. Безникотиновый табак для кальяна безвреден.
Исследования табака без никотина и трав для кальяна показывают, что дым от них содержит окись углерода и другие токсичные вещества, способные увеличить риск развития рака, сердечно-сосудистых заболеваний и болезней легких.
При пассивном курении безникотиновых смесей выбросы токсических веществ равны или даже превышают выбросы при курении смесей на основе табака. Таким образом, кальянный дым от бестабачных продуктов также опасен, и помимо никотина, содержит те же токсические вещества и имеет ту же биологическую активность, что и изделия на основе табака.
Миф 5. Употребление кальяна не влияет на способность к деторождению.
Любое курение влияет на способность иметь детей. Поражение репродуктивной функции происходит и у женщин, и у мужчин.
У женщин, курящих кальян, снижается детородный возраст, менструальный цикл, что приводит к снижению способности к зачатию.У мужчин, предпочитающими курить кальян, в семенной жидкости увеличивается количество сперматозоидов неправильной формы, они становятся малоподвижными. Эти изменения сохраняются в течение нескольких месяцев. Даже если будущая мама, узнав о беременности, сразу бросает курение кальяна, то риск врожденных дефектов у детей сохраняется.
Врачи серьезно обеспокоены тем, что курение кальяна становится все более популярным в нашей стране и стараются информировать людей о вреде, наносимом кальянами организму. У человека всегда есть выбор как проводить свободное время. Кто-то получает удовольствие, тренируя тело в спортивном зале, или вместе с друзьями помогать бездомным животным, а кто-то готов часами просиживать за кальяном и сознательно прикладывать усилия к разрушению своего здоровья.
Бесплодие, больные дети онкология, сердечно-сосудистые и другие заболевания — не слишком ли высока цена?
Как легкие восстанавливаются после коронавируса?
https://ria.ru/20201201/legkie-1587071696.html
Как легкие восстанавливаются после коронавируса?
Как легкие восстанавливаются после коронавируса? — РИА Новости, 01.12.2020
Как легкие восстанавливаются после коронавируса?
Легкие человека самостоятельно регенерируются после перенесенного коронавируса. Как ускорить этот процесс, рассказал в интервью радио Sputnik пульмонолог… РИА Новости, 01.12.2020
2020-12-01T02:12
2020-12-01T02:12
2020-12-01T02:12
распространение коронавируса
александр карабиненко
коронавирус в россии
коронавирус covid-19
россия
здоровье
медицина
общество
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn21.img.ria.ru/images/07e4/0b/03/1582897357_0:135:3162:1914_1920x0_80_0_0_5bea142ef7ec8217bb7281e37751fb07.jpg
МОСКВА, 1 дек — РИА Новости. Легкие человека самостоятельно регенерируются после перенесенного коронавируса. Как ускорить этот процесс, рассказал в интервью радио Sputnik пульмонолог Александр Карабиненко.Перенесенная коронавирусная пневмония оставляет последствия, с которыми придется бороться некоторое время. В легких переболевшего человека еще сохраняется обширная зона фиброзных изменений, кашель и одышка могут наблюдаться достаточно долго, до полутора месяцев, отметил Александр Карабиненко. Но если не мешать организму, пройдет полный процесс восстановления легких, пояснил врач.По его словам, человек, который курит, не дает легким возможности восстановиться. В данном случае это не просто вредная привычка, а медленное самоубийство, уверен Карабиненко. «Если человек курит, то у него легкие никогда не восстановятся после тяжелой пневмонии или коронавируса. Курить после этого – это просто медленное самоубийство. Без этого сами легкие восстановятся. Этот процесс происходит у всех по-разному», – уточнил врач.В среднем восстановление легких идет от трех месяцев до года. Многое зависит от состояния иммунитета и физической формы человека. «Все эти болезни, связанные с коронавирусом и другими инфекционными заболеваниями органов дыхания, говорят о слабости защитных сил. На первом месте иммунитет, потом физические кондиции человека. Человек, который занимается спортом, который следит за своим здоровьем, даже если заболевает, то болеет не так сильно, как тот, кто за собой не следил», – заключил Карабиненко.
https://ria.ru/20201130/virusolog-1587003210.html
https://ria.ru/20201130/simptomy-1587010000.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/07e4/0b/03/1582897357_747:55:3150:1857_1920x0_80_0_0_9166f6a400da1761fee9331f1f518000.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
александр карабиненко, коронавирус в россии, коронавирус covid-19, россия, здоровье, медицина, общество
МОСКВА, 1 дек — РИА Новости. Легкие человека самостоятельно регенерируются после перенесенного коронавируса. Как ускорить этот процесс, рассказал в интервью радио Sputnik пульмонолог Александр Карабиненко.
Перенесенная коронавирусная пневмония оставляет последствия, с которыми придется бороться некоторое время. В легких переболевшего человека еще сохраняется обширная зона фиброзных изменений, кашель и одышка могут наблюдаться достаточно долго, до полутора месяцев, отметил Александр Карабиненко. Но если не мешать организму, пройдет полный процесс восстановления легких, пояснил врач.
«Есть процесс регенерации в нашем организме, когда одни клетки отмирают, а другие рождаются, при этом восстанавливается и структура легких, но в некоторых случаях это происходит не полностью, так бывает, если человек сам себя губит», – сказал пульмонолог.
По его словам, человек, который курит, не дает легким возможности восстановиться. В данном случае это не просто вредная привычка, а медленное самоубийство, уверен Карабиненко.
30 ноября 2020, 17:03Распространение коронавирусаВирусолог назвал условие завершения эпидемии COVID-19 в России
«Если человек курит, то у него легкие никогда не восстановятся после тяжелой пневмонии или коронавируса. Курить после этого – это просто медленное самоубийство. Без этого сами легкие восстановятся. Этот процесс происходит у всех по-разному», – уточнил врач.
В среднем восстановление легких идет от трех месяцев до года. Многое зависит от состояния иммунитета и физической формы человека.
«Все эти болезни, связанные с коронавирусом и другими инфекционными заболеваниями органов дыхания, говорят о слабости защитных сил. На первом месте иммунитет, потом физические кондиции человека. Человек, который занимается спортом, который следит за своим здоровьем, даже если заболевает, то болеет не так сильно, как тот, кто за собой не следил», – заключил Карабиненко.
30 ноября 2020, 17:28Распространение коронавирусаМясников назвал наиболее опасные симптомы коронавируса
Систематический обзор и метаанализ
Введение
Внебольничная пневмония (ВП) — это распространенное инфекционное заболевание, ежегодная заболеваемость с поправкой на возраст составляет 465–649 пациентов, госпитализированных с ВП на 100 000 населения в США. [1,2] В 2016 году инфекции нижних дыхательных путей (ИДП), включая ВП, были зарегистрированы как «самое смертоносное инфекционное заболевание» во всем мире, вызвав три миллиона смертей и являясь второй по частоте причиной потерянных лет жизни после ишемической болезни сердца.[3,4]
Табакокурение является основной причиной заболеваемости и смертности в странах с высоким уровнем доходов и важным фактором риска ВП. [5] Табакокурение ухудшает мукоцилиарный клиренс, вызывая увеличение слизистой и количество аномальных ресничек наряду с уменьшением частоты биений ресничек [6]. Пиатти и др. . обнаружили, что курение табака изменяет поверхность буккального эпителия, что вызывает повышенную адгезию пневмококков по сравнению с никогда не курившими [7]. Большая бактериальная адгезия может привести к большей колонизации ротоглотки и, следовательно, большему риску развития ВП.Также было показано, что воздействие табакокурения или пассивного курения в небольших количествах связано с изменениями в биологии клеток легких, аналогичными тем, которые наблюдаются у курильщиков. [8,9]
Недавний систематический обзор факторов риска ВП у взрослых, опубликованный Almirall et al. . обнаружили, что курение табака было значительным фактором риска ВП по сравнению с никогда не курившими, однако сила связи количественно не оценивалась. [10] Было показано, что пассивное курение увеличивает риск инфекций нижних дыхательных путей (ИДПТ) у детей, родители которых курят [11], однако систематического обзора для обобщения риска развития ВП у взрослых не проводилось.
Целью этого систематического обзора и метаанализов было обобщение имеющихся данных о влиянии курения табака и пассивного курения на риск развития ВП у взрослых, определение силы связи и изучение того, существует ли связь «доза-реакция» между количеством выкуриваемого табака и риском развития ВП.
Методы
Этот систематический обзор проводился с использованием предопределенного протокола, который был зарегистрирован в базе данных PROSPERO (CRD42018093943) и представлен в соответствии с Положением о предпочтительных элементах отчетности для систематических обзоров и мета-анализа (PRISMA).
Стратегия поиска и выбор исследований
Стратегия поиска была разработана для поиска опубликованных исследований. С момента создания этих баз данных до октября 2017 г. был проведен всесторонний поиск в следующих биомедицинских электронных базах данных: MEDLINE, Embase, CINAHL, PsycINFO и Web of Science. Стратегия поиска включала предметные заголовки и ключевые слова, связанные с «внебольничной пневмонией» и «курением». ». Ключевые слова для поиска были определены на основе терминов группы Кокрановского обзора по табаку.[12] Подробная информация о стратегии поиска для каждой базы данных находится в файле S1. Список литературы всех включенных исследований был проверен на включение.
Этот обзор включал обсервационные исследования; проспективные и ретроспективные когортные исследования и исследования случай-контроль. Поперечные исследования были исключены. Учитывались исследования, опубликованные на всех языках, и не было ограничений по датам поиска. Были включены исследования с участием взрослых в возрасте 15 лет и старше с клиническим или рентгенологически подтвержденным диагнозом ВП.Исследования, включающие пациентов с внутрибольничной пневмонией, аспирационной пневмонией, активным легочным туберкулезом и постобструктивной пневмонией, вторичной по отношению к злокачественному новообразованию грудной клетки, были исключены.
Два автора (VB, AH, RM или TM) независимо просматривали названия и аннотации с использованием программного обеспечения Covidence [13], а затем проверяли полные тексты найденных исследований на предмет соответствия критериям отбора. Разногласия разрешались путем обсуждения и достижения консенсуса с привлечением третьего рецензента (TM или WSL), где это необходимо.
Извлечение данных и оценка методологического качества
Два автора (VB, RM или TM) независимо извлекали все данные для исследований на английском языке, в то время как данные неанглийских исследований были извлечены одним рецензентом (TL, LB, MOB или KN) кто был грамотен на этом конкретном языке, используя стандартизированную форму.Любые разногласия, возникшие между рецензентами, разрешались путем обсуждения или с третьим рецензентом (TM), когда это было необходимо. Информация об исследуемой популяции, дизайне исследования, представляющем интерес воздействии (курение табака), включая различные категории воздействия (например, никогда, никогда, бывшие, текущие, «не текущие» и пассивные курильщики), результат (CAP) и скорректированный / нескорректированный размер эффекта (были собраны либо отношения шансов (OR), либо отношения рисков (HR)).
Методологическое качество оценивалось с использованием шкалы оценки качества Ньюкасла-Оттавы [14] либо для когортных исследований, либо для исследований случай-контроль, в зависимости от индивидуального дизайна исследования.Эта шкала основана на трех широких категориях; (1) выбор исследуемой выборки (четыре балла), (2) сопоставимость групп выборки (два балла) и (3) определение воздействия / результата (три балла). Таким образом, исследования получили в общей сложности девять баллов. Оценки были выбраны априори для обозначения различных уровней методологического качества (0–3: низкое качество, 4–6: среднее качество, 7–9: высокое качество)
Синтез данных
Мы проанализировали извлеченные результаты, чтобы оценить, насколько Достаточное сходство существовало для результатов исследования для проведения метаанализа случайных эффектов с использованием Stata / SE 15.1 (StataCorp.2017). Мета-анализ был проведен с использованием 26 исследований, сравнивающих текущие (выбор наибольшего количества выкуриваемого табака для нынешних курильщиков, где было более одной категории), когда-либо, бывших и пассивных и никогда не куривших, в дополнение к сравнению текущих и не текущих курильщиков . Мы оценили систематическую ошибку публикации визуально, используя воронку для связи между текущим курением и риском ВП, учитывая, что в этот метаанализ было включено более 10 исследований. Мы суммировали исследования с объединенными OR и HR отдельно с 95% доверительными интервалами.Меры воздействия с поправкой на искажающие факторы (возраст и пол были априори искажающих факторов) использовались вместо грубых мер воздействия. Статистика I 2 использовалась для помощи в оценке неоднородности исследований. Мы выполнили анализ чувствительности, исключая исследования только с конкретными заболеваниями (мы используем термин «избранные клинические популяции» в остальной части этого документа), чтобы данные были репрезентативными для населения в целом. Чтобы изучить систематическую ошибку установления, мы сравнили величину эффекта в учреждениях первичной медико-санитарной помощи и вторичной помощи.Мы построили логарифмический коэффициент для каждой категории в рамках исследования (предполагая линейную зависимость) и оценили коэффициент регрессии доза-ответ, чтобы определить связь доза-реакция между дозой текущего курения и риском развития ВП.
Результаты
Стратегия поиска первоначально выявила 647 исследований, из которых были рассмотрены 56 полнотекстовых статей (включая пять неанглоязычных исследований; французский, китайский, немецкий и испанский языки) (). В систематический обзор были включены двадцать пять исследований английского языка и два неанглийских исследования (n = 460 592 участника) (таблица S1).Наиболее частой причиной исключения было отсутствие задокументированных релевантных данных об исходах (n = 17/56).
Блок-схема PRISMA для выбора исследования.
Характеристики включенных исследований
Из 27 включенных исследований было 13 когортных исследований и 14 исследований случай-контроль. Все исследования, за исключением двух, включали представителей обоих полов; два исследования включали только мужчин. [15,16] В пяти исследованиях были отобраны клинические группы, в том числе пациенты с вирусом иммунодефицита человека (ВИЧ) [17], отдельные заболевания, связанные с ВИЧ [16], незначительные травмы грудной клетки [18] и хроническая обструктивная легочная недостаточность. заболевание (ХОБЛ) [19,20].В одном исследовании сообщалось о вспышке болезни легионеров, и в нем участвовали участники, посетившие аквариум [21]. Шесть исследований были проведены в учреждениях первичной медико-санитарной помощи, девять — в больницах, четыре — в смешанных условиях, шесть — в общинах и два не указаны (таблица S1). Определение ВП было основано на радиологическом подтверждении в 16 исследованиях, диагностическом кодировании в пяти исследованиях (в четырех исследованиях использовались коды МКБ-9 и в одном исследовании использовались коды чтения данных Clinical Practice Research Datalink) и клинических критериях в пяти исследованиях; в одном исследовании не сообщалось о способе определения ВП.
Риск систематической ошибки
Большинство включенных исследований (n = 16) были среднего качества со средним показателем качества, равным шести (IQR 6–7) (таблица S2). Используя априорные методологические оценки качества, мы оценили десять исследований как высокое качество и одно исследование как низкое. Двадцать четыре исследования (88,9%) имели четкие определения ВП с использованием независимой слепой оценки рентгенограмм грудной клетки, медицинских записей или связи записей (например, кодов МКБ) и 23 исследования (85,2%) с поправкой на искажающие факторы.Тринадцать (92,9%) из всех исследований случай-контроль получили низкие баллы из-за отсутствия отчетов об уровне отсутствия ответов и плохого определения статуса курения (полученная в ходе интервью информация, которая не была скрыта от статуса случая / контроля или сообщалась самостоятельно) . Напротив, более половины когортных исследований (n = 8 исследований, 61,5%) дали хорошие результаты по установлению статуса курения; либо из защищенной медицинской карты, либо из структурированного интервью с участником. Качество некоторых когортных исследований снизилось из-за отсутствия действительно репрезентативной группы облученных (n = 8 исследований, 61.5%), не демонстрируя, что ВП отсутствовала в начале исследования (n = 8 исследований, 61,5%), и не имея заявления о невозможности последующего наблюдения (n = 9 исследований, 69,2%).
Статус курения
Наиболее часто используемые определения статуса курения подробно описаны в. В большинстве исследований категории курения указаны без подробного определения соответствующих категорий; мы использовали определение для каждой категории из Глоссария, подробно описанного в Информации об употреблении табака среди взрослых Центров по контролю и профилактике заболеваний ().[22]
Таблица 1
Категории курения, использованные во включенных исследованиях.
| Категории курения | Определение [22] | Синонимы, использованные во включенных исследованиях | Количество исследований |
|---|---|---|---|
| Никогда | Никогда не курил или курил в течение всей жизни <100 сигарет | Не | 27 |
| Когда-либо | Пожизненная история курения ≥100 сигарет | ‘Текущее / прошлое’ ‘Текущее / бывшее’ | 4 |
| Ex | Пожизненная история курения ≥100 сигарет и бросили курить в время исследования | Бывший, прошлый | 15 |
| Текущий | Пожизненная история курения ≥100 сигарет и курение в настоящее время на момент исследования | Активный | 18 |
| Пассивный | Никогда не курили подверженные воздействию сигаретного дыма из окружающей среды | Воздействие вторичного табачного дыма | 6 |
Четыре исследования количественно оценили курение табака, документируя количество лет на пачку [23,24] и сообщая качественные описания от легкого до тяжелого курения.[16,25] Категория «Нет курящих», которая может включать никогда, никогда и бывших курильщиков, использовалась в двух исследованиях. Доля нынешних курильщиков с ВП была выше в учреждениях вторичной медико-санитарной помощи (31–79%) по сравнению с учреждениями первичной медико-санитарной помощи (21–27,3%).
Метаанализ
Метаанализ 13 исследований показал, что нынешние курильщики более чем вдвое подвержены риску развития ВП, чем никогда не курившие (объединенное ОШ 2,17, 95% ДИ 1,70–2,76, I 2 = 75%) ( ). Анализ чувствительности, за исключением исследований, которые не были репрезентативными для общей популяции (два исследования с выбранными клиническими популяциями [16,18] и одно исследование, в котором приняли участие участники, посещавшие аквариум [21]), обнаружил незначительно меньший эффект (объединенное OR 1.91, 95% ДИ 1,54–2,38, I 2 = 70,8%, n = 10 исследований) (). Не было обнаружено доказательств систематической ошибки публикации, выявленной на графике воронки для связи между текущим курением и риском ВП (). Исследования, в которых сообщалось о соотношении рисков, показали, что у курильщиков, которые курили в настоящее время, на 53% выше вероятность развития ВП, чем у никогда не куривших (объединенный HR 1,52, 95% ДИ 1,13–2,04, I 2 = 89,5%, n = 7 исследований) (). Риск несколько увеличился, когда три исследования с выбранными клиническими популяциями были исключены (объединенный HR 1.72, 95% ДИ 1,43–2,07, I 2 = 19,3%) (). По сравнению с «нетекущими» курильщиками, метаанализ двух исследований показал, что нынешние курильщики почти в три раза подвергались риску развития ВБП (совокупный OR 2,75, 95% ДИ 1,29–5,88, I 2 = 58,3%, n = 2 исследования) (). Было только одно исследование, в котором сравнивали нынешних курильщиков с «не нынешними» курильщиками и сообщали о соотношении рисков (ОР 1,31, 95% ДИ 1,17–1,46), поэтому это исследование не было включено в метаанализ. [26] Метаанализ четырех исследований показал, что когда-либо курильщики подвергались риску развития ВП более чем в два раза, чем никогда не курившие (объединенное ИЛИ 2.31, 95% ДИ 1,99–2,69, I 2 = 0%, n = 4 исследования) ().
Мета-анализ риска внебольничной пневмонии у курильщиков по сравнению с никогда не курившими (отношение шансов).
* Исследование Байка и др. . имели соответствующие данные с разбивкой по полу, поэтому данные этого исследования были включены как две отдельные сущности (т.е. мужчины и женщины). Серый прямоугольник = оценки эффекта по отдельным исследованиям. Алмаз = объединенный результат с доверительным интервалом. Вертикальная линия «1» на оси x — это линия отсутствия эффекта.Вес (в%) = влияние отдельного исследования на объединенный результат.
График воронки для связи между текущим курением и риском развития ВП.
Метаанализ заболеваемости внебольничной пневмонией у курильщиков по сравнению с никогда не курившими (коэффициент опасности).
Серый квадрат = оценка эффекта по результатам отдельных исследований. Алмаз = объединенный результат с доверительным интервалом. Вертикальная линия «1» на оси x — это линия отсутствия эффекта. Вес (в%) = влияние отдельного исследования на объединенный результат.
Мета-анализ риска внебольничной пневмонии у нынешних курильщиков по сравнению с «не нынешними» курильщиками (отношение шансов).
Серый квадрат = оценка эффекта по результатам отдельных исследований. Алмаз = объединенный результат с доверительным интервалом. Вертикальная линия «1» на оси x — это линия отсутствия эффекта. Вес (в%) = влияние отдельного исследования на объединенный результат.
Мета-анализ риска внебольничной пневмонии у нынешних курильщиков по сравнению с «когда-либо» курильщиками (отношение шансов).
Серый квадрат = оценка эффекта по результатам отдельных исследований. Алмаз = объединенный результат с доверительным интервалом. Вертикальная линия «1» на оси x — это линия отсутствия эффекта. Вес (в%) = влияние отдельного исследования на объединенный результат.
Бывшие курильщики имели на 49% больше шансов заболеть ВП, чем никогда не курившие (объединенный OR 1,49, 95% ДИ 1,26–1,75, I 2 = 13,3%, n = 8 исследований) (). Анализ чувствительности, за исключением двух исследований, которые не были репрезентативными для общей популяции, показал аналогичный результат (объединенное OR 1.51, 95% ДИ 1,24–1,84, I 2 = 29,9%, n = 6 исследований) (). Исследования, в которых сообщалось о соотношении рисков, имели высокий уровень неоднородности и не обнаружили значительного влияния между бывшими курильщиками и риском развития ВП (Все подходящие исследования: объединенный HR 1,18, 95% ДИ 0,91–1,52, I 2 = 85,4% , n = 6 исследований и анализ чувствительности: объединенный HR 1,25, 95% ДИ 0,88–1,78, I 2 = 75,3%, n = 2 исследования) ().
Мета-анализ риска внебольничной пневмонии у бывших курильщиков по сравнению с никогда не курившими (отношение шансов).
Серый квадрат = оценка эффекта по результатам отдельных исследований. Алмаз = объединенный результат с доверительным интервалом. Вертикальная линия «1» на оси x — это линия отсутствия эффекта. Вес (в%) = влияние отдельного исследования на объединенный результат.
Метаанализ заболеваемости внебольничной пневмонией у бывших курильщиков по сравнению с никогда не курившими (коэффициент опасности).
Серый квадрат = оценка эффекта по результатам отдельных исследований. Алмаз = объединенный результат с доверительным интервалом. Вертикальная линия «1» на оси x — это линия отсутствия эффекта.Вес (в%) = влияние отдельного исследования на объединенный результат.
Для исследований, проводимых только в учреждениях первичной медико-санитарной помощи, влияние текущего курения на риск развития ВП не было статистически значимым (объединенный OR 1,14, 95% ДИ 0,72–1,82, I 2 = 55,1%, n = 2 исследований и объединенный HR 1,21, 95% ДИ 0,68–2,15, I 2 = 92,8%, n = 2 исследования), тогда как для исследований, проведенных в учреждении вторичной медицинской помощи, текущее курение было значимо связано с ВП по сравнению с никогда не курившими (объединенное ИЛИ 1.95, 95% ДИ 1,45–2,62, I 2 = 0,0%, n = 4 исследования и ОР 1,58, 95% ДИ 1,32–1,89, n = 1 исследование).
Пассивное курение было связано с повышением риска развития ВП на 13% по сравнению с теми, кто не подвергался пассивному курению, однако этот результат не был статистически значимым (объединенный OR 1,13, 95% ДИ 0,94–1,36, I 2 = 26,8%, n = 5 исследований). В анализе чувствительности лиц в возрасте ≥ 65 лет пассивное курение было связано с повышением риска ВБП на 64% (объединенный OR 1.64; 95% ДИ 1,17–2,30, I 2 = 0%, n = 2 исследования).
Тенденция «доза-реакция»: обзорный обзор
В пяти исследованиях была информация о зависимости «доза-реакция» между количеством курения и риском развития ВП. Мы провели анализ «доза-реакция», используя данные, полученные в этих пяти исследованиях (), хотя метаанализ был невозможен из-за различий в методах количественной оценки воздействия курения в исследованиях. Во всех исследованиях были обнаружены значимые зависимости «доза-ответ»; было две линейных [23,27] и три нелинейных [16,25,28] связи, причем эффект в одном исследовании в основном определялся результатами из двух высших категорий ().[25]
Таблица 2
Зависимость «доза-реакция» между количеством курения и риском развития ВП.
Тенденция (OR) 1.xy означает увеличение риска ВБП на xy% при увеличении категории, задокументированной в столбце «Количественная оценка воздействия курения».
| Исследование | Статус курения | Количественная оценка воздействия курения | Тенденция (OR) | Значение p | Association |
|---|---|---|---|---|---|
| Almirall 1999 | Текущие и бывшие курильщики | Годы упаковки • 0 • 5–16.4 • 16,5–38 •> 38 | 1,37, 95% ДИ 1,17–1,61 | <0,001 | Линейный |
| Almirall 2008 | Текущие и бывшие курильщики | Пачки сигарет, выкуриваемые ежедневно x 365 x лет курения $ • 0 • 1–150 • 151–300 •> 300 | 1,27, 95% ДИ 1,17–1,38 | <0,001 | Линейный |
| Almirall 1999 | Ток курильщики | Сигареты, выкуриваемые ежедневно • 0 • 1–9 • 10–20 •> 20 | 1.30, 95% ДИ 1,02–1,67 | 0,037 | Нелинейная |
| Фарр 2000 | Текущие курильщики | Сигареты, выкуриваемые ежедневно x количество выкуриваемых лет • 0 • 1–225 • 226–578 • 579+ | 1,52, 95% ДИ 1,30–1,78 | <0,001 | Нелинейный; эффект в основном в двух высших категориях курения ( жирным шрифтом ) |
| Conley 1996 | Текущие курильщики | Пачки сигарет в день • ≤ половина («легкое») • от половины до <2 («умеренное» ) •> 2 («тяжелый») | 1.51, 95% ДИ 1,10–2,08 | 0,011 | Нелинейный |
Обсуждение
Насколько нам известно, это первое исследование, в котором количественно оценивается влияние курения табака на риск развития ВП через мета- анализ. Наше исследование выявило убедительные доказательства того, что нынешние и бывшие курильщики значительно подвержены более высокому риску развития ВП, в то время как пассивное воздействие табачного дыма имело значительный эффект только у лиц в возрасте ≥ 65 лет. Наиболее сильные ассоциации были очевидны в исследованиях, проведенных в рамках вторичной медицинской помощи.Кроме того, была отмечена тенденция «доза-ответ» с более высоким риском ВП среди нынешних курильщиков, которые курят большее количество табака.
Нынешнее курение связано с широким спектром инфекционных заболеваний, включая бактериальные патогены ( Streptococcus pneumoniae , Haemophilus influenzae , Neisseria meningitidis , Staphylococcus pneumoniae , 007 Legionella 8) возбудители (грипп, риновирус, ВИЧ).[29–34] Вопрос о том, увеличивает ли курение риск заражения различными респираторными патогенами в одинаковой степени, не мог быть полностью изучен в этом систематическом обзоре из-за отсутствия соответствующих данных во включенных исследованиях.
Мы количественно оценили риск развития ВП у нынешних курильщиков, чтобы он был аналогичен ассоциации курения с астмой (ОР 1,61; 95% ДИ, 1,07–2,42), идиопатическим легочным фиброзом (ОР 1,58; 95% ДИ 1,27–1,97), обструктивное апноэ во сне (ОР 1,97; 95% ДИ 1,02–3,82), инсульт (ОР 1.58; 95% ДИ 1,40–1,78) и острого коронарного синдрома (ОР 1,98; 95% ДИ 1,75–2,25), хотя и ниже, чем у развивающегося рака легких (ОР 13,1; 95% ДИ 9,90–17,3) и ХОБЛ (ОР 4,01; 95% ДИ , 3.18–5.05). [35–38]
Наши результаты продвигают описательную презентацию в двух предыдущих систематических обзорах, в которых сообщалось, что курение является независимым изменяемым фактором риска развития ВП наряду с другими факторами образа жизни, включая злоупотребление алкоголем, низкий индекс массы тела и т. Д. регулярный контакт с детьми и плохая гигиена полости рта.[10,39] Курение также косвенно влияет на риск ВП, поскольку оно связано с ХОБЛ и плохим состоянием зубов, которые сами по себе являются независимыми факторами риска развития ВП. [24,28,35,40,41] Этот косвенный эффект количественно не определен.
В когорте иммунокомпетентных взрослых в возрасте 18–64 лет с инвазивным пневмококковым заболеванием (IPD) Nuorti et al . показали, что пассивное курение является независимым фактором риска (ОШ 2,5; 95% ДИ 1,2–5,1), причем повышенный риск наблюдается при более продолжительном воздействии пассивного курения.[42] Хотя пассивное курение не было связано с повышенным риском ВП у взрослых всех возрастов, стоит отметить, что метаанализ двух исследований показал повышенный риск в эти ≥65 лет; одно исследование набирало пациентов из первичной медико-санитарной помощи (подвергшихся пассивному курению дома), а другое — после госпитализации по поводу ВП (подвергшихся пассивному курению). Сочетание факторов хозяина, таких как сопутствующие заболевания, сопровождающие пожилой возраст, полипрагмазия и старение иммунной системы, а также социальные факторы, включая плохое питание и скученность или длительный стационарный уход, могут способствовать повышенному риску заражения, наблюдаемому у пожилых людей.[43]
Мы смогли провести анализ реакции на дозу, используя данные пяти исследований. Наш анализ подтвердил, что более высокие уровни воздействия курения связаны с более высоким риском развития ВП. Это согласуется с данными IPD, где сообщается о линейной зависимости доза-ответ от количества сигарет, выкуриваемых ежедневно. [44] В двух исследованиях, которые объединили в своем анализе нынешних и бывших курильщиков, зависимость доза-реакция между количеством курящих и риском ВП была линейной, тогда как в остальных трех исследованиях, в которых участвовали курильщики в настоящее время, зависимость была нелинейной.Для определения того, как различия в категоризации статуса курения влияют на линейность зависимости доза-реакция, потребуется анализ данных отдельных пациентов.
Табакокурение и инфекция: иммунные механизмы
Помимо структурных механизмов, упомянутых в разделе «Введение», [6,7,45] курение может повышать риск системных инфекций, вызывая изменения в функции клеточной и гуморальной иммунной системы. [46] Курение нарушает функцию полиморфно-ядерных лейкоцитов, которая играет важную роль в защите хозяина от бактериальной инфекции (подавленная миграция нейтрофилов и хемотаксис лейкоцитов), [47, 48] снижает количество CD4 + Т-лимфоцитов, что приводит к снижению В-клеток, секретирующих антитела ( таким образом снижая уровень сывороточного иммуноглобулина примерно на 10%), [49–53] увеличивает количество CD8 + Т-клеток, [54] и снижает секрецию провоспалительных цитокинов, таких как IL-1 и IL-6.[55,56] Никотин от курения табака также может подавлять активность естественных киллеров (NK); NK-клетки обычно активируются как часть раннего иммунного ответа на вирусные инфекции. [57]
Эффект прекращения курения
Единственное исследование, включенное в этот обзор, в котором сообщалось о времени от прекращения курения до развития ВП, было популяционным исследованием случай-контроль, проведенным Almirall et al. . которые сообщили, что риск ВП снизился на 50% (OR) после пяти лет отказа от курения.[23] В исследовании инвазивного пневмококкового заболевания (IPD) риск IPD у бывших курильщиков ежегодно снижался на 14%, а у никогда не куривших — примерно через 13 лет после отказа от курения. [44] Эти наблюдения наряду с результатами этого метаанализа подтверждают мнение о том, что у бывших курильщиков риск ВБП ниже, чем у нынешних курильщиков, и что этот риск уменьшается с увеличением продолжительности отказа от курения.
Неясно, почему бывшие курильщики по-прежнему подвержены риску ВП. Прилипание бактерий имеет решающее значение в патогенезе инфекции.Было показано, что у бывших курильщиков in vitro повышается адгезия Streptococcus pneumoniae к буккальным эпителиальным клеткам на срок до трех лет после прекращения курения, что может способствовать увеличению риска ВП [45]. Что касается изменений иммунной функции, сообщения были неоднозначными; одно исследование показало значительно более низкую долю NK-клеток у бывших курильщиков, которые бросили курить более 20 лет, по сравнению с никогда не курившими (средняя продолжительность с момента отказа от курения 10,7 лет) [58], тогда как в другом исследовании с участием 10 бывших курильщиков продолжительность с момента отказа от курения составляла от шести недель до 10 лет (в среднем 4 года), активность NK-клеток была сопоставима с таковой у никогда не куривших.[59] У заядлых курильщиков (≥50 пачек-лет) отказ от курения на шесть недель был связан с возвращением соотношения CD4 / CD8 к норме. [60] Таким образом, хотя некоторые из связанных с иммунитетом эффектов курения могут относительно быстро обратить вспять после прекращения курения, другие эффекты могут быть более продолжительными или, возможно, необратимыми.
Сильные стороны и ограничения
В этом обзоре всесторонне обобщены текущие знания о влиянии табакокурения на риск развития ВП и он был составлен в соответствии с контрольным списком PRISMA (файл S2).Критерии отбора строго применялись для обеспечения того, чтобы идентифицированные исследования включали только пациентов с ВП, следовательно, исключая внутрибольничную пневмонию, аспирационную пневмонию, активный легочный туберкулез и пост-обструктивную пневмонию, вторичную по отношению к злокачественному новообразованию грудной клетки. В целом включенные исследования были среднего качества, языковых ограничений не применялось. Статистическая неоднородность метаанализа варьировала в разных анализах от низкого (<25%) до высокого (> 75%) уровня и не претерпевала значительных изменений в анализе чувствительности.
Важным ограничением были различные способы определения статуса курения и количественной оценки «дозы» курения. Например, отсутствие различия между «когда-либо» и «не в настоящее время» курильщиками и «бывшими курильщиками» исключило семь исследований из метаанализа с участием бывших курильщиков. Определения ВП также различались, хотя и в меньшей степени. В исследованиях, которые не применяли «золотой стандарт» радиологически подтвержденной ВП (n = 10 исследований), возможно, вместо этого были выявлены некоторые случаи ИДП или острого бронхита.Непневмонические инфекции дыхательных путей (ИРО) обычно считаются более вероятными, вызванными вирусными патогенами, а не бактериальными. [61] Однако нет сравнительных данных, позволяющих предположить различное влияние курения на возникновение вирусных и бактериальных ИРО. Поэтому не ожидается, что включение этих исследований окажет серьезное влияние на объединенные результаты.
Значение
Этот обзор предоставляет убедительные доказательства в поддержку рекомендаций по прекращению курения, а также предотвращению пассивного воздействия табачного дыма, особенно у лиц с высоким риском развития пневмонии.Считается, что пациенты, выздоравливающие после эпизода ВП, подвержены риску рецидива ВП [62–64]. Поэтому госпитализация с ВП дает ценный «поучительный момент», когда следует способствовать отказу от курения. [65–67]
Необходимы дальнейшие исследования, чтобы установить, почему и как долго бывшие курильщики продолжают подвергаться более высокому риску развития ВП после отказа от курения по сравнению с теми, кто никогда не курил. В будущих исследованиях более стандартизованный подход к отчетности о пачках курения вместо качественных описаний с различными определениями облегчил бы сравнение и синтез данных.
СУНДУК
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
Если адрес совпадает с действующей учетной записью, на __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
СУНДУК
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
Если адрес совпадает с действующей учетной записью, на __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
СУНДУК
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
Если адрес совпадает с действующей учетной записью, на __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
СУНДУК
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
Если адрес совпадает с действующей учетной записью, на __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
Курение и заражение сигарет | Инфекционные болезни | JAMA Internal Medicine
Фон
Инфекционные заболевания могут соперничать с раком, сердечными и хроническими заболеваниями легких в качестве источников заболеваемости и смертности от курения.Мы рассмотрели механизмы, с помощью которых курение увеличивает риск заражения, и эпидемиологию связанных с курением инфекций, а также обозначили последствия этого повышенного риска заражения среди курильщиков сигарет.
Методы
В базе данных MEDLINE был проведен поиск статей о механизмах и эпидемиологии инфекционных заболеваний, связанных с курением. Были включены статьи на английском языке и избранные перекрестные ссылки.
Результаты
Механизмы, с помощью которых курение увеличивает риск инфекций, включают структурные изменения дыхательных путей и снижение иммунного ответа.Курение сигарет является существенным фактором риска серьезных бактериальных и вирусных инфекций. Например, у курильщиков риск инвазивного пневмококкового заболевания повышается в 2–4 раза. Риск гриппа в несколько раз выше у курильщиков, чем у некурящих. Возможно, наибольшее воздействие курения на здоровье населения на инфекцию — это повышенный риск туберкулеза, особой проблемы в слаборазвитых странах, где показатели курения быстро растут.
Выводы
Клиническое значение наших результатов включает в себя подчеркивание важности отказа от курения как части терапевтического плана для людей с серьезными инфекционными заболеваниями или пародонтитом, а также для людей с положительными результатами кожных туберкулиновых проб.Контроль воздействия вторичного сигаретного дыма у детей важен для снижения риска менингококковой инфекции и среднего отита, а у взрослых — для снижения риска гриппа и менингококковой инфекции. Другие рекомендации включают вакцинацию от пневмококка и гриппа для всех курильщиков и лечение ацикловиром от ветряной оспы для курильщиков.
Курение сигарет — хорошо известный фактор риска преждевременной смертности от рака, сердечно-сосудистых заболеваний и хронической обструктивной болезни легких.Курение сигарет также является основным фактором риска респираторных и других системных инфекций. Как активное, так и пассивное воздействие сигаретного дыма увеличивают риск инфекций. Врачи не очень ценят заболеваемость и смертность от инфекционных заболеваний, вызванных курением.
Механизм повышенной восприимчивости курильщиков к инфекциям является многофакторным и включает изменение структурной и иммунологической защиты хозяина. Цели этой статьи — рассмотреть механизмы, с помощью которых курение увеличивает риск заражения, проанализировать эпидемиологию связанных с курением инфекций и обсудить последствия повышенного риска заражения среди курильщиков сигарет.
В базе данных MEDLINE был проведен поиск статей о механизмах и эпидемиологии инфекционных заболеваний, связанных с курением. Все соответствующие англоязычные статьи, опубликованные с 1978 по 2003 год в базе данных MEDLINE, были проанализированы с использованием терминов курение сигарет и иммунная система, клеточный иммунитет, гуморальный иммунитет, лейкоциты, цитокины и хемотаксис, а также курение сигарет с различными заболеваниями. специфические инфекционные заболевания.Также были проанализированы избранные ссылки, содержащиеся в этих статьях. Исследования включались, если они оказывались обоснованными с научной точки зрения; однако официальная система оценки качества не использовалась для отбора статей на предмет включения.
Механизмы, с помощью которых курение может предрасполагать к инфекции
Конкретные механизмы, с помощью которых курение сигарет увеличивает риск системных инфекций, изучены не полностью.Они многофакторны и, вероятно, интерактивны по своим эффектам. Они включают структурные и иммунологические механизмы.
Механические и структурные изменения, вызванные курением
Сигаретный дым и многие его компоненты вызывают структурные изменения в дыхательных путях. Эти изменения включают перибронхиолярное воспаление и фиброз, повышенную проницаемость слизистой оболочки, нарушение мукоцилиарного клиренса, изменения прилипания патогенов и нарушение дыхательного эпителия. 1 Считается, что эти изменения предрасполагают к развитию инфекций верхних и нижних дыхательных путей, которые могут усилить воспаление легких, вызванное сигаретным дымом.
Ряд компонентов сигаретного дыма, включая акролеин, ацетальдегид, формальдегид, свободные радикалы, образующиеся в результате химических реакций в сигаретном дыме, и оксид азота, могут способствовать наблюдаемым структурным изменениям в эпителиальных клетках дыхательных путей. 2 , 3
Курение сигарет влияет как на клеточно-опосредованный, так и на гуморальный иммунный ответ у людей и животных. 4 -6
Клеточно-опосредованные иммунные ответы. Подсчет и распределение клеток в периферической крови. У курильщиков в среднем наблюдается повышенное количество лейкоцитов в периферической крови, что примерно на 30% выше, чем у некурящих. Увеличиваются все основные типы клеток. 6 -10 Тейлор и др. 11 обнаружили значительную взаимосвязь между общим количеством лейкоцитов у курильщиков и концентрацией никотина в плазме.Friedman et al., 9 предположили, что вызванное никотином высвобождение катехоламинов может быть механизмом этого эффекта.
Другие исследования подтверждают гипотезу о том, что курение сигарет вызывает стимуляцию костного мозга. Van Eeden и Hogg 12 обнаружили, что полиморфно-ядерные лейкоциты (PMN) от длительных курильщиков имеют фенотипические изменения, указывающие на стимуляцию костного мозга, такие как увеличение количества полосовых клеток, более высокие уровни L-селектина и повышенное содержание миелопероксидазы.Авторы предположили, что провоспалительные факторы, высвобождаемые альвеолярными макрофагами, такие как фактор некроза опухоли α, интерлейкин (IL) 1, IL-8 и фактор, стимулирующий колонии гранулоцитов-макрофагов, вероятно, ответственны за стимуляцию костного мозга при курении сигарет. Vanuxem et al. 13 обнаружили, что количество лейкоцитов у курильщиков связано с концентрацией карбоксигемоглобина, отражающей воздействие сигаретного дыма. Телль и др. 14 показали такую же взаимосвязь между курением сигарет и повышенным количеством лейкоцитов у подростков, что указывает на быстрое влияние курения сигарет на количество лейкоцитов, которое вряд ли связано с хроническими заболеваниями, вызванными курением. как видно у взрослых курильщиков.
Сообщения о влиянии курения на различные подмножества Т-лимфоцитов противоречивы. Влияние курения сигарет на субпопуляции лимфоцитов Т-клеток периферической крови было исследовано с помощью моноклональных антител. У курильщиков от легких до умеренных (в анамнезе менее 50 упаковок-лет) отмечалось значительное увеличение количества CD3 + и CD4 + и тенденция к увеличению количества лимфоцитов CD8 + .Наблюдаемое увеличение соотношения лимфоцитов CD4 + к лимфоцитам CD8 + у курильщиков было связано с увеличением количества клеток CD4 + . 6 , 10 , 15 -17 Через 2-4 года после прекращения курения увеличение количества клеток CD4 + исчезло. 15 , 18 Напротив, исследования заядлых курильщиков (≥50 пачка-лет) сообщили о снижении количества CD4 + и значительном увеличении количества клеток CD8 + .Таким образом, наблюдаемое снижение соотношения лимфоцитов CD4 + к лимфоцитам CD8 + у заядлых курильщиков было обусловлено преимущественно увеличением клеток CD8 + . 16 Эти эффекты оказались обратимыми уже через 6 недель после прекращения курения, 17 , хотя в одном исследовании 6 потребовалось от 2 до 4 лет, чтобы эти эффекты исчезли. В других исследованиях не сообщалось об отсутствии различий в количестве лимфоцитов CD4 + и CD8 + среди умеренно курильщиков. 19
Поскольку клетки CD4 + способствуют пролиферации и дифференцировке В-клеток, а также синтезу иммуноглобулинов, снижение этой подгруппы, наблюдаемое у заядлых курильщиков, может способствовать повышению восприимчивости к инфекциям в этой популяции. Увеличение количества клеток CD8 + , такое как наблюдаемое у заядлых курильщиков, было связано как с неоплазией, так и с инфекцией. 20
Исследования жидкостей легких. Результаты исследования бронхоальвеолярной жидкости курильщиков отличаются от результатов исследования периферической крови. Исследования бронхоальвеолярного лаважа 19 , 21 , 22 продемонстрировали заметное снижение процентного и абсолютного количества клеток CD4 + и увеличение клеток CD8 + с более низким уровнем CD4 + / CD8. Соотношение клеток + у умеренно курильщиков (в среднем, 14 пачек-лет) по сравнению с некурящими. В этой популяции умеренных курильщиков не было обнаружено значительных изменений этих переменных в периферической крови, в отличие от ранее обсуждавшихся результатов у заядлых курильщиков.Таким образом, изменение популяции лимфоцитов в бронхоальвеолярном лаваже у курильщиков может выявить патологические изменения раньше, чем в крови. Более того, эти данные свидетельствуют о том, что у курильщиков наблюдается дефицит клеточного иммунитета в альвеолах легких, месте, которое имеет решающее значение для защиты первой линии от инфекции. Курение также связано со значительным увеличением процента макрофагов 22 в жидкости бронхоальвеолярного лаважа.
Влияние на функцию PMN. Несколько исследований показали, что курение сигарет влияет на функцию лейкоцитов. 23 , 24 Полиморфноядерные лейкоциты периферической крови курильщиков демонстрируют подавленную миграцию и хемотаксис по сравнению с ПМЯ некурящих. 24 , 25 Подвижность и хемотаксис PMN в ротовой полости курильщиков снижены по сравнению с некурящими. 24 , 26 Какие компоненты дыма ответственны за эти эффекты, остается неясным.
Bridges et al. 27 продемонстрировали, что весь сигаретный дым, его газовая фаза и водорастворимая фракция являются мощными ингибиторами хемотаксиса PMN.Из водорастворимой фракции курения сигарет ненасыщенные альдегиды (акролеин и кротоновый альдегид) вносят основной вклад в свойства ингибитора. Bridges and Hsieh 28 показали, что нелетучие компоненты курения сигарет также ингибируют хемотаксис по механизму, который отличается от механизма ненасыщенных альдегидов, присутствующих в паровой фазе дыма. Нелетучий компонент не препятствовал миграции. Наблюдалась взаимосвязь между полярностью фракции и ее ингибирующей способностью; таким образом, ингибирование хемотаксиса PMN нельзя отнести ни к никотину, ни к полициклическим углеводородам.Сасагава и др. 29 обнаружили, что никотин не влияет на миграцию PMN и хемотаксис.
Макрофаги из легких курильщиков обладают более сильным ингибирующим действием на пролиферацию лимфоцитов, чем макрофаги из легких некурящих. Таким образом, иммуносупрессивные эффекты макрофагов на клеточно-опосредованный иммунный ответ у курильщиков усиливаются. 30 Высвобождение цитокинов из макрофагов также может изменяться у курильщиков. 31 Twigg и соавторы 32 показали, что курение сигарет снижает секрецию провоспалительных цитокинов, таких как IL-1 и IL-6.Wewers et al., 22, показали снижение выработки фактора некроза опухоли α. Ouyang et al. 33 и Hagiwara et al 34 сообщили, что курение сигарет также подавляет выработку IL-2 и интерферона γ. Гидрохинон, фенольное соединение в сигаретной смоле, обладал наиболее сильным ингибирующим действием по сравнению с этими цитокинами, тогда как никотин оказывал незначительное влияние. С другой стороны, продукция IL-10 мононуклеарными клетками человека ингибировалась лечением никотиновыми пластырями у пациентов с воспалительным заболеванием кишечника. 35 Недавно Мацунага и др. 36 сообщили, что никотиновые рецепторы ацетилхолина участвуют в цитокиновых ответах альвеолярных макрофагов на инфекцию Legionella pneumophila .
Цитокины IL-1 и IL-6 важны для защиты хозяина от инфекции. 37 , 38 Исследования на животных показали, что истощение этих цитокинов увеличивает восприимчивость к бактериальной пневмонии. Поскольку ПЯН играют важную роль в защите хозяина от острых бактериальных инфекций, нарушение функций ПЯН из-за дыма может способствовать повышенной восприимчивости курильщиков к системным инфекциям, включая бактериальную пневмонию.
Влияние на функции лимфоцитов. Сообщается, что активность естественных киллеров (NK) в периферической крови у курильщиков снижена по сравнению с некурящими. 6 , 15 , 39 -41 Используя анализ цитотоксичности, Ginns et al. 16 обнаружили, что у курильщиков было 47% активности NK некурящих. Эти изменения, по-видимому, обратимы, поскольку активность NK у бывших курильщиков была аналогична активности в группе никогда не курящих по сравнению с курильщиками. 18 , 42 Период восстановления был относительно коротким, всего 6 недель. 15 , 17
Поскольку NK-клетки играют важную роль в раннем эпиднадзоре против вирусных инфекций и устойчивости к микробным инфекциям, 43 , 44 нарушение активности NK-клеток при курении сигарет является потенциальным механизмом увеличения числа инфекций среди курильщиков.
Молекулярные механизмы, с помощью которых курение сигарет изменяет функцию лимфоцитов, как описано ранее, все еще плохо определены.Исследования на животных показали, что никотин подавляет ответ антителообразующих клеток за счет нарушения антиген-опосредованной передачи сигналов в Т-клетках и подавления внутриклеточного ответа на кальций. 5 , 45 , 46 Kalra et al. 47 подвергали крыс воздействию основного потока сигаретного дыма или никотина с помощью осмотических насосов с постоянным высвобождением в течение 30 месяцев и пришли к выводу, что никотин является основным иммунодепрессивным компонентом при курении сигарет. Один из предполагаемых механизмов заключался в активации протеинтирозинкиназ и истощении инозитол-1,4,5-трифосфат-чувствительных запасов кальция в Т-клетках. 47
Гуморальная иммунная система. Периферическая кровь. Влияние курения сигарет на гуморальный иммунитет широко изучено. 4 , 5 Несколько исследований показали, что у курильщиков уровень сывороточного иммуноглобулина (IgA, IgG и IgM) на 10-20% ниже, чем у некурящих. 39 , 48 -51 Мили и др. 10 обнаружили, что уровни IgA, IgG и IgM были выше у бывших курильщиков, чем у нынешних курильщиков, и увеличивались с увеличением продолжительности отказа от курения.Это говорит о том, что эффект был обратимым, с возвращением к уровням иммуноглобулинов у некурящих. Hersey et al. 18 обнаружили, что через 3 месяца после того, как субъекты бросили курить, уровни IgG и IgM, но не IgA, повысились по сравнению с уровнями во время курения.
Легочные жидкости. Было обнаружено, что содержание IgG в бронхиальной жидкости у курильщиков в два раза выше, чем у некурящих. 18 , 52 Избирательное повышение уровней иммуноглобулинов можно объяснить либо стимуляцией местного производства иммуноглобулинов, либо экссудацией иммуноглобулина плазмы в альвеолярные пространства в ответ на вдыхание сигаретного дыма. 53
Доступность опсонических антимикробных антител важна для оптимальной функции фагоцитов по захвату и сдерживанию бактерий. 54 Антительный ответ на различные антигены, такие как вирусная инфекция гриппа и вакцинация 55 и Aspergillus fumigatus , 56 , подавлен у курильщиков сигарет.
Резюме иммунологических эффектов курения сигарет. Таким образом, курение сигарет связано с множеством изменений в функции клеточной и гуморальной иммунной системы.Эти изменения включают снижение уровня циркулирующих иммуноглобулинов, подавление ответов антител на определенные антигены, снижение количества лимфоцитов CD4 + , увеличение количества лимфоцитов CD8 + , снижение активности фагоцитов и снижение высвобождения провоспалительных цитокинов.
Патогенез воздействия курения на иммунную систему изучен недостаточно. Некоторые исследователи продемонстрировали антигенную роль веществ при курении сигарет, что приводит к развитию комплексов антиген-антитело.Эти комплексы способны вызывать легочные и периферические изменения в ответах гуморальной и клеточно-опосредованной системы. Hersey et al. 18 и Costabel et al 19 предположили, что комплексы антиген-антитело могут вызывать локальные изменения иммунного статуса слюны и бронхоальвеолярной жидкости и предрасполагать к инфекциям дыхательных путей.
Курение под действием никотина может стимулировать выброс катехоламинов и кортикостероидов.Эти медиаторы могут увеличивать количество лимфоцитов CD8 + в клеточно-опосредованной системе 17 и подавлять защиту хозяина от инфекций. Важно понимать, что многие иммунологические нарушения у курильщиков проходят в течение 6 недель после прекращения курения, что подтверждает идею о том, что отказ от курения является эффективным средством предотвращения инфекций за относительно короткое время.
Результаты нескольких исследований показывают, что никотин является важным иммунодепрессивным компонентом сигаретного дыма, но другие компоненты, по-видимому, также играют роль.
Курение и клинические инфекционные заболевания
Общие соображения относительно эпидемиологических исследований
При оценке эпидемиологических исследований, сообщающих о связи между курением сигарет и инфекционными заболеваниями, необходимо учитывать возможность смешения.По сравнению с некурящими, курение сигарет связано с более низким социально-экономическим статусом, иным режимом питания, более широким употреблением алкоголя и наркотиков, более низким уровнем физической активности и более рискованным поведением, включая рискованное сексуальное поведение. В большинстве исследований учитывались такие факторы, как возраст, пол, раса / этническая принадлежность, потребление алкоголя, сексуальные привычки и т. Д., Хотя не в каждом исследовании учитывались все возможные факторы, влияющие на ситуацию. Из-за нехватки места мы не можем описать, какие факторы контролировались для каждого исследования, но мы выборочно прокомментировали элементы управления для конкретных исследований, где это казалось актуальным.
Пневмококковая пневмония. Курение сигарет является существенным фактором риска пневмококковой пневмонии, особенно у пациентов с хронической обструктивной болезнью легких. Однако даже без хронической обструктивной болезни легких курение является основным фактором риска. В ходе популяционного эпиднадзора, проведенного в округе Даллас, штат Техас, в 1995 г., 57 курение было тесно связано с инвазивным пневмококковым заболеванием у здоровых взрослых людей молодого и среднего возраста (от 30 до 64 лет), которым проводилась вакцинация от пневмококка. в настоящее время не рекомендуется.Среди таких людей с инвазивным пневмококком 47% были курильщиками. Отношение шансов (OR) для инвазивного пневмококкового заболевания составляло 2,6 (95% доверительный интервал [ДИ], 1,9–3,5) для курильщиков в возрастной группе от 24 до 64 лет и 2,2 (95% ДИ, 1,4–3,4) для курильщиков. 65 лет и старше. Связанный с курением риск составил 31% и 13% в этих 2 группах соответственно. Недавнее популяционное исследование 58 «случай-контроль» показало, что курение является самым сильным независимым фактором риска инвазивного пневмококкового заболевания среди иммунокомпетентных взрослых.OR составлял 4,1 (95% ДИ, 2,4–7,3) для активного курения и 2,5 (95% ДИ, 1,2–5,1) для пассивного курения у некурящих по сравнению с некурящими, не подвергавшимися курению (Таблица 1). Приписываемый риск в этой популяции составлял 51% для курения сигарет и 17% для пассивного курения. Этот эффект показал сильную зависимость «доза-ответ» (рис. 1). Риск пневмококковой инфекции снизился до уровня некурящих через 10 лет после прекращения курения (рис. 2).
В другом исследовании случай-контроль Almirall et al 59 обнаружили, что курение в настоящее время связано с почти двукратным риском внебольничной пневмонии (OR, 1.88; 95% ДИ, 1,11–3,19), где 32% риска связано с курением сигарет. В этом исследовании наблюдалась тенденция к зависимости от дозы. Сообщалось о 50% снижении OR через 5 лет после отказа от курения. Таблица 1 суммирует эти результаты.
Было показано, что прилипание Streptococcus pneumoniae к клеткам буккального эпителия in vitro повышается у курильщиков сигарет. 60 Это повышенное соблюдение режима лечения может сохраняться до 3 лет после отказа от курения.Поскольку повышенное прилипание бактерий к поверхностным клеткам является установленным патогенным этапом бактериальной колонизации и инфекции как в легких, так и в других органах, это может способствовать повышенному риску респираторной инфекции, существующей у курильщиков сигарет.
Болезнь легионеров. Болезнь легионеров — опасная для жизни бронхопневмония, на долю которой приходится от 1% до 3% внебольничных пневмоний. Выявлены различные факторы окружающей среды, и курение сигарет, по-видимому, является независимым фактором риска. 61
Straus et al. 62 сообщил, что риск заболевания легионерами увеличивался на 121% на пачку сигарет, потребляемую ежедневно, с OR 3,48 (95% ДИ, 2,09–5,79) для курения. Для людей без основного заболевания OR для курильщиков по сравнению с некурящими составлял 7,49 (95% ДИ, 3,27-17,17).
Активные курильщики. В исследовании случай-контроль, проведенном Fischer et al, 63 36% пациентов с менингококковой инфекцией курили в настоящее время, а 14% — некурящие (OR, 2.4; 95% ДИ, 0,9-6,6). Во время вспышки менингококковой инфекции серогруппы C среди студентов колледжей 4 из 6 случаев были у курильщиков сигарет, что значительно выше, чем в контрольной группе, подвергшейся воздействию (OR 7,8; 95% ДИ 1,3-64,4). 64
Курение сигарет связано с менингококковой колонизацией носоглотки. Стюарт и др. 65 обнаружили, что 55% активных курильщиков были носителями, по сравнению с 36% некурящих и 76% тех, кто подвергался воздействию вторичного табачного дыма.Риск носительства, связанный с активным курением, увеличивается с увеличением количества выкуриваемых сигарет в день. ОШ для всех курильщиков составляло 2,3 (95% ДИ, 1,2–4,6), с большим риском для курильщиков, выкуривающих более 20 сигарет в день. Caugant и др. 66 провели опрос среди норвежского населения и обнаружили, что активное курение независимо связано с носительством менингококка (OR 2,79; 95% ДИ 1,67–4,64). Не было никакой связи между количеством выкуриваемых сигарет в день и перевозкой.Аналогичная картина была обнаружена в исследовании, проведенном среди новобранцев в Греции. 67
Воздействие вторичного табачного дыма. Пассивное воздействие табачного дыма также связано с повышенным риском менингококковой инфекции. В исследовании «случай-контроль» Fischer et al 63 установили сильную эпидемиологическую связь между курением и менингококковой инфекцией у детей. Для детей младше 18 лет наличие курящей матери было самым сильным независимым фактором риска инвазивной менингококковой инфекции по сравнению с другими факторами риска, такими как образование матери, отсутствие врача первичного звена или использование увлажнителя воздуха (OR, 3.8; 95% ДИ, 1,6-8,9). Тридцать семь процентов инфекций могут быть связаны с курением матери. Число курильщиков, живущих в доме, и количество выкуриваемых пачек в день имели значительную линейную зависимость с риском менингококковой инфекции. В этом исследовании такой связи не наблюдалось для курения отцов. Среди взрослых пациентов с менингококковой инфекцией 50% были пассивными курильщиками по сравнению с 29% в контрольной группе (OR 2,5; 95% ДИ 0,9-6,9). В опросе населения Норвегии Caugant et al 66 обнаружили удвоение количества носителей пассивного курения (OR, 2.30; 95% ДИ 1,21-4,37). В проспективном исследовании Haneberg et al. 68 обнаружили, что пассивное курение у детей младше 12 лет значительно чаще встречается у пациентов с менингококковой инфекцией (62%), чем в контрольной популяции (32%) ( P <0,001).
Существует несколько потенциальных механизмов, с помощью которых табак может увеличить риск менингококковой инфекции. Во-первых, табачный дым является фактором риска носоглоточного носительства менингококка, поэтому у людей, живущих с курильщиками, больше шансов заразиться менингококками.Второй возможный механизм заключается в том, что предшествующая вирусная инфекция, которая чаще встречается у курильщиков, может действовать как кофактор менингококковой инфекции. Во время вспышки менингококковой инфекции в округе Лос-Анджелес, Калифорния, пациенты с менингококковой инфекцией чаще, чем соответствующая контрольная группа, имели инфекцию верхних дыхательных путей (OR, 3,2; 95% ДИ, 1,4-7,1) или подвергались воздействию посетитель домохозяйства с инфекцией верхних дыхательных путей (OR, 2,6; 95% ДИ, 1,02–6,6). 69 В-третьих, неэффективный гуморальный иммунитет против полисахаридной капсулы Neisseria meningitidis является общепризнанным фактором риска инвазивного менингококкового заболевания.
Средний отит и воздействие вторичного табачного дыма. Длительное воздействие табачного дыма является фактором риска развития среднего отита и бронхита у детей. 3 В проспективном исследовании 175 детей с рецидивирующим средним отитом сравнивались с группой из 175 детей того же возраста, чтобы определить роль пассивного курения сигарет в заболеваемости этим заболеванием.Группа пациентов чаще подвергалась воздействию пассивного курения, с OR 1,88 (95% ДИ, 1,02–3,49) ( P = 0,04). Проспективное наблюдение за группой случаев не показало значимых различий в клиническом течении детей, подвергшихся воздействию пассивного курения, и тех, кто не подвергался воздействию табачного дыма. 70 Ilicali et al. 71 исследовали развитие среднего отита с выпотом и рецидивирующего среднего отита у 166 детей от 3 до 7 лет по сравнению с сопоставимой по возрасту контрольной группой из 166 детей.Пассивное курение было значительным фактором риска среднего отита с выпотом и рецидивирующего среднего отита. Группа пациентов подвергалась курению в среднем 19,6 сигарет в день по сравнению с 14,4 сигаретами в день в контрольной группе ( P <0,004). Только курение матери было значимым фактором ( P <0,001). Более того, внутриутробное воздействие сигаретного дыма было связано с повышенным риском среднего отита. В исследовании, проведенном Stathis et al., 72 острые ушные инфекции были связаны с потреблением матерью от 1 до 9 сигарет (OR, 1.6; 95% ДИ 1,1–2,5), от 10 до 19 сигарет (ОШ 2,6, 95% ДИ 1,6–4,2) и 20 или более сигарет (ОШ 3,3; 95% ДИ 1,9–5,9) в день во время беременности. Для подострых инфекций уха наблюдалась связь с потреблением матерью от 10 до 19 сигарет (OR, 2,6; 95% ДИ, 1,4-5,0) и 20 или более сигарет (OR, 2,8; 95% ДИ, 1,3-6,0). Внутриутробное воздействие 20 или более сигарет в день также было связано с повышенным риском хирургического вмешательства на ухе через 5 лет после родов (OR 2,9; 95% CI 1,3-6,6).
Заболевания пародонта. Употребление табака — существенный фактор риска заболеваний пародонта. 73 , 74 У курильщиков вероятность развития пародонтоза в 2,5–6 раз выше, чем у некурящих, и существует прямая зависимость между количеством выкуриваемых сигарет и риском развития заболеваний пародонта. Среди нынешних курильщиков вероятность пародонтита колеблется от 2,79 (95% ДИ, 1,90–4,10) для 9 или менее сигарет в день до 5,88 (95% ДИ, 4,03–8,58) для 31 или более сигарет в день. Среди бывших курильщиков вероятность заболевания пародонтитом снижалась с увеличением количества лет, прошедших с момента отказа от курения, с 3.22 (95% ДИ, 2,18–4,76) в течение 0–2 лет до 1,15 (95% ДИ, 0,83–1,60) в течение 11 или более лет после прекращения курения. 75
Тяжесть пародонтоза также увеличивается у курильщиков, а послеоперационные результаты хуже, чем у некурящих. 76 Существует прямая взаимосвязь между употреблением табака и повышенной потерей прикрепления, глубиной кармана и уменьшением высоты гребня кости. 77 , 78 Курильщики в большей степени подвержены поддесневой бактериальной колонизации, чем никогда не курившие. 79 , 80
Инфекция. Патогенез язвенной болезни многофакторен. Инфекция Helicobacter pylori и курение являются хорошо известными факторами риска. Более 95% язв двенадцатиперстной кишки связаны с инфекцией H pylori , а лечение H pylori заметно снижает частоту рецидивов язвы. У курильщиков чаще развиваются язвы. 81 Язвы у курильщиков заживают дольше 82 и рецидивы у курильщиков возникают чаще, чем у некурящих. 83 -85
Moshkowitz et al. 86 обнаружили, что язвы желудка и двенадцатиперстной кишки чаще встречаются у курильщиков, чем у некурящих (желудочный, 4,1% против 1,8%; дуоденальный, 50% против 39,8%, соответственно; P <0,05). Bateson, 87 , в проспективном исследовании сообщил, что 51,8% пациентов с язвой двенадцатиперстной кишки и 48,8% пациентов с язвой желудка курили по сравнению с 31,8% в контрольной группе. В этом исследовании сообщается о связи между текущим курением и инфекцией H pylori у пациентов с нормальными результатами эндоскопии.У нынешних курильщиков сигарет частота инфицирования H. pylori была выше (49,6%), чем у некурящих и бывших курильщиков (35,5%) ( P <0,01). В другом исследовании 73% курильщиков с положительным результатом на H. pylori имели язву двенадцатиперстной кишки или желудка, тогда как только 27% серопозитивных некурящих имели язвы. 88
Недавно Накамура и др. 89 сообщили о повышенном риске тяжелого атрофического гастрита и кишечной метаплазии, связанного с курением (OR, 9.31; 95% ДИ, 3,85-22,50; и OR, 4,91; 95% ДИ, 1,90–12,68) в пределах H pylori –положительных субъектов.
Никотин усиливает активность вакуолизирующего токсина H pylori . Этот токсин может быть важным фактором, определяющим вирулентность H pylori . На модели in vitro Кавер и др. 90 показали, что обработка клеток никотином после воздействия токсина H pylori индуцирует образование вакуолей внутри эукариотических клеток и вызывает повреждение слизистой оболочки.В то время как курение сигарет является сильным предиктором рецидива язвы в присутствии лечения H pylori , курение сигарет, по-видимому, мало влияет на заживление язвы после уничтожения H pylori . 91 Borody et al 92 показали, что у 197 пациентов с ликвидированным H. pylori и вылеченной язвой двенадцатиперстной кишки с помощью эндоскопического исследования, рецидива язвы не было, независимо от статуса курения в течение периода наблюдения в 6 лет. Эти наблюдения подтверждают идею о том, что основным механизмом, с помощью которого курение увеличивает язвенную болезнь, является увеличение скорости инфекции и / или вирулентности H pylori .
Простуда. Крупные эпидемиологические исследования подтверждают связь между курением и распространенностью простудных заболеваний и симптомов со стороны нижних дыхательных путей. В проспективном когортном исследовании Blake et al. 93 обследовали большую группу новобранцев армии США (1230 солдат) и обнаружили, что 22,7% курильщиков страдали инфекциями верхних дыхательных путей по сравнению с 16% некурящих; относительный риск 1,5 (95% ДИ 1,1–1,8).
Cohen et al. 94 показали, что статус курения является предиктором развития клинической простуды, когда они подвергли 400 здоровых добровольцев интраназальному воздействию низкой дозы 1 из 5 респираторных вирусов.Вирусные суспензии вводили в ноздри, и инфекции диагностировались на основе выделения вируса, вирус-специфических антител и клинических данных. Курильщики имели значительно более высокую частоту возникновения острой инфекции (клинической простуды), чем некурящие, с OR 2,23 (95% ДИ, 1,03–4,82). Среди вирусологически подтвержденных инфицированных лиц курение было связано с более высокой вероятностью появления симптомов, ведущих к постановке клинического диагноза (OR, 1,83; 95% ДИ, 1,00–3,36). Этот риск для курильщиков не зависел от употребления алкоголя, а также от демографических, экологических, иммунологических и психологических переменных.Коэн и др. 94 предположили, что связь между курением и усилением симптомов вирусных респираторных инфекций может быть объяснена нарушением иммунных процессов, которые ограничивают репликацию вируса, или усилением воспалительных процессов, участвующих в возникновении симптомов. Когда Виталис и др. 95 подвергали морских свинок с латентной аденовирусной инфекцией однократной дозой сигаретного дыма, у них развился более агрессивный воспалительный ответ. Важной особенностью аденовирусной инфекции является то, что части его вирусной ДНК сохраняются в клетках-хозяевах после остановки репликации вируса.Это может иметь важное значение в патогенезе постоянной обструкции дыхательных путей, бронхоэктазов, хронической обструктивной болезни легких и эмфиземы. Вероятный механизм — через белок, экспрессируемый латентной вирусной ДНК. Этот белок усиливает экспрессию генов, которые активируются при воспалении дыхательных путей, вызванном сигаретным дымом. 96
Грипп. Несколько исследований подтвердили связь между курением сигарет и риском заражения гриппом. 97 Инфекции гриппа более тяжелые, с большим количеством кашля, острым и хроническим выделением мокроты, одышкой и хрипом у курильщиков. У курящих женщин в израильской армии риск гриппа составлял 60% по сравнению с 41,6% у некурящих (OR 1,44; 95% CI 1,03–2,01). У них также на 44% увеличилось количество осложнений (чаще посещали клинику) во время эпидемического гриппа, вызванного подтипом A (h2N1). 98 В другом исследовании 336 здоровых молодых мужчин-новобранцев израильской военной части, проведенном Карком и др., 99 , заболеваемость гриппом составила 68.5% среди курильщиков и 47,2% среди некурящих ( P <0,001). OR составил 2,42 (95% ДИ 1,53–3,83). Грипп был более тяжелым среди курильщиков, с дозозависимым увеличением частоты: 30% среди некурящих, 43% среди легких курильщиков и 54% среди заядлых курильщиков ( P <0,001). Потеря работы произошла у 50,6% курильщиков и 30,1% некурящих. В целом, 31,2% (95% ДИ, 16,5–43,1) случаев гриппа были связаны с курением сигарет.
Повышенная бактериальная адгезия была задокументирована для инфицированных респираторных клеток, причем вирус гриппа A отвечает за вирусно-бактериальную комбинированную пневмонию. 100 Исследования показали, что воспалительная активация фактора активации тромбоцитов является важным фактором прикрепления и инвазии клеток штаммами пневмококка. Курение сигарет изменяет метаболизм факторов активации тромбоцитов и может способствовать увеличению случаев бактериальной суперинфекции у людей, у которых развивается грипп. 101 , 102
Хотя грипп был более тяжелым у курильщиков, уровни антител к антигену A (h2N1) у курильщиков не были значительно выше, чем у некурящих.Только 50% людей с тяжелым заболеванием достигли титров выше 20. Более того, антитела к гриппу у курильщиков ослабевают быстрее, чем у некурящих. 55 Это открытие предполагает, что курильщики не только подвергаются высокому риску заражения гриппом, но и имеют повышенную восприимчивость к новым приступам впоследствии. 99 Уровень заболеваемости гриппом у вакцинированных курильщиков и некурящих одинаков. Однако вакцинация против гриппа может считаться более эффективной для курильщиков, чем для некурящих, поскольку уровень инфицирования выше у не вакцинированных курильщиков. 103
Ветряная оспа. У взрослых инфекция ветряной оспы связана со значительной частотой осложнений. Одним из таких осложнений является пневмонит, вызванный ветряной оспой, повышенному риску которого подвергаются курильщики. Эллис и др. 104 показали, что среди 29 взрослых с инфекцией ветряной оспы 7 из 19 курильщиков были госпитализированы с пневмонией, но ни у одного из 10 некурящих не развилось пневмонии. Позже Грейсон и Ньютон-Джон 105 сообщили о 15-кратном риске развития ветряной оспы у курильщиков по сравнению с некурящими и ветряной оспой ( P <.001).
Инфекции вируса папилломы человека. Инфекция нижних отделов половых путей, вызванная вирусом папилломы человека (ВПЧ), является одним из наиболее распространенных заболеваний, передающихся половым путем, и является причиной интраэпителиальной неоплазии шейки матки. Хотя вирус папилломы человека является инфекционным агентом, клинические проявления ВПЧ являются функцией взаимодействия вируса и других факторов, таких как клеточно-опосредованная и гуморальная иммунная система пациента, а также характеристик пациента, таких как курение. 106 Частоту инфицирования ВПЧ сложно установить, поскольку большинство инфекций являются временными, и до появления диагностических методов, основанных на полимеразной цепной реакции, серологические измерения не обладали хорошей чувствительностью или специфичностью. От 7% до 50% подростков инфицированы ВПЧ, 107 , 108 в зависимости от их сексуального поведения. Курение сигарет, как активное, так и пассивное, связано с экспрессией ВПЧ и цервикальной интраэпителиальной неоплазией.Сообщается об относительном риске курения 2,7 (95% ДИ 1,7–4,3). 109
Никотин и другие компоненты дыма были обнаружены в цервикальной слизи у активных и пассивных курильщиков. 110 Эти компоненты были связаны с уменьшением количества клеток Лангерганса в шейке матки при цитологическом исследовании. 106 Клетки Лангерганса являются частью системы иммунного ответа, опосредованной антиген-Т-лимфоцитами, и ответственны за рекрутирование лимфоцитов CD4 + , которые необходимы для местного иммунного ответа.Пациенты, которые не ответили на лечение интерфероном от ВПЧ, имели низкий уровень лимфоцитов CD4 + и низкое соотношение CD4 + / CD8 + . Это соотношение было почти нормальным у пациентов, ответивших на лечение интерфероном. 111 Профиль риска с низким соотношением CD4 + / CD8 + аналогичен профилю риска из-за курения, описанному ранее в этой статье. Кроме того, некоторые исследования показали, что витамин А и бета-каротин защищают от интраэпителиальной неоплазии шейки матки. 112 У курильщиков сигарет снизился уровень бета-каротина в сыворотке крови. Скорее всего, сигаретный дым действует как кофактор, способствующий заражению ВПЧ, и как иммунодепрессант. Однако вирус и курение являются независимыми и дополняющими по своему влиянию на иммунную систему.
Инфекция, вызванная вирусом иммунодефицита человека. Несколько исследований изучали курение сигарет как кофактор СПИДа у людей, инфицированных вирусом иммунодефицита человека (ВИЧ). Первую связь между курением и СПИДом наблюдали Newell et al. 113 Позже Ройс и Винкельштейн 114 сообщили о повышенном риске СПИДа и более быстром прогрессировании у серопозитивных курильщиков по сравнению с некурящими. В 1990 году Булос и др. 115 сообщили о связи между курением и ВИЧ-инфекцией у беременных гаитянок. У женщин, выкуривающих 4 или более сигарет в день, уровень серопозитивности к ВИЧ-1 составлял 25% по сравнению с 9,6% для женщин, выкуривающих менее 4 сигарет в день. Связь между ВИЧ-инфекцией и курением осложнялась связью между курением сигарет и сексуальным поведением высокого риска, но было обнаружено, что курение сигарет является независимым фактором риска после контроля как сексуального поведения высокого риска, так и ВИЧ-инфекции в этой популяции.ОШ для курения и ВИЧ-инфекции было значительным (ОШ 3,4; 95% ДИ 1,6-7,5). С другой стороны, Burns et al. 116 наблюдали более высокий уровень сероконверсии к ВИЧ у курящих гомосексуалистов, чем у некурящих, но не обнаружили влияния курения на клинический исход в их когорте. Сходные результаты были также получены Craib et al, 117 , которые не смогли найти значимой связи между курением сигарет и развитием пневмонии, вызываемой Pneumocystis carinii .
Хотя связь между курением и ВИЧ-инфекцией может быть обусловлена смешивающим фактором, таким как участие в поведении, сопряженном с повышенным риском, необходимо учитывать биологический эффект курения сигарет. Никотин и котинин концентрируются в цервикальном секрете курящих женщин 118 , 119 и могут изменять местные иммунные факторы и повышать восприимчивость к вирусным инфекциям половых путей. У пациентов, инфицированных ВИЧ, курение также связано с увеличением заболеваемости бактериальной пневмонией.В многоцентровом исследовании, проведенном Исследовательской группой по легочным осложнениям ВИЧ-инфекции, этот эффект курения был наиболее сильным в подгруппе пациентов с наибольшей лимфопенией. 120
Как обсуждалось ранее, курение сигарет связано с увеличением процента CD4 + в крови в серонегативных популяциях. Несколько исследований 112 , 114 , 116 , 117,121 , 122 показали, что эти эффекты ослабляются у ВИЧ-инфицированных курящих в течение первых 2 лет инфекции.Анализ данных показал, что эффект курения присутствует в течение первых нескольких лет после заражения ВИЧ, но затем исчезает, и у этих пациентов наблюдается заметное снижение количества CD4 + . Другими словами, когда курильщики заражаются ВИЧ, требуется до 2 лет, чтобы вызванное вирусом истощение клеток CD4 преодолело эффект курения. Напротив, в их жидкости бронхоальвеолярного лаважа наблюдается значительное снижение количества клеток CD4 и CD8, что позволяет предположить, что курение сигарет оказывает значительное влияние на защитные силы легких у ВИЧ-инфицированных. 22 У ВИЧ-инфицированных пациентов курение сигарет увеличивает риск кандидоза полости рта (относительный риск 1,32; 95% ДИ 1,02–1,70), волосатой лейкоплакии (связанной с инфекцией вируса Эпштейна-Барра; относительный риск 1,51; 95% ДИ 1,15–1,99) и внебольничная пневмония (относительный риск 2,62; 95% ДИ 1,30–5,27). 116 , 122
Лица с особым риском туберкулеза включают лиц с ослабленным иммунитетом и лиц с низким социально-экономическим статусом.Несколько исследований показали, что курение является фактором риска реактивности туберкулиновой кожной пробы, конверсии кожной пробы и развития активного туберкулеза. Yu et al. 123 сообщили, что относительный риск развития туберкулеза для заядлых курильщиков по сравнению с некурящими составлял 2,17 (95% ДИ 1,29–3,63). Бускин и др. 124 обнаружили, что с поправкой на возраст и чрезмерное употребление алкоголя у курильщиков от 20 лет и более риск туберкулеза у некурящих был в 2,6 раза (95% ДИ 1,1-5,9).
Alcaide et al. 125 также обнаружили тесную связь между активным курением и риском туберкулеза легких. Оба исследования показали зависимость «доза-реакция» от количества выкуриваемых сигарет в день. McCurdy et al. 126 сообщили о частоте возникновения туберкулиновой реактивности в 16,6% (длительность> 10 мм в течение 48–72 часов) среди латиноамериканских мигрантов, проживающих на фермах в Калифорнии. Эта распространенность была выше среди бывших курильщиков, чем среди никогда не куривших (OR, 3.11 [95% ДИ 1,2–8,09] против 1,00). У нынешних курильщиков риск был почти в 2 раза выше, чем у никогда не куривших (OR 1,87; 95% ДИ 0,73–4,80).
В исследовании случай-контроль среди заключенных взрослых Anderson et al. 127 сообщили о 81% конверсии туберкулиновой кожной пробы у курильщиков по сравнению с 10,3% у некурящих. Интересным открытием этого исследования было то, что продолжительность курения была более важной, чем количество сигарет, выкуриваемых за день. В таблице 2 приведены результаты этих исследований.
В крупном исследовании методом случай-контроль, проведенном в Индии, изучалось курение и туберкулез у мужчин в возрасте от 35 до 69 лет. 128 Коэффициент риска распространенности туберкулеза составлял 2,9 (95% ДИ, 2,6–3,3) для постоянно курильщиков по сравнению с никогда не курившими, а распространенность была выше при более высоком уровне потребления сигарет (таблица 2). Смертность от туберкулеза среди мужчин в возрасте от 25 до 69 лет, основанная на 4072 случаях смерти от туберкулеза, показала соотношение риска 4,5 (95% ДИ, 4,0–5,0) и 4.2 (95% ДИ, 3,7–4,8) для городских и сельских жителей соответственно. Авторы обнаружили, что доля смертей от туберкулеза, связанных с курением, составила 61%, что больше, чем доля смертей, связанных с курением, от сосудистых заболеваний или рака.
В исследовании среди детей, живущих с пациентом с активным туберкулезом легких, пассивное курение было сильным фактором риска развития активного туберкулеза (OR, 5,39; 95% ДИ, 2,44-11,91). Пассивное курение было подтверждено измерением уровней котинина в моче, которые были выше у детей, у которых развилось заболевание. 129 Биологической основой, по которой курение табака увеличивает риск туберкулеза, может быть снижение иммунного ответа, механическое нарушение функции ресничек, дефекты иммунного ответа макрофагов и / или лимфопения CD4 + , повышающая восприимчивость к туберкулезу легких. 130 , 131
Исторический интерес представляет связь между туберкулезом и ростом курения сигарет в начале 20 века. Раньше жевательный табак был предпочтительным видом табака.Опасения общества, что потребители жевательного табака, которые плюются в общественных местах, могут распространять туберкулез, являются одним из факторов, которые привели к увеличению продаж сигарет в Соединенных Штатах. Это хорошо описано Клугером 132 следующим образом: «Жевание табака больше не было просто грязным, но социально неприятным в более густонаселенной городской Америке, и его неизбежный побочный продукт, плевание, теперь было определено как распространитель туберкулеза и других инфекций и болезней. , таким образом, официальная угроза здоровью.Неторопливая трубка сразу показалась пережитком более медленной эпохи, а сигарный дым стал новым оскорблением среди многолюдной городской жизни. Сигарету, напротив, можно было быстро выкурить и легко потушить на работе, а также на работе и обратно ».
Курение сигарет остается огромной проблемой для здоровья и основной причиной ряда предотвратимых заболеваний и многих преждевременных смертей. Как правило, врачи считают рак, атеросклеротическое сердечно-сосудистое заболевание и хроническое обструктивное заболевание легких основными проблемами здоровья, вызванными курением.В нашем обзоре суммируются результаты исследований, посвященных еще одному значительному неблагоприятному влиянию активного и пассивного курения на здоровье: развитию инфекций. Инфекционные заболевания могут соперничать с раком, сердечными и хроническими заболеваниями легких в качестве источников заболеваемости и смертности от курения.
Мы проанализировали силу связи между курением и инфекциями, измеренную по относительному риску и наличию эффекта «доза-ответ». Возможные механизмы, с помощью которых курение увеличивает риск инфекций, включают структурные изменения в дыхательных путях и снижение иммунного ответа, как системного, так и локального в легких.
Курение сигарет является существенным фактором риска серьезных бактериальных и вирусных инфекций. Чтобы подчеркнуть некоторые из наиболее распространенных и серьезных связей между курением и инфекцией, курильщики подвергаются в 2–4 раза повышенному риску инвазивного пневмококкового заболевания, заболевания, связанного с высокой смертностью. Риск гриппа у курильщиков в несколько раз выше и намного серьезнее, чем у некурящих. Возможно, самое сильное воздействие курения на здоровье населения на инфекцию — это повышенный риск туберкулеза.Самый высокий уровень заболеваемости туберкулезом и связанной с ним смертностью наблюдается среди бедных и людей в слаборазвитых странах. Распространенность курения среди бедных в развитых странах высока и быстро растет в слаборазвитых странах. Таким образом, вполне вероятно, что курение вносит значительный вклад в бремя болезней туберкулеза во всем мире.
Результаты нашего обзора дополнительно подчеркивают потенциальную пользу для здоровья от отказа от курения и имеют конкретные клинические последствия:
Отказ от курения должен быть частью терапевтического плана для людей с серьезными инфекционными заболеваниями, пародонтитом или положительными результатами туберкулиновых кожных проб.
Следует контролировать воздействие пассивного курения у детей, чтобы снизить риск менингококковой инфекции и среднего отита, и у взрослых, чтобы снизить риск гриппа и менингококковой инфекции.
У нас есть 3 рекомендации по профилактике конкретных заболеваний:
• Пневмококковая вакцина и вакцина против гриппа для всех курильщиков
• Лечение ацикловиром ветряной оспы у курящих женщин
ou • Ежегодно курят мазки Papanicola
Принята к публикации: 28 ноября 2003 г.
Для корреспонденции: Neal L. Benowitz, MD, Отдел клинической фармакологии и экспериментальной терапии, Калифорнийский университет, Сан-Франциско, Box 1220, Сан-Франциско, CA 94143-1220 ([email protected]).
Раскрытие финансовой информации: Нет.
Финансирование / поддержка: Это исследование было частично поддержано грантами Службы общественного здравоохранения DA02277 и DA12393 от Национального института здоровья, Бетесда, Мэриленд, и Института медицинских исследований бортпроводников, Майами, Флорида.
Выражение признательности: Мы благодарим Джоэля Эрнста, доктора медицины, за его критический обзор рукописи и Кэй Уэлч за помощь редактора.
2.Марси
TWMerrill
WW Курение сигарет и инфекция дыхательных путей. Clin Chest Med 1987; 8381-391PubMedGoogle Scholar4.Sopori
MLGoud
Н.С.Каплан
А.М. Влияние табачного дыма на иммунную систему. JH
DeanAE
LustreM
Кимередс. Иммунотоксикология и иммунофармакология New York, NY Raven Press 1994; 413- 432Google Scholar5.Sopori
М.Л.Козак
WSavage
SM
и другие. Влияние никотина на иммунную систему: возможное регулирование иммунных ответов центральными и периферическими механизмами. Психонейроэндокринология 1998; 23189-204PubMedGoogle ScholarCrossref 6. Толлеруд
DJClark
JWBrown
LM
и другие. Влияние курения сигарет на подгруппы Т-лимфоцитов: популяционный опрос здоровых кавказцев. Am Rev Respir Dis 1989; 13
-1451PubMedGoogle ScholarCrossref 8.Corre
FLellouch
Дж. Шварц
D Курение и количество лейкоцитов: результаты эпидемиологического обследования. Lancet 1971; 2632-634PubMedGoogle ScholarCrossref 9. Фридман
GDSiegelaub
ABSeltzer
CCFeldman
RCollen
М.Ф. Курящие привычки и количество лейкоцитов. Arch Environ Health 1973; 26137-143PubMedGoogle ScholarCrossref 10.Mili
FFlanders
WDBoring
JRAnnest
JLDestefano
F Связь расы, курения и отказа от курения с показателями иммунной системы у мужчин среднего возраста. Clin Immunol Immunopathol 1991; 59187-200PubMedGoogle ScholarCrossref 11. Тейлор
RGWoodman
GClarke
SW Концентрация никотина в плазме и количество лейкоцитов у курильщиков. Thorax 1986; 41407-408PubMedGoogle ScholarCrossref 13.Vanuxem
DSampol
JWeiller
PJM’Barki
MGrimaud
C Влияние хронического курения на лейкоциты [на французском]. Дыхание 1984; 46258-264Google ScholarCrossref 14.Расскажи
GSGrimm
RH
Младший Веллар
О.Д. Теодорсен
L Связь количества лейкоцитов, количества тромбоцитов и гематокрита с курением сигарет у подростков: Молодежное исследование Осло. Тираж 1985; 72971-974PubMedGoogle ScholarCrossref 15.Hughes
DAHaslam
PLTownsend
PJTurner-Warwick
M Количественные и функциональные изменения лимфоцитов системы кровообращения у курильщиков сигарет. Clin Exp Immunol 1985; 61459-466PubMedGoogle Scholar16.Джинны
LCGoldenheim
PDMiller
LG
и другие. Субпопуляции Т-лимфоцитов при курении и раке легких: анализ моноклональных антител и проточная цитометрия. Am Rev Respir Dis 1982; 126265-269PubMedGoogle Scholar17.Miller
LGGoldstein
GMurphy
MGinns
LC Обратимые изменения иммунорегуляторных Т-клеток при курении: анализ с помощью моноклональных антител и проточной цитометрии. Сундук 1982; 82526-529PubMedGoogle Scholar18.Hersey
PPrendergast
DEdwards
A. Влияние курения сигарет на иммунную систему: последующие исследования у здоровых людей после прекращения курения. Med J Aust 1983; 2425-429PubMedGoogle Scholar19.Costabel
UBross
KJReuter
CRuhle
К.Х.Маттис
H Изменения в субпопуляциях иммунорегуляторных Т-клеток у курильщиков сигарет: фенотипический анализ бронхоальвеолярных клеток и лимфоцитов крови. Сундук 1986; 9039-44PubMedGoogle ScholarCrossref 20.Reinherz
Е.Л.Рубинштейн
AGeha
RSSтрелкаускас
AJRosen
Ф.С.Шлоссман
С.Ф. Нарушения иммунорегуляторных Т-лимфоцитов при нарушениях иммунной функции. N Engl J Med 1979; 3011018-1022PubMedGoogle ScholarCrossref 21.Leatherman
JWMichael
AFSchwartz
BAHoidal
JR Т-клетки легких при гиперчувствительном пневмоните. Ann Intern Med 1984; 100390-392PubMedGoogle ScholarCrossref 22.Wewers
MDDiaz
PTWewers
MELowe
МП Нагараджа
HNClanton
TL Курение сигарет при ВИЧ-инфекции вызывает подавление воспалительной среды в легких. Am J Respir Crit Care Med 1998; 1581543-1549PubMedGoogle ScholarCrossref 23.Фишер
GLMcNeill
KLFinch
Г.Л. Уилсон
FDGolde
DW Функциональная оценка макрофагов легких у курильщиков сигарет и некурящих. J Reticuloendothel Soc 1982; 32311-321PubMedGoogle Scholar24.Noble
RCPenny
BB Сравнение количества и функции лейкоцитов у курящих и некурящих молодых мужчин. Infect Immun 1975; 12550-555PubMedGoogle Scholar25.Corberand
JNguyen
FDo
AH
и другие. Влияние табакокурения на функции полиморфно-ядерных лейкоцитов. Infect Immun 1979; 23577-581 PubMedGoogle Scholar26.Eichel
Бшахрик
HA Токсичность табачного дыма: потеря функции лейкоцитов в полости рта у человека и жидкоклеточного метаболизма. Science 1969; 1661424-1428PubMedGoogle ScholarCrossref 27.Bridges
РБКраал
JHHuang
LJChancellor
BM Влияние табачного дыма на хемотаксис и метаболизм глюкозы полиморфно-ядерных лейкоцитов. Infect Immun 1977; 15115-123PubMedGoogle Scholar 28.Мосты
RBHsieh
L Влияние фракций сигаретного дыма на хемотаксис полиморфно-ядерных лейкоцитов. J Leukoc Biol 1986; 4073-85PubMedGoogle Scholar29.Sasagawa
SSuzuki
К.Сакатани
TFujikura
T Влияние никотина на функции полиморфно-ядерных лейкоцитов человека in vitro. J Leukoc Biol 1985; 37493-502PubMedGoogle Scholar31.McCrea
KAEnsor
JENall
KBleecker
ERHasday
JD Измененная регуляция цитокинов в легких курильщиков сигарет. Am J Respir Crit Care Med 1994; 150696-703PubMedGoogle ScholarCrossref 32.Twigg
HL
IIIСолиман
DMSpain
Б. Нарушение функции дополнительных клеток альвеолярных макрофагов и снижение заболеваемости лимфоцитарным альвеолитом у курящих ВИЧ-инфицированных пациентов. AIDS 1994; 8611-618PubMedGoogle ScholarCrossref 33.Ouyang
YVirasch
NHao
п
и другие. Подавление продукции человеческого IL-1β, IL-2, IFN-γ и TNF-alpha экстрактами сигаретного дыма. J Allergy Clin Immunol 2000; 106280-287PubMedGoogle ScholarCrossref 34.Hagiwara
Этакахаши
KIOkubo
Т
и другие. Курение сигарет истощает клетки, спонтанно секретирующие цитокины Th (1) в дыхательных путях человека. Цитокин 2001; 14121-126PubMedGoogle ScholarCrossref 35.Madretsma
SWolters
Л.Мван Дейк
JP
и другие. Влияние никотина на продукцию цитокинов неприлипающими мононуклеарными клетками человека in vivo. Eur J Gastroenterol Hepatol 1996; 81017-1020PubMedGoogle ScholarCrossref 36.Мацунага
К.Кляйн
TWFriedman
HYamamoto
Y Участие никотиновых рецепторов ацетилхолина в подавлении антимикробной активности и цитокиновых ответов альвеолярных макрофагов на инфекцию Legionella pneumophila никотином. J Immunol 2001; 1676518-6524PubMedGoogle ScholarCrossref 38. Lustre
М.И.Симеонова
П.П.Галлуччи
RMatheson
J Фактор некроза опухоли α и токсикология. Crit Rev Toxicol 1999; 29491-511PubMedGoogle ScholarCrossref 39.Ферсон
MEdwards
ALind
AMilton
GWHersey
P Низкая активность естественных клеток-киллеров и уровни иммуноглобулинов, связанные с курением у людей. Int J Cancer 1979; 23603-609PubMedGoogle ScholarCrossref 40.Nair
МПКронфол
ЗАШварц
SA Влияние алкоголя и никотина на цитотоксические функции лимфоцитов человека. Clin Immunol Immunopathol 1990; 54395-409PubMedGoogle ScholarCrossref 41.Tollerud
DJClark
JWBrown
LM
и другие.Связь курения сигарет с уменьшением количества циркулирующих естественных клеток-киллеров. Am Rev Respir Dis 1989; 139194-198PubMedGoogle ScholarCrossref 42.Silverman
Н.А.Потвин
CАлександр
JC
JrChretien
PB Реактивность лимфоцитов in vitro и уровни Т-лимфоцитов у хронических курильщиков сигарет. Clin Exp Immunol 1975; 22285-292PubMedGoogle Scholar43.Herberman
РБХолден
HT Естественный клеточный иммунитет. Adv Cancer Res 1978; 27305–377PubMedGoogle Scholar 44.
Херберман
RB Естественный клеточно-опосредованный иммунитет против опухолей . Нью-Йорк, NY Academic Press, 1980;
45.Geng
YSavage
С.М.Джонсон
LJSeagrave
JSopori
ML Влияние никотина на иммунный ответ, I: хроническое воздействие никотина ухудшает передачу сигнала в лимфоцитах, опосредованную рецептором антигена. Toxicol Appl Pharmacol 1995; 135268-278PubMedGoogle ScholarCrossref 46.Geng
YSavage
С.М.Разани-Боруджерди
SSopori
ML Влияние никотина на иммунный ответ, II: хроническое лечение никотином вызывает анергию Т-клеток. J Immunol 1996; 1562384-2390PubMedGoogle Scholar47.Kalra
RSingh
SPSavage
SMFinch
Г.Л.Сопори
ML Влияние сигаретного дыма на иммунный ответ: хроническое воздействие сигаретного дыма ухудшает антиген-опосредованную передачу сигналов в Т-клетках и истощает IP3-чувствительные запасы Ca (2+). J Pharmacol Exp Ther 2000; 293166-171PubMedGoogle Scholar48.Dales
Л.Г.Фридман
GDSiegelaub
ABSelzer
CC. Тесты на курение сигарет и химический состав сыворотки крови. J Chronic Dis 1974; 27293-307PubMedGoogle ScholarCrossref 50.Gerrard
JWHeiner
DCKo
CGMink
JMeyers
ADosman
JA Уровни иммуноглобулинов у курильщиков и некурящих. Ann Allergy 1980; 44261-262PubMedGoogle Scholar51.Andersen
PPedersen
OFBach
BBonde
GJ Сывороточные антитела и иммуноглобулины у курильщиков и некурящих. Clin Exp Immunol 1982; 47467-473PubMedGoogle Scholar52.Onari
К.Сеяма
Айнамизу
Т
и другие.Иммунологическое исследование курильщиков сигарет, часть I: сывороточный белок у курильщиков. Hiroshima J Med Sci 1978; 27113-118PubMedGoogle Scholar53.Warr
Г.А.Мартин
RRSharp
PMRossen
RD Нормальные иммуноглобулины и белки бронхов человека: эффекты курения сигарет. Am Rev Respir Dis 1977; 11625-30PubMedGoogle Scholar55.Finklea
JFHasselblad
VRiggan
WBNelson
WCHammer
DINвилл
В.А. Курение сигарет и реакция ингибирования гемагглютинации на грипп после естественного заболевания и иммунизации. Am Rev Respir Dis 1971; 104368-376PubMedGoogle Scholar56.Gruchow
HWHoffmann
RGMarx
JJ
Младший Эмануэль
DARimm
А.А. Осаждение антител к легочным антигенам фермера в фермерском населении Висконсина. Am Rev Respir Dis 1981; 124411-415PubMedGoogle Scholar57.Pastor
PMedley
FMurphy
TV Инвазивное пневмококковое заболевание в округе Даллас, штат Техас: результаты популяционного эпиднадзора в 1995 г. Clin Infect Dis 1998; 26590-595PubMedGoogle ScholarCrossref 58.Нуорти
JPButler
JCFarley
ММ
и другие. Группа активного бактериального надзора, курение сигарет и инвазивное пневмококковое заболевание. N Engl J Med 2000; 342681-689PubMedGoogle ScholarCrossref 59.Almirall
JGonzalez
CABalanzo
XBolibar
I Доля случаев внебольничной пневмонии, связанных с курением табака. Сундук 1999; 116375-379PubMedGoogle ScholarCrossref 60.Raman
АССвинберн
AJFedullo
AJ Пневмококковая адгезия к клеткам буккального эпителия курильщиков сигарет. Сундук 1983; 8323-27PubMedGoogle ScholarCrossref 61. Doebbeling
BNWenzel
RP Эпидемиология инфекций Legionella pneumophila . Semin Respir Infect 1987; 2206-221PubMedGoogle Scholar62.Straus
WLPlouffe
JFFile
TM
Младший
и другие. Группа по заболеванию легионеров штата Огайо, Факторы риска заражения легионерами в домашних условиях. Arch Intern Med 1996; 1561685-1692PubMedGoogle ScholarCrossref 63.Фишер
MHedberg
KCardosi
п
и другие. Табачный дым как фактор риска менингококковой инфекции. Pediatr Infect Dis J 1997; 16979-983PubMedGoogle ScholarCrossref 64. Имрей
PBJackson
Л.А.Лудвински
PH
и другие. Вспышка менингококковой инфекции серогруппы C, связанная с патронажем университетского бара. Am J Epidemiol 1996; 143624-630PubMedGoogle ScholarCrossref 66.Caugant
DAHoiby
EAMagnus
п
и другие.Бессимптомное носительство Neisseria meningitidis в случайно выбранной популяции. J Clin Microbiol 1994; 32323-330PubMedGoogle Scholar67.Blackwell
CCTzanakaki
Г.Кремастинов
J
и другие. Факторы, влияющие на наличие Neisseria meningitidis среди греческих призывников. Epidemiol Infect 1992; 108441-448PubMedGoogle ScholarCrossref 68.Haneberg
BTonjum
TRodahl
КГедде-Даль
TW Факторы, предшествующие началу менингококковой инфекции, с особым акцентом на пассивное курение, симптомы нездоровья. NIPH Ann 1983; 6169-173PubMedGoogle Scholar69.Tappero
JWReporter
RWenger
JD
и другие. Менингококковая инфекция в округе Лос-Анджелес, Калифорния, и среди мужчин в окружных тюрьмах. N Engl J Med 1996; 335833-840PubMedGoogle ScholarCrossref 70. Кухни
GG Связь экологического табачного дыма со средним отитом у детей раннего возраста. Ларингоскоп 1995; 1051-13PubMedGoogle ScholarCrossref 71.Ilicali
OCKeles
NDeger
KSavas
I Связь пассивного курения сигарет со средним отитом. Arch Otolaryngol Head Neck Surg 1999; 125758-762PubMedGoogle ScholarCrossref 72.Stathis
SLO’Callaghan
DMWilliams
Г.М.Найман
Дж. М. Андерсен
MJBor
W Курение матери сигарет во время беременности является независимым предиктором симптомов заболевания среднего уха через пять лет после родов [серия онлайн]. Педиатрия 1999; 104e16Google ScholarCrossref 73.Barbour
Сенакашима
Кжанг
JB
и другие. Табак и курение: факторы окружающей среды, которые изменяют реакцию хозяина (иммунную систему) и влияют на здоровье пародонта. Crit Rev Oral Biol Med 1997; 8437-460PubMedGoogle ScholarCrossref 74.Arbes
SJ
JrAgustsdottir
HSlade
GD Экологический табачный дым и заболевания пародонта в США. Am J Public Health 2001; -257PubMedGoogle ScholarCrossref 75.Tomar
SLAsma
S Пародонтит, связанный с курением, в США: результаты исследования NHANES III: National Health and Nutrition Examination Survey. J Periodontol 2000; 71743-751PubMedGoogle ScholarCrossref 78.ван дер Вейден
Гаде Слегте
CTimmerman
М.Фван дер Фельден
U Пародонтит у курильщиков и некурящих: распределение карманов в полости рта. J Clin Periodontol 2001; 28955-960PubMedGoogle ScholarCrossref 79.Haffajee
А.Д.Сокранский
С.С. Связь курения сигарет с поддесневой микробиотой. J Clin Periodontol 2001; 28377-388PubMedGoogle ScholarCrossref 80.Shiloah
JPatters
MRWaring
М.Б. Распространенность патогенной микрофлоры пародонта у здоровых курильщиков молодого возраста. J Periodontol 2000; 71562-567PubMedGoogle ScholarCrossref 81.Anda
RFWilliamson
DFEscobedo
LGRemington
PL Курение и риск язвенной болезни среди женщин в США. Arch Intern Med 1990; 1501437-1441PubMedGoogle ScholarCrossref 82.Kato
INomura
AMStemmermann
GNChyou
PH Проспективное исследование язвы желудка и двенадцатиперстной кишки и ее связи с курением, алкоголем и диетой. Am J Epidemiol 1992; 135521-530PubMedGoogle Scholar83.Зонтаг
SGraham
DYBelsito
А
и другие. Циметидин, курение сигарет и рецидив язвы двенадцатиперстной кишки. N Engl J Med 1984; 311689-693PubMedGoogle ScholarCrossref 84.Korman
М.Г.Ганский
JEaves
Э. Р. Шмидт
GT Влияние курения сигарет на заживление и рецидив язвенной болезни двенадцатиперстной кишки. Гастроэнтерология 1983; 85871-874PubMedGoogle Scholar85.Endoh
KLeung
FW Влияние курения и никотина на слизистую оболочку желудка: обзор клинических и экспериментальных данных. Гастроэнтерология 1994; 107864-878PubMedGoogle ScholarCrossref 86.Moshkowitz
MBrill
Сконикофф
FMAverbuch
MArber
NHalpern
Z Аддитивный вредный эффект курения на гастродуоденальную патологию и клиническое течение у Helicobacter pylori –положительных пациентов с диспепсией. Isr Med Assoc J 2000; 2892-895PubMedGoogle Scholar88.Martin
DFMontgomery
Едобек
Патрисси
GAPeura
DA Campylobacter pylori , НПВП и курение: факторы риска язвенной болезни. Am J Gastroenterol 1989; 841268-1272PubMedGoogle Scholar89.Nakamura
MHaruma
Камада
Т
и другие. Курение сигарет способствует развитию атрофического гастрита у Helicobacter pylori –положительных субъектов. Dig Dis Sci 2002; 47675-681PubMedGoogle ScholarCrossref 90.Cover
TLVaughn
SGCao
PBlaser
MJ Potentiation of Helicobacter pylori вакуолизирующая активность токсина никотином и другими слабыми основаниями. J Infect Dis 1992; 1661073-1078PubMedGoogle ScholarCrossref 91.О’Коннор
HJKanduru
CBhutta
ASMeehan
JMFeeley
KMCunnane
K Влияние эрадикации Helicobacter pylori на заживление язвенной болезни. Postgrad Med J 1995; 7190-93PubMedGoogle ScholarCrossref 92.Borody
TJ Джордж
LLBrandl
Эндрюс
Пьянкевич
EOstapowicz
N Курение не способствует рецидиву язвы двенадцатиперстной кишки после эрадикации Helicobacter pylori . Am J Gastroenterol 1992; 871390-1393PubMedGoogle Scholar93.Блейк
GHAbell
TDStanley
WG Курение сигарет и инфекции верхних дыхательных путей среди призывников, проходящих базовую боевую подготовку. Ann Intern Med 1988; 109198-202PubMedGoogle ScholarCrossref 94.Cohen
Стиррелл
Д.А.Рассел
MAJarvis
MJSmith
А.П. Курение, употребление алкоголя и предрасположенность к простуде. Am J Public Health 1993; 831277-1283PubMedGoogle ScholarCrossref 95.Vitalis
TZKeicho
Нитабаши
Шаяши
Шогг
JC Модель латентной инфекции аденовирусом 5 у морской свинки ( Cavia porcellus ). Am J Respir Cell Mol Biol 1996; 14225-231 PubMedGoogle ScholarCrossref 96.Hogg
JC. Скрытая аденовирусная инфекция в патогенезе эмфиземы: лекция Паркера Б. Фрэнсиса. Комод 2000; 117
((5, приложение 1))
282S- 285SGoogle ScholarCrossref 97.Finklea
JFSandifer
SHSmith
Д.Д. Курение сигарет и эпидемия гриппа. Am J Epidemiol 1969;
-399PubMedGoogle Scholar98.Kark
Ю.Д.Лебиуш
M Курение и эпидемическое гриппоподобное заболевание у призывников женского пола: краткий обзор.
Am J Public Health 1981; 71530-532PubMedGoogle ScholarCrossref 99.Kark
Ю.Д.Лебиуш
MRannon
L Курение сигарет как фактор риска эпидемического гриппа A (H 1 N 1 ) у молодых мужчин. N Engl J Med 1982; 3071042-1046PubMedGoogle ScholarCrossref 100.Hament
JMKimpen
JLFleer
Волки
TF Респираторно-вирусная инфекция, предрасполагающая к бактериальному заболеванию: краткий обзор. FEMS Immunol Med Microbiol 1999; 26189-195PubMedGoogle ScholarCrossref 101.Мияура
SEguchi
HJohnston
JM Влияние экстракта сигаретного дыма на метаболизм провоспалительного аутакоида, фактора активации тромбоцитов. Circ Res 1992; 70341-347PubMedGoogle ScholarCrossref 102.Ichimaru
TTai
HH Изменение метаболизма фактора активации тромбоцитов (PAF) в легочных альвеолярных макрофагах и плазме крыс в результате курения сигарет. Prostaglandins Leukot Essent Fatty Acids 1992; 47123-128PubMedGoogle ScholarCrossref 103.Cruijff
MThijs
CGovaert
TAretz
KDinant
GJKnottnerus
A Влияние курения на грипп, эффективность вакцинации против гриппа и реакцию антител на вакцинацию против гриппа. Vaccine 1999; 17426-432PubMedGoogle ScholarCrossref 104.Ellis
MENeal
KRWebb
AK Является ли курение фактором риска развития пневмонии у взрослых, больных ветряной оспой? BMJ (Clin Res Ed) 1987; 2941002PubMedGoogle ScholarCrossref 106.Sedlacek
ТВ Достижения в диагностике и лечении инфекций, вызванных вирусом папилломы человека. Clin Obstet Gynecol 1999; 42206-220PubMedGoogle ScholarCrossref 107.Schneider
AKirchhoff
TMeinhardt
GGissmann
L Повторная оценка статуса вируса папилломы 16 человека в мазках из шейки матки молодых женщин с нормальными мазками Папаниколау в анамнезе. Obstet Gynecol 1992; 79683-688PubMedGoogle Scholar108.Moscicki
АБСибоски
SBroering
J
и другие. Естественная история инфекции вируса папилломы человека, измеренная с помощью повторных ДНК-тестов у подростков и молодых женщин. J Pediatr 1998; 132277-284PubMedGoogle ScholarCrossref 109.Kataja
VSyrjanen
SYliskoski
M
и другие. Факторы риска, связанные с инфекциями вируса папилломы человека шейки матки: исследование случай-контроль. Am J Epidemiol 1993; 138735-745PubMedGoogle Scholar110.Hellberg
DNilsson
Шейли
NJHoffman
DWynder
E Курение и цервикальная интраэпителиальная неоплазия: никотин и котинин в сыворотке и цервикальной слизи у курильщиков и некурящих. Am J Obstet Gynecol 1988; 158910-913PubMedGoogle ScholarCrossref 111.Arany
ITyring
SK Статус местного клеточного иммунитета при интерферон-чувствительных и невосприимчивых поражениях, связанных с вирусом папилломы человека. Sex Transm Dis 1996; 23475-480PubMedGoogle ScholarCrossref 112.Winkelstein
W
Младший Курение и рак шейки матки — текущее состояние: обзор. Am J Epidemiol 1990; 131945- 960PubMedGoogle Scholar113.Newell
GRMansell
PWWilson
MBLynch
HKSpitz
MRHersh
EM Анализ факторов риска среди мужчин, направленных по поводу возможного синдрома приобретенного иммунодефицита. Prev Med 1985; 1481-91PubMedGoogle ScholarCrossref 114.Royce
RAWinkelstein
W
Младший ВИЧ-инфекция, курение сигарет и количество CD4 + Т-лимфоцитов: предварительные результаты исследования здоровья мужчин в Сан-Франциско. AIDS 1990; 4327-333PubMedGoogle ScholarCrossref 115.Boulos
RHalsey
NAHolt
E
и другие. Cite Soleil / JHU AIDS Project Team, ВИЧ-1 у гаитянских женщин 1982-1988 гг. J Acquir Immune Defic Syndr 1990; 3721-728PubMedGoogle Scholar116.Ожоги
Д. Н. Крамер
А.Еллин
F
и другие. Курение сигарет: модификатор инфицирования вирусом иммунодефицита человека 1 типа? J Acquir Immune Defic Syndr 1991; 476-83 PubMedGoogle ScholarCrossref 117.Craib
KJSchechter
MTMontaner
JS
и другие. Влияние курения сигарет на подгруппы лимфоцитов и прогрессирование СПИДа в когорте гомосексуальных мужчин. Clin Invest Med 1992; 15301-308PubMedGoogle Scholar118.Sasson
IMHaley
NJHoffmann
DWynder
ELHellberg
DNilsson
S Курение сигарет и новообразование шейки матки: компоненты дыма в цервикальной слизи. N Engl J Med 1985; 312315-316PubMedGoogle Scholar119.Winkelstein
W
Младший Курение и рак шейки матки: текущее состояние. Am J Epidemiol 1990; 131945-957PubMedGoogle Scholar120.Hirschtick
REGlassroth
JJordan
MC
и другие. Группа изучения легочных осложнений ВИЧ-инфекции, Бактериальная пневмония у лиц, инфицированных вирусом иммунодефицита человека. N Engl J Med 1995; 333845-851PubMedGoogle ScholarCrossref 121.Парк
LPMargolick
JBGiorgi
СП
и другие. Влияние инфекции ВИЧ-1 и курения сигарет на профили лейкоцитов у гомосексуальных мужчин: многоцентровое когортное исследование СПИДа. J Acquir Immune Defic Syndr 1992; 51124-1130PubMedGoogle Scholar122.Conley
LJBush
Т.Дж.Бухбиндер
SPPenley
К.А.Джудсон
FNHolmberg
SD Связь между курением сигарет и некоторыми заболеваниями, связанными с ВИЧ. AIDS 1996; 101121–1126PubMedGoogle Scholar123.Ю
GPHsieh
CCPeng
J Факторы риска, связанные с распространением туберкулеза легких среди санитарных работников в Шанхае. Бугорок 1988; 69105-112PubMedGoogle ScholarCrossref 124.Buskin
SEGale
JLWeiss
Н.С.Нолан
CM Факторы риска туберкулеза у взрослых в округе Кинг, Вашингтон, с 1988 по 1990 год. Am J Public Health 1994; 841750-1756PubMedGoogle ScholarCrossref 125.Alcaide
JAltet
MNPlans
п
и другие.Курение сигарет как фактор риска туберкулеза у молодых людей: исследование случай-контроль. Tuber Lung Dis 1996; 77112-116PubMedGoogle ScholarCrossref 126.McCurdy
SAArretz
DSBates
Реактивность туберкулина RO среди латиноамериканских сельскохозяйственных рабочих-мигрантов из Калифорнии. Am J Ind Med 1997; 32600-605PubMedGoogle ScholarCrossref 127.Anderson
RHSy
FSThompson
SAddy
Курение сигарет и конверсия кожной туберкулиновой пробы среди заключенных. Am J Prev Med 1997; 13175-181Google Scholar128.Gajalakshmi
ВПето
RKanaka
TSJha
P Курение и смертность от туберкулеза и других заболеваний в Индии: ретроспективное исследование 43 000 смертей среди взрослых мужчин и 35 000 человек из контрольной группы. Lancet 2003; 362507-515PubMedGoogle ScholarCrossref 129.Altet
MNAlcaide
JPlans
п
и другие. Пассивное курение и риск туберкулеза легких у детей сразу после заражения: исследование случай-контроль. Tuber Lung Dis 1996; 77537-544PubMedGoogle ScholarCrossref 130.Rich
EAEllner
JJ Патогенез туберкулеза. LN
Фридманед. Туберкулез, современные концепции и лечение Бока-Ратон, Флорида, CRC Press, 1994; 27-31Google Scholar, 132.
Клюгер
R Прах к праху: столетняя сигаретная война Америки, общественное здравоохранение и беззастенчивый триумф Филип Моррис . Нью-Йорк, Нью-Йорк Альфред А. Кнопф 1996; 19
Курение связано с развитием пневмонии у больных раком легких | BMC Pulmonary Medicine
Брей Ф., Ферлай Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире. CA Cancer J Clin. 2018; 68 (6): 394–424.
PubMed
PubMed Central
Статья
Google Scholar
Сафдар А., Армстронг Д. Инфекционная заболеваемость у больных раком в критическом состоянии. Crit Care Clin. 2001. 17 (3): 531–70.
CAS
PubMed
Статья
Google Scholar
Wong JL, Evans SE. Бактериальная пневмония у онкологических больных: новые факторы риска и лечение. Clin Chest Med. 2017; 38 (2): 263–77.
PubMed
PubMed Central
Статья
Google Scholar
Ван З., Цай XJ, Ши Л., Ли Ф.Й., Лин Н.М. Факторы риска послеоперационной внутрибольничной пневмонии у больных раком легкого I-IIIa стадии. Азиатский Pac J Cancer Prev. 2014; 15 (7): 3071–4.
PubMed
Статья
Google Scholar
Лю GW, Sui XZ, Wang SD, Zhao H, Wang J. Выявление пациентов с повышенным риском пневмонии после резекции легкого. J Thorac Dis. 2017; 9 (5): 1289–94.
PubMed
PubMed Central
Статья
Google Scholar
Такигучи Х., Хаяма Н., Огума Т., Харада К., Сато М., Хорио Ю. и др. Пневмония после бронхоскопии у пациентов, страдающих раком легких: разработка и проверка оценки прогнозирования риска. Respir Investig. 2017; 55 (3): 212–8.
PubMed
Статья
Google Scholar
Ban WH, Lee JM, Ha JH, Yeo CD, Kang HH, Rhee CK, et al. Одышка как прогностический фактор у пациентов с немелкоклеточным раком легкого. Йонсей Мед Дж. 2016; 57 (5): 1063–9.
PubMed
PubMed Central
Статья
Google Scholar
Evans SE, Ost DE. Пневмония у больного нейтропеническим раком. Curr Opin Pulm Med.2015; 21 (3): 260–71.
PubMed
PubMed Central
Статья
Google Scholar
Кластерски Дж., Аун М. Оппортунистические инфекции у онкологических больных. Энн Онкол. 2004; 15 (Приложение 4): iv329–35.
PubMed
Статья
Google Scholar
Пекхэм Д., Эллиотт М.В. Легочные инфильтраты у лиц с ослабленным иммунитетом: диагностика и лечение. Грудная клетка. 2002; 57 (Дополнение 2): ii3–7.
PubMed
PubMed Central
Google Scholar
Коттманн Р.М., Келли Дж., Лида Э., Гурелл М., Сталика Дж., Орнисби В. и др. Бронхоскопия с бронхиальным лаважем: детерминанты выхода и влияние на лечение пациентов с ослабленным иммунитетом. Грудная клетка. 2011; 66: 823.
PubMed
Статья
Google Scholar
Hummel M, Rudert S, Hof H, Hehlmann R, Buchheidt D.Диагностическая ценность бронхозопии с бронхоальвеолярным лаважем у пациентов с лихорадкой, гематологическими злокачественными новообразованиями и легочными инфильтратами. Ann Hematol. 2008; 87: 291–7.
PubMed
Статья
Google Scholar
Ким Э.С., Ким Э.С., Ли С.М., Ян С.С., Ю Ц.Г., Ким Ю.В. и др. Бактериальный выход из количественных культур жидкости бронхоальвеолярного лаважа у пациентов с пневмонией, получающих антимикробную терапию. Korean J Intern Med. 2012; 27: 156–62.
PubMed
PubMed Central
Статья
Google Scholar
Винченци Б., Фиорони I, Пантано Ф, Анджелетти С., Дикуонцо Дж., Зокколи А. и др. Прокальцитонин как диагностический маркер инфекции у пациентов с солидными опухолями с лихорадкой. Научный доклад 2016; 17 (6): 28090.
Артикул
Google Scholar
Wang Z, Huo B, Wu Q, Dong L, Fu H, Wang S и др. Роль прокальцитонина в дифференциальной диагностике острого лучевого пневмонита и бактериальной пневмонии у пациентов с раком легкого, получающих торакальную лучевую терапию.Научный доклад 2020; 19; 10 (1): 2941.
Agostini P, Cieslik H, Rathinam S, Bishay E, Kalkat MS, Rajesh PB, et al. Послеоперационные легочные осложнения после торакальной операции: есть ли изменяемые факторы риска? Грудная клетка. 2010. 65 (9): 815–8.
CAS
PubMed
Статья
Google Scholar
Азулай Э, Лемайэль В., Мокарт Д., Пене Ф., Куатчет А., Перес П. и др. Острый респираторный дистресс-синдром у больных злокачественными новообразованиями.Intensive Care Med. 2014. 40 (8): 1106–14.
PubMed
Статья
Google Scholar
Ли Э.Х., Ким ЭЙ, Ли Ш., Чанг Дж., Парк М.С. Факторы риска и клиническая характеристика пневмонии pneumocystis jirovecii при раке легкого. Научный доклад 2019; 9: 2094.
PubMed
PubMed Central
Статья
Google Scholar
Lee JO, Kim DY, Lim JH, Seo MD, Yi HG, Kim YJ, et al.Факторы риска бактериальной пневмонии после цитотоксической химиотерапии у пациентов с распространенным раком легких. Рак легких. 2008. 62 (3): 381–4.
PubMed
Статья
Google Scholar
Акиносоглу К.С., Каркулиас К., Марангос М. Инфекционные осложнения у больных раком легкого. Eur Rev Med Pharmacol Sci. 2013; 17 (1): 8–18.
CAS
PubMed
Google Scholar
Bodey GP, Buckley M, Sathe YS, Freireich EJ. Количественные отношения между циркулирующими лейкоцитами и инфекцией у пациентов с острым лейкозом. Ann Intern Med. 1966. 64 (2): 328–40.
CAS
PubMed
Статья
Google Scholar
Кудерер Н.М., Дейл округ Колумбия, Кроуфорд Дж., Кослер Л. Е., Лайман Г. Х. Смертность, заболеваемость и затраты, связанные с фебрильной нейтропенией у взрослых онкологических больных. Рак. 2006. 106 (10): 2258–66.
PubMed
Статья
Google Scholar
Шарма А., Локешвар Н. Фебрильная нейтропения при злокачественных гематологических заболеваниях. J Postgrad Med. 2005; 51 (Приложение 1): S42–8.
PubMed
Google Scholar
Freifeld AG, Bow EJ, Sepkowitz KA, Boeckh MJ, Ito JI, Mullen CA, et al. Руководство по клинической практике использования противомикробных препаратов у пациентов с нейтропенией и раком: обновление 2010 г., подготовленное обществом инфекционистов Америки. Clin Infect Dis. 2011; 52 (4): e56–93.
PubMed
Статья
Google Scholar
Klastersky J, Paesmans M, Rubenstein EB, Boyer M, Elting L, Feld R, et al. Международная ассоциация поддерживающей терапии по индексу риска рака: международная система оценки для выявления пациентов с фебрильным нейтропеническим раком низкого риска. J Clin Oncol. 2000. 18 (16): 3038–51.
CAS
PubMed
Статья
Google Scholar
Lanoix JP, Pluquet E, Lescure FX, Bentayeb H, Lecuyer E, Boutemy M, et al. Профили бактериальной инфекции у больных раком легких с фебрильной нейтропенией.BMC Infect Dis. 2011; 11: 183.
PubMed
PubMed Central
Статья
Google Scholar
Альмиралл Дж., Болибар I, Серра-Прат М., Роиг Дж., Госпиталь I, Каранделл Э. и др. Новые доказательства факторов риска внебольничной пневмонии: популяционное исследование. Eur Respir J. 2008; 31 (6): 1274–84.
CAS
PubMed
Статья
Google Scholar
Arnson Y, Shoenfeld Y, Amital H.Влияние табачного дыма на иммунитет, воспаление и аутоиммунитет. J Autoimmun. 2010; 34 (3): J258–65.
CAS
PubMed
Статья
Google Scholar
Brandstadter JD, Yang Y. Ответы естественных клеток-киллеров на вирусную инфекцию. J. Врожденный иммунитет. 2011; 3 (3): 274–9.
CAS
PubMed
PubMed Central
Статья
Google Scholar
Стеммелин Г.Р., Доти К.А., Шанли С.М., Чересетто Дж.М., Рабинович О.М., Висенте Репарас М.А. и др.Курение как причина легкой хронической нейтрофилии. Кровь. 2004; 104 (11): 3796.
Артикул
Google Scholar
Хси М.М., Эверхарт Дж. Э., Берд-Холт Д. Д., Тисдейл Дж. Ф., Роджерс Г. П.. Распространенность нейтропении среди населения США: возраст, пол, статус курения и этнические различия. Ann Intern Med. 2007. 146 (7): 486–92.
PubMed
Статья
Google Scholar
Jung J, Moon SM, Jang HC, Kang CI, Jun JB, Cho YK, et al.Заболеваемость и факторы риска послеоперационной пневмонии после онкологической хирургии у взрослых пациентов с выбранным солидным раком: результаты исследования «Cancer POP». Cancer Med. 2018; 7 (1): 261–9.
PubMed
Статья
Google Scholar
Лугг С.Т., Тикка Т., Агостини П.Дж., Керр А., Адамс К., Калкат М.С. и др. Курение и сроки прекращения курения при послеоперационных легочных осложнениях после радикальной хирургии рака легкого. J Cardiothorac Surg.2017; 12 (1): 52.
PubMed
PubMed Central
Статья
Google Scholar
Али М.А., Краут М.Дж., Вальдивьесо М., Херскович А.М., Ду В., Калемкерий Г.П. Исследование фазы II гиперфракционной лучевой терапии и одновременной еженедельной чередующейся химиотерапии при ограниченно-стадийном мелкоклеточном раке легкого. Рак легких. 1998. 22 (1): 39–44.
CAS
PubMed
Статья
Google Scholar
Закон А, Карп Д.Д., Дипетрилло Т., Дейли Б.Т. Возникновение повышенных церебральных метастазов после предоперационной лучевой терапии высокими дозами с химиотерапией у пациентов с местнораспространенным немелкоклеточным раком легкого. Рак. 2001. 92 (1): 160–4.
CAS
PubMed
Статья
Google Scholar
van Meerten E, Verweij J, Schellens JH. Противоопухолевые средства. Лекарственные взаимодействия, имеющие клиническое значение. Drug Saf. 1995. 12 (3): 168–82.
PubMed
Статья
Google Scholar
E G, O T, T Y, M M, H I, K T, et al. Обструктивный пневмонит у больных раком легкого — ретроспективное исследование. Nihon Kyobu Shikkan Gakkai Zasshi. 1992. 30 (10): 1820–4.
Google Scholar
