ОНКОМАРКЕРЫ В ДИАГНОСТИКЕ РАКА | Институт радиобиологии НАН Беларуси
В связи со значительными успехами современной медицины уменьшилась частота смертности от инфекционных заболеваний. Основную угрозу для жизни населения на современном этапе представляют сердечно-сосудистые и онкологические заболевания. Непосредственной причиной возникновения злокачественных опухолей является нарушение регуляции процесса клеточного деления, в результате чего начинается аномальный рост и развитие клеток. Опухолевые клетки значительно отличаются от нормальных не только морфологически, но и биохимически вследствие многочисленных генетических мутаций в ходе онтогенеза. В аномальных опухолевых клетках начинается синтез соединений, практически не встречающихся в здоровых тканях. Эти соединения получили название опухолевых, или онкомаркеров. Концентрация онкомаркеров коррелирует со стадией развития опухоли и/или ее размерами
Обнаружение опухолеспецифических эктопических соединений послужило основой для создания диагностических тест-систем, позволяющих проводить количественное определение концентрации «опухолевых маркеров» в кровяном русле и других биологических жидкостях организма. В настоящее время известно более 200 соединений, относящихся к опухолевым маркерам [1].
Опухолевый маркер – любая белковая субстанция, которая появляется у онкологического больного и коррелирует с наличием опухоли, степенью ее распространения и регрессией в результате лечения.
Основным применением тестов на определение опухолевых маркеров является мониторинг течения заболевания и эффективности хирургического лечения и/или радио-, химио- и гормонотерапии. Показано, что динамика уровня опухолевого маркера отражает изменение состояния пациента. К тому же иногда удается дифференцировать доброкачественные и злокачественные заболевания по скорости повышения уровня маркера, которая при доброкачественных заболеваниях крайне низка.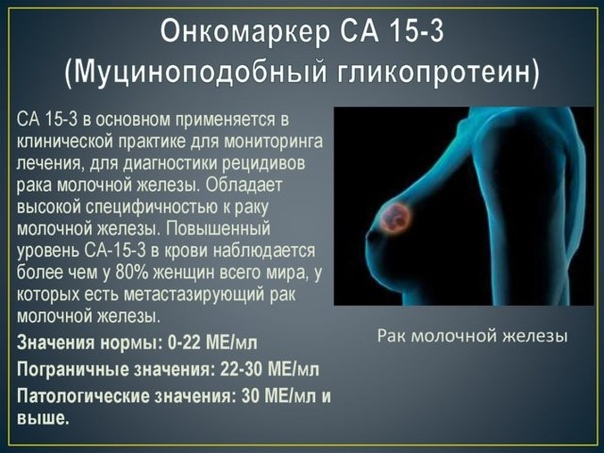
В ряде случаев (до 50%) корректно определенный профиль изменения концентраций опухолевого маркера позволяет выявлять изменения в развитии опухолевого процесса на 1-6 мес. раньше, чем прочие, в том числе инвазивные, диагностические методы. Так, повторное повышение уровня опухолевого маркера после лечения с большой вероятностью свидетельствует о местном рецидиве или об отдаленных метастазах. В то же время монотонное снижение концентрации опухолевого маркера на фоне терапии свидетельствует о ее эффективности. Следует отметить, однако, что в течение нескольких первых дней после операции, химио- или радиотерапии возможно повышение концентрации маркера, обусловленное либо послеоперационным воспалительным процессом, либо деструктивными изменениями опухоли.
Тесты на такие онкомаркеры, как РЭА при колоректальной карциноме, АФП и чХГ при герминомах и Р2— МГ при множественной миеломе, могут использоваться также в прогностических целях [2, 3, 4, 5, 6].
Несколько иная ситуация складывается при обследовании пациентов групп высокого риска, имеющих определенную симптоматику и наибольшую вероятность данного заболевания. В таких случаях ряд тестов может использоваться в качестве диагностических при скрининговых обследованиях. Например, определение уровня PSA у мужчин старше 50 лет позволяет своевременно диагностировать заболевания предстательной железы; определение уровня АФП у жителей Южной и Восточной Африки и Южной и Средней Азии, считающихся популяциями высокого риска по гепатоцеллюлярной аденокарциноме, — выявлять это заболевание на доклинической стадии и тем самым повышать эффективность терапии; определение АФП, чХГ и СА 125 при опухолях яичников — провести дифференциальную диагностику, своевременно определить тип опухоли и подобрать адекватную терапию [7, 8, 9].
Рак легких неустановленной природы
Доля рака легких в структуре онкозаболеваний составляет, по данным разных авторов, от 21 до 29% [11]. Большинство первичных опухолей легкого относится кследующим основным гистологическим типам:
Большинство первичных опухолей легкого относится кследующим основным гистологическим типам:
- плоскоклеточная карцинома;
- аденокарцинома;
- немелкоклеточная карцинома;
- мелкоклеточный рак легкого.
К моменту постановки диагноза почти 50% пациентов имеют операбельные опухоли, однако только у 15% из них опухоли могут быть полностью резецированы. Поэтому основной задачей при лечении данной патологии является как можно более ранняя диагностика и установление типа опухоли [10].
Маркерами выбора при подозрении на рак легкого являются NSE, РЭА и Cyfra 21-1. Определение этих маркеров особенно важно в ситуации, когда нужно установить гистологический тип опухоли перед проведением инвазивной процедуры.
Так, наиболее чувствительным маркером плоскоклеточной карциномы легкого является Cyfra 21-1 (чувствительность до 60%), мелкоклеточной карциномы
- NSE (чувствительность до 80%), аденокарциномы
- РЭА (чувствительность до 50%), немелкоклеточной карциномы – CYFRA 21-1 и РЭА (чувствительность 40 и 42% соответственно).
Следует отметить, что определение уровня опухолевых маркеров не может заменить гистологическую верификацию типа опухоли, но может быть единственным доступным способом типирования опухоли, когда по тем или иным причинам установить окончательный диагноз на основании биопсии невозможно. Такая ситуация не исключена приблизительно у 20% больных раком легких и бронхов.
Определение перечисленных выше маркеров может проводиться и в прогностических целях, поскольку скорость снижения концентрации маркеров и уровни, до которых это снижение происходит, во многом определяют исход заболевания. Рассмотрим тест-системы определения самых распространенных онкозаболеваний.
Карцинома желудка
Доля рака желудка в структуре онкозаболеваний колеблется, по данным разных авторов, от 12 до 18%. Отмечаются значительные географические различия в распространенности данного заболевания. Наибольшая его частота наблюдается в странах Азии. В частности, в Японии в год регистрируется до 100 случаев заболевания на 100 000 населения. В то же время в странах Западной Европы частота возникновения данной патологии не превышает 30 случаев на 100 000 населения в год и имеет тенденцию к снижению.
Наибольшая его частота наблюдается в странах Азии. В частности, в Японии в год регистрируется до 100 случаев заболевания на 100 000 населения. В то же время в странах Западной Европы частота возникновения данной патологии не превышает 30 случаев на 100 000 населения в год и имеет тенденцию к снижению.
Для диагностики рака желудка используются такие маркеры, как СА 72-4, СА 19-9 и РЭА. Тестом выбора является определение концентрации СА 72-4, поскольку данный тест имеет наиболее высокую специфичность и чувствительность в отношении карциномы желудка при специфичности 95% чувствительность тестов для СА 72-4 составляет 48%, для РЭА – 43% и для СА 19-9 она равна 41%. Однако сочетанное определение уровня СА 72-4 и РЭА позволило увеличить чувствительность до 72%. В этой связи в настоящее время именно такая комбинация маркеров рекомендуется для диагностики карциномы желудка, мониторинга течения болезни и эффективности терапии [11, 12, 13, 14].
Карцинома поджелудочной железы
За последнее десятилетие частота этой патологии возросла в 2 -3 раза и составляет около 5% от общего числа онкозаболеваний [15]. Приблизительно 30% больных раком поджелудочной железы умирают в течение месяца после установления диагноза, и только 1% больных выживают в течение 5 лет. Поэтому раннее выявление этой опухоли является актуальной проблемой онкологии. Определение онкомаркеров позволяет не только диагностировать данную патологию на доклинической стадии, но и дифференцировать ее с хроническим панкреатитом [16].
Опухолевым маркером выбора при раке поджелудочной железы является СА 19-9. Чувствительность теста составляет 70-80%. Сочетанное использование тестов на СА 19-9 и РЭА повышает чувствительность до 87% для пациентов с операбельными опухолями и до 98% для пациентов с метастазами.
Исходя из этого, пациентам старше 45 лет с эпигастральной симптоматикой рекомендуется проводить определение уровня СА 19-9 и РЭА через 2-3 недели после болевого приступа. Повторное определение уровня этих маркеров через 0,5-1,5 месяца считается информативным в плане дифференциальной диагностики злокачественного и доброкачественного процессов. Повышение концентрации одного или обоих онкомаркеров приблизительно в 2 раза за этот период свидетельствует о развитии злокачественного процесса. При хроническом панкреатите увеличение концентрации онкомаркеров, как правило, отсутствует либо крайне незначительно [17, 18].
Повторное определение уровня этих маркеров через 0,5-1,5 месяца считается информативным в плане дифференциальной диагностики злокачественного и доброкачественного процессов. Повышение концентрации одного или обоих онкомаркеров приблизительно в 2 раза за этот период свидетельствует о развитии злокачественного процесса. При хроническом панкреатите увеличение концентрации онкомаркеров, как правило, отсутствует либо крайне незначительно [17, 18].
В конце можно отметить, что необходимая частота повторных определений зависит от природы опухоли, проводимый терапевтических мероприятий и степени изменений концентрации онкомаркеров. Исходя из изложенного, представляется, что основной областью применения тестов на онкомаркеры является мониторинг течения онкозаболевания и эффективности его терапии. Определение соответствующих онкомаркеров у пациентов групп риска способствует раннему выявлению онкозаболевания и тем самым более оптимистичному прогнозу. Использование комбинации нескольких тестов не только повышает чувствительность диагностики, но и в ряде случаев обеспечивает возможность установления типа опухоли. Это крайне важно в ситуациях, когда образец опухоли нельзя получить с помощью инвазивных методов. Определение уровня онкомаркеров при некурабельных опухолях нецелесообразно
Список источников :
- Fateh-Moghadam A., Lamerz R., Stieber P. Maligne Lebertumoren: Die aussagekraft von ensymen und tumormarkern. Immunol Spekbrum 1988; 5: 4–44.
- Feinstein M.C., Akat A., Bleacker N. hCG et ses sous-unites comme marqueurs tumoraux. J Steroid Biochem 1989; 33: 771– 5.
- Fendrick Y.L., Staley K.A., Gree M.K. et al. Characterization of CA 125 synthesized by human epithelial amnion WISH cell line. Tumor Biol 1993; 14: 310
- Gaspard U.Y., Reuter A.M., Deville Y.L. Trophoblastic tumors. Clin Endocr 1988; 13: 319 –
- Gold P., Freedman S.O. Specific carcinoembryonic antigens of human digestive systems. J Exp Med 1965; 122: 467–
- Haglund C.
 , Roberts P. Evaluation of CA 19-9 as a serum tumor marker in pancreatic cancer. Br J Cancer 1986; 53: 197–202.
, Roberts P. Evaluation of CA 19-9 as a serum tumor marker in pancreatic cancer. Br J Cancer 1986; 53: 197–202. - wakiri Y., Grandbois K., Graves H. et al. An analysis of urinary PSA before and after radical prostatectomy. J Urol 1993; 149: 783–6.
- Kaiser E., Kusmits R., Pregant P. et al. Clinical biochemistry of neuron specific enolase. Clin Chim Asta 1989; 183: 13–32.
- Karlsson F.A., Wibbell L., Evrin P.E. p2-microglobulin in clinical medicine. Scand J Clin Lab Invest 1980; 40: 27–37.
- Klug T.L., Bast R.C., Niloff Y.M. Monoclonal antibody immuonassay for an antigenic determinant. Cancer Res 1984; 44: 1048–53.
- Kohler G., Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 275: 485.
- Kuan S.F., Burd J.C., Basbaum C., Kim J.S. Inhibition of mucin glycosylation by aril-n-acetil-a-galactosaminides in human colon cancer cells. J Biol Chem 1989; 264: 19271–7.
- Lambin P., Lefrere Y.Y., Doinel C. et al. Neopterin and p2-microglobulin in serum of HSV-seropositive subjects during a two-year follow-up. Clin Chem 1988; 34: 1367–8.
- Liotta L.A., Steeg P.S., Stetler-Stevenson W.G. Cancer metastasis and angiogenesis: an imbalance of positive and negative regulation. Cell 1991; 64: 327–34.
- Lloyd K.O. Human tumor antigens: Detection and characterization with monoclonal antibodies. In: Basis and Chinical Tumor Immunology. R.B. Herberman (ed). Boston 1983; 159–214.
- Martin E.W. A retrospective and prospective study of serial CEA determinations in the early detection of recurrent colon cancer. Am J Surg 1979; 137: 167–9.
- Meier W., Bayerl B., Stiber P. et al. Serum levels of CA 125 and CA 72¬4 at the time of second look laparotomy in ovarian cancer patients. In Resent resalts in tumor diagnosis and therapy. Ed. R. Klapdor. Vienna 1990; 113–6.
- Mione R., Barichello M., Sartorello P. et al. Third-generation PSA: untrasensitive ore untraprecive assay? Int J Biol Markers 1995; 4: 229–35.

- Molina R., Agusti C., Mane M. et al. CYFRA 21-1 in lung cancer: comparison with CEA, CA 125, SCC and NSE serum levels. Int J Biol Markers 1994; 9: 96–101.
© Матвей Матвеенков, младший научный сотрудник лаборатории комбинированных воздействий
Диагностика рака: почему онкомаркеры «не работают»
Анализ крови на онкомаркеры – одно из самых популярных исследований, которые люди назначают себе «на всякий случай». Почему этого делать нельзя, и какие диагностические методы на самом деле помогают выявить рак на ранней стадии, рассказывает онколог ЕМС, д.м.н. Гелена Петровна Генс.
Гелена Петровна, можно ли с помощью онкомаркеров диагностировать рак на ранней стадии?
Действительно, у многих пациентов существует устойчивая вера в то, что опухолевые клетки выделяют определенные вещества, которые циркулируют в крови с момента зарождения новообразования, и достаточно периодически сдавать анализ крови на онкомаркеры, чтобы удостовериться, что рака нет.
Есть множество материалов в интернете на эту тему, которые содержат, к сожалению, абсолютно ложные утверждения о том, что проверяя кровь на онкомаркеры, возможно обнаружить заболевание на ранней стадии.
На самом деле использование онкомаркеров для достоверного выявления рака не показало своей эффективности ни в одном исследовании, соответственно, они не могут быть рекомендованы для первичной диагностики онкологических заболеваний.
Далеко не всегда значения онкомаркеров коррелируют с заболеванием. Для примера приведу случай из своей практики: недавно у меня проходила лечение пациентка – молодая женщина, у которой был диагностирован метастатический рак молочной железы, при этом значения онкомаркера CA 15.3 оставались в пределах нормы.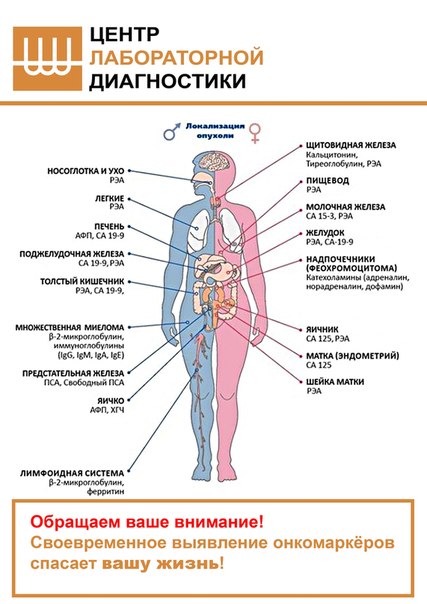
Какие причины кроме онкологических заболеваний, могут вызвать повышение онкомаркеров?
В диагностике есть два критерия, которыми мы оцениваем любое исследование – это чувствительность и специфичность. Маркеры могут быть высокочувствительными, но низкоспецифичными. Это говорит о том, что их повышение может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. Например, маркер рака яичников CA 125 может быть повышен не только при опухолях или воспалительных заболеваниях яичников, а, например, при нарушении функции печени, воспалительных заболеваниях шейки матки и самой матки. Часто при нарушениях функции печени повышается раковоэмбриональный антиген (РЭА). Таким образом, значения онкомаркеров зависят от целого ряда процессов, в том числе и воспалительных, которые могут происходить в организме.
При этом бывает так, что незначительное повышение онкомаркера служит началом для старта целого ряда диагностических процедур вплоть до такого небезвредного исследования, как позитронно-эмиссионная томография (ПЭТ/КТ), и как выясняется впоследствии, эти процедуры были совсем не нужны этому пациенту.
Для чего применяются онкомаркеры?
Онкомаркеры в основном используются для мониторинга течения заболевания и оценки эффективности лекарственной терапии опухолевых заболеваний. В том случае, если изначально при установлении диагноза у пациента было обнаружено повышение онкомаркера, в дальнейшем с его помощью мы можем отслеживать, как проходит лечение. Часто после операции или проведенного химиотерапевтического лечения мы видим, как уровень маркера с нескольких тысяч единиц буквально «обваливается» до нормальных значений. Его повышение в динамике может говорить о том что, произошел либо рецидив опухоли, либо оставшаяся, как говорят врачи, – «резидуальная» опухоль проявила резистентность к лечению. Наряду с результатами других исследований это может послужить для врачей сигналом о том, что следует подумать о смене тактики лечения и о дальнейшем полном обследовании пациента.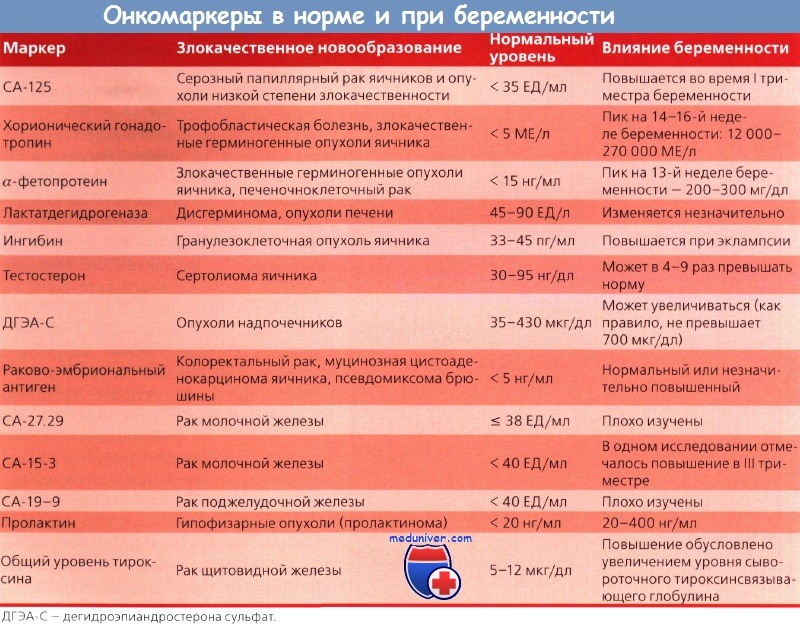
Есть ли исследования, которые действительно помогают выявить рак на ранней стадии?
Существуют исследования для выявления некоторых видов рака, которые показали свою надежность и действенность в больших эпидемиологических исследованиях и рекомендуются для применения в скрининговом режиме.
Так, например, Специальная комиссия США по профилактике заболеваний (United States Preventive Service Task Force — USPSTF) по результатам недавних клинических исследований рекомендует проведение низкодозовой компьютерной томографии для скрининга рака легкого. Низкодозовая КТ рекомендуется людям в возрастной группе от 55 до 80 лет и которые при этом имеют 30-летнюю историю курения или бросили курить не более, чем 15 назад. На сегодняшний день это самый точный метод для раннего выявления рака легкого, эффективность которого подтверждена с точки зрения доказательной медицины.
Ни рентгеновское исследование, ни тем более флюорография органов грудной клетки, которые применялись ранее, не могут заменить низкодозовую КТ, так как их разрешающая способность позволяет выявить только крупноочаговые образования, которые свидетельствуют о поздних стадиях онкологического процесса.
При этом взгляды на некоторые виды скрининга, которые массово применялись в течение нескольких десятилетий, сегодня пересматриваются. Например, раньше мужчинам врачи рекомендовали сдавать анализ крови на ПСА для скрининга рака простаты. Но последние исследования показали, что уровень ПСА не всегда служит надежным основанием для начала диагностических мероприятий. Поэтому сейчас мы рекомендуем сдавать ПСА только после консультации с урологом.
Для скрининга рака молочной железы рекомендации остаются прежними – для женщин, не входящих в группу риска по раку молочной железы, обязательная маммография после 50 лет раз в два года. При повышенной плотности тканей молочной железы (встречается примерно у 40% женщин) необходимо дополнительно к маммографии проводить УЗИ молочных желез.
Еще одно очень распространенное онкологическое заболевание, которое может быть выявлено с помощью скрининга – рак кишечника.
Для выявления рака кишечника рекомендуется колоноскопия, которую достаточно проводить раз в пять лет, начиная с 50 лет, в том случае если нет жалоб и отягощенной наследственности по данному заболеванию. По желанию пациента обследование может быть проведено под анестезией и не доставить никаких неприятных ощущений, при этом оно является самым точным и эффективном методом диагностики колоректального рака.
Сегодня существуют и альтернативные методики: КТ-колонография, или «виртуальная колоноскопия», позволяет провести исследование толстой кишки без введения эндоскопа — на компьютерном томографе. Метод обладает высокой чувствительностью: 90% при диагностике полипов более 1 см при продолжительности исследования около 10 минут. Ее можно рекомендовать тем, кто уже ранее проходил традиционную скрининговую колоноскопию, которая не выявила никаких отклонений.
На что стоит обратить внимание молодым людям?
Скрининг, который начинается в более раннем возрасте – это скрининг на рак шейки матки. Мазок на онкоцитологию (ПАП-тест), по американским рекомендациям, необходимо сдавать с 21 года. Кроме того, необходимо сдавать тест на вирус папилломы человека (ВПЧ), так как длительное носительство определенных онкогенных типов ВПЧ ассоциируется с высоким риском развития рака шейки матки. Надежным методом защиты от рака шейки матки является вакцинация девочек и молодых женщин против ВПЧ.
К сожалению, в последнее время увеличивается заболеваемость раком кожи и меланомой. Поэтому желательно показывать так называемые «родинки» и другие пигментные образования на коже дерматологу раз в год, особенно если вы находитесь в группе риска: у вас светлая кожа, были случаи заболевания раком кожи или меланомой в семье, были случаи солнечных ожогов, или вы любитель посещать солярии, которые, кстати, запрещены в некоторых странах к посещению до 18 лет. Доказано, что два и больше эпизодов солнечных ожогов кожи повышают риск возникновения рака кожи и меланомы.
Доказано, что два и больше эпизодов солнечных ожогов кожи повышают риск возникновения рака кожи и меланомы.
Можно ли следить за «родинками» самостоятельно?
К самоосмотрам у специалистов отношение скептическое. Например, самоосмотр молочных желез, который так пропагандировали раньше, не доказал своей эффективности. Теперь это считается вредным, потому что усыпляет бдительность и не позволяет вовремя провести диагностику. Так же и осмотром кожи. Лучше, если его проведет дерматолог.
Могут ли онкологические заболевания передаваться по наследству?
К счастью, большинство онкозаболеваний не передаются по наследству. Из всех видов рака только около 15% являются наследственными. Яркий пример наследственного рака – это носительство мутаций в антионкогенах BRCA 1 и BRCA 2, которое связано с повышенным риском рака молочной железы и в меньшей степени с раком яичников. Всем хорошо известна история Анжелины Джоли, мама и бабушка которой умерли от рака молочной железы. Таким женщинам необходимо регулярно наблюдаться и проходить обследования молочной железы и яичников, чтобы предотвратить развитие наследственного рака.
Остальные 85% опухолей — это опухоли, которые возникают спонтанно, не зависят от какой-либо наследственной предрасположенности.
Однако если в семье несколько кровных родственников страдали онкологическими заболеваниями, мы говорим о том, что их дети могут иметь сниженную способность к метаболизму канцерогенных веществ, а также к репарации ДНК, то есть к «починке» ДНК, если говорить упрощенно.
Каковы основные факторы риска развития онкологических заболеваний?
К основным факторам риска можно отнести работу на вредных производствах, курение, частое (более трех раз в неделю) и длительное употребление алкоголя, ежедневное употребление красного мяса, постоянное употребление пищи, которая прошла термическую обработку, была заморожена и продается в готовом к употреблению виде.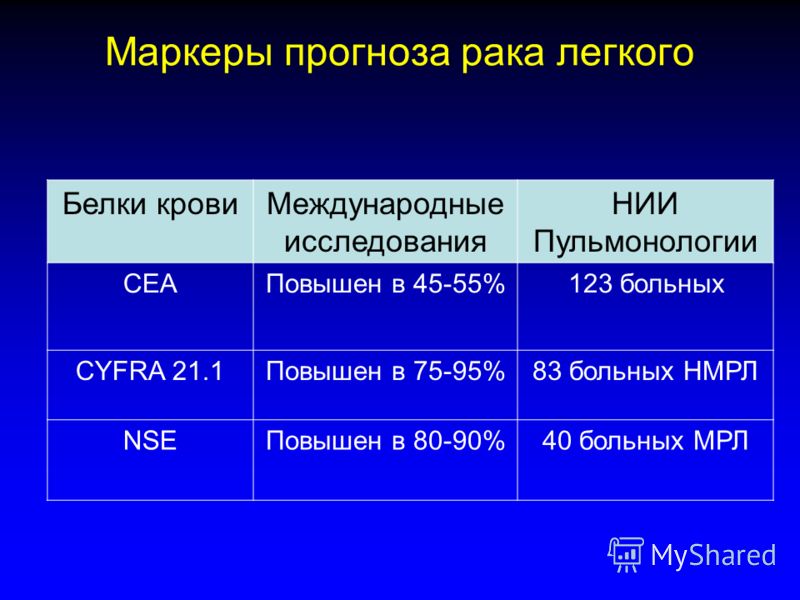 Такая пища бедна волокнами, витаминами и другими необходимыми человеку веществами, что может вести к повышенному риску возникновения, например, рака молочной железы. Курение — это один из наиболее распространенных и грозных факторов риска – оно приводит не только к раку легких, но и раку пищевода, желудка, мочевого пузыря, опухолей головы и шеи: раку гортани, раку слизистой щеки, раку языка и т.д.
Такая пища бедна волокнами, витаминами и другими необходимыми человеку веществами, что может вести к повышенному риску возникновения, например, рака молочной железы. Курение — это один из наиболее распространенных и грозных факторов риска – оно приводит не только к раку легких, но и раку пищевода, желудка, мочевого пузыря, опухолей головы и шеи: раку гортани, раку слизистой щеки, раку языка и т.д.
Для рака кожи и меланомы, как мы уже упоминали, фактором риска является пребывание на солнце до солнечных ожогов.
Длительное употребление гормональных препаратов, например, заместительной гормональной терапии, более 5 лет и не под наблюдением врачей, может вести к повышению риска заболевания раком молочной железы и раком матки у женщин, поэтому прием таких препаратов должен проводиться под строгим контролем маммолога и гинеколога.
Как мы уже упоминали выше, фактором риска могут являться и вирусы, в том числе онкогенные типы вируса ВПЧ, которые приводят к раку половых органов и раку полости рта. Некоторые неканцерогенные вирусы могут также являться факторами риска. Например, вирусы гепатита B и C: они не вызывают напрямую рак печени, но приводят к хроническому воспалительному заболеванию печени – гепатиту, и через 15 лет у пациента с хроническим гепатитом B и C может развиться гепатоцеллюлярный рак.
Когда стоит проконсультироваться с врачом?
Если есть факторы риска, или человек чувствует беспокойство, лучше проконсультироваться с врачом-онкологом. Чего точно не стоит делать – назначать обследования самому себе. Вы можете получить массу ложноположительных и ложноотрицательных результатов, которые усложнят Вашу жизнь и могут привести к стрессу, ненужным диагностическим процедурам и вмешательствам. Конечно, если вдруг появились тревожные симптомы, то проконсультироваться с онкологом нужно обязательно, независимо от рисков.
На консультации мы задаем очень много вопросов, нас интересует все: образ жизни, стаж курения, употребление алкоголя, частота стрессов, характер питания, аппетит, индекс массы тела, наследственность, условия работы, как пациент спит ночью и др. Если это женщина, важен гормональный статус, репродуктивный анамнез: во сколько лет появился первый ребенок, сколько было родов, кормила ли женщина грудью и т.д. Пациенту может показаться, что эти вопросы не имеют отношения к его проблеме, но для нас они важны, они позволяют составить индивидуальный портрет человека, оценить риски развития у него тех или иных онкологических заболеваний и назначить именно тот комплекс обследований, который ему необходим.
Если это женщина, важен гормональный статус, репродуктивный анамнез: во сколько лет появился первый ребенок, сколько было родов, кормила ли женщина грудью и т.д. Пациенту может показаться, что эти вопросы не имеют отношения к его проблеме, но для нас они важны, они позволяют составить индивидуальный портрет человека, оценить риски развития у него тех или иных онкологических заболеваний и назначить именно тот комплекс обследований, который ему необходим.
Персонализированный онкологический чек-ап в Европейском медицинском центре.
Анализ на рак легких — онкомаркер ProGRP
Диагностическое направление
Онкоскрининги
Общая характеристика
Гастрин рилизинг пептид (ГРП, GRP) — гормон кишечника, присутствует также в тканях мозга, в волокнах нервов, в нейроэндокринных клетках, в клетках легких. В значительном количестве вырабатывается клетками мелкоклеточного рака легких, однако ГРП является крайне нестабильным в крови, в связи с чем, как маркер мелкоклеточного рака легких используется белок-предшественник — Прогастрин-рилизинг пептид (ProGRP). ProGRP является одним из таких маркеров, как нейро-специфическая энолаза, (NSE) и хромогранин А, которые ассоциируются с нейроэндокринными опухолями. Повышенный уровень ProGRP в сыворотке отмечен при ряде нейроэндокринных опухолей, включая мелкоклеточный рак легких, карциноид, недифференцированный крупноклеточный рак легких с нейроэндокринными признаками, медуллярная карцинома щитовидной железы, другие нейроэндокринные злокачественные новообразования, и в подгруппе андроген-независимого рака предстательной железы с нейроэндокринными признаками. Выживание у пациентов с низкими значениями ProGRP и NSE гораздо выше, чем у пациентов с высокими значениями маркеров, причем как в случае повышения уровней NSE и ProGRP одновременно, так и при повышении уровня только одного маркера. Как прогностический фактор большее значение имеет уровень NSE.
Показания для назначения
• Обследование в группах риска развития рака легких ( при мелкоклеточном раке ProGRP повышается уже на ранней стадии), • Для дифференциальной диагностики мелкоклеточного рака легких от немелкоклеточной карциномы. • Для дифференциальной диагностики мелкоклеточного рака легких от доброкачественных заболеваний легких. Дополнительную информацию о гистологическом диагнозе предоставляет одновременное измерение сывороточной нейро-специфической энолазы (у 27,5% пациентов с мелкоклеточнім раком легких, имеющих нормальный уровень ProGRP, уровень NSE повышенный) • Для мониторинга ответа на терапию мелкоклеточного рака легких • Для выявления рецидива мелкоклеточного рака легких. • Может быть применен для дифдиагностики немелкоклеточного рака легких
Маркер
Маркер мелкоклеточного рака легких
Клиническая значимость
• обследование в группах риска развития рака легких • дифференциальная диагностика мелкоклеточного рака легких от немелкоклеточной карциномы. • дифференциальная диагностика мелкоклеточного рака легких от доброкачественных заболеваний легких. • мониторинг ответа на терапию мелкоклеточного рака легких • выявление рецидива мелкоклеточного рака легких. • может быть применен для дифдиагностики немелкоклеточного рака легких • прогностическая значимость в оценке выживаемости
Состав показателей:
Онкомаркер легких (ProGRP)
Метод:
Хемилюминесцентный иммуноанализ
Диапазон измерений:
>3
Единица измерения:
Пикограмм на миллилитр
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
Плазма
Условия доставки:
24 Час. при температуре от 2 до 8 градусов Цельсия
Контейнер:
Вакутейнер с разделительным гелем ЭДТА
Объем:
5.5 Миллилитров
Правила подготовки пациента
Утром до 11-00, натощак, через 8-12 часов периода голодания.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Повышение уровня креатинина приводит к ложно завышенным результатам ProGRP
- Не обнаружено
Интерпретация:
- > 200 пг/мл — высокая вероятность рака легких, > 300 пг/мл при нормальных показателях функции почек — уровень, характерный для мелкоклеточного рака легких > 100 пг/мл у пациента с диагностированным немелкоклеточным раком — рекомендуется провести дополнительные исследования на присутствие мелкоклеточного компонента, нейроэндокринной дифференцировки.
- Снижение на фоне лечения мелкоклеточного рака легких свидетельствует об эффективности лечения
Анализ крови на онкомаркеры — ФГБУ «НМИЦ ТПМ» Минздрава России
Очень часто люди живут, не подозревая о том, что у них есть онкологическое заболевание. Это очень опасно и чревато серьезными последствиями, вплоть до ухода из жизни. Чтобы этого не допустить, нужно периодически проводить диагностику состояния своего организма на выявление признаков подобных заболеваний. Для этого врачи рекомендуют сдавать анализ крови на онкомаркеры. С помощью такого исследования выявляются специфические белки и химические соединения, наличие и концентрация которых в крови могут быть вызваны злокачественной опухолью.
Виды онкомаркеров
Одним из наиболее распространенных анализов для выявления онкологического заболевания является анализ на онкомаркер са 125. Он позволяет установить наличие рака или метастазов в яичниках. У здоровых людей показатель данного маркера близок к нулю. Если же он в несколько раз выше нормы, существует высокий риск наличия онкологического заболевания или его рецидива. Однако не всегда стоит паниковать. Например, в первый триместр беременности повышение этого вещества является нормальным физиологическим состоянием.
Другое, не менее известное и часто проводимое исследование — анализ на онкомаркер РЭА. Данная аббревиатура расшифровывается как раковый эмбриональный антиген, представляющий собой белково-углеводное соединение. В небольших количествах это вещество присутствует в клетках даже здорового человека. Однако показатели, превышающие норму, могут свидетельствовать о раке толстой и прямой кишки, желудка, легких, яичников и других внутренних органов. В некоторых случаях повышение РЭА может наблюдаться при воспалительных, аутоиммунных и иных заболеваниях. Поэтому в каждом случае необходимо посещать врача. Отклонение данного маркера от нормы может наблюдаться также у курильщиков и людей, злоупотребляющих алкоголем. Это не исчерпывающий перечень анализов, поскольку для каждого конкретного онклогического заболевания предусмотрен специфический маркер.
Прохождение исследования
Многие люди, решившие проверить состояние своего организма, задаются вопросом, где сдать анализ на онкомаркеры. Такие услуги предлагают многие диагностические клиники. Наш центр профилактической медицины оснащен ультрасовременным оборудованием и имеет в штате ведущих специалистов – академиков и профессоров. Обращение в наше учреждение дает гарантию получения качественных услуг и возможность своевременно выявлять серьезные заболевания. Чтобы узнать, сколько стоит анализ на онкомаркеры, достаточно зайти на сайт конкретного медицинского учреждения.
Анализ крови на онкомаркер представляет собой важное медицинское исследование. Оно не только дает информацию о наличии в организме опухоли или ее отсутствии, но также применяется для определения качества новообразования, оценки эффективности лечения и контроля заболевания.
Страница носит информационный характер. Точный перечень оказываемых услуг и особенности проведения процедур узнавайте по телефонам.
Анализы на онкомаркеры в Ярославле
В Медицинском центре МиР Вы можете сдать анализы на онкомаркеры.
Опухолевые маркеры (онкомаркеры) — это специфические вещества, которые производятся в организме в ответ на рак и другие заболевания. Онкомаркеры помогают в диагностике и мониторинге течения онкологических заболеваний. В некоторых случаях опухолевые маркеры помогают диагностировать рак на ранней стадии.
Зачем делать анализ на онкомаркеры?
- позволяет выявить заболевание или оценить риск его возникновения у здоровых людей
- помогает поставить уже заболевшему правильный диагноз (уточнить локализацию и происхождение опухоли)
- помогает контролировать течение заболевания, оценивать эффективность проводимого лечения
- делает возможным раннее выявление рецидивов опухоли.
Важно! Не всегда повышение уровня онкомаркера в крови означает наличие злокачественной опухоли. Но и отрицательный результат теста не гарантирует ее отсутствия. Поэтому результаты анализа на онкомаркеры должен интерпретировать только врач-специалист. Кроме того, обязательно назначаются дополнительные обследования, чтобы исключить рак.
Наиболее распространенные виды рака и онкомаркеры:
Название | Наиболее специфичный маркер | Другие маркеры | Цель исследования | Использование для диагностики | Необходимость дополнительных | |
Рак молочных желез | CA15-3, CEA | CA 27.29 | Контроль лечения | Нет | маммография, томография, биопсия | |
| Рак мочевого пузыря | BTA, NMP22 | CEA, CA125, CA 19-9 | Контроль лечения, выявление рецидивов | Нет | цистоскопия, биопсия, цитологическое исследование мочи | |
Рак прямой кишки | CEA, CA 19-9 | — | Контроль лечения, выявление рецидивов, оценка прогноза | Нет | колоноскопия, ректороманоскопия, | |
Рак печени | AFP | — | Диагностика, контроль лечения | Нет/Да | биопсия, УЗИ, томография | |
Рак легких | CEA, NSE | TPA | Контроль лечения, выявление рецидивов | Нет | рентгенологические исследования, | |
Меланома | TA 90, SU100 | — | Метастазирование, прогрессирование | Нет | биопсия | |
Рак яичников | CA 125 | CA 72-4,LASA-P,AFP | Контроль лечения, выявление рецидивов | Нет/скрининг групп повышенного риска | УЗИ, биопсия | |
Рак поджелудочной железы | CA 19-9 | PAP, PSMA | Контроль лечения, выявление рецидивов, подтверждение диагноза | Нет | УЗИ, томография | |
Рак предстательной железы | PSA | Ранняя диагностика, контроль лечения, выявление рецидивов | Да | ТРУЗИ, биопсия | ||
Рак желудка | — | CEA | Метастазирование | Нет | фиброгастроскопия, биопсия | |
Рак яичек | HCG | AFP | Подтверждение диагноза, контроль лечения | Нет | + | |
Ответим на все Ваши вопросы по телефону:
(4852) 233-170
Онкомаркеры для диагностики онкологических заболеваний ЖКТ
Кому и зачем назначаются онкомаркеры при заболеваниях желудка?
Онкомаркеры могут назначаться гастроэнтерологом при предраковых заболеваниях и новообразованиях желудка — хронический атрофический гастрит, кишечная метаплазия желудка, полипы, аденомы, кисты и другие новообразования желудка, обнаруженные во время ФГДС. Рак желудка находится на втором месте по частоте выявления среди злокачественных заболеваний желудочно-кишечного тракта, часто он диагностируется на поздних стадиях.
Раковый антиген СА 72-4 является наиболее чувствительным к наличию опухолей в желудке. При повышении в 2-5 раза и более относительно нормы (2-4,5 ед./мл) велика вероятность обнаружения рака желудка. Может иногда быть повышенным до 7 ед./мл у здоровых людей или у людей с различными заболеваниями желудочно-кишечного тракта.
Раковый антиген СА 19-9 используется как основной маркер для диагностики рака поджелудочной железы и как дополнительный при подозрении на рак желудка. Имеет значение повышение в 3 и более раз относительно нормы.
Раковый антиген РЭА используется как основной маркер для диагностики рака толстого кишечника. Может также повышаться при раке желудка, поджелудочной, молочной железы, легких, простаты, яичников, поэтому используется и как дополнительный при подозрении на рак желудка. Имеет значение десятикратное повышение относительно нормы.
Применение онкомаркеров рака желудка:
- в дифференциальной диагностике доброкачественных и злокачественных заболеваний;
- в комбинации с другими показателями для выявления первичной локализации опухоли при метастазировании;
- для контроля эффективности лечения рака желудка;
- для оценки стадии заболевания.
Кому и зачем назначаются онкомаркеры при заболеваниях печени?
Определение уровня альфа-фетопротеина показано пациентам:
- с циррозом печени для предупреждения развития рака;
- с онкологическими заболеваниями для контроля проводимого лечения;
- с циррозом печени и постоянно повышенными печеночными ферментами и уровнем гамма-глобулинов.
АФП-тест применяется для раннего обнаружения и динамического наблюдения первичного гепатоцеллюлярного рака у пациентов с циррозом печени любого происхождения. Специфичность и чувствительность АФП для рака печени у больных гепатитом С составляет 70-95% и 45-100% соответственно. При этом опухоль выявляется на значительно более ранней стадии, с единичными очагами, меньшего размера.
У 60-65% больных раком печени уровень АФП в крови повышен. Кроме того определение уровня АФП используется для контроля лечения онкологических заболеваний печени. Определение уровня АФП особенно важно в тех случаях, когда УЗИ и КТ не выявляют четких признаков очаговой патологии печени, а клинические подозрения на наличие опухоли присутствуют.
При доброкачественных заболеваниях печени значение АФП может снижаться, а при прогрессировании злокачественного процесса уровень АФП растет. Для ранней диагностики гепатомы пациенты с циррозом печени должны два раза в год проходить анализ на АФП.
Кому и зачем назначаются онкомаркеры при заболеваниях кишечника?
Пациентам с воспалительными заболеваниями кишечника, полипозом кишечника и аденоматозными полипами, входящим в группу риска по раку кишечника, а также имеющим генетическую предрасположенность, а также всем пациентам старше 50 лет.
Данные показатели используются при наличии у врача подозрений на начало патологического процесса в кишечнике, для наблюдения за пациентами с предраковыми состояниями и для контроля лечения рака.
РЭА (раковый эмбриональный антиген). В небольших количествах обнаруживается у здоровых людей. Диагностическое значение имеет более чем десятикратное повышение концентрации маркера в сыворотке крови. На начальной стадии рака кишечника только у 30% больных повышен РЭА, поэтому для ранней диагностики он используется только при наличии других клинических симптомов после консультации гастроэнтеролога;
СА-19 (карбоантиген). Имеет значение повышение его больше чем в три раза одновременно с повышением РЭА в больше чем 10 раз. Небольшое повышение РЭА встречается 15-20% больных с доброкачественными полипами толстой кишки, панкреатитами, болезнями печени, в том числе у 50% больных алкогольным циррозом печени. РЭА и СА-19 могут также повышаться при воспалительных и аутоиммунных заболеваниях, например при болезни Крона и неспецифическом язвенном колите;
Анализ кала на скрытую кровь является скрининговым методом диагностики онкологических заболеваний и позволяет выявить даже незначительное внутреннее кровотечение в желудочно-кишечном тракте, которое может быть симптомом различных заболеваний, в том числе онкологических. При минимальном кровотечении, под микроскопом в образце кала определяется наличие красных кровяных телец (эритроцитов).
Кальпротектин в кале повышается при воспалительных заболеваниях кишечника и используется в качестве дополнительного лабораторного метода диагностики рака кишечника.
Колоноскопия — это эндоскопическое исследование, которое используется как для выявления злокачественных новообразований в толстом кишечнике, так и для профилактики рака толстого кишечника. Во время колоноскопии можно обнаружить аденоматозные полипы, которые являются предраковым состоянием, до их перерождения. Результаты колоноскопии позволяют исключить или обнаружить в толстом кишечнике доброкачественные или злокачественные новообразования, воспалительный процесс, язвы, эрозии, дивертикулы.
Кому и зачем назначаются онкомаркеры при заболеваниях поджелудочной железы?
Маркер СА 19-9 является специфичным именно для онкологических заболеваний поджелудочной железы и используется для контроля хода лечения пациентов с онкологическими заболеваниями и пациентов с хроническим панкреатитом на поздних стадиях.
Повышение уровня онкомаркеров СА 19-9, РЭА выше значения, допустимого для воспаления, является косвенным признаком трансформации хронического панкреатита в рак поджелудочной железы. У больных раком поджелудочной железы определяется высокий уровень ракового эмбрионального антигена (PЭА), но его стандартное измерение отличается недостаточной специфичностью; положительные результаты отмечаются при других опухолях и при обострении хронического панкреатита.
сдать анализ в клинике Городской Медицинский Центр
Несмотря на современное изобилие и доступность информации об онкологических заболеваниях, сегодня продолжают существовать заблуждения касательно этой болезни. Наиболее распространенным из них является то, что диагнозу «рак» всегда сопутствует самый плохой исход. Но в современной медицине успешно применяются высокоэффективные методы лечения, которые позволяют дать болезни отпор и обеспечить человеку шансы на долгую и полноценную жизнь. Это возможно при своевременном выявлении рака, и одним из средств, позволяющих определить болезнь на самых ранних стадиях, является анализ на онкомаркеры желудка.
Что такое онкомаркеры
Это антигены, которые вырабатываются клетками злокачественной опухоли и выделяются в кровеносное русло. У здорового человека в ходе лабораторного исследования такие вещества практически не обнаруживаются. Но при повышении уровня антигенов можно с высокой степенью достоверности предполагать, что в организме протекает злокачественный процесс. Для рака желудка характерно присутствие в крови антигена СА 72-4, который вырабатывается раковыми клетками, находящимися преимущественно в железистой ткани. По мере прогрессирования заболевания и метастазирования опухоли уровень этого вещества в крови повышается, а по снижению уровня антигена можно сделать заключение об эффективности назначенного лечения.
Показания к проведению анализа на онкомаркеры
Анализ крови на онкомаркеры желудка необходим в следующих случаях:
- Обращение пациента к врачу с симптомами, указывающими на возможное онкозаболевание верхних отделов пищеварительной системы (потеря аппетита, боль в верхней части живота, необъяснимое снижение массы тела, приступы тошноты и/или рвоты без других признаков пищевого отравления и пр.).
- Необходимость подтвердить или исключить злокачественный характер новообразования, выявленного с помощью других диагностических средств (контрастная рентгенография или эндоскопическое исследование желудка и пр.).
- Уже диагностированный рак этого органа и необходимость в оценке степени распространения заболевания, стадии, для формирования плана лечения и для контроля над эффективностью терапии.
- Дифференцирование доброкачественных и злокачественных опухолей в яичниках.
- Контроль над течением ремиссии и своевременным выявлением рецидива онкозаболевания.
Лечащий врач может назначить анализ на антиген СА 72-4 и в других случаях, если считает это целесообразным.
Как проводится анализ
Осуществляется забор венозной крови. Перед проведением исследования нет необходимости в специальной подготовке, достаточно следовать нескольким правилам:
- Отказаться от приема пищи за 10–12 часов до забора крови. В день проведения анализа можно выпить воды.
- Исключить употребление спиртных напитков за сутки и курение за 12 часов до проведения исследования.
- Исключить прием любых лекарственных препаратов. Если это по каким-либо причинам невозможно, следует обязательно проинформировать врача и/или лаборанта о названии препарата и дозировке, в которой он принимается. Это необходимо, чтобы исключить ложную интерпретацию полученных результатов на фоне приема медикаментов.
Расшифровка результатов анализа
Показатели анализов на антиген СА 72-4 интерпретируются в зависимости от жалоб, с которыми обратился пациент, от данных его анамнеза и других обстоятельств. Важно понимать, что в качестве изолированного средства диагностики рака уровень антигена СА 74-2 не используется. Повышение этого показателя может происходить по причинам, не связанным с онкологическими заболеваниями: воспалительные процессы в органах ЖКТ, кисты яичников, хронические патологии печени (гепатит, цирроз), ревматические патологии и пр. Поэтому при обращении пациента к врачу с жалобами, указывающими на возможный злокачественный процесс в желудке, вместе с анализом крови на онкомаркеры применяются другие методы исследования. Одними из них являются онкомаркеры РЭА (раково-эмбриональный антиген), СА 125, СА 19–9 и пр. Только комплексная диагностика подтверждает или исключает диагноз «рак желудка».
Симптомы
Одной из наибольших проблем в диагностике является то, что у этого заболевания нет специфичных признаков — проявлений, которые бы однозначно указывали на эту болезнь. Поэтому важно обратиться к врачу как можно раньше, если наблюдаются любые симптомы возможного рака желудка:
- Боль различного характера в эпигастральной области (тянущая, ноющая, тупая), которая может быть связанной или не связанной с приемом пищи.
- Диспепсические проявления после еды (изжога, вздутие живота, ощущение «камня» в желудке, отрыжка, раннее насыщение).
- Проблемы с проглатыванием пищи (ощущение того, что пищевод пережат или что в нем присутствует инородное тело).
- Необъяснимая потеря веса, снижение аппетита вплоть до его полного отсутствия.
- Застойная рвота (рвотные массы содержат фрагменты пищи, которая была съедена накануне) или рвотные массы со следами крови.
- Очень темный или черный кал.
Когда еще стоит пройти обследование
Кроме того, даже при отсутствии признаков неблагополучия проходить регулярное профилактическое обследование и сдавать анализы на онкомаркеры следует при таких обстоятельствах:
- У близких родственников были случаи заболевания раком желудка или кишечника, и есть вероятность того, что вы унаследовали склонность к этой болезни.
- У вас диагностированы полипы желудка — эти доброкачественные новообразования могут со временем трансформироваться в злокачественные.
- Хронические заболевания желудка — они изменяют структуру слизистой оболочки этого органа и относятся к провокаторам рака.
- Любые нарушения иммунитета — иммунная система является основным и самым мощным барьером на пути преобразования здоровых клеток в раковые, поэтому длительное снижение иммунитета переводит человека в группу повышенного риска.
Преимущества обращения в «Городской Медицинский Центр»
При необходимости оценить состояние своего здоровья и своевременно принять меры по его восстановлению вы можете обратиться в «Городской Медицинский Центр». Наша клиника оснащена новейшим оборудованием, которое позволяет провести лабораторные исследования в кратчайшие сроки и предоставить высокоточную диагностическую информацию. Специалисты нашего медцентра — опытные высококвалифицированные врачи, готовые помочь вам вернуть здоровье и сохранить ваше долголетие. Для записи на обследование звоните или заполните онлайн-форму. При необходимости вы можете воспользоваться услугой «Врач на дом» и сдать анализы без посещения клиники. Кроме того, вам доступны комплексные диагностические программы, которые включают в себя весь спектр лабораторных и аппаратных методов обследования.
Archivos de Bronconeumología
Archivos de Bronconeumologia — это научный журнал, который преимущественно публикует перспективные оригинальные исследовательские статьи, содержание которых основано на результатах, касающихся нескольких аспектов респираторных заболеваний, таких как эпидемиология, патофизиология, клиники, хирургия и фундаментальные исследования. Другие типы статей, такие как обзоры, редакционные статьи, несколько специальных статей, представляющих интерес для общества и редколлегии, научные письма, письма в редакцию и клинические изображения, также публикуются в журнале.Это ежемесячный журнал, который публикует в общей сложности 12 выпусков и несколько приложений, которые содержат статьи, относящиеся к разным разделам.
Все рукописи, поступающие в Журнал, оцениваются редакторами и отправляются на экспертную рецензию, в то время как редакция и / или заместитель редактора из группы обрабатывают их. Журнал издается ежемесячно на испанском и английском языках. Таким образом, приветствуется подача рукописей, написанных на испанском или английском языках. Переводчики, работающие в журнале, берут на себя соответствующие переводы.
Рукописи будут представлены в электронном виде с использованием следующего веб-сайта: https://www.editorialmanager.com/ARBR/, ссылка на который также доступна через главную веб-страницу Archivos de Bronconeumologia.
Доступ к любой опубликованной статье на любом языке возможен через веб-страницу журнала, а также из PubMed, Science Direct и других международных баз данных. Кроме того, журнал также присутствует в Twitter и Facebook. Журнал выражает голос Испанского респираторного общества пульмонологии и торакальной хирургии (SEPAR), а также других научных обществ, таких как Латиноамериканское торакальное общество (ALAT) и Иберийско-американская ассоциация торакальной хирургии (AICT).
Авторы также могут присылать свои статьи в сопутствующем заголовке журнала с открытым доступом, Open Respiratory Archives .
Онкологические маркеры легких в онкологической практике: исследование TPA и CA125
База данных пациентов и план исследования
В 1982 году группа врачей-терапевтов, которые позже стали известны как CuLCaSG, начала работать в области рака легких. Группа по-прежнему действует в пульмонологическом отделении ‘S. Больница Croce e Carle ’в городе Кунео, Пьемонт, Италия.Больница обслуживает всю провинцию Кунео в качестве третьего специализированного учреждения. Среди основных действий CuLCaSG была создана база данных для пациентов с карциномой легкого, действующая в январе 1983 года. Все пациенты с раком легких, направленные к врачу группы, лечились единообразно, а их клинические данные записывались на компьютер.
Все пациенты, осмотренные в 1997 году и позже, были включены в это исследование, если у них был патологический диагноз НМРЛ (Всемирная организация здравоохранения, 1991).Исходя из требований нашего исследования, все пациенты прошли каждое из следующих действий: (1) полная и точная оценка степени заболевания; (2) рутинные анализы опухолевых маркеров, включая определение уровней ТРА и СА125 в плазме как до лечения, так и после лечения; (3) Строгое наблюдение и ежегодная проверка их статуса (для тех немногих случаев, которые отказались от своих программ последующего наблюдения). Последующие повторные оценки состояли из клинических, лабораторных и радиологических повторных оценок, выполняемых с 3-недельными интервалами во время химиотерапии и каждые 3–6 недель в случае паллиативной лучевой терапии или отсутствия противоракового лечения.Пациенты, получавшие радикальное хирургическое вмешательство, были запланированы для последующих посещений с более длительными интервалами, от 3 до 6 месяцев. Основываясь на нашем предыдущем опыте (Buccheri, 1999), анализ опухолевых маркеров считался важной частью клинической оценки пациентов, и для этого исследования не требовалось формального информированного согласия.
Выживаемость регистрировалась с момента постановки гистологического диагноза до смерти, последнего клинического обследования или телефонного контакта с самим пациентом, его семьей, домашним врачом или муниципальным офисом регистратуры.Следовательно, как продолжительность выживания, так и статус мертвого или живого на момент закрытия исследования (то есть в конце декабря 2001 г.) были доступны для всех пациентов. По состоянию на декабрь 2001 г. 176 пациентов (46%) были живы после среднего периода наблюдения 23 недели.
В течение 5-летнего периода исследования 384 новых подходящих пациента были осмотрены и включены в исследование. Всего было получено 1000 измерений в плазме двойных TPA и CA125 (616 во время или после лечения). Антропометрические и клинические характеристики исследуемой когорты представлены в таблице 1.
Таблица 1 Демографические и клинические характеристики исследуемой когорты
CA125 и анализы TPA
Сыворотки на CA125 и TPA хранили при -20 ° C, температуре, которая удовлетворительно обеспечивает стабильность образцов крови, и анализировали три раза в неделю. в центральной лаборатории ФГУП «С. Больница Кроче и Карла. Лаборатория расположена в корпусе «С. Дом Кроче. Он получает образцы крови из многих медицинских и хирургических отделений, в том числе из отделения легких больницы А. Карле ».Поскольку мы не предоставляем клинической информации, биологи не имеют возможности узнать даже болезнь, для которой требуется конкретный тест.
Измерения в плазме были выполнены в соответствии с инструкциями производителя и с использованием реагентов, содержащихся в коммерческих наборах AB Sangtec Medical Co., Бромма, Швеция (TPA) и B-R-A-H-M-S Diagnostica GmbH, Берлин, Германия (CA125). Контрольные значения составляли до 80 Ед. Л -1 (TPA) и 35 Ед. Мл -1 (CA125).
Другие предварительные оценки лечения
Все пациенты, включенные в этот отчет, были обследованы с помощью компьютерной томографии (КТ) грудной клетки, верхней части живота и головного мозга.Узлы средостения считались аномальными, если они были 1,5 см или больше (наименьший диаметр). Все компьютерные томограммы интерпретировались без ограничения клинической информации, доступной на момент экзамена. В дополнение к компьютерной томографии базовая клиническая оценка включала физикальное обследование, стандартные лабораторные тесты, бронхоскопию и функциональные респираторные тесты. Почти в половине выборки базовое обследование было дополнено сканированием костей с метилендифосфонатом технеция-99m. Другие методы визуализации (включая рентген, компьютерную томографию и магнитно-резонансную томографию скелета, ультразвуковые исследования брюшной полости и другие органоспецифические тесты) были необязательными и выполнялись в соответствии с клиническими показаниями.Оценка стадии до лечения была патологической у 50 пациентов, перенесших хирургическую резекцию опухоли (13% когорты). Все диагностические и постановочные тесты были получены в течение 2–3 недель.
Анализ данных и статистические соображения
Статистический анализ данных проводился с использованием пакета SPSS для Windows, версия 9.0 (SPSS Inc., Чикаго, Иллинойс, США). Непараметрические тесты (Siegel, 1956) использовались для проверки взаимосвязи и различий между уровнями онкомаркеров в плазме или между этими факторами и другими переменными.В частности, при необходимости использовались ранговый тест Спирмена, критерий Краскалла – Уоллиса и медианные тесты. Медианы и диапазоны описывают непрерывные переменные, поскольку для многих переменных, включая TPA и CA125, их распределение не было гауссовым (Siegel, 1956).
Диагностические возможности как для TPA, так и для CA125 были предназначены для выявления наличия (или отсутствия) состояния конкретного заболевания, такого как метастатическое распространение или объективный ответ на лечение. Для оценки диагностических возможностей мы использовали кривые рабочих характеристик приемника (ROC) (Mcneil et al, 1975), ограниченные области которых (площадь под кривой) дают оценку диагностической эффективности (Hanley and Mcneil, 1982).
Все параметры, оцененные при постановке диагноза и перечисленные в таблице 1, были учтены для анализа выживаемости. Время выживания было зависимой переменной. Кривые выживаемости оценивались по методу Каплана-Мейера (Kaplan and Meier, 1958) и строились с недельными интервалами. Различия между кривыми оценивали в соответствии с лог-ранговым тестом (Peto et al, 1977). Чтобы контролировать влияние потенциальных искажающих факторов, был проведен многомерный анализ, основанный на регрессионной модели пропорциональных рисков Кокса (Cox, 1972).Для каждой переменной, включенной в модель, допущение о пропорциональном риске было проверено графически.
Уровень вероятности ( P ) <0,05 считался статистически значимым. Все статистические тесты были двусторонними.
Антитела рака легких, используемые в иммуногистохимии
Иммуногистохимические маркеры рака легких
Рак легкого является второй по частоте причиной смерти от рака в США. Рак легких существует в трех подтипах: немелкоклеточный рак легкого (НМРЛ),
которые состоят из подтипов аденокарциномы и плоскоклеточного рака, которые вместе составляют 75% случаев, и мелкоклеточного рака легких (нейроэндокринного происхождения)
которые составляют остаток.
Доступность таргетных методов лечения требует правильного подтипа НМРЛ: маркеров IHC, таких как
NKX2-1 / TTF-1, Напсин А,
и сурфактант A (аденокарцинома) или p63,
CK5 / CK6,
SOX2 и десмоглеин-3
(плоскоклеточная карцинома) может использоваться для определения подтипа в случаях, когда морфология неясна, или при биопсии, когда есть
недостаточно материала для постановки диагноза (Noh, 2012; Gurda, 2015).Мелкоклеточный рак легких можно идентифицировать с помощью таких маркеров, как
LMWK,
CAM5.2,
хромогранин, синаптофизин,
CD56 и NKX2-1 / TTF-1 (Трэвис, 2012).
Хотя химиотерапия на основе платины является стандартным лечением метастатического НМРЛ, рака легких с мутациями, связанными с рецептором эпидермального фактора роста.
(EGFR) и киназа анапластической лимфомы (ALK) могут реагировать на специфические ингибиторы киназ, поэтому существует
необходимо определить подмножество, которое демонстрирует эти мутации (Cooper, 2011; Malhotra, 2017; Kumar, Curr Probl Cancer, 2017 Mar — Apr; 41 (2): 111-124).Более того…
Щелкните, чтобы развернуть текст ▸
AHR
Арилуглеводородный рецептор (AHR) — это фактор транскрипции, участвующий в метаболизме ксенобиотиков и аутофагии, и он экспрессируется во многих тканях, включая легкие. При раке AHR участвует в миграции и пролиферации и активируется в опухолях поджелудочной железы, печени, головы и шеи, легких, щитовидной железы и желудочно-кишечного тракта. AHR, по-видимому, действует как в подавлении опухолей, так и в туморогенезе, в зависимости от типа клеток и ткани (Tsai, 2017; Safe, 2013).В легких экспрессия AHR коррелирует с опухолями, вызванными курением, где канцерогены, такие как BaP, напрямую связываются с AHR и индуцируют метаболизм ксенобиотиков. Активация AHR приводит к усилению регуляции CYP1A1 и других ферментов цитохрома P450, которые отвечают за метаболизм канцерогенов, но иногда по ошибке могут создавать более разрушительное вещество (Tsay, 2013). Более высокая экспрессия AHR в карциномах легких связана с худшим прогнозом, особенно в опухолях с мутантным EGFR. В этих опухолях активация AHR индуцирует онкогенную экспрессию Src и функциональную пролиферативную передачу сигналов (PI3K / Akt), что приводит к устойчивости к ингибиторам тирозинкиназы, которые нацелены на EGFR (Ye, 2017).
Окрашивание:
Ожидается, что AHR будет иметь ядерное и цитоплазматическое окрашивание.
тестов на биомаркеры | LUNGevity Foundation
Варианты лечения рака легких у пациентов с раком легких с поздней стадией (метастатическим) немелкоклеточным раком легкого (НМРЛ) теперь включают ряд таргетных методов лечения. нанесение вреда нормальным клеткам, направленное на определенные мутации драйвера; изменение ДНК раковых клеток, которое, как считается, стало причиной развития рака и помогло раковым клеткам расти; некоторые виды иммунотерапии; тип лечения рака, при котором используются вещества для стимуляции. или подавить иммунную систему, чтобы помочь организму бороться с раком, инфекцией и другими заболеваниями, нацеленными на собственную иммунную систему пациента.Каждый из этих методов лечения может принести существенную пользу, но не всем пациентам. Чтобы врачи знали, назначать ли какое-либо из этих методов лечения пациенту с раком легких, требуется тип тестирования, известный как тестирование биомаркеров.
Чтобы помочь вам понять и поделиться этой информацией, вы можете запросить нашу бесплатную брошюру, которая резюмирует подробную информацию, представленную здесь. (Опубликовано в январе 2018 г.)
Комплексное тестирование биомаркеров используется среди пациентов с диагностированным раком легких на поздней стадии для определения наличия определенных мутаций или определенного белка.Это первый шаг в прецизионной медицине — гарантия того, что пациенту будет назначено правильное лечение в нужное время на основе биомаркера пациента — биологической молекулы, обнаруженной в крови, других жидкостях организма или тканях, которая является признаком нормального или ненормального состояния. процесса, состояния или заболевания. Биомаркером может быть изменение статуса ДНК (мутации), РНК или белка.
Чтобы получить удобный справочник по тестированию биомаркеров, загрузите брошюру ниже и поделитесь ею со своей семьей и поставщиками медицинских услуг ; в загрузке также есть полезные «быстрые факты».
Что такое биомаркер?
Биомаркер — это любая молекула, которая может быть измерена в тканях, крови или других жидкостях организма. Наличие биомаркера может быть признаком аномального процесса в организме, состояния или заболевания. Биомаркер также можно назвать молекулярным маркером, генотипом или сигнатурной молекулой. 1
Биомаркеры можно использовать для:
- Определить наличие болезни или состояния
- Определите, насколько агрессивно заболевание
- Предсказать, насколько хорошо организм отреагирует на лечение болезни или состояния
Что такое тестирование биомаркеров? Почему это важно для больных раком легких?
Тестирование биомаркеров (также известное как мутационное, геномное или молекулярное тестирование) — это способ для медицинской бригады собрать как можно больше информации об уникальном раке легких пациента.Он определяет, есть ли у пациента излечимая мутация драйвера, и устанавливает PD-L1Part механизма иммунной системы пациента, который не дает Т-клеткам функционировать. Молекула протеина А, состоящая из аминокислот, необходимых для правильного функционирования организма. Белки являются основой структур тела, таких как кожа и волосы, а также других веществ, таких как ферменты, цитокины и уровень экспрессии антител. Результаты этих тестов помогают определить, подходит ли какой-либо из одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) таргетных методов лечения рака легких или конкретного иммунотерапевтического препарата на основе биомаркеров в качестве части плана лечения пациента.Тестирование биомаркеров используется для планирования этих методов лечения далеко зашедших стадий немелкоклеточного рака легких. (Обратите внимание, что тестирование биомаркеров также может быть полезно в некоторых ситуациях при ранней стадии рака легких.) 2
Какие типы биомаркеров используются для определения наилучшего лечения пациентов с раком легких?
В настоящее время для оптимизации плана лечения пациента с раком легкого используются два типа биомаркеров: драйверные мутации в ДНК раковых клеток, молекулы внутри клеток, которые несут генетическую информацию и передают ее от одного поколения к другому.Также называется дезоксирибонуклеиновой кислотой, чтобы определить, подходит ли таргетная терапия, и уровень экспрессии конкретного белка в опухоли пациента, чтобы определить, подходит ли иммунотерапевтический препарат.
Драйвер мутации
Все органы и ткани нашего тела состоят из клеток, и каждая из этих клеток содержит тысячи закодированных генов инструкций внутри клетки, которые контролируют систематический и точный рост клетки. Гены состоят из ДНК, которая представляет собой особый код, который в конечном итоге используется для создания белков, выполняющих определенные функции для клетки.Для каждого гена очень важно иметь правильный код ДНК или инструкции для создания своего белка. Когда ДНК верна, белок может выполнять правильную функцию. 3
Когда ген имеет ошибку в ДНК, он считается мутировавшим или измененным. Мутации могут быть: 3
- Приобретенный: Также называется соматическим. Присутствует только в опухоли и не передается детям
- Унаследовано: присутствует во всех клетках тела и передается детям
Фактически все биомаркеры, которые помогают принимать решения о лечении рака легких, приобретаются.Унаследованные биомаркеры все еще исследуются. В этом разделе мы говорим только о приобретенных мутациях.
Мутации происходят часто, и обычно организм может их исправить. Однако, в зависимости от того, где в гене произошло изменение, небольшое изменение может остаться незамеченным организмом и стать частью плана клетки. Со временем накопление мутаций может привести к образованию опухоли. Мутации, вызывающие рак, называются мутациями-драйверами. 3
Несколько типов мутаций драйвера вызывают рак.Некоторые из них включают:
- Активирующая мутация: Активирующая мутация — это изменение в последовательности ДНК, которое может вызвать изменения в белке, производимые геном, так что белок всегда активен, что приводит к неконтролируемому росту клеток. 4
Примеры активирующих мутаций в аденокарциноме легкого Тип немелкоклеточного рака легкого, который обычно развивается в клетках, выстилающих легкие. Это наиболее распространенный тип рака легких, наблюдаемый у некурящих, включая мутацию замены L858R или делецию экзона 19 в гене рецептора эпидермального фактора роста (EGFR) и мутацию V600E в гене BRAF. 4,5
- Слияние: Слияние или перестройка происходит, когда часть одного гена сливается с частью другого гена или присоединяется к ней. Затем слитый ген производит уникальный белок, который способствует аномальному неконтролируемому росту клеток. 6
Примеры гибридных генов при аденокарциноме легких включают ALK-EML4 и CD74-ROS1. 7,8
- Амплификация: Амплификация означает, что существует намного больше копий гена, чем обычно.Затем сверхэкспрессия приводит к повышенной активности белка и неконтролируемому росту клеток. 6
Примеры генов, которые могут быть амплифицированы при аденокарциноме легких, включают HER2 и MET. 9
- Удаление: Удаление означает, что в раковых клетках отсутствует часть или весь ген. Затем делеция приводит к снижению уровня белка, продуцируемого раковыми клетками, и неконтролируемому росту клеток. 6
Примеры делеционных генов при мелкоклеточном раке легкого (SCLC) Быстрорастущий рак, который формируется в тканях легкого и может распространяться на другие части тела.Названные «маленькими» из-за того, как раковые клетки выглядят под микроскопом, включают TP53 и RB. 10
Рак легких человека может иметь или не иметь одну из многих известных мутаций-драйверов. На данный момент ученые идентифицировали более 20 различных мутаций драйверов, которые иногда встречаются при NSCLC и SCLC, и продолжают поиски новых. 9
Эти мутации-драйверы являются биомаркерами, которые используются в тестировании биомаркеров при раке легких; их присутствие может определить, будет ли пациенту назначен один из нескольких одобренных таргетных методов лечения или он потенциально имеет право на клинические испытания таргетной терапии, которая все еще находится в стадии разработки.
На данный момент у ученых есть больше всего информации о мутациях-драйверах в подтипе НМРЛ, называемом аденокарциома легкого. Драйверные мутации в аденокарциноме легких, для которых в настоящее время доступны одобренные FDA препараты для таргетной терапии, включают EGFR, ALK, ROS1, BRAF V600E, NTRK, MET и RET.
Источник изображения: Hirsch F, et al. Новые и появляющиеся целевые методы лечения распространенного немелкоклеточного рака легкого. Ланцет. Том 388. 3 сентября, 2016
Ученые также достигают прогресса в понимании мутаций плоскоклеточного рака легких, хотя пока нет одобренных FDA целевых методов лечения этих заболеваний.
Источник изображения: Hirsch F, et al. Новые и появляющиеся целевые методы лечения распространенного немелкоклеточного рака легкого. Ланцет. Том 388. 3 сентября, 2016.
Драйверные мутации при SCLC и других типах рака легких также изучаются. Пока что нет одобренных FDA таргетных методов лечения.
Биомаркеры иммунотерапии
Есть несколько биомаркеров иммунотерапии; только один, PD-L1, в настоящее время используется в клинике рака легких.
- PD-L1: PD-L1 — это белковый биомаркер, используемый для определения того, может ли больной раком легких получить пользу от лечения типом иммунотерапевтических препаратов, называемых ингибиторами иммунных контрольных точек.Ингибиторы иммунных контрольных точек — это лекарства, которые помогают собственной иммунной системе пациента бороться с раком. Они делают это, подавляя отказоустойчивые механизмы иммунной системы, которые предназначены для подавления иммунного ответа в подходящее время, чтобы минимизировать повреждение здоровых тканей. Пациенты с высоким уровнем PD-L1 с большей вероятностью будут реагировать на ингибиторы иммунных контрольных точек. Однако даже те, у кого опухоли не экспрессируют PD-L1, могут ответить. 11
- Другие биомаркеры иммунотерапии: Хотя они еще не используются в клинике для лечения рака легких, ученые также изучают типы биомаркеров иммунотерапии, помимо PD-L1, такие как мутационная нагрузка опухоли (TMB) Общее количество мутаций (изменений) обнаружен в ДНК раковых клеток.Знание о бремени мутаций опухоли может помочь спланировать лучшее лечение. Например, опухоли с большим количеством мутаций с большей вероятностью будут реагировать на определенные виды иммунотерапии. Мутационная нагрузка опухоли используется как тип биомаркера. Также называемые TMB., Экспрессия CTLA-4 и микросателлитная нестабильность — изменение, которое происходит в ДНК определенных клеток (например, опухолевых клеток), в которых количество повторов микросателлитов (коротких повторяющихся последовательностей ДНК) отличается от количества повторы, которые были в ДНК, когда она была унаследована.Причиной микросателлитной нестабильности может быть нарушение способности исправлять ошибки, сделанные при копировании ДНК в клетке. Также называется MSI. 12,13
Когда целесообразно тестирование на биомаркеры?
Может потребоваться анализ биомаркера:
- Когда врачи подозревают рак легких и рекомендуют биопсию
- Когда у пациента уже диагностирован рак легких
- Если рак легких у пациента рецидивирует (возвращается) после лечения
Всем пациентам с диагнозом рака легких следует обсудить тестирование биомаркеров со своим лечащим врачом.
На какие биомаркеры следует тестировать пациента?
В таблице ниже приведены рекомендации по тестированию биомаркеров от Национальной комплексной онкологической сети и Колледжа американских патологов (CAP), Международной ассоциации по изучению рака легких (IASLC) и Ассоциации молекулярной патологии (AMP) партнерство с рекомендациями по молекулярному тестированию) : 14,15
Тип рака легкого | Стадия рака легкого | Рекомендации по тестированию биомаркеров |
Аденокарцинома легкого | Стадия I, II или III | Тестирование на EGFR, ALK, KRAS, ROS1, BRAF V600E, пропуск экзона 14 MET, мутации RET и NTRK, а также на уровни белка PD-L1 во время диагностики и хирургической резекции не всегда рекомендуется, но может быть рассмотрено.Решение следует принимать в индивидуальном порядке с вашими врачами. |
Аденокарцинома легкого IV стадии или аденокарцинома легкого, которая рецидивировала или прогрессировала после первоначального диагноза рака легкого стадии I, II или III у пациентов, которые ранее не обследовались | Опухоли должны быть проверены на наличие мутаций EGFR, ALK, KRAS, ROS1, BRAF V600E, пропуска экзона 14, RET и NTRK во время постановки диагноза. Тестирование на эти другие биомаркеры может быть полезным при определении права на участие в клинических испытаниях: мутации RET и ERBB2 (HER2) и бремя мутаций опухоли (TMB). Примечание. В настоящее время не одобрено ни одно лекарство, направленное на мутацию KRAS, хотя методы лечения находятся в стадии разработки. Тем не менее, тестирование KRAS может быть информативным, потому что рак с мутациями KRAS очень маловероятно реагирует на таргетную терапию мутации EGFR. PD-L1 иммуногистохимия Лабораторный метод, использующий антитела для проверки определенных антигенов (маркеров) в образце ткани. Антитела обычно связаны с ферментом или флуоресцентным красителем. После того, как антитела связываются с антигеном в образце ткани, фермент или краситель активируются, и антиген можно увидеть под микроскопом.Иммуногистохимия используется для диагностики таких заболеваний, как рак. Его также можно использовать, чтобы отличить разные типы рака. рекомендуется для определения того, будет ли вам полезен иммунотерапевтический препарат в условиях первой линии (начального лечения). | |
Плоскоклеточный рак легкого | Этапы I, II и III |
|
IV этап |
Иммуногистохимия | |
Мелкоклеточный рак легкого | Все ступени |
|
Как происходит сбор и обработка опухолевой ткани для диагностики и тестирования биомаркеров?
Тестирование биомаркеров может быть выполнено с использованием образца опухолевой ткани или образца крови; Когда используется образец крови, процедура известна как жидкая биопсия.В настоящее время исследование опухолевой ткани является наиболее распространенной процедурой и обсуждается в этом разделе. Жидкие биопсии обсуждаются в следующем разделе.
Для тестирования биомаркеров с образцом опухолевой ткани врачи чаще всего получают опухолевую ткань с помощью биопсии.
Существует множество различных методов биопсии, которые можно использовать для получения опухолевой ткани. Методика зависит от расположения и размера опухоли, а также от общего состояния здоровья пациента. Медицинская бригада пациента обсудит с пациентом лучшие варианты, а также риски и преимущества процедур.
Среди методов сбора тканей — бронхоскопия — процедура, при которой используется бронхоскоп для исследования внутренней части рахеи, бронхов и легких. Бронхоскоп — это тонкий трубчатый инструмент с подсветкой и линзой для просмотра. В нем также может быть инструмент для удаления ткани; затем эту ткань можно проверить под микроскопом на наличие признаков заболевания. Бронхоскоп вводится через нос или рот, эндобронхиальная трансбронхиальная пункционная аспирация под контролем УЗИ (EBUS-TBNA) Процедура, при которой бронхоскоп, снабженный ультразвуковым устройством, проводится по трахее; после этого через бронх в лимфатический узел вводится игла для получения образца.EBUS-TBNA требует местной анестезии, трансторакальной игольной биопсии, процедуры, при которой интервенционный радиолог вводит иглу в грудную стенку для удаления жидкости или ткани, торакоскопии, процедуры, при которой хирург делает небольшой разрез на коже грудной стенки и вставляет специальный инструмент с небольшой видеокамерой на конце, чтобы исследовать внутреннюю часть сундука. Образцы ткани берутся, чтобы патолог мог посмотреть на них под микроскопом. Также называется VATS, торакоцентез: Удаление жидкости вокруг легких через полую иглу, вставленную между ребрами, медиастиноскопия — процедура, проводимая под общим наркозом, чтобы осмотреть область между легкими или средостение.Над грудиной делается небольшой разрез и вставляется тонкая трубка с линзой для просмотра и инструментом для удаления ткани. Образцы отправляются в лабораторию для проверки на наличие раковых клеток и медиастинотомии — процедуры взятия ткани из области между легкими. Разрез, немного больший, чем при медиастиноскопии, делается около грудины и между левым вторым и третьим ребрами, чтобы достичь лимфатических узлов, недоступных для медиастиноскопии. Независимо от того, как собирается ткань, пациент должен Перед удалением ткани уточните у врачей, что будет собрана соответствующая ткань, чтобы можно было провести все необходимые тесты на биомаркеры. Ткань опухоли сохраняется надолго, поэтому при необходимости можно провести дополнительное исследование. Для получения более подробной информации о каждом методе биопсии прочтите «Биопсии».
После сбора опухолевой ткани ее отправляют в лабораторию для исследования. В идеале необходимо провести комплексное тестирование на биомаркеры. При всестороннем тестировании биомаркеров драйверные мутации в нескольких генах проверяются для одновременно , а не последовательно, включая не только те, которые прошли одобренное лечение, но также и другие известные драйверные мутации.Некоторые из мутаций-драйверов, которые в настоящее время не одобрены для лечения, могут быть протестированы сейчас или в ближайшем будущем в клинических испытаниях, с которыми может быть сопоставлен пациент. Преимущество всестороннего тестирования биомаркеров заключается в том, что при обнаружении новой цели мутации ее можно легко добавить к набору тестируемых мутаций. Комплексное тестирование биомаркеров проводится с помощью процесса, известного как секвенирование следующего поколения, или NGS,
.
Нужны ли множественные биопсии?
Иногда рекомендуется дополнительная биопсия.Это может произойти, когда: 15
- Во время первичной диагностической биопсии получено недостаточно ткани
- Таргетная терапия, которая хорошо зарекомендовала себя против рака легких, перестала работать, и рак вернулся. Тестирование резистентного рака на предмет дополнительных мутаций, которые могли развиться, или редких изменений в гистологии показано, чтобы помочь скорректировать план лечения пациента
- Утверждены новые препараты для лечения рака легких, которые могут принести пользу пациенту.Для нового препарата или лечения может потребоваться тестирование биомаркеров
Таким образом, врач пациента может порекомендовать дополнительные биопсии и тестирование биомаркеров на нескольких этапах процесса лечения. Окончательное решение порекомендовать еще одну биопсию зависит от локализации рака, состояния здоровья и функции легких пациента.
Что такое жидкая биопсия? Как это используется?
В настоящее время биопсия тканей — единственный способ подтвердить диагноз рака легких, и они являются основным способом обнаружения мутаций-драйверов или уровней белка PD-L1.Однако в определенных ситуациях врач пациента может использовать жидкостную биопсию вместо биопсии ткани, если диагноз уже был поставлен на основе опухолевой ткани, чтобы решить, подходят ли пациенту определенные целевые методы лечения.
Клетки выпускают ДНК в кровоток; это называется внеклеточной ДНК. Внеклеточная ДНК, которую выделяют раковые опухолевые клетки, называется циркулирующей опухолевой ДНК или цтДНК. При жидкостной биопсии цтДНК захватывается и проверяется на наличие специфических мутаций. 16
В настоящее время жидкая биопсия может помочь медицинской бригаде пациента: 16 , 17
- Определить, присутствует ли нацеленная мутация во время диагностики, и решить, подходят ли нацеленные методы лечения
- Проверить, стал ли рак пациента устойчивым к целевой терапии, и выбрать следующий вариант лечения
- Следите за реакцией пациента на конкретную таргетную терапию
Важно знать, что не все раковые клетки выделяют ДНК, поэтому не всех пациентов можно успешно протестировать с помощью жидкостной биопсии.
Какая информация включается в отчет о тестировании биомаркера?
В лаборатории образец ткани, взятый во время процедуры биопсии, проверяется и анализируется патологом — врачом, который выявляет заболевания, изучая клетки и ткани под микроскопом или с помощью другого оборудования. Лабораторные результаты биопсии заносятся в протокол.
Первоначальный отчет патолога, который включает диагноз рака легких, его гистологический тип и стадию, называется отчетом о патологии.(В некоторых случаях также может быть включена ограниченная информация о наличии или отсутствии нескольких общих биомаркеров, включая, скорее всего, EGFR и ALK.)
Однако чаще всего за первоначальным отчетом о патологии следует отдельный отчет патологоанатома с информацией о более обширном наборе результатов тестирования биомаркеров. Этот отчет обычно называется отчетом о тестировании биомаркеров (но также может называться отчетом о молекулярном тестировании или отчетом о результатах геномного тестирования). Отчет об исследовании биомаркера основан на тестировании биомаркера, которое проводится после первоначального диагноза рака легких у пациента.Отчет содержит важную информацию о раке пациента. В частности, отчет о тестировании биомаркеров указывает, есть ли у пациента биомаркеры — либо драйверные мутации, либо высокий уровень экспрессии белка PD-L1, — которые указывают на то, что пациент может отвечать на конкретную таргетную терапию или на иммунотерапевтический препарат, одобренный или клинический. разработка.
Обработка отчета о тестировании биомаркера может занять до 4 недель. Пациенты должны запросить копию отчета для своей медицинской документации.Иногда отчет также доступен в электронных медицинских картах пациента, которые доступны через портал для пациентов больницы. Отчет о тестировании биомаркера может быть полезен для обсуждения с медицинской бригадой пациента, для получения второго мнения о диагнозе и / или рекомендованном плане лечения или для проведения клинического исследования. (Примечание: образцы тканей также понадобятся для получения второго мнения; как упоминалось ранее, они хранятся в течение длительного времени, поэтому будут доступны.)
Основываясь на беседах с несколькими патологами, ниже приведены две основные вещи, на которые следует обратить внимание в отчете о тестировании биомаркеров: 18,19,20
- Биомаркер (мутация или статус PD-L1): Эта информация находится на первой странице.После названия каждой проверенной мутации в отчете указывается, присутствует ли мутация. В некоторых случаях в отчете может быть указано «не обнаружено никаких действенных мутаций», чтобы указать, что тестирование не выявило наличия у пациента мутации при таргетной терапии, одобренной FDA. Аналогичным образом, здесь можно найти уровень экспрессии белка PD-L1 пациента.
- Соответствующий препарат для биомаркера: Как правило, рядом с местоположением статуса биомаркера в отчете указывается препарат или препараты (если доступны несколько вариантов), которые могут быть эффективны для пациента с данной конкретной мутацией
Как результаты теста на биомаркеры влияют на лечение?
Если анализы пациента с раком легких на поздней стадии положительны на EGFR, ALK, ROS1, BRAF V600E, NTRK, RET или мутацию, для каждого из них могут быть назначены одобренные FDA таргетные методы лечения.Для получения подробной информации о каждом лечении: что это такое, кто имеет право на него, как оно проводится и т. Д., Прочтите «Таргетированная терапия».
Кроме того, определенный уровень биомаркера PD-L1 поможет медицинской бригаде определить, может ли пациент получить пользу от иммунотерапевтического препарата. Для получения подробной информации о каждом лечении иммунотерапией: что это такое, кому оно подходит, как оно проводится и т. Д., Прочтите «Иммунотерапия».
Вопросы о тестировании на биомаркеры, которые следует задать вашей медицинской бригаде
Чтобы помочь вам поговорить со своим врачом о тестировании биомаркеров, загрузите нашу программу беседы о биомаркерах.
Перед тестированием на биомаркеры:
- Что вы пытаетесь найти с помощью тестов на биомаркеры?
- Были ли у меня тесты на биомаркеры? Какие?
- Кто выполняет эти тесты?
- Как проводятся тесты?
- Есть ли какие-либо осложнения после этих тестов?
- Сколько времени потребуется, чтобы получить результаты теста?
- Где я могу получить дополнительную информацию о тестировании биомаркеров?
- Существуют ли какие-либо ограничения тестирования биомаркеров?
- Оплачивает ли страховка эти тесты?
После тестирования на биомаркеры:
- Какие тесты проводились?
- Каковы результаты этих тестов?
- Как результаты повлияют на мое лечение?
- Результат отрицательный: нужно ли сдавать анализ повторно?
- Результаты теста неясны: нужно ли мне пройти повторное тестирование?
- Существуют ли лекарства от моего типа рака легких?
- Мне снова понадобятся эти тесты? Если да, то почему? Когда?
- Открыты ли мне какие-либо клинические испытания на основании этих результатов?
- Как я могу получить копию отчета о тестировании на биомаркеры?
| Онкофетальные антигены | Альфа-фетопротеин | AFP | опухоли печени, зародышевых клеток, яичников, яичка | ||||||
| CE026AM, дугофетал-антигены , колоректальный, грудь, щитовидная железа | |||||||||
| Онкофетальные антигены | CEACAM6 | CEACAM6 | пищевод, желчный проток, колоректальный, молочная железа, щитовидная железа | , колоректальный, грудная, щитовидная | |||||
| Онкофетальные антигены | CEACAM7 | CEACAM7 | пищевод, желчный проток, колоректальный, грудь, щитовидная железа | ||||||
| кардинальная анальгетика | |||||||||
| Муравей, ассоциированный с опухолью igens | CA15-3 | MUC1 | грудь | ||||||
| Связанные с опухолью антигены | CA19-9 | — | поджелудочная железа, желчный пузырь, желчный проток , желудочный | — | желчный проток, рак желудка | ||||
| Антигены, ассоциированные с опухолью | CA125 | MUC16 | яичников | ||||||
| Горы и рецепторы | CGA, хлорсин | хориокарцинома яичка | |||||||
| Гормоны и рецепторы | Кальцитонин | CALC1 | медуллярный рак щитовидной железы | ||||||
| Гормоны и рецепторы 9026 CH2 CHGA и рецепторы | |||||||||
| Гормоны и рецепторы | EGFR | немелкоклеточный рак легкого | |||||||
| Hormes и рецепторы | Рецептор эстрогена (ER) | ESR1 | груди | 9026 Рецептор Hor | ER) | ESR2 | грудь | ||
| Hormes и рецепторы | HER2 / neu | ERBB2 | грудь, желудок, пищевод | ||||||
| 9026 9026 Костный горм и рецепторы | |||||||||
| Гормоны и рецепторы | Рецептор прогестерона (PGR) | PGR | грудь | ||||||
| Гормоны и рецепторы | Рецептор трансферрина | TFRC | Trahymes рецепторы | TFRC | Trahymes | грудь | яичник | 902 71 | |
| Ферменты и модуляторы | Щелочная фосфатаза (Кость) | ALPL | Кость | ||||||
| Ферменты и модуляторы | BCR / ABL1 | BCR / ABL1 хроническая лейкоземия, острая миулоуземия, острая миелогенная лейкемия | |||||||
| Ферменты и модуляторы | BRAF V600E | BRAF | Кожная меланома и колоректальный рак | ||||||
| Ферменты и модуляторы | KIT | ||||||||
| Анализ мутации KRAS | KRAS | колоректальный немелкоклеточный рак легкого | |||||||
| Ферменты и модуляторы | Простатоспецифический антиген | PSA | Ферменты | простаты | |||||
| Лактатдегидрогеназа A | LDHA | Опухоли зародышевых клеток, желудочные | |||||||
| Ферменты и модуляторы | Лактатдегидрогеназа B | LDHB | Опухоли зародышевых клеток, ферменты LHB | ||||||
| LDHC | Опухоли зародышевых клеток желудка | ||||||||
| Ферменты и модуляторы | Нейронспецифическая энолаза (NSE) | ENO2 | легкое | ||||||
| Nуклеарная матрица | N-ферменты и модуляторы | NUMA1 | мочевой пузырь | ||||||
| Ферменты и модуляторы | Ингибитор активатора плазминогена (PAI-1) | SERPINE1 | грудь | ||||||
| Ферменты и модуляторы легких | SERVB, SERV 9025 | плоскоклеточный рак | Ферменты и модуляторы | SCC | SERPINB4 | карцинома пищевода, легких, яичников, плоскоклеточная карцинома | |||
| Ферменты и модуляторы | Урокиназа | ||||||||
| Аполипопротеин A1 | APOA1 | яичников | |||||||
| Сывороточные и тканевые белки | Бета-2-микроглобулин | B2M | лимфома 9025 ткани и множественная миелома 9025 Серная миелома 9025 лимфоцитарная лимфоцита 9025 Серная лимфоцита 9025 белки | Цитокератиновые фрагменты 21-1 (Cyfra 21-1) | KRT19 | грудь, легкие | |||
| Сывороточные и тканевые белки | WAP Four-Disulfide Core Domain 2 (WFDC2) | WAP5 | WAP5 | ||||||
| Белки сыворотки и тканей | Ферритин | FTL, FTh2 | печень | ||||||
| Сывороточные и тканевые белки | Фибриноген | — | мочевой пузырь | ||||||
| Сывороточные и тканевые белки | |||||||||
| Сывороточные и тканевые белки | S100 | S100A1 | злокачественный меланом | ||||||
| Сывороточные и тканевые белки | Тканевый полипептидный антиген (ТРА) | — | белки ткани легкого | Тироглобулин | TG | щитовидная железа | |||
| Раковые стволовые клетки | Альдегиддегидрогеназа | ALDh2A1 | стволовые клетки рака CD, груди, толстой кишки, легких, меланомы, 9025 стволовых клеток поджелудочной железы 9025 | MS4A1 | Раковые стволовые клетки, Non-Ho лимфома dgkin, меланома | ||||
| Раковые стволовые клетки | CD24 | CD24 | Раковые стволовые клетки, рак толстой кишки | ||||||
| Раковые стволовые клетки | CD44 | CD44 9026 печень, яичники, поджелудочная железа, простата | |||||||
| Раковые стволовые клетки | Нестин | NES | Раковые стволовые клетки, глиома поджелудочной железы |
NTRK и рак легких | Американская ассоциация легких
Поддержка этой образовательной программы обеспечивается Amgen, AstraZeneca, Blueprint Medicines, Bristol Myers Squibb, Genentech, Lilly Oncology, Merck, Novartis и Pfizer.
Когда опухолевую ткань исследуют под микроскопом, врачи могут увидеть, какой это тип рака. Но врачи также могут искать изменения в ДНК опухоли, которые могут вызывать рост опухоли. Иногда эти изменения называют биомаркерами или молекулярными маркерами.
Можно подумать, что наша ДНК похожа на инструкцию. Если в инструкции по эксплуатации допущена опечатка, клетка получает неправильные инструкции и может перерасти в рак. Тестирование биомаркеров ищет эти опечатки, чтобы врачи знали, подходите ли вы для получения целевой терапии, которая непосредственно устраняет эти опечатки.
Ошибка в гене NTRK (произносится как en-track) — это один из биомаркеров, который врачи ищут при немелкоклеточном раке легкого. Если у вас немелкоклеточный рак легких, важно поговорить со своим врачом о всестороннем тестировании биомаркеров, чтобы узнать, есть ли у вас ошибка в гене NTRK или другом биомаркере. Результаты этого тестирования влияют на ваши варианты лечения. Чтобы узнать больше о тестировании биомаркеров, посетите Lung.org/biomarker-testing.
Что такое слияние генов NTRK?
В опухоли со слиянием гена NTRK часть гена NTRK и часть неродственного гена сливаются или соединяются вместе.Это активирует ген NTRK таким образом, что вызывает неконтролируемый рост клеток и рак. Слияния генов NTRK присутствуют при многих различных типах рака. Хотя слияние генов NTRK при раке легких встречается редко (менее 1% случаев), для него существует эффективное лечение, поэтому очень важно знать, есть ли у пациента слияние генов NTRK.
У кого, скорее всего, будет слияние генов NTRK?
Не существует одного типа пациентов, у которых наиболее вероятно слияние гена NTRK.
Какие бывают типы слияний генов НТРК?
Существует три различных типа генов NTRK, называемых NTRK 1, 2 и 3.Слияния названы двумя соединенными генами. Итак, если у вас есть слияние генов NTRK, вы можете увидеть NTRK и название гена, с которым он слит, рядом с ним, указанным в вашем отчете. В общем, лечение одинаково, независимо от того, какой тип слияния гена NTRK у вас есть.
Как узнать, есть ли у вас слияние генов NTRK?
Слияния генов NTRK могут быть обнаружены с помощью секвенирования следующего поколения (NGS). При этом типе тестирования ткань опухоли пациента (полученная при биопсии) помещается в аппарат, который одновременно ищет большое количество возможных биомаркеров.Не все тесты NGS включают NTRK, поэтому лучше поговорить со своим врачом, чтобы убедиться, что вы проходите максимально полный тест.
В некоторых случаях пациенту может не быть выполнена биопсия, необходимая для выполнения NGS, поэтому может быть рекомендована жидкая биопсия. Жидкая биопсия может искать определенные биомаркеры в крови пациента. Поговорите со своим врачом, чтобы убедиться, что один из этих тестов был проведен.
Узнайте больше о различных типах тестов на биомаркеры здесь .
Каков курс лечения для человека со слиянием генов NTRK?
Знание того, есть ли у вас слияние гена NTRK, важно независимо от стадии рака легких, но имеет наибольшее значение для лечения пациентов с четвертой стадией.
В настоящее время существует два одобренных таргетных метода лечения слияния генов NTRK при раке легких: энтректиниб и ларотректиниб. Эти препараты вводятся в форме таблеток и непосредственно нацелены или подавляют слияние, вызывающее рост рака.
Обычно больным раком легких сначала назначают энтректиниб, потому что он может проникнуть в мозг, а рак легких часто распространяется на мозг. В течение нескольких месяцев или лет рак, вероятно, разовьется, и ингибитор NTRK может перестать работать. Варианты лечения второй линии для пациентов со слияниями генов NTRK могут включать клинические испытания, химиотерапию или химиотерапию плюс иммунотерапию.
Важно отметить, что слияния генов NTRK отличаются от мутаций NTRK.Существуют методы лечения слияний NTRK, но не мутаций. Однако, если у вас есть слияние NTRK, а затем развивается мутация NTRK, это может означать, что у вас развилась мутация устойчивости, и препараты-ингибиторы NTRK могут больше не работать. В этом случае вам может подойти клиническое испытание.
Работайте со своим врачом, чтобы обсуждать ваши цели и варианты каждый раз, когда вам нужно принять решение о лечении. Следует задать три важных вопроса:
- Какова цель этого лечения?
- Каковы возможные побочные эффекты?
- Какие еще у меня есть варианты?
Исследования проводятся в быстром темпе, и ваш врач должен быть в курсе рекомендаций для вашего конкретного типа рака легких.Если вас не устраивают получаемые ответы, не стесняйтесь обращаться к другому мнению.
Где я могу получить поддержку?
Рак легкого | Справочная статья по радиологии
Рак легкого (первичный рак легких) , или часто, если несколько ошибочно называют бронхогенная карцинома , является широким термином, относящимся к основным гистологическим подтипам первичных злокачественных новообразований легких, которые в основном связаны с вдыхаемыми канцерогенами, с сигаретный дым является основным виновником.
В этой статье будут широко обсуждаться все гистологические подтипы как группа, уделяя особое внимание их общим аспектам, а для получения дополнительной информации, пожалуйста, обратитесь к конкретным статьям по каждому подтипу, описанным ниже.
Рак легких является ведущим видом рака, по распространенности равным раку груди 13 . Это основная причина смертности от рака во всем мире; приходится ~ 20% всех смертей от рака 1 .
Факторы риска
Основным фактором риска является курение сигарет, которое присутствует в 90% случаев и увеличивает риск рака легких, который можно разделить по гистологическим подтипам 10 :
- плоскоклеточный рак легкого: 11x ( мужчины), 15x (женщины)
- Мелкоклеточный рак легкого: 10x (мужчины), 25x (женщины)
- Крупноклеточный рак легкого: 7x (мужчины), 8x (женщины)
- Аденокарцинома легкого: 4x (мужчины и женщины)
Другие факторы риска:
Ассоциации
При раке легких могут возникать различные паранеопластические синдромы:
- эндокринные / метаболические
- неврологический
- другое
Пациенты с раком легких могут протекать бессимптомно до 50% случаев.Кашель и одышка — довольно неспецифические симптомы, часто встречающиеся у больных раком легких.
Центральные опухоли могут вызывать кровохарканье и периферические поражения с плевритной болью в груди.
Пневмония, плевральный выпот, хрипы, лимфаденопатия не редкость. Другие симптомы могут быть вторичными по отношению к метастазам (кость, контралатеральное легкое, мозг, надпочечники и печень, в порядке частоты для NSCLC 12 ) или паранеопластическим синдромам.
Термин «бронхогенная карцинома» несколько вольно используется для обозначения первичных злокачественных новообразований легких, которые связаны с вдыхаемыми канцерогенами. 1 и включает четыре основных гистологических подтипа.Они широко подразделяются на немелкоклеточную карциному и мелкоклеточную карциному, поскольку они различаются клинически в отношении проявления, лечения и прогноза:
Другие злокачественные новообразования легких включают лимфому и саркому (редко).
Каждый подтип имеет различный рентгенологический, демографический и прогнозируемый вид:
Маркеры
Некоторые антитела или маркеры из образцов тканей могут быть полезны в диагностике и прогнозировании заболевания. К ним относятся
Genetics
- Мутация ROS1: 1-2% NSCLC 15 ; чаще встречается у женщин 14
- Мутация ALK: 2-5% NSCLC; чаще встречается у мужчин, более молодых, мало / никогда не куривших, и с большей вероятностью будет аденокарциномой на поздней стадии заболевания 16 (см .: основная статья)
Стадия
Лечение и прогноз
Лечение и прогноз зависят не только от стадии, но и от типа клеток.В общем, хирургия, химиотерапия и лучевая терапия предлагаются в зависимости от стадии, операбельности, работоспособности и функционального статуса. Целенаправленное лечение зависит от молекулярного тестирования, например Рак легких с мутацией ALK можно лечить ингибиторами ALK (например, кризотинибом) 16 .

 , Roberts P. Evaluation of CA 19-9 as a serum tumor marker in pancreatic cancer. Br J Cancer 1986; 53: 197–202.
, Roberts P. Evaluation of CA 19-9 as a serum tumor marker in pancreatic cancer. Br J Cancer 1986; 53: 197–202.