TNM классификация опухолей
TNM классификация
Большая часть опухолей, также рак лёгкого, подразделяется, испозьзуя систему TNM и Международную систему классификации рака лёгких (ISS). Название TNM системы произошло от первых букв: Tumor — первичная опухоль, Node — метастазы в региональные лимфатические узлы, Metastases — отдалённые метастазы.
Первый фактор T в классификации опухолей описывает объём первичной опухоли.
Степени T фактора:
- TX – первичную опухоль нельзя оценить
- T0 – нет первичной опухоли
- Tis – карцинома in situ (рак в пределах слизистой)
- T1 – T4 увеличение размеров первичной опухоли и/или локального распространения
Классификация вовлечения лимфатических узлов (N):
- NX – региональные лимфатические узлы нельзя оценить
- N0 – нет метастазов в региональные лимфатические узлы
- N1 – N3 есть метастазы в региональные лимфатические узлы.

Присутствие или отсутствие идентифицируемых метастазов:
- Mx – отдалённые метастазы нельзя оценить
- M0 – нет отдалённых метастазов
- M1 – установленные отдалённые метастазы
Разделение по стадиям
Вместе с диагнозом – рак лёгких — нужно определить распространение болезни или стадию. Главная цель – определить возможности для хирургической операции, как лучшей возможности для лечения рака лёгких. Также от стадии болезни будет зависить, какие средства будут наиболее эффективны в случае локального прогрессирования болезни.
Эта таблица показывает TNM классификацию, специфичную только для рака лёгких.
| TNM описание | Стадия |
|---|---|
| Карцинома in situ | 0 |
| T1N0M0 | IA |
| T2N0M0 | IB |
| T1N1M0 | IIA |
| T2N0M0 | IIB |
| T3N0M0 | IIB |
| T3N1M0 | IIIA |
| T1N2M0 | IIIA |
| T2N2M0 | IIIA |
| T3N2M0 | IIIA |
| T4N0M0 | IIIB |
| T4N1M0 | IIIB |
| T4N2M0 | IIIB |
| T1N3M0 | IIIB |
| T3N3M0 | IIIB |
| T4N3M0 | IIIB |
| Любой T, любой N, M1 | IV |
Нейроэндокринные опухоли легкого: современная классификация и алгоритм морфологической диагностики | Делекторская
1. Travis W.D. Pathology and diagnosis of neuroendocrine tumors: lung neuroendocrine. Thorac Surg Clin 2014;24(3):257–66.
Travis W.D. Pathology and diagnosis of neuroendocrine tumors: lung neuroendocrine. Thorac Surg Clin 2014;24(3):257–66.
2. Asamura H., Kameya T., Matsuno Y. et al. Neuroendocrine neoplasms of the lung: a prognostic spectrum. J Clin Oncol 2006;24(1):70–6.
3. Swarts D.R., Ramaekers F.C., Speel E.J. Molecular and cellular biology of neuroendocrine lung tumors: evidence for separate biological entities. Biochim Biophys Acta 2012;1826(2): 255–71.
4. Wick M.R. Neuroendocrine neoplasia. Current concepts. Am J Clin Pathol 2000;113(3):331–5.
5. Huang Q., Muzitansky A., Mark E.J. Pulmonary neuroendocrine carcinomas. A review of 234 cases and a statistical analysis of 50 cases treated at one institution using a simple clinicopathologic classification. Arch Pathol Lab Med 2002;126(5):545–53.
Arch Pathol Lab Med 2002;126(5):545–53.
6. Rekhtman N. Neuroendocrine tumors of the lung: an update. Arch Pathol Lab Med 2010;134(11):1628–38.
7. Travis W.D. Advances in neuroendocrine lung tumors. Ann Oncol 2010; 21(Suppl 7):65–71.
8. Travis W.D., Brambilla E., Nicholson A.G. et al. The 2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification. J Thorac Oncol 2015;10(9):1243–60.
9. Righi L., Volante M., Rapa I. et al. Neuroendocrine tumours of the lung. A review of relevant pathological and molecular data. Virchows Arch 2007;451(Suppl 1):S51–9.
10. Moran C.A., Suster S. Neuroendocrine carcinomas (carcinoid, atypical carcinoid, small cell carcinoma, and large cell neuroendocrine carcinoma): current concepts. Hematol Oncol Clin North Am 2007;21(3):395–407.
Moran C.A., Suster S. Neuroendocrine carcinomas (carcinoid, atypical carcinoid, small cell carcinoma, and large cell neuroendocrine carcinoma): current concepts. Hematol Oncol Clin North Am 2007;21(3):395–407.
11. den Bakker M.A., Thunnissen F.B. Neuroendocrine tumours – challenges in the diagnosis and classification of pulmonary neuroendocrine tumours. J Clin Pathol 2013;66(10):862–9.
12. Travis W.D., Brambilla E., Burke A.P. et al. WHO classification of tumours of the lung, pleura, thymus and heart. 4th edn. Lyon: IARC Press, 2015.
13. Caplin M.E., Baudin E., Ferolla P. et al. Pulmonary neuroendocrine (carcinoid) tumors: European Neuroendocrine Tumor Society expert consensus and recommendations for best practice for typical and atypical pulmonary carcinoids. Ann Oncol 2015;26(8):1604–20.
Ann Oncol 2015;26(8):1604–20.
14. Travis W., Colby T., Corrin B. et al. Hystological typing of lung and pleural tumours. Berlin, Heidelberg, New York: Springer Verlag, 1999.
15. Travis W., Brambilla E., MullerHermelink H., Harris C. Tumours of the lung, pleura, thymus and heart. Lyon: IARC Press, 2004.
16. Pelosi G., Hiroshima K., MinoKenudson M. Controversial issues and new discoveries in lung neuroendocrine tumors. Diagn Histopathol 2014;20:392–7.
17. Moran C.A., Suster S., Coppola D., Wick M.R. Neuroendocrine carcinomas of the lung: a critical analysis. Am J Clin Pathol 2009;131(2):206–21.
18. Klimstra D.S., Modlin I.R., Adsay N.V. et al. Pathology reporting of neuroendocrine tumors: application of the Delphic consensus process to the development of a minimum pathology data set. Am J Surg Pathol 2010;34(3):300–13.
Klimstra D.S., Modlin I.R., Adsay N.V. et al. Pathology reporting of neuroendocrine tumors: application of the Delphic consensus process to the development of a minimum pathology data set. Am J Surg Pathol 2010;34(3):300–13.
19. Klimstra D.S., Modlin I.R., Coppola D. et al. The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems. Pancreas 2010;39(6):707–12.
20. Yang Z., Tang L.H., Klimstra D.S. Gastroenteropancreatic neuroendocrine neoplasms: historical context and current issues. Semin Diagn Pathol 2013;30(3):186–96.
21. Pelosi G., Rodriguez J., Viale G., Rosai J. Typical and atypical pulmonary carcinoid tumor overdiagnosed as smallcell carcinoma on biopsy specimens: a major pitfall in the management of lung cancer patients. Am J Surg Pathol 2005;29(2):179–87.
Am J Surg Pathol 2005;29(2):179–87.
22. Aslan D.L., Gulbahce H.E., Pambuccian S.E. et al. Ki-67 immunoreactivity in the differential diagnosis of pulmonary neuroendocrine neoplasms in specimens with extensive crush artifact. Am J Clin Pathol 2005;123(6):874–8.
23. Swarts D.R., van Suylen R.J., den Bakker M.A. et al. Interobserver variability for the WHO classification of pulmonary carcinoids. Am J Surg Pathol 2014;38(10):1429–36.
24. Pelosi G., Rindi G., Travis W.D., Papotti M. Ki-67 antigen in lung neuroendocrine tumors: unraveling a role in clinical practice. J Thorac Oncol 2014;9(3):273–84.
25. Grimaldi F., Muser D., Beltrami C.A. et al. Partitioning of bronchopulmonary carcinoids in two different prognostic categories by Ki-67 score. Front Endocrinol (Lausanne) 2011;2:20.
Front Endocrinol (Lausanne) 2011;2:20.
26. Walts A.E., Ines D., Marchevsky A.M. Limited role of Ki-67 proliferative index in predicting overall short-term survival in patients with typical and atypical pulmonary carcinoid tumors. Mod Pathol 2012;25(9):1258–64.
27. Zahel T., Krysa S., Herpel E. et al. Phenotyping of pulmonary carcinoids and a Ki-67-based grading approach. Virchows Arch 2012;460(3):299–308.
28. Pelosi G., Papotti M., Rindi G., Scarpa A. Unraveling tumor grading and genomic landscape in lung neuroendocrine tumors. Endocr Pathol 2014;25(2):151–64.
29. Rindi G., Klersy C., Inzani F. et al. Grading the neuroendocrine tumors of the lung: an evidence-based proposal. Endocr Relat Cancer 2014; 21(1):1–16.
Endocr Relat Cancer 2014; 21(1):1–16.
30. Pelosi G., Pattini L., Morana G. et al. Grading lung neuroendocrine tumors: controversies in search of a solution. Histol Histopathol 2017;32(3):223–41.
31. Righi L., Volante M., Rapa I. et al. Therapeutic biomarkers in lung neuroendocrine neoplasia. Endocr Pathol 2014;25(4):371–7.
32. Pelosi G., Volante M., Papotti M. et al. Peptide receptors in neuroendocrine tumors of the lung as potential tools for radionuclide diagnosis and therapy. Q J Nucl Med Mol Imaging 2006;50(4):272–87.
33. Gridelli C., Rossi A., Airoma G. et al. Treatment of pulmonary neuroendocrine tumours: state of the art and future developments. Cancer Treat Rev 2013;39(5):466–72.
34. Kunz P.L. Carcinoid and neuroendocrine tumors: building on success. J Clin Oncol 2015;33(16):1855–63.
35. Rouquette Lassalle I. Pulmonary neuroendocrine tumors and preneoplasic lesions. Ann Pathol 2016;36(1):34–43.
36. Mete O., Asa S.L. Precursor lesions of endocrine system neoplasms. Pathology 2013;45(3):316–30.
37. Pelosi G., Fabbri A., Cossa M. et al. What clinicians are asking pathologists when dealing with lung neuroendocrine neoplasms? Semin Diagn Pathol 2015;32(6):469–79.
38. Filosso P.L., Guerrera F., Evangelista A. et al. Prognostic model of survival for typical bronchial carcinoid tumours: analysis of 1109 patients on behalf of the European Association of Thoracic Surgeons (ESTS) Neuroendocrine Tumours Working Groupdagger. Eur J Cardiothorac Surg 2015;48:441–7.
Eur J Cardiothorac Surg 2015;48:441–7.
39. Zeng M. Classification and pathology of lung cancer. Surg Oncol Clin N Am 2016;25(3):447–68.
40. Travis W.D., Rush W., Flieder D.B. et al. Survival analysis of 200 pulmonary neuroendocrine tumors with clarification of criteria for atypical carcinoid and its separation from typical carcinoid. Am J Surg Pathol 1998;22(8):934–44.
41. Beasley M.B., Thunnissen F.B., Brambilla E. et al. Pulmonary atypical carcinoid: predictors of survival in 106 cases. Hum Pathol 2000;31(10):1255–65.
42. Tsuta K., Liu D.C., Kalhor N. et al. Using the mitosis-specific marker antiphosphohistone h4 to assess mitosis in pulmonary neuroendocrine carcinomas. Am J Clin Pathol 2011;136(2):252–9.
Am J Clin Pathol 2011;136(2):252–9.
43. Swarts D.R., Van Neste L., Henfling M.E. et al. An exploration of pathways involved in lung carcinoid progression using gene expression profiling. Carcinogenesis 2013;34(12):2726–37.
44. George J., Lim J.S., Jang S.J. et al. Comprehensive genomic profiles of small cell lung cancer. Nature 2015;524(7563):47–53.
45. Swarts D.R., Scarpa A., Corbo V. et al. MEN1 Gene mutation and reduced expression are associated with poor prognosis in pulmonary carcinoids. J Clin Endocrinol Metab 2014;99(2):374–8.
46. Fernandez-Cuesta L., Peifer M., Lu X. et al. Frequent mutations in chromatinremodelling genes in pulmonary carcinoids. Nat Commun 2014;5:3518.
47. Warth A., Fink L., Fisseler-Eckhoff A. et al. Interobserver agreement of proliferation index (Ki-67) outperforms mitotic count in pulmonary carcinoids. Virchows Arch 2013;462(5):507–13.
48. Ha S.Y., Han J., Kim W.S. et al. Interobserver variability in diagnosing high-grade neuroendocrine carcinoma of the lung and comparing it with the morphometric analysis. Korean J Pathol 2012;46(1):42–7.
49. den Bakker M.A., Willemsen S., Grunberg K. et al. Small cell carcinoma of the lung and large cell neuroendocrine carcinoma interobserver variability. Histopathology 2010; 56(3):356–63.
50. Marchevsky A.M., Gal A.A., Shah S., Koss M.N. Morphometry confirms the presence of considerable nuclear size overlap between small cells and large cells in high-grade pulmonary neuroendocrine neoplasms. Am J Clin Pathol 2001;116(4):466–72.
Am J Clin Pathol 2001;116(4):466–72.
51. Wang H., Iyoda A., Roh M.S. et al. WHO histologic classification is an independent predictor of prognosis in lung neuroendocrine(NE) tumors but Ki-67 proliferation rate is not(abstract 1952). Mod Pathol 2013;26:469A.
52. Iyoda A., Hiroshima K., Nakatani Y., Fujisawa T. Pulmonary large cell neuroendocrine carcinoma: its place in the spectrum of pulmonary carcinoma. Ann Thorac Surg 2007;84(2):702–7.
53. Fasano M., Della Corte C.M., Papaccio F. et al. Pulmonary large-cell neuroendocrine carcinoma: from epidemiology to therapy. J Thorac Oncol 2015;10(8):1133–41.
54. Pelosi G., Rossi G., Cavazza A. et al. DeltaNp63 (p40) distribution inside lung cancer: a driver biomarker approach to tumor characterization. Int J Surg Pathol 2013;21(3):229–39.
Int J Surg Pathol 2013;21(3):229–39.
55. Sturm N., Lantuejoul S., Laverriere M.H. et al. Thyroid transcription factor 1 and cytokeratins 1, 5, 10, 14 (34betaE12) expression in basaloid and large-cell neuroendocrine carcinomas of the lung. Hum Pathol 2001;32(9):918–25.
56. Rekhtman N., Pietanza M.C., Hellmann M.D. et al. Next-generation sequencing of pulmonary large cell neuroendocrine carcinoma reveals small cell carcinoma-like and non-small cell carcinoma-like subsets. Clin Cancer Res 2016;22(14):3618–29.
57. Iyoda A., Travis W.D., Sarkaria I.S. et al. Expression profiling and identification of potential molecular targets for therapy in pulmonary large-cell neuroendocrine carcinoma. Exp Ther Med 2011;2(6):1041–5.
58. Quinn A.M., Chaturvedi A., Nonaka D. High-grade neuroendocrine carcinoma of the lung with carcinoid morphology: a study of 12 cases. Am J Surg Pathol 2017;41(2):263–70.
Quinn A.M., Chaturvedi A., Nonaka D. High-grade neuroendocrine carcinoma of the lung with carcinoid morphology: a study of 12 cases. Am J Surg Pathol 2017;41(2):263–70.
59. Nicholson S.A., Beasley M.B., Brambilla E. et al. Small cell lung carcinoma (SCLC): a clinicopathologic study of 100 cases with surgical specimens. Am J Surg Pathol 2002;26(9):1184–97.
60. Thunnissen E., Borczuk A.C., Flieder D.B. et al. The use of immunohistochemistry improves the diagnosis of small cell lung cancer and its differential diagnosis. An international reproducibility study in a demanding set of cases. J Thorac Oncology 2017;12(2):334–46.
61. Saito T., Tsuta K., Fukumoto K.J. et al. Combined small cell lung carcinoma and giant cell carcinoma: a case report. Surg Case Rep 2017;3(1):52.
62. Eberhardt W.E., Mitchell A., Crowley J. et al. The IASLC lung cancer staging project: proposals for the revision of the m descriptors in the forthcoming eighth edition of the tnm classification of lung cancer. J Thorac Oncol 2015;10(11):1515–22.
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
1
16171819202122
23242526272829
3031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Гистологическая классификация
До начала лечения РЛ необходимо установить гистологический подтип опухоли. Это имеет критическое значение, так как при мелкоклеточном РЛ наиболее эффективно применение ХТ. Вместе с тем при микроскопическом исследовании возможно возникновение затруднений в дифференциальной диагностике между мелкоклеточным РЛ и НМРЛ [1].
Это имеет критическое значение, так как при мелкоклеточном РЛ наиболее эффективно применение ХТ. Вместе с тем при микроскопическом исследовании возможно возникновение затруднений в дифференциальной диагностике между мелкоклеточным РЛ и НМРЛ [1].
В 1999 г. в классификацию опухолей легкого, предложенную ВОЗ, были внесены дополнения [1]. Наибольшие изменения в обновленной классификации по сравнению с классификацией 1981 г. касались дополнительного введения двух преинвазивных патологий в группу плоскоклеточных дисплазий и карцином in situ: атипичная аденоматозная гиперплазия и диффузная идиопатическая легочная нейроэндокринная клеточная гиперплазия. Другое значительное изменение заключалось в изменении субклассификации аденокарциномы: термин «бронхоальвеолярная карцинома» решено применять только в отношении неинвазивных опухолей. Также отмечается значительная эволюция в понимании классификации нейроэндокринных опухолей легкого. Крупноклеточная нейроэндокринная карцинома в настоящее время воспринимается как гистологический вариант высокодифференцированного НМРЛ с признаками нейроэндокринной дифференцировки и иммуногистохимических нейроэндокринных маркеров. В настоящее время к классу крупноклеточных карцином относят несколько вариантов, включая крупноклеточную нейроэндокринную и базалоидную карциномы, которые характеризуются неблагоприятным прогнозом. И, наконец, идентифицирован новый класс РЛ, характеризующийся широким спектром клеточной дифференцировки (от эпителиальной до мезенхимальной), получивший название карциномы с плеоморфными, саркоматоидными или саркоматозными элементами. Иммуногистохимический метод и электронная микроскопия являются ценными методами диагностики и субклассификации гистологических подтипов, однако большинство опухолей легкого могут быть классифицированы при использовании только световой микроскопии.
В настоящее время к классу крупноклеточных карцином относят несколько вариантов, включая крупноклеточную нейроэндокринную и базалоидную карциномы, которые характеризуются неблагоприятным прогнозом. И, наконец, идентифицирован новый класс РЛ, характеризующийся широким спектром клеточной дифференцировки (от эпителиальной до мезенхимальной), получивший название карциномы с плеоморфными, саркоматоидными или саркоматозными элементами. Иммуногистохимический метод и электронная микроскопия являются ценными методами диагностики и субклассификации гистологических подтипов, однако большинство опухолей легкого могут быть классифицированы при использовании только световой микроскопии.
Список злокачественных немелкоклеточных эпителиальных опухолей легкого приведен ниже.
Изменения в классификации ВОЗ описаны в деталях в последующих секциях.
Новая гистологическая классификация НМРЛ по ВОЗ/Международная ассоциация по изучению рака легкого.
1. Плоскоклеточный рак легкого
- Папиллярный
- Светлоклеточный
- Мелкоклеточный
- Базалоидный
2. Аденокарцинома
Аденокарцинома
- Ацинарная
- Папиллярная
- Бронхиолоальвеолярная карцинома
- Немуцинозная
- Муцинозная
- Смешанная муцинозная и немуцинозная или неопределенный клеточный тип
- Солидная аденокарцинома с муцином
- Аденокарцинома со смешанными подтипами
- Варианты
- Высокодифференцированная фетальная аденокарцинома
- Муцинозная (коллоидная) аденокарцинома
- Муцинозная цистоаденокарцинома
- Перстневидно-клеточная аденокарцинома
- Светлоклеточная аденокарцинома
3. Крупноклеточная карцинома
- Варианты
- Крупноклеточная нейроэндокринная карцинома
- Комбинированная крупноклеточная нейроэндокринная карцинома
- Базалоидная карцинома
- Лимфоэпителиомоподобная карцинома
- Светлоклеточная карцинома
- Крупноклеточная карцинома с рабдоидным фенотипом
4. Железисто-плоскоклеточная карцинома
Железисто-плоскоклеточная карцинома
5. Карциномы с плеоморфными, саркоматоидными или саркоматозными элементами.
- Карцинома веретено- и/или гигантоклеточная
- Веретеноклеточная карцинома
- Гигантоклеточная карцинома
- Карциносаркома
- Пульмональная бластома
6. Карциноидные опухоли
- Типичный карциноид
- Атипичный карциноид
7. Слюнно-железистый тип карцином
- Мукоэпителиальная карцинома
- Аденокистозная карцинома
- Другие
8. Неклассифицированные карциномы
Аденокарцинома
В настоящее время в большинстве стран аденокарцинома является доминирующим гистологическим подтипом НМРЛ, поэтому вопросы субклассификации аденокарцином очень важны. Одна из актуальнейших проблем в диагностике аденокарциномы легкого заключается в ее гистологическом разнообразии. В практическом отношении сочетание различных гистологических подтипов аденокарциномы встречается чаще, чем опухоли, состоящие из только одного подтипа ацинарной, папиллярной, бронхиолоальвеолярной или солидной аденокарциномы с образованием муцина. Критерии определения бронхиолоальвеолярной аденокарциномы в прошлом в значительной степени варьировали. В используемой в настоящее время классификации ВОЗ/Международной ассоциации по изучению рака легкого определение бронхиолоальвеолярного рака является более строгим, чем ранее используемые патоморфологами, и включает только неинвазивные опухоли. В случае выявления стромальной, сосудистой или плевральной инвазии аденокарциномы со значительным компонентом бронхиолоальвеолярного рака, в соответствии с настоящей классификацией, опухоль будет классифицирована как аденокарцинома смешанного типа с преобладанием бронхиолоальвеолярной карциномы в сочетании с ацинарной, солидной или папиллярной карциномами в зависимости от выявляемого гистологического подтипа, характеризующегося инвазивным ростом. В новой классификации дано определение нескольким вариантам аденокарциномы, включая высокодифференцированную фетальную аденокарциному, муцинозную (коллоидную) аденокарциному, муцинозную цистоаденокарциному, перстневидно-клеточную и светлоклеточную аденокарциному.
Критерии определения бронхиолоальвеолярной аденокарциномы в прошлом в значительной степени варьировали. В используемой в настоящее время классификации ВОЗ/Международной ассоциации по изучению рака легкого определение бронхиолоальвеолярного рака является более строгим, чем ранее используемые патоморфологами, и включает только неинвазивные опухоли. В случае выявления стромальной, сосудистой или плевральной инвазии аденокарциномы со значительным компонентом бронхиолоальвеолярного рака, в соответствии с настоящей классификацией, опухоль будет классифицирована как аденокарцинома смешанного типа с преобладанием бронхиолоальвеолярной карциномы в сочетании с ацинарной, солидной или папиллярной карциномами в зависимости от выявляемого гистологического подтипа, характеризующегося инвазивным ростом. В новой классификации дано определение нескольким вариантам аденокарциномы, включая высокодифференцированную фетальную аденокарциному, муцинозную (коллоидную) аденокарциному, муцинозную цистоаденокарциному, перстневидно-клеточную и светлоклеточную аденокарциному.
Нейроэндокринные опухоли
В классификации нейроэндокринной опухоли легкого отмечается значительная эволюция ее понимания. Крупноклеточную нейроэндокринную карциному относят к НМРЛ высокой дифференцировки. Опухоль характеризуется неблагоприятным прогнозом, идентичным таковому при мелкоклеточном РЛ. Атипичный карциноид представляет собой нейроэндокринную опухоль промежуточной дифференцировки, характеризующуюся более благоприятным прогнозом, чем при высокодифференцированном мелкоклеточном РЛ и крупноклеточной нейроэндокринной карциноме, и менее благоприятным, чем при типичном карциноиде. Нейроэндокринная дифференцировка может быть выявлена методами иммуногистохимии и электронной микроскопии в 10—20% случаев НМРЛ без признаков нейроэндокринной морфологии. Такие опухоли формально не классифицированы в соответствии с системой ВОЗ, так как клиническое и терапевтическое значение нейроэндокринной дифференцировки при НМРЛ не установлено. Эти опухоли объединяют в группу НМРЛ с нейроэндокринной дифференцировкой.
Крупноклеточная карцинома
Кроме общей категории крупноклеточных карцином известно несколько необычных вариантов, включая крупноклеточную нейроэндокринную карциному, базалоидную карциному, лимфоэпителиомоподобную, светлоклеточную и крупноклеточную карциному с рабдоидным фенотипом. Базалоидная карцинома также рассматривается и как вариант плоскоклеточного рака, и, редко, аденокарцинома может проявлять признаки базалоидной карциномы; однако базалоидная карцинома без вышеперечисленных признаков рассматривается как вариант крупноклеточного рака.
Карциномы с плеоморфными, саркоматоидными или саркоматозными элементами
Эта группа опухолей встречается редко. Веретеноклеточные и гигантоклеточные карциномы и карциносаркомы составляют 0,4 и 0,1% всех злокачественных опухолей легких, соответственно. Кроме того, эта группа опухолей отражает гистологическое разнообразие и наличие эпителиальной и мезенхимальной дифференцировок опухолей. Бифазная легочная бластома рассматривается как один из видов карцином с плеоморфными, саркоматоидными или саркоматозными элементами, исходя из клинических и молекулярных данных.
Литература
1. Travis W.D., Colby T.V., Corrin B. et al. Histological typing of lung and pleural tumours. 3rd ed. Berlin, Springer-Verlag; 1999.
Хирургическое лечение пациентки с нейроэндокринной опухолью легкого, ассоциированной с АКТГ-эктопическим синдромом: клинический случай | Пикунов
Аннотация
Среди первичных новообразований легких доля нейроэндокринных опухолей составляет до 20–25%. Согласно базе данных Surveillance Epidemiology and End Results (SEER), с 1970 г. отмечен значительный рост диагностики первичных карциноидных опухолей разныхорганов с максимальным приростом заболеваемости в группе бронхолегочной локализации. Карциноидные опухоли легкого составляют приблизительно 2% от всех первичных опухолей легких, но только 5% этих образований связаны с продукцией АКТГ.
Несмотря на выраженность клинических проявлений и быстрое прогрессирование симптомов гиперкортицизма, топическая диагностика АКТГ-эктопического синдрома зачастую вызывает определенные затруднения. Сложность диагностики эктопированных опухолейсвязана с тем, что большая часть этих образований имеет столь малые размеры, что они могут быть пропущены при стандартных методиках исследования (рентгенография, УЗИ, МСКТ или МРТ). После постановки диагноза АКТГ-эктопического синдрома единственнымоптимальным методом патогенетической терапии является радикальное удаление опухоли, которое приводит к нормализации функции коры надпочечников и ликвидации гиперкортицизма. Однако достижение этой цели во многих случаях затруднено из-за позднейтопической диагностики, распространенности опухолевого процесса и обширного метастазирования.
Сложность диагностики эктопированных опухолейсвязана с тем, что большая часть этих образований имеет столь малые размеры, что они могут быть пропущены при стандартных методиках исследования (рентгенография, УЗИ, МСКТ или МРТ). После постановки диагноза АКТГ-эктопического синдрома единственнымоптимальным методом патогенетической терапии является радикальное удаление опухоли, которое приводит к нормализации функции коры надпочечников и ликвидации гиперкортицизма. Однако достижение этой цели во многих случаях затруднено из-за позднейтопической диагностики, распространенности опухолевого процесса и обширного метастазирования.
В работе представлено клиническое наблюдение пациентки с диагнозом “нейроэндокринная опухоль легкого с АКТГ-эктопическим синдромом”. Описаны значимость мультидисциплинарного подхода, сложности дифференциальной диагностики, особенностипериоперационного периода и отдаленные результаты лечения.
Актуальность
Нейроэндокринные опухоли (НЭО) – группа гетерогенных новообразований, происходящих из клеток диффузной эндокринной системы (нейроэндокринных клеток Кульчицкого) и обладающих рядом общих биологических свойств [1]. Наиболее часто нейроэндокринные опухоли локализованы в органах желудочно-кишечного тракта (прямая кишка, тонкий кишечник, поджелудочная железа и др.). Согласно базе данных “Скрининг, эпидемиология и заключительные результаты” (SEER) Национального онкологического института, в течение 15 лет произошло значительное увеличение заболеваемости нейроэндокринными опухолями различных органов, причем наибольший рост отмечен для новообразований бронхолегочной локализации, доля которых составляет до 30% [2]. Группа нейроэндокринных опухолей бронхолегочной локализации разнообразна по потенциалу злокачественности и прогнозу. Согласно классификации ВОЗ от 2015 г., выделяют четыре гистологических варианта НЭО легких: типичный карциноид, атипичный карциноид, крупноклеточная нейроэндокринная опухоль и мелкоклеточный рак легких [3, 4].
Наиболее часто нейроэндокринные опухоли локализованы в органах желудочно-кишечного тракта (прямая кишка, тонкий кишечник, поджелудочная железа и др.). Согласно базе данных “Скрининг, эпидемиология и заключительные результаты” (SEER) Национального онкологического института, в течение 15 лет произошло значительное увеличение заболеваемости нейроэндокринными опухолями различных органов, причем наибольший рост отмечен для новообразований бронхолегочной локализации, доля которых составляет до 30% [2]. Группа нейроэндокринных опухолей бронхолегочной локализации разнообразна по потенциалу злокачественности и прогнозу. Согласно классификации ВОЗ от 2015 г., выделяют четыре гистологических варианта НЭО легких: типичный карциноид, атипичный карциноид, крупноклеточная нейроэндокринная опухоль и мелкоклеточный рак легких [3, 4].
Гормонально активные новообразования, ассоциированные с различными паранеопластическими синдромами (Кушинга, карциноидным, акромегалией, миастеническим, Ламберта–Итона и др. ), диагностируют не более чем в 5% среди всех НЭО [5]. Лидирующее место среди НЭО-активных новообразований бронхолегочной локализации занимает АКТГ-эктопический синдром (2%), для которого характерно развитие эндогенного гиперкортицизма с клинической картиной синдрома Иценко–Кушинга [6].
), диагностируют не более чем в 5% среди всех НЭО [5]. Лидирующее место среди НЭО-активных новообразований бронхолегочной локализации занимает АКТГ-эктопический синдром (2%), для которого характерно развитие эндогенного гиперкортицизма с клинической картиной синдрома Иценко–Кушинга [6].
В настоящей работе представлено клиническое наблюдение пациентки с НЭО бронхолегочной локализации, ассоциированной с АКТГ-эктопическим синдромом.
Описание случая
Пациентка Н. 31 года обратилась к терапевту с жалобами на мышечную слабость, эпизоды повышения артериального давления до 200/100 мм рт.ст., учащенное сердцебиение, нарушение менструального цикла, прибавку в весе в течение последних двух лет. При обследовании в эндокринологическом отделении у пациентки выявлен эндогенный гиперкортицизм (таблица).
Результаты эндокринологических лабораторных испытаний
По данным МРТ головного мозга данных о наличии аденомы гипофиза не получено. В ходе дальнейшего диагностического поиска по результатам большой дексаметазоновой пробы установлен эктопический характер продукции АКТГ. При заборе крови из нижних каменистых синусов была подтверждена эктопическая продукция АКТГ. По данным МСКТ органов грудной клетки и брюшной полости с контрастированием выявлено новообразование в средней доле (S5) правого легкого неправильной округлой формы с нечеткими контурами, расположенное по ходу субсегментарного бронха, размерами 21,8 × 13 × 13 мм, неравномерно накапливающее контрастное вещество до 48 ед.Н. Медиастинальной лимфоаденопатии нет (рис. 1). При ФГДС и колоноскопии опухолевых новообразований не выявлено.
При заборе крови из нижних каменистых синусов была подтверждена эктопическая продукция АКТГ. По данным МСКТ органов грудной клетки и брюшной полости с контрастированием выявлено новообразование в средней доле (S5) правого легкого неправильной округлой формы с нечеткими контурами, расположенное по ходу субсегментарного бронха, размерами 21,8 × 13 × 13 мм, неравномерно накапливающее контрастное вещество до 48 ед.Н. Медиастинальной лимфоаденопатии нет (рис. 1). При ФГДС и колоноскопии опухолевых новообразований не выявлено.
Рис. 1. МСКТ органов грудной клетки пациентки Н. с контрастным усилением.
Пациентка госпитализирована в отделение торакальной хирургии с диагнозом: нейроэндокринная опухоль средней доли правого легкого c T1bN0M0. АКТГ-эктопический синдром.
Выполнена видеоассистированная краевая резекция средней доли правого легкого. При срочном морфологическом исследовании картина нейроэндокринной опухоли солидно-альвеолярного строения. Определяется два митоза в одном поле зрения. Окончательный объем операции – видеоассистированная средняя лобэктомия справа, медиастинальная лимфаденэктомия. По данным планового морфологического и иммуногистохимического исследования – морфологическая картина атипичного карциноида легкого размерами 2,2 × 1,2 × 1 см. Количество митозов – 1 в 10 полях зрения при увеличении 400 (2 мм кВ). ИП Ki67 – 20%; pT1pN0(0/23)cM0;R0;L0,V0 (рис. 2).
Окончательный объем операции – видеоассистированная средняя лобэктомия справа, медиастинальная лимфаденэктомия. По данным планового морфологического и иммуногистохимического исследования – морфологическая картина атипичного карциноида легкого размерами 2,2 × 1,2 × 1 см. Количество митозов – 1 в 10 полях зрения при увеличении 400 (2 мм кВ). ИП Ki67 – 20%; pT1pN0(0/23)cM0;R0;L0,V0 (рис. 2).
Рис. 2. Слева: микропрепарат удаленной нейроэндокринной опухоли солидно-трабекулярного строения, два митоза в одном поле зрения (окраска гематоксилином и эозином, ×400). Справа: иммуногистохимическое исследование удаленной нейроэндокринной опухоли, реакция с антителом к Ki-67 (клон SP6, Cell Marque), индекс Ki67 около 15% (ДАБ, гематоксилин, ×400).
Кортизол периферической крови достиг уровня референсных значений в течение первого часа после операции. Динамика уровня кортизола в периоперационном периоде представлена на диаграмме (рис. 3).
Рис. 3. Периоперационная динамика уровня кортизола периферической крови.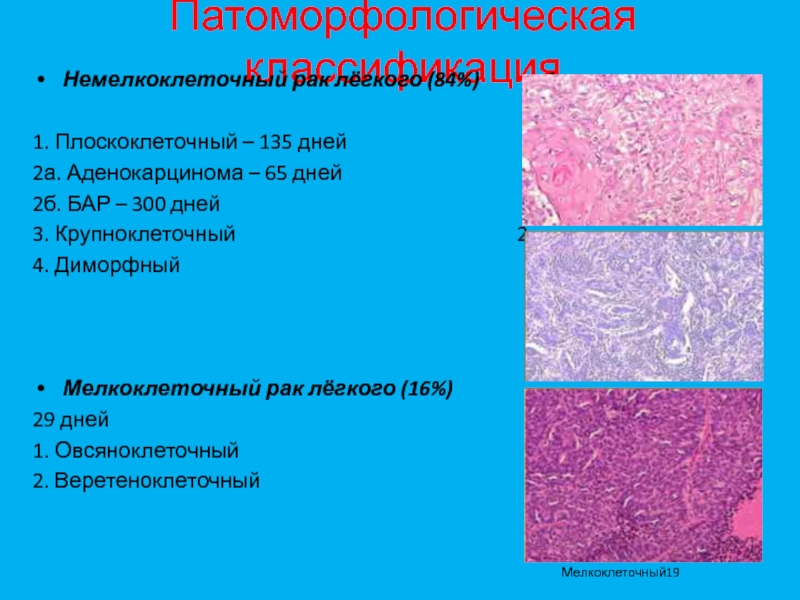
Пациентка активизирована на вторые сутки после операции. С целью предупреждения развития острой надпочечниковой недостаточности в послеоперационном периоде проводилась заместительная гормональная терапия (гидрокортизон).
При контрольном обследовании через 6 мес пациентка отмечает значимое субъективное улучшение общего самочувствия – отсутствие подъемов артериального давления, снижение веса и нормализацию менструального цикла. Уровень утреннего кортизола через 6 мес после операции – 250 нмоль/л. Внешний вид пациентки до и после хирургического лечения представлен на рис. 4.
Рис. 4. Внешний вид пациентки до операции и спустя 6 мес.
Обсуждение
Связь между мелкоклеточным раком легкого и синдромом Кушинга впервые была обнаружена в 1928 г. Определение этой болезни как синдрома описано в работе C.K. Meador и соавт., которые в 1962 г. продемонстрировали биологическую активность АКТГ при карциноидных опухолях легких [7]. Данные новообразования характеризуются отсутствием взаимосвязи с курением в отличие от рака легкого [8, 9].
Карциноидные опухоли легких возникают из нейроэндокринных клеток Кульчицкого, локализованных в слизистой оболочке бронхиального дерева, и составляют от 2 до 5% всех первичных злокачественных заболеваний легких, эктопическая гиперсекреция АКТГ происходит только у 0,5–2% этих новообразований [10, 11]. Эктопический источник АКТГ расположен в легком более чем в 45% опухолей различной локализации [12, 13]. Тимус (11%) и поджелудочная железа (8%) являются следующими наиболее распространенными органами, где могут возникать нейроэндокринные опухоли с АКТГ-эктопическим синдромом. У пациентов с АКТГ-эктопическим синдромом концентрация кортизола и скорости его секреции могут достигать свыше 2000 нмоль/л. В представленном клиническом наблюдении диагноз был установлен спустя 2 года после манифестации синдрома Иценко–Кушинга.
Диагностика АКТГ-эктопического синдрома часто представляет определенные трудности в проведении дифференциального диагноза у клиницистов. Селективный забор крови из нижних каменистых синусов считается методом выбора при проведении дифференциальной диагностики. Раннее обнаружение и удаление гормонопродуцирующей опухоли позволяет избежать вынужденной двусторонней адреналэктомии и снижает риск прогрессирования заболевания. При подтверждении АКТГ-эктопического синдрома в стандарты топической диагностики входит выполнение МРТ головного мозга, МСКТ брюшной полости и грудной клетки с контрастным усилением, ФГДС, колоноскопии. Основным методом лечения локализованных форм карциноидных опухолей бронхолегочной локализации является хирургический [14]. Характер и объем операции несколько отличаются от таковых при раке легкого, предпочтение отдается выполнению органосохраняющих операций типа сегментэктомии, бисегментэктомии, лобэктомии, резекции легких с бронхопластическими этапами. Метастазирование в лимфатические узлы группы N1 при типичных карциноидах встречается примерно в 4–5% случаев, поражение N2 описано в единичных наблюдениях, однако нет сомнений относительно необходимости выполнения медиастинальной лимфаденэктомии[15, 16].
Раннее обнаружение и удаление гормонопродуцирующей опухоли позволяет избежать вынужденной двусторонней адреналэктомии и снижает риск прогрессирования заболевания. При подтверждении АКТГ-эктопического синдрома в стандарты топической диагностики входит выполнение МРТ головного мозга, МСКТ брюшной полости и грудной клетки с контрастным усилением, ФГДС, колоноскопии. Основным методом лечения локализованных форм карциноидных опухолей бронхолегочной локализации является хирургический [14]. Характер и объем операции несколько отличаются от таковых при раке легкого, предпочтение отдается выполнению органосохраняющих операций типа сегментэктомии, бисегментэктомии, лобэктомии, резекции легких с бронхопластическими этапами. Метастазирование в лимфатические узлы группы N1 при типичных карциноидах встречается примерно в 4–5% случаев, поражение N2 описано в единичных наблюдениях, однако нет сомнений относительно необходимости выполнения медиастинальной лимфаденэктомии[15, 16].
В последнее время дискутабельным остается вопрос целесообразности выполнения сублобарных анатомических резекций при опухоли диаметром менее 2 см. Ввиду относительной редкости карциноидов легких отсутствуют крупные многоцентровые исследования, однозначно подтверждающие или опровергающие такой подход. В данной ситуации нам представляется возможным экстраполировать результаты аналогичных исследований при неметастатическом раке легкого (НМРЛ) [17, 18], свидетельствующие о возможности выполнения сублобарных резекций без ущерба онкологическому радикализму при образованиях менее 2 см в диаметре, а также имеющие функциональные преимущества в раннем и отдаленном послеоперационном периоде по данным ряда исследований [18, 19].
Ввиду относительной редкости карциноидов легких отсутствуют крупные многоцентровые исследования, однозначно подтверждающие или опровергающие такой подход. В данной ситуации нам представляется возможным экстраполировать результаты аналогичных исследований при неметастатическом раке легкого (НМРЛ) [17, 18], свидетельствующие о возможности выполнения сублобарных резекций без ущерба онкологическому радикализму при образованиях менее 2 см в диаметре, а также имеющие функциональные преимущества в раннем и отдаленном послеоперационном периоде по данным ряда исследований [18, 19].
В послеоперационном периоде у пациентов с АКТГ-эктопическим синдромом необходим динамический контроль уровня кортизола крови для раннего выявления и коррекции симптомов надпочечниковой недостаточности вследствие компенсаторной атрофии и неполноценной работы надпочечников.
Заключение
Карциноидные опухоли бронхолегочной локализации – медленнорастущие новообразования, характеризующиеся относительно благоприятным прогнозом, при условии своевременного радикального хирургического лечения. Нейроэндокринные опухоли легких – наиболее распространенная причина АКТГ-эктопического синдрома. Топический поиск очага при установленном АКТГ-эктопическом синдроме до настоящего времени остается сложной задачей, лежащей в области интересов врачей разных специальностей.
Основным методом лечения карциноидных опухолей легких является хирургический. Анатомическая резекция легкого (лобэктомия, сегментэктомия, бисегментэктомия) с медиастинальной лимфодиссекцией – операция выбора при карциноидных опухолях легкого вне зависимости от степени дифференцировки. Последнее время в различных исследованиях часто обсуждается возможность выполнения сублобарных резекций при ранних формах НМРЛ (размере первичного очага менее 2 см и отсутствии медиастинальной лимфаденопатии). Проведение подобных исследований в отношении новообразований с меньшим потенциалом злокачественности, таких как НЭО, остается перспективным направлением в развитии торакальной хирургии.
Дополнительная информация
Источник финансирования. Подготовка и публикация статьи осуществлены на личные средства авторского коллектива.
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию своих медицинских данных в журнале “Эндокринная хирургия”.
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов, связанных с публикацией настоящей статьи, о которых следовало бы сообщить.
Благодарности. Огромная благодарность сотрудникам патологоанатомического отделения Института хирургии им. А.В. Вишневского за сотрудничество и предоставленный материал.
1. Paladugu RR, Benfield JR, Pak HY, et al. Bronchopulmonary Kulchitzky cell carcinomas. A new classification scheme for typical and atypical carcinoids. Cancer. 1985;55(6):1303-1311. doi: 10.1002/1097-0142(19850315)55:6<1303::aid-cncr2820550625>3.0.co;2-a.
2. Travis W, Brambilla E, Burke A, et al. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. 4th ed. Lyon: IARC Press; 2015.
3. Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol. 2015;10(9):1243-1260. doi: 10.1097/JTO.0000000000000630/
4. Тер-Ованесов М.Д., Полоцкий Б.Е. Карциноидные опухоли торакальной локализации – современное состояние проблемы. // Проблемы туберкулеза и болезней легких. – 2005. – Т. 6. – №4. – С. 220-226. [Ter-Ovanesov M.D., Polotskiy B.E. Kartsinoidnye opukholitorakal'noy lokalizatsii – sovremennoe sostoyanie problemy. Probl Tuberk Bolezn Legk. 2005;6(4):220-226. (In Russ.)]
5. Чекини А.С. Нейроэндокринные опухоли легких (карциноиды) и тимуса: Дис. … канд. мед. наук. – М.; 2012. [Chekini AS. Neyroendokrinnye opukholi legkikh (kartsinoidy) i timusa. Moscow; 2012. (In Russ.)]
6. Meador CK, Liddle GW, Island DP, et al. Cause of Cushing's syndrome in patients with tumors arising from “nonendocrine” tissue. J Clin Endocrinol Metab. 1962;22:693-703. doi: 10.1210/jcem-22-7-693.
7. Fink G, Krelbaum T, Yellin A, et al. Pulmonary carcinoid: presentation, diagnosis, and outcome in 142 cases in Israel and review of 640 cases from the literature. Chest. 2001; 119(6):1647-1651. doi: 10.1378/chest.119.6.1647.
8. Gustafsson BI, Kidd M, Chan A, et al. Bronchopulmonary neuroendocrine tumors. Cancer. 2008;113(1):5-21. doi: 10.1002/cncr.23542.
9. Deb SJ, Nichols FC, Allen MS, et al. Pulmonary carcinoid tumors with Cushing's syndrome: an aggressive variant or not? Ann Thorac Surg. 2005;79(4):1132-1136; discussion 1132-1136. doi: 10.1016/j.athoracsur.2004.07.021.
10. Ilias I, Torpy DJ, Pacak K, et al. Cushing's syndrome due to ectopic corticotropin secretion: twenty years' experience at the National Institutes of Health. J Clin Endocrinol Metab. 2005;90(8):4955-4962. doi: 10.1210/jc.2004-2527.
11. Isidori AM, Kaltsas GA, Pozza C, et al. The ectopic adrenocorticotropin syndrome: clinical features, diagnosis, management, and long-term follow-up. J Clin Endocrinol Metab. 2006;91(2):371-377. doi: 10.1210/jc.2005-1542.
12. Scanagatta P, Montresor E, Pergher S, et al. Cushing's syndrome induced by bronchopulmonary carcinoid tumours: a review of 98 cases and our experience of two cases. Chir Ital. 2004;56(1):63-70.
13. Isidori AM, Lenzi A. Ectopic ACTH syndrome. Arq Bras Endocrinol Metabol. 2007;51(8):1217-1225. doi: 10.1590/s0004-27302007000800007.
14. Cardillo G, Sera F, Di Martino M, et al. Bronchial carcinoid tumors: nodal status and long-term survival after resection. Ann Thorac Surg. 2004;77(5):1781-1785. doi: 10.1016/j.athoracsur.2003.10.089.
15. Oberg K, Hellman P, Ferolla P, et al. Neuroendocrine bronchial and thymic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012; 23 Suppl 7:vii120-123. doi: 10.1093/annonc/mds267.
16. Villamizar N, Swanson SJ. Lobectomy vs. segmentectomy for NSCLC (T<2 cm). Ann Cardiothorac Surg. 2014;3(2): 160-166. doi: 10.3978/j.issn.2225-319X.2014.02.11.
17. Okada M, Mimae T, Tsutani Y, et al. Segmentectomy versus lobectomy for clinical stage IA lung adenocarcinoma. Ann Cardiothorac Surg. 2014;3(2):153-159. doi: 10.3978/j.issn.2225-319X.2014.02.10.
18. Okada M, Koike T, Higashiyama M, et al. Radical sublobar resection for small-sized non-small cell lung cancer: a multicenter study. J Thorac Cardiovasc Surg. 2006;132(4): 769-775. doi: 10.1016/j.jtcvs.2006.02.063.
19. Saito H, Nakagawa T, Ito M, et al. Pulmonary function after lobectomy versus segmentectomy in patients with stage I non-small cell lung cancer. World J Surg. 2014;38(8):2025-2031. doi: 10.1007/s00268-014-2521-3.
Лечение рака лёгких — Онкология в Белоруссии: клиники, врачи, методы
Легкие – это орган дыхания, который обеспечивает организм кислородом. Легкие разделено на доли: правое — 3 доли, левое – 2. Доли, в свою очередь, делятся на сегменты.
Рак легкого — это бесконтрольный рост и размножение «опухолевых» клеток в ткани легкого.
СИМПТОМЫ РАКА ЛЕГКОГО
Рак легкого часто протекает бессимптомно, т.е. нет каких-либо особых признаков заболевания. Если опухоль уже получила значительное распространение, то к наиболее частым симптомам относятся:
-
1. Длительный кашель. -
2. Боль в грудной клетке. Особенно усиливающаяся при глубоком вдохе. -
3. Боли в плече, онемение пальцев рук, опущением века. -
4. Снижение аппетита и потеря веса. -
5. Мокрота коричневая, возможно даже с прожилками крови. -
6. Одышка. -
7. Лихорадка без явной причины. -
8. Частые инфекции верхних дыхательных путей, бронхиты, пневмонии и т.д. -
9. Хрипы в легких. -
10. Потеря сознания, головные боли, головокружение, нарушение речи и зрения.
Также существует симптомы, которые могут указывать на распространение опухоли за пределы легких:
-
Боль в костях -
Увеличение лимфатических узлов. -
Желтое окрашивание кожи и склер.
При появлении симптомов заболевания необходимо как можно быстрее обратиться к специалисту.
Записаться на консультацию
Единой причины развития рака легкого нет. Чаще всего это:
-
1. Табакокурение
-
2. Наследственная предрасположенность
-
3. Вредные условия труда
-
4. Хронические заболевания легких
-
5. Ионизирующая радиация
-
6. Возраст старше 50 лет
-
7. Неблагоприятная окружающая среда
-
8. Гормональные изменения
Курение, как активное — так и пассивное, является самым главный факторов развития рака легкого. У курильщиков в 5 раз увеличивает вероятность развития рака!
Разновидности рака легкого
В зависимости от вида клеток опухоли различают мелкоклеточный и не мелкоклеточный рак легкого.
НЕМЕЛКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО наиболее распространен. Это до 80% от всех опухолей легких.
В зависимости от строения опухоли не мелкоклеточный рак подразделяется на:
-
Опухоль из ороговевающего эпителия
-
Аденокарцинома
-
Крупноклеточная недифференцированная карцинома
Очень важно правильно определить стадию процесса.
Международная классификация TNM, предложенная в 1997 г. Всемирной организацией здравоохранения (ВОЗ) ввела следующие обозначения:
«Т» — обозначает размер опухоли,
«N» — обозначает наличие пораженных лимфатических узлов,
«М» — наличие метастазов.
| Неопределяемая карцинома | Tх | N0 | M0 |
|---|---|---|---|
| Стадия 0 | Tis | N0 | M0 |
| Стадия I A | T1 | N0 | M0 |
| Стадия I В | T2 | N0 | M0 |
| Стадия II А | T1 | N1 | M0 |
| Стадия II В | T2 | N1 | M0 |
| Стадия III А | T1-2 | N0 | M0 |
| T3 | N2 | M0 | |
| Стадия III В | любая T | N3 | M0 |
| T4 | любая N | M0 | |
| Стадия IV | любая T | любая N | M1 |
Tх — неопределяемая опухоль,
Tis – опухоль, которая не распространяется в соседние ткани,
T1 — опухоль не более 3 см, не распространяющаяся в главный бронх;
T2 — опухоль более 3 см, но не захватывающая все легкое и располагающаяся более 2 см от области разветвления трахеи.
T3 — опухоль переходящая на грудную стенку, диафрагму, плевру, перикард (оболочку сердца) или опухоль, не доходящая до области разветвления трахеи менее 2см, или с ателектазом всего легкого или пневмонией всего легкого.
T4 — опухоль, непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, область разветвления трахеи.
Мелкоклеточный рак легкого
Мелкоклеточный рак легкого – это примерно 20% от всех опухолей легких. Данный вариант также известен под названиями «низкодифференцированная нейроэндокринная карцинома» или «мелкоклеточная недифференцированная карцинома».
Стадии процесса:
| Неопределяемая карцинома | Tх | N0 | M0 |
|---|---|---|---|
| Стадия 0 | Tis | N0 | M0 |
| Стадия I A | T1 | N0 | M0 |
| Стадия I В | T2 | N0 | M0 |
| Стадия II А | T1 | N1 | M0 |
| Стадия II В | T2 | N1 | M0 |
| Стадия III А | T1-2 | N0 | M0 |
| T3 | N2 | M0 | |
| Стадия III В | любая T | N3 | M0 |
| T4 | любая N | M0 | |
| Стадия IV | любая T | любая N | M1 |
Tх — неопределяемая опухоль,
Tis — опухоль не распространяющаяся в соседние ткани,
T1 — опухоль не более 3 см, не распространяющаяся в главный бронх;
T2 — опухоль более 3 см, но не захватывающая все легкое и располагающаяся более 2 см от области разветвления трахеи.
T3 — опухоль переходящая на грудную стенку, диафрагму, плевру, перикард (оболочку сердца) или опухоль, не доходящая до области разветвления трахеи менее 2см, или с ателектазом всего легкого или пневмонией всего легкого.
T4 — опухоль, непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, область разветвления трахеи.
Кроме данной классификации, также широко используется 2х стадийная «VALG» — классификация:
-
1. Локализованный (ограниченный) опухолевый процесс
-
Стадии 0 — III B: заболевание ограниченное одной половиной грудной клетки.
-
2. Распространенная форма опухолевого процесса (стадия IV).
Для диагностики рака легкого применять как неинвазивные методы обследования: осмотр, рентгенографию органов грудной клетки, компьютерную томографию, магнитно-резонансную томографию, ультразвуковое исследование органов брюшной полости, так и инвазивные методы: бронхоскопию, торакоскопию, медиастиноскопию, трансторакальную игловую биопсию опухоли. Цифровая рентгенография органов грудной клетки. Компьютерная томография органов грудной клетки с контрастным усилинением позволяет оценить распространенность опухоли на крупные сосуды.
Основным методом лечения рака легкого является хирургический.
Объем операции определяется после обследования и зависит от локализации опухоли в легком и ее распространенности. При периферическом раке чаще выполняется удаление доли легкого (лобэктомия), при центральном – удаление легкого (пневмонэктомия).
В некоторых случаях при центральном раке выполняются бронхопластические операции, при которых удается сохранить долю легкого с наложением межбронхиального анастомоза. При вовлечении в опухоль грудной стенки или анатомических структур средостения выполняются комбинированные операции с резекцией этих структур. Развитие анестезиологии и хирургии сделало возможным в настоящее время выполнение сложных хирургических вмешательств на трахее, а также на легких и сердце с применением искусственного кровообращения.
Использование видеоторакоскопической техники позволяет выполнить резекцию легкого или удаление доли легкого через небольшие разрезы грудной стенки и уменьшить травматичность операции.
После хирургического лечения рака легкого может потребоваться проведение дополнительной химиотерапии или лучевой терапии.
После проведения лечения требуется курс реабилитации и диспансерное наблюдение: первый год каждые 3 месяца осмотр, рентгенография органов грудной клетки в 2-х проекциях, УЗИ органов брюшной полости
Выбор метода лечения — это очень важный этап. Решение специалиста всегда основываться на точных данных диагностики заболевания и индивидуальных особенностей пациента. Общая программа лечения обязательно обсуждается с пациентом и, по его желанию, с его близкими.
Записаться к специалисту
Вызов каждому Этим болеют тысячи россиян. От болезни не застрахован никто: Наука и техника: Lenta.ru
Услышав диагноз «рак легкого», хочется сдаться и опустить руки. Это заболевание – самая частая причина смерти от онкологического заболевания у мужчин, а у женщин он уступает лишь раку молочной железы. Однако современные методы лечения помогают продлить жизнь пациента на годы, особенно когда опухоль диагностирована на ранних стадиях. «Лента.ру» рассказывает, какие варианты терапии доступны пациентам.
Рак легкого – это злокачественная опухоль, развивающаяся из эпителиальных клеток бронхов разного калибра. Когда клетки эпителия по тем или иным причинам начинают неконтролируемо делиться, возникает злокачественная опухоль, которая постепенно разрастается и вытесняет нормальные клетки эпителия.
Гистологический срез плоскоклеточного рака — одного из подтипов немелкоклеточного рака легкого
Изображение: librepathology.org
Рак легкого делится на типы в зависимости от того, как выглядят вышедшие из-под контроля клетки и какого они размера. Самый распространенный тип — немелкоклеточный рак легкого, который составляет примерно 85 процентов от всех случаев рака легкого.
Цитологическая картина мелкоклеточного рака легкого
Изображение: Wikimedia.org
Другой тип – мелкоклеточный рак легкого – встречается намного реже. Он опасен тем, что его клетки делятся очень быстро. В большинстве случаев такой рак рано распространяется и в другие органы через кровь или лимфу (дает метастазы). Вследствие раннего метастазирования, в том числе, в оба легких, эффективно удалить его хирургическим путем бывает невозможно. Вместе с тем, использование противоопухолевой химиотерапии замедляет рост опухоли, а в ряде случаев приводит к полному излечению; особенно эффективными являются комбинации противоопухолевых препаратов и сочетание лекарственного метода с лучевой терапией.
Немелкоклеточный рак легкого, напротив, более устойчив к химиотерапии, но его бывает легче удалить при помощи операции.
Подходящий метод лечения и эффективность терапии зависят не только от разновидности рака, но и от его стадии. Злокачественные опухоли врачи классифицируют по системе TNM.
Аббревиатура образована по первым буквам слов tumor (опухоль), nodes (лимфатические узлы), metastasis (метастазы). Эти параметры помогают оценить размер опухоли, а также степень ее распространенности. Существует также классификация опухолей по стадиям от I до IV — в зависимости от размера, расположения и наличия метастазов.
В зависимости от стадии рак легкого можно разделить на локализованный (I-II стадии) и распространенный (III-IV стадии).
Избавиться от локализованного немелкоклеточного рака легкого может помочь хирургическая операция, после которой до 60 процентов пациентов проживут минимум пять лет. Нередко больные, которых отказались оперировать по месту обращения, стремятся найти другого хирурга. Они собирают деньги на операцию, выезжают за рубеж, но не учитывают, что операцию можно выполнить далеко не каждому, а иногда оно будет опаснее, чем другие методы лечения. Больным с мелкоклеточным раком легкого удалить опухоль хирургически можно только в том случае, если поражено одно легкое.
После операции больному нередко назначают курс химио- или лучевой терапии на тот случай, если в организме еще остались клетки опухоли. Это снижает вероятность возвращения болезни (рецидива). Такой подход рекомендуется при немелкоклеточном раке легкого, начиная со стадии IIB. На третьей стадии, которая считается условно операбельной, используется комбинированное лечение с применением лучевой или химиотерапии (*).
Лучевая терапия может стать хорошим вариантом для лечения рака легкого в том случае, когда опухоль невозможно удалить хирургическим путем или существует риск операционных осложнений. Но в одиночку этот метод редко справляется, поэтому для усиления действия его сочетают с химиотерапией.
Химиотерапия для немелкоклеточного рака легкого может стать дополнением к хирургической операции. Она может стать и основным способом лечения для пациентов, которым операция по различным причинам не может быть проведена. Лекарства замедляют деление клеток или убивают их. Оба метода помогают продлить жизнь пациентов.
Для мелкоклеточного рака легкого химиотерапия будет основным лечением, зачастую в сочетании с лучевой терапией. Облучение уничтожает опухолевые клетки в лимфатических узлах, если заболевание распространилось и на них (**).
Преимущества лучевой и химиотерапии даются высокой ценой. Качество жизни пациентов ухудшают побочные эффекты: сильные боли, потеря волос, постоянная тошнота, когнитивные нарушения. При лечении страдают не только клетки опухоли, но и здоровые клетки организма. Комбинация этих подходов подойдет только пациентам с удовлетворительным общим состоянием (0-1 балл по шкале ECOG, основанной на степени двигательной активности, по которой определяется функциональный статус). К сожалению, несмотря на все эти жертвы, болезнь отступает далеко не всегда. Поэтому исследователи всего мира десятилетиями вели поиски более эффективных и безопасных методов терапии, при которых здоровые клетки не страдали бы.
Частичное решение данной проблемы было найдено в 1980-х годах. Именно тогда ученые экспериментально доказали, что клетки опухоли можно убивать при помощи лекарств, которые химически связываются со специфической «мишенью» — белками, располагающимися в большей степени на раковых клетках и, в меньшей степени на всех остальных клетках организма. Так появилась таргетная терапия (от английского target — «мишень»).
В борьбе против немелкоклеточного рака легкого применяется несколько типов таргетной терапии: препараты, влияющие на рост кровеносных сосудов, и препараты, воздействующие на специфические белки, которые появляются в клетках из-за генетических нарушений. Эти лекарства могут быть эффективны даже на поздних стадиях, а также в тех случаях, когда другая терапия не помогла или когда болезнь возвращается.
Препараты первого типа нацелены на белок, стимулирующий рост сосудов. Его подавление лишает опухоль питания.
Вторая группа препаратов нацелена на специфические белки, кодируемые генами EGFR, ALK или ROS-1, которые отвечают за деление и рост клеток. Некоторые мутации могут приводить к повышенному синтезу этих белков, из чего следует неконтролируемое деление и развитие опухоли.
Генетические нарушения или мутации, приводящие к избыточному синтезу белков, на которые нацелена таргетная терапия, есть у 10-35 процентов пациентов с немелкоклеточным раком легкого, поэтому данный вид лечения может применяться далеко не у всех больных. Что же делать остальным?
В последнее десятилетие набирает обороты новое направление в медицине — иммуноонкология. Несколько лекарств этого типа уже одобрены для лечения немелкоклеточного рака легкого. Как и в случае с таргетной терапией, важную роль играют белки на поверхности опухолевых клеток или биомаркеры. В одиночку иммуноонкологические препараты могут применяться примерно у одной трети больных, опухолевые клетки которых имеют экспрессию специфических белков на поверхности, но в комбинации с химиотерапией лечение может применяться вне зависимости от этого условия, то есть даже при отсутствии биомаркеров. Иммуноонкологические препараты изменили прогноз при немелкоклеточном раке легкого, поскольку при наличии в опухоли высокой экспрессии специфических белков каждый третий пациент живет более 5 лет (***).
Чтобы понять, как это работает, вспомним об исследованиях Джеймса Эллисона и Тасуку Хондзе, которые получили Нобелевскую премию по физиологии и медицине «за открытие терапии рака при помощи подавления негативной иммунной регуляции» в 2018 году. Что это значит и как это может быть связано с лечением злокачественных опухолей?
Иммунная регуляция — настройка интенсивности, с которой иммунитет реагирует на опасность, будь то бактерия, клетка опухоли или клетка, зараженная вирусом. Эта система похожа на полицию, которая должна охранять порядок в государстве. Если полиция сработает плохо, пропустит и не обезвредит нарушителей, у человека может возникнуть рак. Если же иммунитет будет чересчур строгим, то пострадают невиновные — обычные клетки, которые никому не угрожают. Такой сценарий может привести к аутоиммунным заболеваниям — например, диабету, псориазу, системной красной волчанке.
Нобелевские лауреаты исследовали белки под названием PD-1 и CTLA-4. Эти белки находятся на поверхности Т-клеток, или Т-лимфоцитов (одного из типов иммунных клеток). Оба белка становятся «выключателями» активированных Т-клеток, чтобы они не атаковали нормальные клетки организма. Различие между ними заключается в фазе иммунного ответа, в которой они действуют: CTLA-4 работает в фазу активации Т-лимфоцитов, PD-1 — непосредственно в месте уничтожения патогена (в т.ч., опухолевой клетки). Предотвращение активации PD-1 или CTLA-4 называется подавлением негативной иммунной регуляции.
Подробнее об этом виде терапии – в ролике Национального института здоровья США (на английском)
Эти белки действуют как контрольные точки, которые не дают Т-лимфоцитам вершить расправу слишком опрометчиво. Но если в организме уже развивается злокачественная опухоль, то иммунитет, судя по всему, работал слишком слабо. Поэтому ученые придумали блокировать эти и другие контрольные точки. Если не останавливать Т-клетки, они быстрее заметят нарушения и начнут сами сражаться против опухоли. Эта идея стала революцией в лечении рака и привела к рождению нового направления терапии. Неудивительно, что за нее вручили самую престижную научную награду.
Особенности организма пациентов — от генетики и общего состояния здоровья до вида рака, его распространенности и молекулярного подтипа — делают каждый случай индивидуальным. Врачи принимают решение о тактике лечения, учитывая множество характеристик. Поэтому если вы где-то услышали, что лучше всего от рака легкого помогает химиотерапия, таргетная, иммунотерапия или, наоборот, операция, это еще не значит, что такой подход будет лучшим для вас. Но узнав особенности опухоли, ее распространенность и наличие биомаркеров, можно вместе с лечащим врачом выбрать оптимальный план лечения.
Не всегда рекомендованная схема лечения срабатывает сразу, и приходится переходить на другую. Порой рак возвращается через годы после проведенного с эффектом лечения, и для этих случаев также можно подобрать действенные методы.
Современная медицина быстро движется вперед: вероятность продлить жизнь онкологическим больным есть даже в тех случаях, которые казались безнадежными еще десять лет назад. Но ничто так не повышает шансы на успех, как ранняя диагностика. Поэтому стоит уделять внимание к своему здоровью и регулярно проходить медосмотр: чем быстрее удастся заметить нарушения, тем выше вероятность, что будет поставлен своевременный диагноз. Благодаря этому можно будет обойтись малыми жертвами.
***
Информация предоставлена при поддержке ООО «МСД Фармасьютикалс», 119021, Россия, г. Москва, ул. Тимура Фрунзе, д.11, стр. 1, тел. +7-495-916-70-94
Необходима консультация специалиста здравоохранения.
RU-NON-00117 04.2020
* — Лактионов К.К., Артамонова Е.В., Бредер В.В., Горбунова В.А., Моисеенко Ф.В., Реутова Е.В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 32–48.
** — Чубенко В.А., Бычков М.Б., Деньгина Н.В., Кузьминов А.Е., Сакаева Д.Д., Семенова А.И. Практические рекомендации по лекарcтвенному лечению мелкоклеточного рака легкого. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2019 (том 9). С.49–54.
*** — DOI: 10.1200/JCO.19.00934 Journal of Clinical Oncology 37, no. 28 (October 01, 2019) 2518-2527.
Очерки патологии — классификация ВОЗ
Легкое
Общее
Классификация ВОЗ
Главный редактор: Дебра Л. Зингер, MD
Тема завершена: 20 января 2020 г.
Незначительные изменения: 16 июня 2021 г.
Авторские права : 2020-2021, PathologyOutlines.com, Inc.
Поиск в PubMed : Опухоль легкого по классификации ВОЗ
просмотров страниц в 2020 г .: 8,209
просмотров страниц в 2021 г. по настоящее время: 9,003
Цитируйте эту страницу: Бычков А.Классификация ВОЗ. Сайт PathologyOutlines.com. https://www.pathologyoutlines.com/topic/lungtumorwho.html. По состоянию на 12 августа 2021 г.
ВОЗ (2015)
Классификация опухолей легких ВОЗ (Трэвис: Классификация опухолей легких, плевры, тимуса и сердца ВОЗ, 4-е издание, 2015 г.)
- Эпителиальные опухоли Коды ICD-O
- Аденокарцинома 8140/3
- Лепидная аденокарцинома 8250/3
- Ацинарная аденокарцинома 8551/3
- Папиллярная аденокарцинома 8260/3
- Аденокарцинома микропапиллярная 8265/3
- Солидная аденокарцинома 8230/3
- Инвазивная муцинозная аденокарцинома 8253/3
- Смешанная инвазивная муцинозная и немлизистая аденокарцинома 8254/3
- Коллоидная аденокарцинома 8480/3
- Аденокарцинома плода 8333/3
- Кишечная аденокарцинома 8144/3
- Минимально инвазивная аденокарцинома
- Nonmucinous 8256/3
- Муцинозный 8257/3
- Преинвазивные поражения
- Атипичная аденоматозная гиперплазия 8250/0
- Аденокарцинома in situ8140 / 2
- Без слизистых 8250/2
- Муцинозный 8253/2
- Плоскоклеточный рак 8070/3
- Кератинизирующий плоскоклеточный рак 8071/3
- Некератинизирующий плоскоклеточный рак 8072/3
- Базалоидный плоскоклеточный рак 8083/3
- Преинвазивное поражение
- Плоскоклеточный рак in situ 8070/2
- Нейроэндокринные опухоли
- Мелкоклеточная карцинома 8041/3
- Комбинированная мелкоклеточная карцинома 8045/3
- Крупноклеточная нейроэндокринная карцинома 8013/3
- Комбинированная крупноклеточная нейроэндокринная карцинома 8013/3
- Карциноидные опухоли
- Типичный карциноид 8240/3
- Атипичный карциноид 8249/3
- Преинвазивное поражение
- Диффузная идиопатическая гиперплазия нейроэндокринных клеток легких 8040/0
- Мелкоклеточная карцинома 8041/3
- Крупноклеточная карцинома 8012/3
- Аденосквамозная карцинома 8560/3
- Плеоморфная карцинома 8022/3
- Веретено-клеточная карцинома 8032/3
- Гигантоклеточная карцинома 8031/3
- Карциносаркома 8980/3
- Легочная бластома 8972/3
- Другие и неклассифицированные карциномы
- Лимфоэпителиомоподобный рак 8082/3
- ОРЕХОВАЯ карцинома 8023/3
- Опухоли типа слюнных желез
- Мукоэпидермоидная карцинома 8430/3
- Аденоидно-кистозная карцинома 8200/3
- Эпителиальный миоэпителиальный рак 8562/3
- Плеоморфная аденома 8940/0
- Папилломы
- Плоскоклеточная папиллома 8052/0
- Экзофитический 8052/0
- перевернутый 8053/0
- Папиллома железы 8260/0
- Смешанная плоскоклеточная и железистая папиллома 8560/0
- Плоскоклеточная папиллома 8052/0
- Аденомы
- Склерозирующая пневмоцитома 8832/0
- Альвеолярная аденома 8251/0
- Папиллярная аденома 8260/0
- Муцинозная цистаденома 8470/0
- Аденома слизистой железы 8480/0
Мезенхимальные опухоли
- Гамартома легкого 8992/0
- Хондрома9220 / 0
- PECоматозные опухоли
- Лимфангиолейомиоматоз 9174/1
- PEComa, доброкачественная 8714/0
- PECома злокачественная 8714/3
- Врожденная перибронхиальная миофибробластическая опухоль 8827/1
- Диффузный лимфангиоматоз легких
- Воспалительная миофибробластическая опухоль 8825/1
- Эпителиоидная гемангиоэндотелиома 9133/3
- Плевропульмональная бластома 8973/3
- Синовиальная саркома 9040/3
- Саркома интимы легочной артерии 9137/3
- Легочная миксоидная саркома с транслокацией EWSR1-CREB1 8842/3
- Миоэпителиальные опухоли
- Миоэпителиома 8982/0
- Миоэпителиальная карцинома 8982/3
Лимфогистиоцитарные опухоли
- Экстранодальная лимфома маргинальной зоны слизистой лимфоидной ткани (MALT лимфома) 9699/3
- Диффузная В-крупноклеточная лимфома 9680/3
- Лимфоматоидный гранулематоз 9766/1
- Внутрисосудистая крупноклеточная В-клеточная лимфома 9712/3
- Легочный гистиоцитоз из клеток Лангерганса 9751/1
- Болезнь Эрдхейма-Честера 9750/1
Опухоли эктопического происхождения
- Опухоли зародышевых клеток
- Тератома, зрелая 9080/0
- Тератома незрелая 9080/1
- Внутрилегочная тимома 8580/3
- Меланома 8720/3
- Менингиома, NOS 9530/0
Метастатические опухоли
- ICD-O note : поведение кодируется: / 0 для доброкачественных опухолей; / 1 для неопределенного, пограничного или неопределенного поведения; / 2 для карциномы in situ и интраэпителиальной неоплазии III степени; и / 3 для злокачественных опухолей
Основные обновления
- Концептуальные изменения (J Thorac Oncol 2015; 10: 1243)
- Использование иммуногистохимии во всей классификации
- Новый акцент на генетических исследованиях, в частности, на интеграции молекулярного тестирования, чтобы помочь персонализировать стратегии лечения пациентов с прогрессирующим раком легких.
- Новая классификация для малых биопсий и цитологии, аналогичная предложенной в классификации 2011 IASLC / ATS / ERS
- Изменения в терминологии и диагностических критериях (J Thorac Oncol 2015; 10: 1243)
- Пересмотренная классификация аденокарциномы легкого
- Ограничена диагностика крупноклеточной карциномы только резецированными опухолями, не имеющими четкой морфологической или иммуногистохимической дифференциации, с переклассификацией оставшихся бывших подтипов крупноклеточной карциномы в разные категории
- Плоскоклеточный рак переклассифицирован на ороговевающий, некератинизирующий и базалоидный подтипы с некератинизирующими опухолями, требующими иммуногистохимического доказательства плоскоклеточной дифференцировки
- Нейроэндокринные опухоли, объединенные в одну категорию
- Добавлен карцинома NUT
- Термин склерозирующая гемангиома изменен на склерозирующую пневмоцитому.
- Изменено название гамартома на легочную гамартому.
- Создана группа PEComatous опухолей, которые включают (a) лимфангиолейомиоматоз, (b) PEComa, доброкачественную (со светлоклеточной опухолью в качестве варианта) и (c) PEComa, злокачественную
- Представлен субъект миксоидной саркомы легких с транслокацией EWSR1-CREB1
- Добавлены сущности миоэпителиома и миоэпителиальная карцинома, которые могут обнаруживать перестройки гена EWSR1
- Признание полезности слияния WWTR1-CAMTA1 в диагностике эпителиоидных гемангиоэндотелиом
- Добавлена болезнь Эрдхейма-Честера к лимфопролиферативной опухоли и
группа опухолей эктопического происхождения, включающая опухоли зародышевых клеток, внутрилегочную тимому, меланому и менингиому
Вопрос в стиле обзора Правления № 1
- Какой новый объект был добавлен в классификацию опухолей легких ВОЗ 2015 года?
- Аденосквамозная карцинома
- MALT лимфома
- ОРЕХОВАЯ карцинома
- Склерозирующая гемангиома
- Гиалинизирующая гранулема
Стиль проверки совета директоров, ответ № 1
C .ОРЕХОВАЯ карцинома. Срединная карцинома NUT — это недавно признанная высокоагрессивная опухоль, определяемая слиянием NUT. Поскольку он встречается исключительно редко в легких, он был включен в классификацию опухолей легких ВОЗ 2015 года. Аденосквамозная карцинома и лимфома MALT входят в классификацию ВОЗ, но не являются новыми образованиями в издании 2015 года. Склерозирующая гемангиома — устаревший термин; эта опухоль недавно была переименована в склерозирующую пневмоцитому. Гиалинизирующая гранулема — это воспалительное поражение, а не опухоль.
Комментарий здесь
Ссылка: Легкое — классификация ВОЗ
Вопрос стиля проверки совета директоров № 2
- Как называется аденокарцинома с таким типом роста в соответствии с классификацией опухолей легких ВОЗ 2015 г.?
- Ацинар
- Бронхиолоальвеолярный
- лепидовый
- Микропапиллярный
- Папиллярный
Ответ # 2 в стиле проверки совета директоров
C .Лепидовый. Лепидная аденокарцинома состоит из неопластических клеток, растущих вдоль поверхности альвеолярных стенок (лепидный рисунок) без архитектурных нарушений и лимфоваскулярной / плевральной инвазии. Ранее она была известна как бронхиолоальвеолярная карцинома (устаревший термин).
Комментарий здесь
Ссылка: Легкое — классификация ВОЗ
Вернуться наверх
Типы мелкоклеточного и немелкоклеточного рака легкого
Какие типы рака легкого?
Рак легких в целом подразделяется на два типа: мелкоклеточный рак легкого (SCLC) и немелкоклеточный рак легкого (NSCLC).Эта классификация основана на микроскопическом виде опухолевых клеток. Эти два типа рака растут, распространяются и лечатся по-разному, поэтому важно проводить различие между этими двумя типами.
SCLC составляет около 10-15% случаев рака легких. Этот тип рака легких является наиболее агрессивным и быстрорастущим из всех. SCLC сильно связан с курением сигарет. SCLC быстро метастазируют во многие участки тела и чаще всего обнаруживаются после того, как они широко распространились.
NSCLC — наиболее распространенный рак легких, на который приходится около 85% всех случаев. НМРЛ имеет три основных типа, определяемых типом клеток, обнаруженных в опухоли. Это:
- Аденокарциномы являются наиболее распространенным типом НМРЛ в США и составляют до 40% случаев рака легких. Хотя аденокарциномы связаны с курением, как и другие виды рака легких, этот тип также наблюдается у некурящих, особенно у женщин, у которых развивается рак легких. Большинство аденокарцином возникает во внешних или периферических областях легких.Они также имеют тенденцию распространяться на лимфатические узлы и за их пределы. Аденокарцинома in situ (ранее называвшаяся бронхиолоальвеолярной карциномой) — это подтип аденокарциномы, который часто развивается в нескольких местах в легких и распространяется вдоль уже существующих альвеолярных стенок. На рентгеновском снимке грудной клетки это также может выглядеть как пневмония. Это становится все более частым и чаще встречается у женщин. У людей с этим типом рака легких прогноз лучше, чем у людей с другими типами рака легких.
- Плоскоклеточные карциномы ранее встречались чаще, чем аденокарциномы; сегодня на них приходится от 25% до 30% всех случаев рака легких.Плоскоклеточный рак чаще всего возникает в центральной области грудной клетки в бронхах. Этот тип рака легких чаще всего остается в легких, распространяется на лимфатические узлы и становится довольно большим, образуя полость.
- Крупноклеточные карциномы , иногда называемые недифференцированными карциномами, являются наименее распространенным типом НМРЛ, составляя 10-15% всех случаев рака легких. Этот тип рака имеет высокую тенденцию распространяться на лимфатические узлы и удаленные участки.
Другие виды рака могут возникать в легких; эти типы гораздо реже, чем NSCLC и SCLC, и вместе составляют лишь 5-10% случаев рака легких:
- Бронхиальные карциноиды составляют до 5% случаев рака легких.Эти опухоли обычно имеют небольшой размер (3–4 см или меньше) на момент диагностики и чаще всего возникают у лиц моложе 40 лет. Карциноидные опухоли, не связанные с курением, могут метастазировать, и небольшая часть этих опухолей выделяет гормоноподобные вещества. Карциноиды обычно растут и распространяются медленнее, чем бронхогенный рак, и многие из них обнаруживаются достаточно рано, чтобы их можно было удалить хирургическим путем.
- Рак поддерживающей легочной ткани, такой как гладкие мышцы, кровеносные сосуды или клетки, участвующие в иммунном ответе, в легких встречаются редко.
Как обсуждалось ранее, метастатический рак из других первичных опухолей в организме часто обнаруживается в легких. Опухоли из любой части тела могут распространяться в легкие через кровоток, через лимфатическую систему или непосредственно из близлежащих органов. Метастатические опухоли чаще всего множественные, разбросаны по всему легкому и сконцентрированы во внешних областях, а не в центральных областях органа.
Что такое рак легких? | Типы рака легких
Рак легких — это тип рака, который начинается в легких.Рак начинается, когда клетки тела начинают бесконтрольно расти. Чтобы узнать больше о том, как возникает и распространяется рак, см. Что такое рак?
Нормальное строение и функция легких
Ваши легкие — это два губчатых органа в груди. Правое легкое состоит из 3 частей, которые называются долей . У вашего левого легкого 2 доли. Левое легкое меньше, потому что сердце занимает больше места на этой стороне тела.
Когда вы вдыхаете, воздух входит через рот или нос и попадает в легкие через трахею (дыхательное горло).Трахея делится на трубки, называемые , бронхи и , которые входят в легкие и делятся на более мелкие бронхи. Они делятся на более мелкие ветви, называемые бронхиолами . В конце бронхиол находятся крошечные воздушные мешочки, известные как альвеол .
Альвеолы поглощают кислород в вашу кровь из вдыхаемого воздуха и удаляют углекислый газ из крови при выдохе. Поглощение кислорода и избавление от углекислого газа — основные функции ваших легких.
Рак легких обычно начинается в клетках, выстилающих бронхи и части легких, такие как бронхиолы или альвеолы.
Тонкий слой подкладки, называемый плеврой, окружает легкие. Плевра защищает ваши легкие и помогает им скользить вперед и назад по грудной стенке, поскольку они расширяются и сжимаются во время дыхания.
Под легкими тонкая куполообразная мышца, называемая диафрагмой , отделяет грудную клетку от брюшной полости. Когда вы дышите, диафрагма движется вверх и вниз, заставляя воздух входить и выходить из легких.
Типы рака легких
Существует 2 основных типа рака легких, и их лечат по-разному.
Немелкоклеточный рак легкого (НМРЛ)
Около 80–85% случаев рака легких являются НМРЛ. Основными подтипами НМРЛ являются аденокарцинома, плоскоклеточный рак и крупноклеточный рак. Эти подтипы, которые начинаются с разных типов клеток легких, объединены в группу НМРЛ, поскольку их лечение и прогнозы (прогнозы) часто схожи.
Аденокарцинома: Аденокарциномы возникают в клетках, которые обычно выделяют такие вещества, как слизь.
Этот тип рака легких встречается в основном у людей, которые в настоящее время курят или ранее курили, но он также является наиболее распространенным типом рака легких, наблюдаемым у людей, которые не курят. Он чаще встречается у женщин, чем у мужчин, и чаще встречается у молодых людей, чем другие типы рака легких.
Аденокарцинома обычно обнаруживается во внешних частях легкого и с большей вероятностью будет обнаружена до того, как она распространилась.
Люди с типом аденокарциномы, называемым аденокарциномой in situ (ранее называвшейся бронхиолоальвеолярной карциномой ), как правило, имеют лучший прогноз, чем люди с другими типами рака легких.
Плоскоклеточный рак: Плоскоклеточный рак начинается в плоскоклеточных клетках, которые представляют собой плоские клетки, выстилающие внутреннюю часть дыхательных путей в легких. Они часто связаны с курением в анамнезе и, как правило, обнаруживаются в центральной части легких, рядом с главными дыхательными путями (бронхами).
Крупноклеточная (недифференцированная) карцинома: Крупноклеточная карцинома может появиться в любой части легкого. Он имеет тенденцию быстро расти и распространяться, что затрудняет лечение.Подтип крупноклеточной карциномы, известный как крупноклеточная нейроэндокринная карцинома , представляет собой быстрорастущий рак, очень похожий на мелкоклеточный рак легкого.
Другие подтипы: Несколько других подтипов НМРЛ, такие как аденосквамозная карцинома и саркоматоидная карцинома, встречаются гораздо реже.
Мелкоклеточный рак легкого (МРЛ)
Приблизительно от 10% до 15% всех случаев рака легких приходится на SCLC, и его иногда называют раком овсяных клеток .
Этот тип рака легких имеет тенденцию расти и распространяться быстрее, чем НМРЛ. Около 70% людей с МРЛ будут иметь рак, который уже распространился на момент постановки диагноза.
Поскольку этот рак быстро растет, он хорошо поддается химиотерапии и лучевой терапии. К сожалению, для большинства людей в какой-то момент рак вернется.
Другие виды опухолей легких
Наряду с основными видами рака легких в легких могут возникать и другие опухоли.
Карциноидные опухоли легких: Карциноидные опухоли легких составляют менее 5% опухолей легких. Большинство из них растут медленно. Для получения дополнительной информации об этих опухолях см. Карциноидная опухоль легких.
Другие опухоли легких: Другие типы рака легких, такие как аденоидно-кистозные карциномы, лимфомы и саркомы, а также доброкачественные опухоли легких, такие как гамартомы, встречаются редко. Они лечатся иначе, чем более распространенные виды рака легких, и здесь не обсуждаются.
Рак, который распространяется на легкие: Рак, который начинается в других органах (например, в груди, поджелудочной железе, почках или коже), иногда может распространяться (метастазировать) в легкие, но это не рак легких. Например, рак, который начинается в груди и распространяется на легкие, по-прежнему является раком груди, а не раком легких. Лечение метастатического рака в легкие зависит от того, где он начался (первичный очаг рака).
типов рака легкого: общие, редкие и другие разновидности
Немелкоклеточный рак легкого
Немелкоклеточный рак легкого — наиболее распространенный тип рака легкого.На него приходится почти девять из каждых 10 случаев, и он обычно растет медленнее, чем SCLC. Чаще всего он развивается медленно и вызывает незначительные симптомы или не вызывает их вовсе, пока не разовьется.
Существует три основных типа немелкоклеточного рака легкого:
Аденокарцинома легкого: Аденокарцинома легкого — наиболее распространенная форма рака легкого, на которую приходится 30 процентов всех случаев в целом и около 40 процентов всех случаев немелкоклеточного рака легкого. Аденокарциномы обнаруживаются при нескольких распространенных формах рака, включая рак груди, простаты и колоректальный рак.Аденокарциномы легких обнаруживаются во внешней области легких, в железах, которые выделяют слизь и помогают нам дышать. Симптомы включают кашель, охриплость голоса, потерю веса и слабость.
Аденокарциномы образуются в клетках, которые обычно производят слизь, и диагностируются в основном у нынешних и бывших курильщиков.
Другие ключевые факты об аденокарциноме включают:
- Это самый распространенный вид рака среди людей, которые никогда не курили.
- Это наиболее распространенная форма рака легких среди молодежи.
- Женщины более склонны к развитию этого рака, чем мужчины.
- Врачи часто обнаруживают аденокарциному еще до того, как она распространится.
- Для аденокарциномы in situ (когда врачи обнаруживают аномальные клетки в железистой ткани, выстилающей легкие) прогноз часто намного лучше по сравнению с другими типами рака легких.
Подробнее об аденокарциноме легкого
Плоскоклеточный: Этот тип рака легкого обнаруживается в центре легкого, где более крупные бронхи соединяются с трахеей и легким, или в одной из основных ветвей дыхательных путей.Плоскоклеточный рак легкого является причиной около 30 процентов всех немелкоклеточных форм рака легкого и, как правило, связан с курением.
Крупноклеточная недифференцированная карцинома: Крупноклеточная недифференцированная карцинома Рак легких быстро растет и распространяется и может быть обнаружен в любом месте легких. На этот тип рака легких обычно приходится от 10 до 15 процентов всех случаев НМРЛ. Крупноклеточная недифференцированная карцинома имеет тенденцию к быстрому росту и распространению.
Другие ключевые факты о крупноклеточной недифференцированной карциноме включают:
- Этот тип рака легких может быстро разрастаться и распространяться, что затрудняет лечение.
- Другой быстрорастущий подтип, называемый крупноклеточной нейроэндокринной карциномой, имеет сходство с мелкоклеточным раком легкого.
Другие менее распространенные подтипы НМРЛ включают саркоматоидную карциному и аденосквамозную карциному.
Врачи определяют степень тяжести НМРЛ с помощью процесса определения стадии, который показывает, распространился ли рак на легкие или на другие части тела.
НМРЛ классифицируется по следующим стадиям:
- Оккультизм, или скрытый, этап
- Этап 0
- 1 этап
- 2 этап
- 3 этап
- Этап 4
Для диагностики и определения стадии НМРЛ врачи используют ряд тестов, в том числе:
Лечение немелкоклеточного рака легкого включает:
Мелкоклеточный рак легкого
Мелкоклеточный рак легких также известен как «овсяно-клеточный» рак, потому что под микроскопом клетки выглядят как овес.Он часто начинается в бронхах, затем быстро растет и распространяется на другие части тела, включая лимфатические узлы. Этот тип рака легких составляет менее 20 процентов всех случаев рака легких и обычно вызывается курением табака.
SCLC часто растет и распространяется быстрее, чем NSCLC, но обычно хорошо поддается химиотерапии и лучевой терапии. SCLC часто рецидивирует у многих людей, у которых он развивается.
Мелкоклеточный рак легкого делится на два типа, названных в честь типов клеток, обнаруженных в раке, и того, как эти клетки выглядят под микроскопом:
- Мелкоклеточная карцинома (овсяноклеточный рак)
- Комбинированный мелкоклеточный рак
Врачи могут использовать эти тесты для диагностики и определения стадии SCLC:
Мелкоклеточный рак легкого может быть очень агрессивным и требует немедленного лечения.Лечение мелкоклеточного рака легкого включает:
- Химиотерапия
- Иммунотерапия
- Лазерная терапия
- Лучевая терапия
- Хирургия
Карциноидные опухоли легких
Карциноидные опухоли легких, или карциноиды легких, представляют собой необычный тип рака легких, который, по данным ACS, обычно растет медленнее и составляет от 1 до 2 процентов всех случаев рака легких.
Обычно они образуются в клетках легких, называемых нейроэндокринными клетками.
Двумя основными подтипами карциноидных опухолей легких являются типичные карциноиды и атипичные карциноиды:
- Типичные карциноиды, которые обычно растут медленно, составляют 90 процентов случаев карциноидов легких. Они не часто распространяются через легкие и не связаны с курением. Средний возраст этого диагноза — 45 лет.
- Атипичные карциноиды растут быстрее, могут иметь больше шансов на распространение на другие органы и могут быть связаны с курением. Они встречаются реже, чем типичные карциноиды, и имеют клетки, напоминающие клетки быстрорастущей опухоли.Средний возраст для этого диагноза — 55 лет.
Иногда врачи классифицируют карциноидные опухоли легких на основе того места, где они впервые появились в легких:
- Центральные карциноиды составляют большинство случаев карциноидов легких. Эти опухоли развиваются в бронхах, которые представляют собой большие дыхательные пути около середины легких. Большинство центральных карциноидов являются типичными карциноидами.
- Периферические карциноиды развиваются в бронхиолах, которые представляют собой более мелкие дыхательные пути около внешних областей легких.Большинство периферических карциноидов также являются типичными карциноидами.
Поскольку при раке легких симптомы не всегда развиваются, рак часто дает метастазы до того, как его диагностируют. Даже если рак мог образовать опухоль в новом месте тела,
Подробнее о метастатическом раке легких
Редкие формы рака легких
Несколько типов и подтипов рака легких очень редки. В их числе:
- Аденосквамозная карцинома легкого, гибрид аденокарциномы и плоскоклеточного рака легкого
- Крупноклеточная нейроэндокринная карцинома, агрессивный подтип немелкоклеточного рака легкого
- Карцинома легких по типу слюнных желез, которая чаще всего обнаруживается в центральных дыхательных путях легких
- Карциноиды легких, редкий тип рака, часто обнаруживаемый у пациентов с раком легких моложе среднего
- Мезотелиома, редкий тип рака, который развивается в тонкой ткани, называемой мезотелием, которая выстилает легкие и брюшную полость
Опухоли средостения также редки и развиваются в средостении, которое разделяет легкие в центре грудной клетки.
Трахея (или трахея), пищевод, сердце, соединительные ткани и другие органы являются частью средостения. У взрослых большинство опухолей средостения формируются в передней части средостения и обычно относятся к одной из следующих категорий:
- Опухоли зародышевых клеток
- Злокачественные или раковые лимфомы
- Тимома
К другим чрезвычайно редким формам рака легких относятся саркоматоидная карцинома легкого и злокачественные гранулярно-клеточные опухоли легких.
Следующая тема: Что такое аденокарцинома рака легкого?
Классификация опухолей легких, принятая Всемирной организацией здравоохранения 2015 г .: влияние генетических, клинических и радиологических достижений с момента введения классификации 2004 г.
Резюме
Классификация опухолей легких, плевры, тимуса и сердца Всемирной организации здравоохранения (ВОЗ) 2015 г. был опубликован с многочисленными важными изменениями по сравнению с классификацией ВОЗ 2004 года. Наиболее значительные изменения в этом издании включают (1) использование иммуногистохимии во всей классификации, (2) новый акцент на генетических исследованиях, в частности, интеграцию молекулярного тестирования, чтобы помочь персонализировать стратегии лечения для пациентов с прогрессирующим раком легких, (3) a новая классификация для небольших биопсий и цитологии, аналогичная той, что предложена в классификации Ассоциации по изучению рака легких / Американского торакального общества / Европейского респираторного общества 2011 года, (4) совершенно другой подход к аденокарциноме легких, предложенный Ассоциацией исследований 2011 года классификации рака легких / Американского торакального общества / Европейского респираторного общества, (5) ограничение диагностики крупноклеточной карциномы только резецированными опухолями, не имеющими четкой морфологической или иммуногистохимической дифференциации, с переклассификацией оставшихся бывших подтипов крупноклеточной карциномы в разные категории, ( 6) переклассификация плоскоклеточных карцином на ороговевшие, некератинизирующие атинизирующие и базалоидные подтипы с некератинизирующими опухолями, требующие иммуногистохимического доказательства плоской дифференцировки, (7) объединение нейроэндокринных опухолей в одну категорию, (8) добавление NUT карциномы, (9) изменение термина склерозирующая гемангиома на склерозирующую пневмоцитому, ( 10) изменение названия гамартома на «легочная гамартома» (11) создание группы PEComatous опухолей, которые включают (a) лимфангиолейомиоматоз, (b) PEComa, доброкачественную (со светлоклеточной опухолью в качестве варианта) и (c) PEComa, злокачественную , (12) введение сущности миксоидной саркомы легкого с транслокацией EWSR1 – CREB1 , (13) добавление сущностей миоэпителиома и миоэпителиальная карцинома, которые могут показать перестройки гена EWSR1 , (14) признание полезности WWTR1 – слияний в диагностике эпителиоидных гемангиоэндотелиом, (15) добавление болезни Эрдхейма-Честера к лимфопролиферативной опухоли и (16) группа опухолей эктопического происхождения к включают опухоли зародышевых клеток, внутрилегочную тимому, меланому и менингиому.
Стадия рака легкого | LUNGevity Foundation
Что такое стадирование рака легких и почему это важно?
Стадия рака легкого — это способ описания того, где находится рак легкого, распространился ли он и где он распространился, а также влияет ли он на другие части тела. Варианты лечения доступны для всех стадий рака легких, и знание стадии поможет вашей медицинской бригаде:
• Узнайте, насколько далеко у вас рак легких
• Порекомендуйте те варианты лечения, которые могут быть наиболее эффективными для вас
• Оцените свой ответ на лечение
Чтобы помочь вам понять и поделиться этой информацией, вы можете запросить наши бесплатные буклеты по немелкоклеточному раку легкого I, II, III и IV стадии, в которых кратко изложена подробная информация в следующих разделах.
Когда ставят стадию рака легких?
Рак легкого может быть поставлен один или два раза. Первая стадия, которую должны пройти все пациенты, проводится при первоначальном диагнозе пациента; его следует завершить до начала лечения. Этот тип стадирования называется клиническим стадированием. Клиническая стадия основана на результатах различных тестов, более подробно обсуждаемых в разделе «Диагностика рака легких» статьи «Рак легкого 101», включая визуализационные тесты и биопсию. Клиническая стадия — это не только основа для принятия решения о плане лечения пациента, но также основа для сравнения при проверке реакции пациента на лечение.Вторая стадия, называемая патологической или хирургической, добавляет к определению стадии то, что известно о раке пациента в результате хирургического лечения. Если патологическая стадия отличается от клинической (что может быть, например, если очевидно, что рак легких распространился больше, чем первоначально предполагалось), то медицинская бригада может более точно скорректировать лечение. 1,2
Система стадирования рака легкого TNM
Описанная здесь система стадирования — это система, используемая для немелкоклеточного рака легкого (НМРЛ).включая аденокарциному легкого, плоскоклеточный рак легкого и крупноклеточный рак легкого. Классификация стадий основана на 8-м издании классификации стадий рака легкого Американского объединенного комитета по раку. 3,4,5,6,7,8
Система стадирования TNM также может использоваться для мелкоклеточного рака легкого, хотя другая система стадирования для мелкоклеточного рака легкого имеет только две стадии, ограниченная стадия Рак, который находится в легком, где он начался, и мог распространиться на область между Рак, который широко распространился по легкому, другому легкому, лимфатическим узлам на другой стороне грудной клетки или отдаленным органам, является более распространенным. 9
стадий TNM основаны на значениях, присвоенных раку легкого пациента в трех категориях — T (опухоль — аномальная масса ткани, которая возникает, когда клетки делятся больше, чем должны, или не умирают, когда должны), N (узел, лимфатический узел — округленное значение). масса лимфатической ткани, окруженной капсулой из соединительной ткани) и M (метастаз — распространение рака из первичного очага или места его возникновения в другие места тела):
T: размер первичной опухоли и наличие прилежащих структур.Первичная опухоль является исходной или первой опухолью.
N: поражены ли раком регионарные лимфатические узлы — округлая масса лимфатической ткани, окруженная капсулой из соединительной ткани, и каким образом. Лимфатические узлы — это небольшие бобовидные структуры, которые являются частью кровеносной и иммунной систем организма: региональные лимфатические узлы — это те, которые находятся в области вокруг опухоли.
M: Есть ли отдаленные метастазы. Дистанционное метастазирование — это распространение раковых клеток от места, где они впервые образовались, к отдаленным органам, таким как надпочечник — небольшая железа, вырабатывающая гормоны; он помогает контролировать частоту сердечных сокращений, артериальное давление и другие важные функции организма.Над каждой почкой, костями, мозгом или другим легким или отдаленными лимфатическими узлами находится надпочечник.
Конкретная комбинация значений TNM, присвоенная раку легких пациента, определяет его стадию.
Этапы, использующие классификации TNM, обозначаются цифрами от нуля (0) до четырех. От первого до четвертого используются римские цифры от I до IV. Чем ниже номер стадии, тем менее запущен рак и тем лучше, вероятно, будет исход; чем выше номер стадии, тем более развит рак.Этапы I-IV далее делятся на подэтапы.
Этап 0
Это заболевание называется заболеванием «in situ», что означает, что рак находится «на месте» и не распространился с того места, где он впервые развился. 4,5,6,7,8,10,11
I этап
Рак легких стадии I — это небольшие первичные опухоли, которые находятся только в одном легком. Рак легких I стадии не распространился на лимфатические узлы и не дал метастазов. Рак легкого стадии I делится на две подстадии, стадию IA и стадию IB, в основном в зависимости от размера опухоли.
Более мелкие опухоли, не более 3 сантиметров (см) в наибольшем измерении, относятся к стадии IA, тогда как опухоли немного большего размера — более 3 см, но не более 4 см в наибольшем измерении — относятся к стадии IB. Опухоли стадии IB могут прорасти, а могли и не прорасти в главный бронх или внутреннюю оболочку легкого, или вызвать коллапс или отек легкого. 4,5,6,7,8,10,11
II этап
Подобно раку легких I стадии, рак легких II стадии находится в том легком, где он возник.Рак легких стадии II не метастазирует в отдаленные части тела.
Рак легких II стадии делится на две стадии: стадия IIA и стадия IIB. 4,5,6,7,8,10,11
Опухоли стадии IIA более 4 см, но не более 5 см в наибольшем измерении и не распространились на близлежащие лимфатические узлы. Опухоли могут прорасти или не прорасти в главный бронх или во внутреннюю оболочку легкого, либо вызвали коллапс или отек легкого.
Опухоли стадии IIB:
- более 5 см, но не более 7 см в наибольшем измерении и не распространились на близлежащие лимфатические узлы.Они вросли во внешнюю оболочку легких или близлежащие участки, включая грудную стенку, диафрагмальный нерв — нерв, идущий от спинного мозга к диафрагме (тонкая мышца под легкими и сердцем, отделяющая грудную клетку от брюшной полости). Это заставляет диафрагму сокращаться и расслабляться, что помогает контролировать дыхание, или слизистую оболочку сердца, или первичные и вторичные опухоли в одной и той же доле А части органа, такой как легкое
ИЛИ
- не более 5 см в наибольшем измерении и распространились на перибронхиальные клетки, относящиеся к тканям, окружающим бронх, влияющие или являющиеся тканями, окружающими бронх, узлами и / или корнем, относящимся к воротам, на медиальной стороне каждого легкое, где главный бронх, легочные артерии, бронхиальные артерии и нервы входят в легкое, и где легочные вены, бронхиальные вены и лимфатические сосуды выходят из легкого и внутрилегочные; расположены внутри, возникают внутри или вводятся путем попадания в легкие; узлы легкого. с первичной опухолью.Они могли прорасти в главный бронх или во внутреннюю слизистую оболочку легкого или вызвали коллапс или отек легкого. 4,5,6,7,8,10,11
III этап
Рак легких стадии III распространился по грудной клетке, но не метастазировал в отдаленные части тела. Иногда его называют местно-развитым.
Рак легкого III стадии подразделяется на три стадии: стадия IIIA, стадия IIIB и стадия IIIC. 4,5,6,7,8,10,11
Опухоли стадии IIIA:
- более 7 см в наибольшем измерении и не распространились на близлежащие лимфатические узлы.Возможно, они вросли в диафрагму, тонкую мышцу под легкими и сердцем, которая отделяет грудную клетку от брюшной полости, средостение, область между легкими. Органы в этой области включают сердце и его большие кровеносные сосуды, трахею, пищевод, тимус и лимфатические узлы, но не легкие, сердце или его основные кровеносные сосуды, трахею, возвратный гортанный нерв. гортань, которая поднимается ниже ларникса, проходит под подключичной артерией с правой стороны и под дугой аорты с левой стороны и возвращается вверх в гортань, чтобы снабжать все мышцы щитовидной железы, кроме перстневидного сустава, гребень киля у основания трахеи, которая разделяет отверстия правого и левого главных бронхов, пищевода или позвоночника, или есть вторичные опухоли в том же легком, но в другой доле, чем первичная опухоль
ИЛИ
- более 5 см в наибольшем измерении и распространились на перибронхиальные узлы и / или на прикорневые и внутрилегочные узлы легкого с первичной опухолью.Опухоли прорастают во внешнюю оболочку легкого или близлежащие участки, включая грудную стенку, диафрагмальный нерв или слизистую оболочку сердца, либо в той же доле есть первичные или вторичные опухоли; и / или опухоли прорастают в диафрагму, средостение, сердце или его основные кровеносные сосуды, дыхательное горло, возвратный гортанный нерв, киль, пищевод или позвоночник, или есть вторичные опухоли в том же легком, но в другой доле, чем первичная опухоль
ИЛИ
- не более 5 см в наибольшем измерении и распространились на средостенные лимфатические узлы, включая субкаринальные, расположенные чуть ниже киля трахеи, где она разделяется на правый и левый узловые узлы главного бронха, рядом с легким с первичной опухолью.Они могли прорасти, а могли и не прорасти в главный бронх или внутреннюю оболочку легкого, или вызвали коллапс или отек легкого.
Опухоли стадии IIIB:
- более 5 см в наибольшем измерении и распространились на средостенные лимфатические узлы, которые включают субкаринальные узлы, рядом с легким с первичной опухолью. Опухоли прорастают во внешнюю оболочку легкого или близлежащие участки, включая грудную стенку, диафрагмальный нерв или слизистую оболочку сердца, либо в той же доле есть первичные или вторичные опухоли; и / или опухоли выросли в диафрагме, средостении, сердце или его основных кровеносных сосудах, дыхательном горле, возвратном гортанном нерве, киле, пищеводе или позвоночнике, или есть вторичные опухоли в том же легком, но в другой доле, чем первичная опухоль
ИЛИ
- не более 5 см в наибольшем измерении и распространились на средостенные или прикорневые узлы рядом с легким без первичной опухоли или на любые надключичные лимфатические узлы, расположенные или расположенные над ключицей или лестничной клеткой.Они могли прорасти, а могли и не прорасти в главный бронх или внутреннюю оболочку легкого, или вызвали коллапс или отек легкого.
Опухоли стадии IIIC имеют размер более 5 см в наибольшем измерении и распространились на средостенные или прикорневые узлы рядом с легким без первичной опухоли или на любые надключичные или лестничные лимфатические узлы. Опухоли выросли во внешнюю оболочку легкого или близлежащие участки, включая грудную стенку, диафрагмальный нерв или слизистую оболочку сердца, или есть первичные или вторичные опухоли в той же доле, и / или опухоли выросли в диафрагму, средостение, сердце. или его основные кровеносные сосуды, дыхательное горло, рекуррентный гортанный нерв, киль, пищевод или позвоночник, или есть вторичные опухоли в том же легком, но в другой доле, чем первичная опухоль.
IV этап
В отличие от рака легких на ранних стадиях, рак легкого на четвертой стадии метастазирует в отдаленные части тела. Опухоли могут быть любого размера и могут распространяться или не распространяться на лимфатические узлы.
Рак легкого IV стадии делится на две стадии: IVA и IVB. 4,5,6,7,8,10,11
Опухоли стадии IVA могут иметь любой размер, могут распространяться или не распространяться на какие-либо лимфатические узлы и метастазировать из одного легкого в другое легкое в слизистую оболочку легкого (и образовывать вторичные узелки) в оболочку сердца. (и образовали вторичные узелки) или в жидкость вокруг легких или сердца; и / или опухоли распространяются на одно место за пределами грудной клетки (например,g., надпочечник или кости).
Опухоли стадии IVB могут иметь любой размер, могут распространяться или не распространяться на какие-либо лимфатические узлы и метастазировать во множество участков за пределами грудной клетки (например, надпочечники и кости). 4,5,6,7,8,10,11
Повторение
Рецидивирующий рак легких Рак легких, который вернулся после периода времени, в течение которого рак не мог быть обнаружен. Рак легкого может вернуться в легкое рядом с исходной опухолью, в лимфатических узлах или в отдаленном органе.это рак легких, который вернулся после лечения. Если есть рецидив, может потребоваться повторная стадия рака («повторная стадия») с использованием системы, описанной выше. 8
Обновлено 19 февраля 2021 г.
Список литературы
1. Стадия рака. Веб-сайт Американского онкологического общества. https://www.cancer.org/treatment/understanding-your-diagnosis/staging. Пересмотрено 18 июня 2020 г. Проверено 12 февраля 2021 г.
2. Стадия рака. Веб-сайт Национального института рака NIH.https://www.cancer.gov/about-cancer/diagnosis-staging/staging. Размещено 25 марта 2015 г. По состоянию на 12 февраля 2021 г.
3. Стадии немелкоклеточного рака легких. https://www.cancer.org/cancer/non-small-cell-lung-cancer/detection-diagnosis-staging/staging.html. Пересмотрено 1 октября 2019 г. Проверено 19 июля 2018 г.
4. Рак легкого — немелкоклеточный: стадии. Сайт Cancer.Net. https://www.cancer.net/Cancer-types/lung-cancer-non-small-cell/stages. Утверждено в мае 2020 г. По состоянию на 12 февраля 2021 г.
5.Деттербек Ф., Боффа Д., Ким А., Тануэ Л. Восьмое издание классификации стадий рака легких. СУНДУК 2017; 151 (1): 193-203 . https://journal.chestnet.org/article/S0012-3692(16)60780-8/fulltext . По состоянию на 12 февраля 2021 г.
6. Kay FU, Kandathil A, Batra K, et al. Изменения в стадии опухоли, узла, метастазирования рака легкого (8-е издание): обоснование, рентгенологические данные и клиническое значение. Всемирный радиологический журнал . 2017 июн 28: 9 (6): 269-279.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5491654/. По состоянию на 12 февраля 2021 г.
7. Рекомендации NCCN для пациентов®: Рак легкого: метастатический — немелкоклеточный рак легкого. Версия 5.2019. https://www.nccn.org/patients/guidelines/content/PDF/lung-metastatic-patient.pdf. Размещено 7 июня 2019 года. По состоянию на 12 февраля 2021 г. CA: Онкологический журнал для клиницистов. Том 67, Выпуск 2. Март / апрель 2017 г. Стр. 138-155. https://onlinelibrary.wiley.com/doi/10.3322/caac.21390/full. По состоянию на 12 февраля 2021 г.
9. Стадии мелкоклеточного рака легких. https://www.cancer.org/cancer/small-cell-lung-cancer/detection-diagnosis-staging/staging.html. Пересмотрено 1 октября 2019 г. Проверено 12 февраля 2021 г.
10. Деттербек, ФК. Восьмое издание TNM-классификации стадий рака легких: что это значит на главной улице? Журнал торакальной и сердечно-сосудистой хирургии.Том 155, номер 1. Январь 2018 г. https://www.jtcvs.org/article/S0022-5223(17)32136-0/pdf. По состоянию на 19 февраля 2021 г.
11. Лечение немелкоклеточного рака легких (PDQ®) — Версия для пациентов. Веб-сайт Национального института рака NIH. https://www.cancer.gov/types/lung/patient/non-small-cell-lung-treatment-pdq. Обновлено 3 декабря 2020 г. Проверено 18 февраля 2021 г.
Типы рака легких | Исследования рака, Великобритания
Тип рака легких, который у вас есть, говорит вам о типе клетки, в которой начался рак.Эта информация поможет вашему врачу решить, какое лечение вам нужно.
Рак, который начинается в легком, называется первичным раком легких. Если рак распространяется в легкие из других частей тела, это вторичный рак легких.
Существуют различные типы первичного рака легких, которые делятся на 2 основные группы:
- мелкоклеточный рак легкого (SCLC)
- немелкоклеточный рак легкого (NSCLC)
Наиболее распространенным типом является немелкоклеточный рак легкого.
Мелкоклеточный рак легкого (SCLC)
Примерно 15–20 из каждых 100 диагностированных случаев рака легкого (около 15–20%) относятся к этому типу. Обычно это вызвано курением. Эти виды рака имеют тенденцию распространяться довольно рано.
Мелкоклеточный рак легкого также относится к нейроэндокринным опухолям. Нейроэндокринные опухоли (НЭО) — это редкие опухоли, которые развиваются в клетках нейроэндокринной системы. При мелкоклеточном раке легкого опухоль начинается в нейроэндокринных клетках легкого.
Немелкоклеточный рак легкого (НМРЛ)
Около 80–85 из 100 случаев рака легких (около 80–85%) в Великобритании относятся к немелкоклеточному раку легкого (НМРЛ).Три основных типа — аденокарцинома, плоскоклеточный рак и крупноклеточный рак.
Они сгруппированы вместе, потому что ведут себя одинаково и одинаково реагируют на лечение.
Аденокарцинома
Это наиболее распространенный тип, он начинается в слизи, вырабатывающей клетки желез в слизистой оболочке дыхательных путей.
Плоскоклеточный рак
Этот тип развивается в плоских клетках, покрывающих поверхность дыхательных путей. Он имеет тенденцию расти около центра легкого.
Крупноклеточный рак
Раковые клетки под микроскопом кажутся большими и круглыми.
Другие виды немелкоклеточного рака
Если ваши раковые клетки под микроскопом выглядят очень неразвитыми, ваш врач не сможет определить, какой у вас тип рака. Есть и другие тесты, которые команда может провести, чтобы получить больше информации из образца.
Другие виды рака легких
В легких встречаются и другие типы опухолей.Они встречаются гораздо реже. Примеры:
- опухоли типа слюнных желез
- саркома легкого
- лимфома легкого
Лечение для них отличается от лечения SCLC и NSCLC.
Рак в верхней части легкого называется опухолью Панкоста.
Мезотелиома — это редкий тип рака, который начинается в покрове легкого (плевре).
Некоторые виды рака могут распространяться в легкие. Это называется вторичным раком легких.
.

