Противогрибковые препараты широкого спектра действия: применение и эффективность
Антимикотики — огромный класс лекарственных средств, которые обладают активностью в отношении грибов, характеризующихся патогенными свойствами.
Как и любые лекарства, они могут быть получены из природных компонентов, так и искусственно синтезированы.
Также противогрибковые препараты подразделяются на группы в соответствии с химической структурой, спектром активности (широкий или узкий), и по клиническому применению.
К сожалению, в настоящее время возрастает потребность в таких препаратах. Это связано с бесконтрольным приемом антибиотиков в первую очередь. Зачастую, применение таких препаратов должно быть под контролем и только по назначению врача.
Иногда пациент сам назначает себе лечение, предпринимая неоправданные меры.
Это приводит к нарушению нормального баланса микрофлоры, увеличению числа патогенных микроорганизмов, к тому же, условно-патогенные бактерии и грибы меняют свойства в патогенную сторону.
Необходимость противогрибковых препаратов
Также увеличивается количество людей, страдающих от сниженного иммунитета. Они теряют естественную защиту организма и становятся подвержены различным заболеваниям, в том числе и грибковым.
Перед тем, как описать существующие на рынке противогрибковые препараты в таблетках, нужно сказать, что курс лечения ними нельзя прерывать. Также ни в коем случае нельзя самостоятельно менять дозировку и пропускать прием лекарства.
Полиены
Они причисляются к противогрибковым препаратам с широким спектром действия. К этой группе принадлежат:
Названные активные вещества активны в борьбе с грибками рода Candida, а натамицин также уничтожает и простейших.
Но, несмотря на широкий спектр, область применения полиенов ограничивается грибковыми поражениями пищеварительной системы, кожи и слизистых оболочек.
Нистатин, пожалуй, самый известный препарат из группы полиенов. Его эффективность в лечении заболеваний, вызванных грибами Candida. Нужно сказать, что в настоящее время он почти не применяется.
Нужно сказать, что в настоящее время он почти не применяется.
Несомненными достоинствами можно считать невысокую цену и эффективность в лечении кандидоза. Но высока вероятность развития побочных реакций, в виде аллергии, диспепсических явлений (тошнота, рвота, диарея).
Можно обратить внимание на препарат Нистатин украинского производства.
Натамицин, известный под торговым названием «Пимафуцин» обладает широким спектром действия. Доказана его эффективность в отношении целого ряда плесневых, дрожжевых видов грибов.
Эти противогрибковые таблетки широкого спектра действия не оказывают генерализованного, системного воздействия на организм.
Их назначают при грибковых поражениях (кандидоз) пищеварительной системы, слизистых оболочек, острый кандидоз у людей с ослабленным иммунитетом.
Также, препарат назначается в качестве профилактического средства после курса антибиотиков и кортикостероидов. Побочные эффекты также выражаются в виде аллергических реакций и нарушений пищеварения.
Азолы
Антимикотические препараты этой группы обладают высокой эффективностью в отношении грибковых заболеваний, поражающих волосистую часть головы, кожу и ногти. Также, они помогают бороться с кандидозом слизистых оболочек, в частности, влагалища.
Наиболее известным средством является флуконазол, выпускаемый под торговыми названиями Флюкостат или Дифлюкан. Это высокоспецифичные антигрибковые средства, действующие в отношении ферментов грибов, что нарушает их рост и репликацию.
Показания к применению флуконазола довольно широки:
- Генерализованный кандидоз. Включает поражения органов дыхания, мочеполовой системы, глаз и органов брюшной полости.
- Системное поражение, вызванное грибами рода Cryptococcus.
- Кандидоз слизистых оболочек, в том числе и половых органов.
- Грибок, поражающий стопу и кожу, ногти.
- Отрубевидный лишай.
Противогрибковые препараты: группы эффективных средств
Поражение ногтей грибком считается одним из распространенных заболеваний, и его лечение требует применения различных медикаментозных препаратов. Сформировать иммунитет к такой болезни просто невозможно, и основным профилактическим методом считается поддержание личной гигиены. Для борьбы с патологией созданы различные противогрибковые препараты в форме мазей, таблеток, кремов, лаков и спреев.
Сформировать иммунитет к такой болезни просто невозможно, и основным профилактическим методом считается поддержание личной гигиены. Для борьбы с патологией созданы различные противогрибковые препараты в форме мазей, таблеток, кремов, лаков и спреев.
При отсутствии положительного эффекта после локального лечения пораженных участков кожи подбирается терапия пероральными и системными медикаментами. Применение новейших антигрибковых средств позволяет не только справиться с болезнью, но и предупредить ее появление в будущем.
Первые признаки атаки микоза
Своевременная диагностика позволяет как можно раньше начать терапию микоза и подобрать противогрибковое средство. Выделяют особенные признаки микоза, которые могут свидетельствовать о болезни:
- огрубение кожных покровов на ногах;
- появление трещин в области пяток;
- окрашивание эпителия в красный цвет;
- утолщение пластины ногтя;
- сильное отслоение эпидермиса;
- образование пятен желтого цвета либо полос на ногтях;
- сильный зуд и жжение.

При заболевании отмечается расслоение ногтя, изменения границ его края и частичное разрушение пластины.
Медикаментозное лечение грибка
Противогрибковые средства, которые применяются для терапии микоза, получили название антимикотики. Под таким термином объединяют разные виды медикаментов против грибка, которые характеризуются высокой эффективностью в лечении. Некоторые виды средств для наружного удаления грибка получают лишь в химических лабораториях, а другие – добывают из природных соединений. Все медикаментозные средства для лечения поражений грибком классифицируют на следующие группы с учетом:
- фармакологического состава;
- особенностей воздействия лекарства на отдельные штаммы грибов.
Все противогрибковые препараты в форме таблеток имеют определенные противопоказания к своему применению и могут провоцировать побочные реакции. С учетом такой их особенности назначать их может только врач-дерматолог. Кроме этого, именно специалист определяет дозировку противогрибковых препаратов широкого спектра действия в таблетках и продолжительность их применения.
В том случае, если пациенту назначается прием препаратов внутрь, то необходимо обязательно соблюдать продолжительность приема и определенную периодичность. Это обозначает, что использовать для лечения средство нужно в одно и то же время, избегая пропусков и ни в коем случае не удваивая дозу. Дело в том, что нарушение последовательности лечения либо его преждевременное завершение может вызывать повторное развитие грибка ног и ногтей. Подобрать наиболее эффективное средство от грибка может только специалист.
Как действуют таблетки от грибков
Эффективность медикаментов с противогрибковым эффектом, выпускаемых в таблетированной форме, основано на их фунгицидных особенностях. Это обозначает, что противогрибковые таблетки ускоряют устранение спор микоза и тормозят дальнейшее размножение патогенной микрофлоры.
При приеме внутрь противомикозное средство за короткое время проникает в кровь и активно воздействует на споры. В организме человека действующий компонент пребывает в активном состоянии в течение продолжительного времени, после чего естественным путем выводится наружу. Существуют различные группы медикаментов, которые отличаются между собой по фармакологическим особенностям. При лечении грибковых поражений могут применяться следующие препараты:
Существуют различные группы медикаментов, которые отличаются между собой по фармакологическим особенностям. При лечении грибковых поражений могут применяться следующие препараты:
- Антибиотические противогрибковые препараты в таблетированной форме, в которых главным компонентом служит кетоконазол. С их помощью удается затормозить формирование мембраны возбудителя на клеточном уровне.
- Препараты от микоза с тербинафином и итраконазолом. Такие средства нарушают производство эргостерола и тем самым препятствуют размножению патогенных клеток.
- Медикаменты с содержанием флуконазола. С их помощью удается уничтожить клетки возбудителя, и не допустить формирования новых.
- Таблетки с гризеофульвином для внутреннего применения помогают избежать деления спор и дальнейшего прогрессирования болезни.
Типология эффективных средств от грибка
Все поражения кожных покровов специалисты подразделяют на следующие группы:
- наружные грибковые заболевания, поражающие волосяной покров, эпителий и ногти;
- внутренние либо скрытые микозы, атакующие внутренние органы.

При лечении патологий грибковой этиологии обычно применяются:
- местное антибактериальное противогрибковое средство;
- противогрибковые средства с широким спектром действия, предназначенные для уничтожения грибка.
Перед назначением противогрибковой терапии предварительно обязательно проводятся клинические исследования, по результатам которого подбирается наиболее эффективное средство против того или иного штамма микоза. В лечении особенно эффективен гризеофульвин, помогающий быстро уничтожить споры грибка.
Группы эффективных противогрибковых препаратов
Противогрибковые таблетки разделяются с учетом их химической структуры, спектра действия и клинического предназначения. Все современные противогрибковые препараты для приема человеком внутрь условно разделяют на несколько групп со следующими названиями:
- полиены;
- азолы;
- аллиамиды.
- пиримидины;
- эхинокандины.
Некоторые грибки быстрее, чем другие вырабатывают устойчивость к воздействию определенных противогрибковых таблеток широкого спектра действия. Именно по этой причине незавершенное лечение лекарствами может привести к тому, что в следующий раз придется назначать медикамент с иным действующим компонентом.
Именно по этой причине незавершенное лечение лекарствами может привести к тому, что в следующий раз придется назначать медикамент с иным действующим компонентом.
Важно! Препараты в таблетках и растворах необходимо применять в строгой дозировке, подобранной врачом. Продолжительность терапии определяется формой препарата и составом.
Первая группа антимикотиков полиены
Полиены – это сильные мощные противогрибковые препараты разностороннего действия, которые выпускаются в форме таблеток и мази. Преимущественно их назначают для лечения кандидоза кожи, слизистых оболочек и желудочно-кишечного тракта. Наиболее эффективными в борьбе с недугом считаются следующие препараты группы полиенов:
- Нистатин;
- Леворин;
- Пимафуцин.
Благодаря антимикотикам такой группы проводится лечение кандидоза слизистых половых органов и эпителиальной ткани, а также грибковых поражений желудка.
Вторая группа антигрибковых средств – азолы
Азолы являются современными противогрибковыми препаратами, которые используются для лечения микозов волосистого покрытия, кожи, ногтей и лишая. Некоторые медикаменты этой группы назначаются для терапии кандидозов слизистых оболочек и молочницы. Фунгицидные свойства азолов проявляются в разрушении клеток грибков, и добиться положительного эффекта удается лишь при высоких концентрациях антимикотиков
Некоторые медикаменты этой группы назначаются для терапии кандидозов слизистых оболочек и молочницы. Фунгицидные свойства азолов проявляются в разрушении клеток грибков, и добиться положительного эффекта удается лишь при высоких концентрациях антимикотиков
Такую группу препаратов считают наиболее эффективной, и ее представителями являются:
- Кетоконазол. Медикамент основан на действующем компоненте с идентичным названием. Назначается Кетоконазол для терапии дрожжеподобных микозов, дерматофитов, хронической формы кандидоза и разноцветного лишая. Применение препарата может вызывать побочные реакции, а противопоказаниями к терапии считаются любые патологии почек и печени.
- Итраконазол. такие таблетки эффективны против дрожжевых и плесневелых грибков, а также дерматофитов. Интраконазол содержится в таких препаратах, как Орунгал, Орунит, Ирунин, Итрамикол и Кандитрал.
- Флуконазол. Такой противогрибковый препарат считается одним из лучших против болезни, и помогает остановить рост микозов в организме человека.
 Лекарственное средство назначается для терапии кандидамикозов, дерматофитии и глубоких микозов. В качестве действующего компонента флуконазол содержится в таких препаратах, как Дифлазон, Микофлюкан, Дифлюкан, Флюкостат и Фунголон.
Лекарственное средство назначается для терапии кандидамикозов, дерматофитии и глубоких микозов. В качестве действующего компонента флуконазол содержится в таких препаратах, как Дифлазон, Микофлюкан, Дифлюкан, Флюкостат и Фунголон.
Третья группа – аллиамиды
Противогрибковые средства группы аллиамидов эффективны при терапии дерматомикозов – грибковых поражений кожи, ногтей и волос.
Наиболее распространенным медикаментом такой группы считается Тербинафин, который обладает фунгистатическим и фунгицидным действием. Лекарство помогает при борьбе с дерматофитией, кандидозом, хромомикозом и глубокими микозами.
Противогрибковым препаратом, в котором содержится действующее вещество нафтифин, является крем и раствор Экзодерил. Такое средство применяется для терапии ногтей и кожных покровов, и воспаленный участок кожи смазывается 1 раз в сутки.
Препарат для тяжелых форм микоза
Для лечения осложненных микозных форм может назначаться такой противогрибковый препарат широкого спектра действия в таблетках, как Гризеофульвин. Его используют для устранения микроспорий волос, эпителия и ногтей, а также для борьбы с трихофитией, дерматомикозами и эпидермофитией. Противопоказанием к лечению таким микотическим препаратом является детский возраст до 2 лет, онкологические патологии, беременность и период грудного вскармливания. Могут появляться побочные реакции в работе пищеварительной и нервной системы, а также возможна аллергия.
Его используют для устранения микроспорий волос, эпителия и ногтей, а также для борьбы с трихофитией, дерматомикозами и эпидермофитией. Противопоказанием к лечению таким микотическим препаратом является детский возраст до 2 лет, онкологические патологии, беременность и период грудного вскармливания. Могут появляться побочные реакции в работе пищеварительной и нервной системы, а также возможна аллергия.
Препараты для наружного удаления грибка
Для лечения грибка эпителия могут назначаться следующие фунгицидные противогрибковые препараты системного действия:
- Лотридерм;
- Тридерм;
- Сикортен;
- Синалар;
- Травокорт.
Эффективным лекарственным средством считаются лечебные лаки Лоцерил и Батрафен, которые следует наносить на пораженную ногтевую пластину. Они быстро проникают в ноготь человека, эффективно борются с заболеванием и образуют защитную пленку на его поверхности. Для местной терапии микоза рекомендуется применять такие антимикозные шампуни, как Микозорал, Циновит и Себипрокс.
Полностью избавиться от грибка удается лишь с помощью комплексного лечения, подобранного врачом. Оно предполагает прием пероральных лекарственных препаратов, повышение иммунитета организма и местную обработку поврежденных участков эпителия.
Противогрибковые антибиотики широкого спектра действия
Виды противогрибковых препаратов
По действующей химической группе, фармакологической активности в классификации противогрибковых препаратов выделяют полиеновые и неполиеновые антибиотики, азолы, группы аллиламинов, пиримидинов, эхинокандинов.
Противогрибковые антибиотики
Обладают системным действием и часто назначаются при лечении микозов препараты амфотерицин В, гризеофульвин, микогептин. При дерматомикозах используются противогрибковые антибиотики гризеофульвин, амфоглюкамин, нистатин.
Их все чаще заменяют противогрибковыми средствами Ламизил, Орунгал. При лечении кандидозов предпочтение отдают антимикотикам флуконазол, кетоконазол, леворин, нистатин, миконазол.
Против дерматофитов используют Оксиконазол, Гризеофульвин, Толциклат, Толнафтат. Препаратами выбора служат Нафтифин, Натамицин, Аморолфин, Тербинафин, Батрафен, Амфотерицин В.
В современной классификации противогрибковых препаратов выделяют полиеновые и неполиеновые антибиотики.
Полиеновые антибиотики
Полиеновые противогрибковые антибиотики применяются при тяжелых формах микозов, у пациентов с ослабленным иммунитетом.
Противогрибковый антибиотик натамицин относится к группе макролидов, отличается широким спектром действия, наибольшую активность проявляет по отношению к дрожжеподобным грибкам. Фунгицидное действие натамицина проявляется в разрушении мембран грибов, что вызывает их гибель.
Противогрибковые свечи широкого спектра действия Натамицин, Пифамуцин, Примафунгин, Экофуцин с натамицином в качестве активного вещества используются при лечении молочницы, кожных кандидозов.
Пифамуцин активен по отношению к плесневым грибам аспергиллус, пенициллинам, дрожжеподобным кандида, цефалоспоринам, фузариум.
Препарат Пифамуцин выпускают в виде таблеток, крема, вагинальных свеч, средство относится к противогрибковым лекарствам, разрешенным при беременности и лактации.
Натамицин не эффективен против дерматофтов, псевдоаллешерии.
Амфотерицин В назначают при дерматомикозах, кандидозе внутренних органов, плесневых, глубоких микозах. Препарат выпускается в виде мазей, раствора для инъекций. Амфотерицин В является действующим веществом в Амфоглюкамине, Фунгизоне.
Противогрибковые препараты Нистатин, Леворин проявляют активность в отношении грибов кандида, применяются в комплексной терапии при длительном лечении пенициллиновыми, тетрациклиновыми антибиотиками.
Противогрибковый антибиотик микогептин по спектру действия сходен с амфотерицином В, назначается при плесневых микозах, кандидозах, глубоких микозах.
Микогептин токсичен, в таблетках не назначается при беременности и детям до 9 лет.
Неполиеновые антибиотики
Гризеофульвин – противогрибковый антибиотик, продуцируемый Penicillium nigricans. Наибольшая эффективность препарата достигается при приеме внутрь.
Гризеофульвин подавляет рост грибов дерматомицетов, является одним из основных препаратов при лечении трихофитии, микроспории кожи головы, фавуса, грибка ногтей.
Гризеофульвин содержат противогрибковые средства Грицин, Грифулин, Грифульвин, Фульцин, Фульвин, Гризефулин, Ламорил, Споростатин.
Гризеофульвин эффективен при приеме внутрь, в виде таблеток это противогрибковое средство назначают при стригущем лишае.
Противогрибковое средство гризеофульвин в виде суспензии используется для лечения детей до 3 лет. Подросткам и взрослым назначают препарат в таблетках, суточная доза вычисляется из расчета веса больного.
Гризеофульвин не используется при кандидамикозах, не назначается при беременности, лактации. Препарат обладает тератогенным эффектом, опасность для плода сохраняется в течение года после лечения гризеофульвином.
Синтетические антимикотики
Современные противогрибковые средства относятся к синтетическим препаратам, обладают широким спектром действия, используются при местном и системном лечении микозов. В группу синтетических антимикотиков входят азолы, аллиламины, пиримидины.
Азолы
Противогрибковые препараты из этой группы проявляют фунгистатическое – подавление размножения грибка, и фунгицидное действие.
Фунгицидные свойства выражаются в разрушении клеток гриба, эффект достигается лишь при высоких концентрациях антимикотиков. В группу азолов входят:
- кетоконазол, бифоназол, клотримазол, эконазол, миконазол, оксиконазол, бутоконазол, изоконазол, сертаконазол, фентиконазол – имидазолы;
- вориконазол, флуконаз
Какие таблетки от грибка обладают широким спектром действия и помогают справиться с инфекцией
Многие препараты местного назначения сначала устраняют внешние признаки заболевания, а только потом подавляют очаг инфекции. А если дело касается поражений грибком области стопы, ногтей или верхних конечностей, то с этой проблемой справиться становится еще сложнее. По-другому действуют таблетки от грибка, которые способны моментально устранить причину болезни. Поэтому такие лекарственные средства считаются результативными в фармацевтике.
А если дело касается поражений грибком области стопы, ногтей или верхних конечностей, то с этой проблемой справиться становится еще сложнее. По-другому действуют таблетки от грибка, которые способны моментально устранить причину болезни. Поэтому такие лекарственные средства считаются результативными в фармацевтике.
Принципы терапии грибковой болезни
В основе лечения грибка лежит комплексная терапия. Препараты подбираются только врачом, исходя из степени запущенности заболевания. Чтобы быстро избавиться от грибка, терапия подбирается следующим образом:
- Сначала назначаются средства местного воздействия. Это Тербинафин, Низорал, Кетоконазол, Клотримазол, Сангридок.
- Если грибок перешел в острую форму, тогда прописывают лекарственные препараты, в составе которых содержится раствор перманганата калия, глюконат кальция и резорцин.
- Когда грибковая инфекция не отступает под воздействие средств местного назначения, к лечению подключают лекарства системного действия.
 Это Тербинафин, Итраконазол, Флуконазол.
Это Тербинафин, Итраконазол, Флуконазол.
При выборе нужного медикаментозного средства врач учитывает вид возбудителя, степень поражения ногтевой пластины и противопоказания. Некоторые препараты обладают токсичностью, поэтому используются с осторожностью, особенно если пациент уже страдает хроническими заболеваниями.
Отказаться от применения лекарственных препаратов следует в том случае, если имеется индивидуальная непереносимость одного из компонентов, входящих в состав лекарства. Также, если человек страдает серьезными заболеваниями почек и печени. Нежелательно проходить такое лечение и в период беременности, грудного вскармливания, при наличии заболеваний почек и печени.
Эффективные таблетки от грибка на ногах
В зависимости от основного действующего вещества все медикаментозные средства против грибка подразделяются на группы:
- Полиены. К ним относятся: Нистатин, Пимафуцин, Леворин, Амфотерицин, Натамицин. Эти препараты оказывают широкое воздействие.
 Они быстро уничтожают патогенные микроорганизмы, обитающие не только на ногтях и коже, но и на слизистой оболочке.
Они быстро уничтожают патогенные микроорганизмы, обитающие не только на ногтях и коже, но и на слизистой оболочке. - Азолы. К этой группе относятся такие лекарственные средства, как: Флуконазол, Орунгал, Итраконазол, Кетоконазол. Состав у них синтетический, но они борются с любыми грибковыми инфекциями.
- Аллиламины. Это Нафтифин, Тербинафин, Ламизил. Препараты этой группы помогают справиться с дерматомикозами в запущенной стадии, которые поражают кожные и волосяные покровы, и ногтевые пластины.
Иногда врач может назначить противогрибковые препараты природного происхождения, такие как Гризеофульвин или Калий Йодид. Однако они обладают более узким спектром действия. Чтобы ускорить процесс выздоровления, можно использовать средства местного назначения. Хороший результат дает гель Экзолоцин.
К натуральным препаратам, способным бороться с грибковой инфекцией на ногах, можно отнести спрей Сангридок. Он устраняет шелушение, зуд и уменьшает локализацию патогенных микроорганизмов. При этом лекарство значительно ускоряет процесс регенерации пораженных участков.
При этом лекарство значительно ускоряет процесс регенерации пораженных участков.
Чтобы моментально справиться с грибком ногтей, можно попробовать таблетки Тинидазол. Уже через три часа после начала применения пациент ощутит значительное улучшение, а все дискомфортные симптомы исчезнут. Принимается Тинидазол на протяжении четырех суток.
Таблетки от грибка кожи
Чтобы вылечить грибковую инфекцию на коже тела, можно использовать следующие препараты:
- Итраконазол. Эти таблетки борются с плесневыми и Candida грибками, и с дерматофитами. Назначают это средство пациентам, у которых нет никаких проблем с печенью и почками. Длительность курса составляет семь дней, потом делается трехнедельный перерыв и если возникает необходимость, лечение снова повторяется.
- Ирунин. Такое средство подходит для лечения микоза кожи и ногтей на пальцах ноги. Состав препарата не оказывает вреда на состояние желудочного и кишечного тракта. Преимущество этих таблеток в том, что достигнутый положительный результат обладает пролонгированным воздействием.

- Тербинафин. Такие таблетки обладают системным воздействием. Они дают хороший терапевтический результат, когда речь идет о грибке кожного и волосяного покрова. Взрослому человеку необходимо принимать по одной таблетке в день. Однако у препарата имеются и свои противопоказания. Его нельзя пить тем, кто страдает псориазом, а также в период беременности и кормления грудью.
- Пимафуцин. Этот препарат используется для лечения грибковой инфекции разного вида. Принимать лекарство следует по одной таблетке четыре раза в день на протяжении семи дней. Лекарство не подходит для тех, кто страдает непереносимостью лактозы, для беременных и кормящих женщин, и страдающих сахарным диабетом пациентов.
Какими таблетками лечат грибок горла
Чтобы устранить грибок в горле, понадобится воспользоваться не только препаратами местного назначения, но и антимикотическими средствами. При этом нужно обязательно восстановить нарушенную микрофлору кишечника. Делается это благодаря приему таких антибактериальных лекарств, как Интестопан или Мексаформ.
Что касается основного лечения, то оно должно состоять из препаратов трех лекарственных групп. Это может быть Леворин, Флуконазол и Тербинафин. Если грибковое заболевание обнаружено в обостренной стадии, тогда длительность лечебного курса составляет две недели. Когда очаг инфицирования будет блокирован, дозировка лекарств уменьшается.
Для борьбы с дрожжевым грибком горла многие специалисты предпочитают использовать Флуконазол или его аналог Флюкостат. Эти препараты хорошо переносятся и редко провоцируют побочные эффекты. Дозировка определяется врачом в индивидуальном порядке. Обычно такое лекарство принимается по одной таблетке в день на протяжении 1-2 недель. Если за это время препарат не дает ожидаемого результата, специалист заменяет его аналогом.
Когда грибок успел выработать устойчивость к назначенному медикаменту, то может внутривенно вводиться Амфотерицин. При этом обязательно назначается средство местного назначения, снимающее неприятную симптоматику заболевания.
Как принимать антигрибковые таблетки
Все противогрибковые препараты назначаются только врачом. Именно специалист определяет дозировку, исходя из стадии развития заболевания и площади пораженного участка.
Внимание! Любые таблетки должны приниматься пациентом только в течение определенного курса. Продлевать лечение самостоятельно нельзя, так как это может привести к возможным осложнениям и нарушениям.
Если во время приема больной замечает отрицательные проявления, тогда об этом нужно обязательно сообщить лечащему врачу.
Плюсы и минусы противогрибковых таблеток
Таблетки, обладающие противогрибковыми свойствами, имеют свои плюсы и минусы.
Преимущества приема таблетированных препаратов
- Блокировка очага инфекции.
- Подавление любых видов грибков.
- Остановка развития внутреннего патологического процесса.
Несмотря на достоинства таблеток, у них имеются и отрицательные эффекты. Чтобы препарат начал действовать, его концентрация в организме должна накопиться до определенного уровня. Поэтому терапевтическое воздействие лекарства на организм появляется не сразу.
Чтобы препарат начал действовать, его концентрация в организме должна накопиться до определенного уровня. Поэтому терапевтическое воздействие лекарства на организм появляется не сразу.
Возможные побочные эффекты
Сильнодействующие противогрибковые препараты, которые принимаются внутрь, могут провоцировать появление побочных эффектов. Особенно большую роль играет превышение допустимой дозировки препарата при приеме или увеличение продолжительности терапевтического курса. В этом случае наблюдаются нарушения со стороны работы печени и почек, могут проявиться аллергические реакции и регулярные головные боли, подступающая тошнота, расстройство стула, выражающееся диареей. При проявлении таких симптомов прием назначенного препарата следует прекратить. Специалист в таком случае подбирает другой аналог или назначает средство местного воздействия.
Но если строго следовать инструкции и рекомендациям врача, учитывать имеющиеся противопоказания каждого лекарственного средства, тогда побочных эффектов удастся избежать. При этом грибковая инфекция будет вылечена полностью, а все ее признаки будут устранены.
При этом грибковая инфекция будет вылечена полностью, а все ее признаки будут устранены.
Противогрибковые агенты — EMCrit Project
Вы здесь: Домашняя страница / IBCC / Противогрибковые агенты
, Джош Фаркас
СОДЕРЖАНИЕ
обзор
(вернуться к содержанию)
По мере того, как мы ведем все более сложную популяцию пациентов в критическом состоянии, бремя грибковых инфекций постоянно растет. Таким образом, мы должны понимать противогрибковые препараты и чувствовать себя комфортно, начав их быстро.Консультанты по инфекционным заболеваниям часто будут работать с этими пациентами, но мы не должны звонить им в 3 часа ночи, чтобы получить указания, как начать прием эхинокандина для лечения кандидемии.
К счастью, эта задача не слишком сложная. По сути, существует пять противогрибковых агентов, которые обычно используются для лечения тяжелых больных (таблица ниже). Итраконазол и позаконазол здесь исключены из-за отсутствия внутривенных препаратов и скудных доказательств при тяжелом заболевании.
Итраконазол и позаконазол здесь исключены из-за отсутствия внутривенных препаратов и скудных доказательств при тяжелом заболевании.
флуконазол
(вернуться к содержанию)
спектр и использование
- Виды Candida: флуконазол покрывает большую часть, но не все (отсутствуют Candida glabrata и Candida krusei).
- Флуконазол может использоваться в качестве начальной терапии легкой инфекции (например, кандидозного эзофагита).
- Флуконазол не следует использовать в качестве эмпирической терапии инвазивной инфекции Candida, приобретенной в отделении интенсивной терапии. Однако флуконазол может использоваться в качестве ступенчатой терапии после эмпирического лечения эхинокандином (если виды Candida чувствительны к флуконазолу).(31617055)
- Cryptococcus neoformans: Флуконазол является препаратом выбора из-за отличного проникновения в ЦНС.
фармакология
- Биодоступность при приеме внутрь составляет 90–100% (не зависит от pH желудочного сока или пищи).

- Связывание с белками в крови: Флуконазол находится в крови только 12%. В отличие от других азолов, флуконазол циркулирует в основном в виде свободного лекарственного средства. (32000291)
- Период полураспада составляет ~ 30 часов.
- Выведение в основном происходит через почки, где он выводится в неизмененном виде.
- Проникновение
- Объем распределения ~ 0,7 л / кг.
- Хорошее проникновение в глаз и ЦНС.
- Превосходная концентрация в моче, поскольку флуконазол в основном выводится с мочой в неизмененном виде.
доза
- Кандидоз ротоглотки или пищевода: нагрузка 200 мг, а затем 100 мг в день.
- Системный кандидоз: 800 мг внутривенно, затем 400 мг внутривенно ежедневно.
- Почечная коррекция:
- СКФ 11-50 мл / мин: уменьшить дозу на 50%.
- Гемодиализ: заменить дозу после диализа.

- Нарушение функции печени: без корректировки дозы.
- Ожирение: можно рассмотреть возможность корректировки дозы в зависимости от фактической массы тела (нагрузка 12 мг / кг, затем поддерживающая доза 6 мг / кг в день). (31617055)
- Дополнительная информация: 📚 Монография Medscape по флуконазолу
мониторинг, токсичность и противопоказания
- ⚠️ Противопоказания
- Удлинение QTc.
- Активный гепатит с ухудшением функциональных проб печени (делает невозможным мониторинг функциональных проб печени).
- Тяжелое лекарственное взаимодействие с основным лекарством (см. Взаимодействия ниже).
- 🖥 Мониторинг
- Обычно выполняются функциональные пробы печени.
- Рассмотрите возможность следующего интервала QTc, если он продлен на исходном уровне.
- 🤒 Токсичность
- Флуконазол обычно хорошо переносится (даже при длительном применении).

- Может произойти повышение уровня трансаминаз. В редких случаях флуконазол может вызвать серьезное повреждение печени.
- Удлинение QTc.
- Может возникнуть тошнота, рвота или дискомфорт в животе.
- Флуконазол обычно хорошо переносится (даже при длительном применении).
- 🤺 Лекарственные взаимодействия
- Индукторы CYP (например, рифампицин, фенитоин) могут снижать уровень флуконазола.
- Флуконазол — сильный ингибитор CYP2C9 и умеренный ингибитор CYP3A4 и CYP2C19. Это может повысить уровень других лекарств (например,г., варфарин, фенитоин, циклоспорин, такролимус). Флуконазол также ингибирует уридиндифосфат-глюкуронозилтрансферазу (UGT).
- Ниже показаны некоторые наиболее распространенные взаимодействия.
- Для большей тщательности проверьте взаимодействие с помощью 🧮 средства проверки взаимодействия с лекарствами MedScape.
вориконазол
(вернуться к содержанию)
спектр и использование
- Кандида
- Вориконазол обладает противокандидозной активностью, аналогичной флуконазолу.
 (31789904)
(31789904) - Может использоваться в качестве понижающей терапии для изолятов, устойчивых к флуконазолу (например, Candida glabrata или Candida krusei).
- Вориконазол обладает противокандидозной активностью, аналогичной флуконазолу.
- Aspergillus
- Вориконазол — это первая терапия инвазивного аспергиллеза (с лучшими результатами, чем амфотерицин в одном РКИ). (12167683)
- Вориконазол не распространяется на зигомицетов (например, Mucorales spp.), Поэтому он не идеален в качестве эмпирического средства против плесени у пациентов с длительной иммуносупрессией.
- Эндемичные грибы , , включая кокцидиоидомикоз, гистоплазмоз и бластомикоз. (1
90) Хотя вориконазол традиционно не используется при этих инфекциях, он может быть полезен в отдельных случаях (например, у пациентов с поражением ЦНС или противопоказаниями к применению амфотерицина).
фармакология
- Биодоступность при приеме внутрь :
- Обычно хорошо всасывается (> 90%).

- Жирная пища может снизить абсорбцию примерно на 30%.
- Обычно хорошо всасывается (> 90%).
- Связывание с белками в крови умеренное, 58%.
- Период полураспада составляет 6 часов.
- Выведение происходит через метаболизм в печени, в основном с помощью системы CYP2C19. Медленные метаболизаторы могут накапливать более высокие уровни вориконазола (чаще встречается у пациентов азиатского или тихоокеанского происхождения).
- <2% вориконазола выводится с мочой.
- Проникновение
- Объем раздачи большой, на 4.5 л / кг.
- Хорошее проникновение в спинномозговую жидкость и глаза.
- Плохо проникает в мочу (бесполезен при грибковой инфекции мочевыводящих путей).
- Внутривенная форма вориконазола солюбилизируется с помощью циклодекстринового носителя (тот же носитель, который используется для солюбилизации ремдесивира). Циклодекстрин нефротоксичен и может накапливаться при нарушении функции почек, поэтому внутривенно вориконазол противопоказан, если СКФ <50 мл / мин.
 Однако пероральный вориконазол остается безопасным при почечной дисфункции.
Однако пероральный вориконазол остается безопасным при почечной дисфункции.
доза
- Дозирование при инвазивном аспергилле:
- IV: Нагрузка 6 мг / кг каждые 12 часов в день № 1, затем снижение до поддерживающей дозы 4 мг / кг каждые 12 часов.
- PO: Нагрузка 400 мг каждые 12 часов в день # 1, затем поддерживающая терапия 200 мг внутрь каждые 12 часов.
- Нарушение функции печени (детский класс A и B): та же ударная доза, уменьшите поддерживающую дозу на 50%. Следите за функциональными тестами печени и уровнем препарата вориконазол.
- Почечная дисфункция
- Оральное дозирование: То же
- Внутривенное дозирование: Избегайте, если СКФ <50 мл / мин; рассмотрите возможность использования перорального вориконазола вместо этого.Особенно избегайте длительного использования IV при почечной дисфункции.
- Дополнительная информация: 📚 Монография Medscape по вориконазолу
мониторинг, токсичность и противопоказания
- ⚠️ Противопоказания
- Удлинение QTc.

- Почечная недостаточность (СКФ <50 мл / мин является противопоказанием, но только для внутривенного введения).
- Активный гепатит с ухудшением функциональных проб печени (делает невозможным мониторинг функциональных проб печени).
- Тяжелое лекарственное взаимодействие с основным лекарством (см. Взаимодействия ниже).
- Удлинение QTc.
- 🖥 Мониторинг
- Обычно выполняются функциональные пробы печени. (32000291)
- Рассмотреть возможность соблюдения интервала QTc, если он продлен на исходном уровне
- При лечении инвазивных грибковых инфекций следует использовать терапевтический мониторинг лекарственных средств. Минимальные уровни можно проверить через 4 дня терапии. (22761409)
- Целевой уровень кормушки ~ 2-5.5 мг / л.
- Минимальные уровни ниже <1-2 мг / л связаны с неэффективностью лечения, поэтому рассмотрите возможность увеличения дозы.
- Минимальные уровни> 5,5 мг / дл связаны с повышенным риском делирия.

- 🤒 Токсичность
- Нарушение зрения (преходящее, связанное с инфузией, редко требует отмены вориконазола).
- Нейротоксичность может включать галлюцинации, делирий, возбуждение или миоклонус (дозозависимый, предполагает чрезмерный уровень вориконазола).
- Нарушение функционального теста печени (в основном обратимое, но возможно тяжелое повреждение печени).
- Гипогликемия
- Пневмонит
- Удлинение QTc
- Почечная недостаточность (только препарат для внутривенного введения, из-за использования носителя циклодекстрина, а не самого вориконазола).
- Может возникнуть тошнота, рвота или дискомфорт в животе.
- 🤺 Лекарственные взаимодействия
- Индукторы CYP (например, рифампицин, фенитоин) могут снижать уровень вориконазола.
- Вориконазол метаболизируется CYP2C19, поэтому ингибиторы этого фермента могут повышать уровень вориконазола.

- Вориконазол слабо ингибирует CYP2C9, CYP2C19 умеренно и CYP3A4 сильно. Это может повысить уровень других лекарств.
- Ниже показаны некоторые наиболее распространенные взаимодействия.
- Для большей тщательности проверьте взаимодействие с помощью 🧮 средства проверки взаимодействия с лекарствами MedScape.
изавуконазол
(вернуться к содержанию)
спектр и использование
- Преимущества изавуконазола перед вориконазолом:
- (1) Более широкий спектр действия, включая виды Mucorales (участвующие в мукормикозе).
- (2) Более благоприятный профиль безопасности (особенно в отношении почечной дисфункции и удлинения интервала QT). В исследовании SECURE изавуконазол не уступал вориконазолу в отношении инвазивного аспергилла или других мицелиальных грибов, однако изавуконазол лучше переносился. (26684607)
- (3) Исавуконазол вызывает меньшее количество лекарственных взаимодействий (вориконазол взаимодействует с большим количеством печеночных ферментов CYP, чем изавуконазол).
 (31102782)
(31102782)
- Применение изавуконазола включает:
- (1) Эмпирическая терапия инвазивной плесневой инфекции: изавуконазол имеет преимущество в том, что покрывает как виды Aspergillus, так и Mucorales, если возбудитель плесени неизвестен.
- (2) Возможное использование в качестве индукционной терапии эндемичных грибов? Это остается неясным, поскольку подтверждается только одноэтапным исследованием. (27169478) In vitro изовуконазол, по-видимому, имеет более благоприятный эффект для эндемичных грибов по сравнению с другими азолами, что подтверждает его потенциальную терапевтическую роль.
- (3) Исавуконазол может использоваться при инвазивном кандидозе в отдельных ситуациях. Однако одно исследование показало худшие результаты по сравнению с эхинокандинами, поэтому изавуконазол не может рассматриваться как препарат первой линии против Candida spp.(30289478)
фармакология
- Пероральная биодоступность составляет ~ 100%, что позволяет использовать пероральное дозирование попеременно с внутривенным дозированием.

- Связывание с белками составляет 98-99%. Это обеспечивает длительный период полувыведения изавуконазола, а также предотвращает выведение лекарственного средства при гемодиализе.
- Период полураспада составляет ~ 80-120 часов.
- Выведение происходит через метаболизм в печени (включая уридиндифосфатглюкуронозилтрансферазу и CYP3A4).
- <1% выводится с мочой, поэтому изавуконазол может мало использоваться для лечения инфекций мочевыводящих путей. (29725999)
- Проникновение
- Объем распределения 6.5 л / кг.
- Исавуконазол широко проникает в ткани, включая мозг и глаза. (32000291) Однако уровни CSF низкие. (29551442)
доза
- Типовая схема дозирования
- Ударная доза: 372 мг сульфата изавуконазония (a.k.a., 200 мг изавуконазония основания) перорально / в / в каждые 8 часов x6 доз в течение двух дней.

- Поддерживающая доза: 372 мг сульфата изавуконазония (также известна как 200 мг основания изавуконазония) перорально / внутривенно каждые 24 часа.
- Дозы следует вводить медленно в течение часа, чтобы избежать реакции на инфузию.
- Примечание. Само лекарство представляет собой сульфат изавуконазония, который представляет собой пролекарство , которое метаболизируется в изавуконазол (активное лекарство). 372 мг сульфата изавуконазония эквивалентно 200 мг изавуконазония основания .Это один и тот же препарат, но в разных странах к нему относятся по-разному.
- Ударная доза: 372 мг сульфата изавуконазония (a.k.a., 200 мг изавуконазония основания) перорально / в / в каждые 8 часов x6 доз в течение двух дней.
- Коррекция дозы не требуется при почечной или печеночной недостаточности (хотя это не изучалось при тяжелой печеночной дисфункции).
- Дополнительная информация: 📚 Монография Medscape по изавуконазолу
мониторинг, токсичность и противопоказания
- ⚠️ Противопоказания
- Врожденный синдром короткого интервала QT.

- Активный гепатит с ухудшением функциональных проб печени (делает невозможным мониторинг функциональных проб печени).
- Тяжелое лекарственное взаимодействие с основным лекарством (см. Взаимодействия ниже).
- Врожденный синдром короткого интервала QT.
- 🖥 Мониторинг
- Обычно выполняются функциональные пробы печени.
- 🤒 Токсичность
- Тяжелая печеночная недостаточность может возникнуть редко.
- Короткий интервал QT (!) — клинически проблема возникает редко.
- Наиболее частыми нежелательными явлениями являются тошнота, рвота и диарея.
- Гипокалиемия.
- Периферический отек.
- Инфузионные реакции (озноб, одышка и гипотония).
- 🤺 Лекарственные взаимодействия
- На уровни изавуконазола влияют лекарства, которые влияют на систему CYP3A4 (например, рифампицин снижает уровни изавуконазола на 90%, а лопинавир / ритонавир удваивает уровни изавуконазола).
 (29725999)
(29725999) - Исавуконазол влияет на уровни множества различных агентов, управляемых через многочисленные системы (например, систему CYP3A4, систему P-гликопротеина, системы транспорта органических анионов и CYP2C9).
- В таблице ниже показаны некоторые заметные лекарственные взаимодействия. На практике лучший подход — запустить электронную проверку взаимодействия лекарств (например, с помощью программы проверки взаимодействия лекарств MedScape).
- На уровни изавуконазола влияют лекарства, которые влияют на систему CYP3A4 (например, рифампицин снижает уровни изавуконазола на 90%, а лопинавир / ритонавир удваивает уровни изавуконазола).
эхинокандины (micaFUNGIN, caspoFUNGIN, anidulaFUNGIN)
(вернуться к содержанию)
спектр и использование
- Все три агента имеют одинаковый спектр и полезность. Обычно они считаются клинически взаимозаменяемыми.
- Клиническая эффективность в основном ограничена Candida и Aspergillus.
- Кандида:
- Эхинокандины охватывают почти все виды Candida. Однако некоторая устойчивость может быть обнаружена среди C.
 parapsilosis и C. guilliermondii. Среди C. glabrata (особенно штаммов, устойчивых к флуконазолу) редко можно обнаружить устойчивость.
parapsilosis и C. guilliermondii. Среди C. glabrata (особенно штаммов, устойчивых к флуконазолу) редко можно обнаружить устойчивость. - Эхинокандины обычно являются препаратом выбора для эмпирического лечения кандидемии в отделениях интенсивной терапии. Эхинокандины могут быть уникально эффективными против Candida, внедренного в биопленки (например,g., окружающие протезы), где флуконазол или амфотерицин-B могут быть менее эффективными. Эхинокандины обладают фунгицидным действием против Candida (в отличие от азолов, которые обладают фунгистатическим действием). (32722455)
- Эхинокандины охватывают почти все виды Candida. Однако некоторая устойчивость может быть обнаружена среди C.
- Aspergillus
- Эхинокандины не рекомендованы для монотерапии .
- Эхинокандины проявляют синергетическую активность в сочетании с вориконазолом. Комбинированная противогрибковая терапия обычно не рекомендуется в качестве терапии первой линии, но ее можно использовать в следующих ситуациях:
- Спасательная терапия из-за клинической неэффективности азола.

- Известная устойчивость к азолам.
- Высокие региональные показатели устойчивости к азолам.
- Обработка видов с более высоким уровнем устойчивости (например, Aspergillus calidoustus).
- Спасательная терапия из-за клинической неэффективности азола.
фармакология
- Связывание с белками:
- каспофунгин: 92-97%
- Анидулафунгин: 99%
- Микафунгин: 99,95%
- Период полураспада:
- Каспофунгин: вначале 8 часов, с конечным периодом полувыведения 27-50 часов
- Анидулафунгин: 40-50 часов
- Микафунгин: 13-20 часов
- Ликвидация
- Каспофунгин: метаболизируется путем N-ацетилирования в печени и спонтанной химической деградации (независимо от системы CYP).
- Анидулафунгин: спонтанная деградация в плазме.
- Микафунгин: метаболизм в печени системой CYP.
- Проникновение
- Объем распределения низкий (~ 0,3-0,6 л / кг) для всех.

- Минимальное проникновение в СМЖ, мочу или глаза.
- Объем распределения низкий (~ 0,3-0,6 л / кг) для всех.
доза при инвазивной инфекции
- Каспофунгин : нагрузочная доза 70 мг, затем 50 мг в день (или, возможно, 70 мг в день, если вес> 80 кг или одновременное применение сильнодействующих индукторов CYP4A4, таких как карбамазепин, фенобарбитал, фенитоин и рифампицин).(31617055)
- Анидулафунгин : ударная доза 200 мг, затем 100 мг в день.
- Микафунгин : 100-150 мг внутривенно каждые 24 часа (инвазивный кандидоз) или 150 мг внутривенно каждые 24 часа (инвазивный аспергиллез).
- Нет поправки на почечную или печеночную дисфункцию.
- Другие показания (например, кандидоз пищевода или противогрибковая профилактика) могут включать более низкие дозы.
- Дополнительная информация: 📚 Монографии Medscape по каспофунгину, анидулафунгину и микафунгину.
токсичность и противопоказания
- Эхинокандины в целом обладают относительно благоприятным профилем безопасности (обычно превосходят амфотерицин или азолы).
 (29304209)
(29304209) - ⚠️ Противопоказания
- Рекомендуется избегать при острой печеночной недостаточности с ухудшением функциональных проб печени (делает невозможным мониторинг функциональных проб печени).
- 🖥 Мониторинг
- Мониторинг функциональных проб печени (чаще с микафунгином, чем с другими).
- 🤒 Токсичность
- При быстром введении может возникнуть реакция, связанная с инфузией.
- Нарушение функционального теста печени (особенно с микафунгином)
- Гипокалиемия
- Флебит в месте инфузии
- Нейтропения регистрируется редко
- 🤺 Лекарственные взаимодействия
- Каспофунгин: метаболизм каспофунгина может быть ускорен, что приводит к снижению уровня каспофунгина за счет сильных индукторов CYP3A4 (например,g., рифампицин, карбамазепин, дексаметазон, фенитоин). Для этого может потребоваться более высокая поддерживающая доза каспофунгина (70 мг вместо 50 мг).

- Анидулафунгин практически не взаимодействует с лекарствами из-за его физиологии спонтанного разложения (без взаимодействия с какими-либо ферментами печени).
- Микафунгин имеет относительно небольшое количество лекарственных взаимодействий. Однако он может повышать уровень сиролимуса, циклоспорина, итраконазола или нифедипина.
- Проверьте взаимодействие с помощью 🧮 средства проверки взаимодействия с лекарствами MedScape.
- Каспофунгин: метаболизм каспофунгина может быть ускорен, что приводит к снижению уровня каспофунгина за счет сильных индукторов CYP3A4 (например,g., рифампицин, карбамазепин, дексаметазон, фенитоин). Для этого может потребоваться более высокая поддерживающая доза каспофунгина (70 мг вместо 50 мг).
липосомальный амфотерицин
(вернуться к содержанию)
спектр и использование
- Липосомальный амфотерицин в значительной степени заменил старые формы дезоксихолата, поскольку липосомальный амфотерицин менее токсичен, но столь же эффективен. (29304209)
- Возможное использование:
- Диморфные грибы и Cryptococcus neoformans: Традиционно первоначально используются для индукции терапии.
- Плесень: Традиционно амфотерицин использовался в качестве эмпирического средства против плесени (для покрытия видов Aspergillus или Mucorales).
 Однако изавуконазол здесь является более безопасным вариантом, если он доступен.
Однако изавуконазол здесь является более безопасным вариантом, если он доступен. - Инвазивный кандидоз: амфотерицин имел эквивалентную эффективность по сравнению с микафунгином в одном исследовании и в метаанализах, но амфотерицин вызывал более выраженные побочные эффекты. (17482982, 30257597)
- Современное применение: Амфотерицин все чаще заменяется более новыми и безопасными препаратами. Тем не менее, амфотерицин по-прежнему играет нишевую роль в ситуациях, когда нельзя использовать другие агенты, например:
- Виды Aspergillus, устойчивые к азолам.
- Пациенты с острой печеночной недостаточностью или гепатитом (азолы и эхинокандины могут вызывать нарушение функции печени). Однако обратите внимание, что пациентов со стабильным циррозом класса A-B по Чайлдсу можно лечить азолами или эхинокандинами.
- Индукционная терапия для пациентов с диморфными грибами (хотя все больше данных свидетельствует о том, что вориконазол здесь часто может быть адекватной терапией).

- Виды Candida, устойчивые к флуконазолу и эхинокандинам (редко!).
фармакология
- Связывание с белками в крови составляет 95-99%, с объемом распределения 0,05-2,2 л / кг. Амфотерицин нерастворим в воде (следовательно, требуется липосомальный препарат).
- Период полураспада составляет примерно 24 часа.
- Выведение происходит через ретикулоэндотелиальную систему. На это не влияет почечная или печеночная дисфункция.
- Проникновение
- Плохое проникновение в ЦНС или глаз.
- Низкие концентрации обнаружены в легких и почках. (32000291)
- Объем распределения 0,05-2 л / кг.
доза
- липосомальный препарат 3-5 мг / кг внутривенно каждые 24 часа
- Кандидемия без подозрения на поражение ЦНС: 3 мг / кг в день.
- Инвазивный аспергиллез: 5 мг / кг.

- Нет корректировки дозы при почечной или печеночной дисфункции.
- При патологическом ожирении рассмотрите возможность дозирования на основе идеальной массы тела (а не общей массы тела).
- Дополнительная информация: 📚 Монография Medscape о липосомальном амфотерцине.
мониторинг, токсичность и противопоказания
- ⚠️ Противопоказания
- Почечная недостаточность
- Печеночная недостаточность
- Удлинение QT
- 🖥 Мониторинг
- Следите за функцией почек и электролитами, включая кальций и магний.
- Рассмотреть возможность следующего интервала QTc, если он продлен на исходном уровне
- 🤒 Токсичность
- Инфузионные реакции — могут включать лихорадку, озноб, озноб, бронхоспазм, тошноту / рвоту, гипотензию, тахипноэ.
- Острая почечная недостаточность — дозозависимая кумулятивная общая доза.
 Обычно неолигурический и обратимый.
Обычно неолигурический и обратимый. - Почечный канальцевый ацидоз IV типа, приводящий к гипокалиемии и гипомагниемии.
- Гепатотоксичность (однако, это относительно редко, и мониторинг функциональных проб печени обычно не требуется). (29304209)
- 🤺 Лекарственные взаимодействия : На основании его выведения через ретикулоэндотелиальную систему, прямых лекарственных взаимодействий нет.Однако синергетическая токсичность может возникнуть, если амфотерицин вводится совместно с лекарствами, которые имеют следующие эффекты: (32000291)
- Гипокалиемия
- Torsade de Pointes, удлинение QT
- Нефротоксичность
- Использование зидовудина с амфотерицином может привести к синергическому токсическому воздействию на костный мозг
- Проверьте взаимодействие с помощью 🧮 средства проверки взаимодействия с лекарствами MedScape.
подкаст
(назад к содержанию)
Следуйте за нами в iTunes
вопросы и обсуждения
(вернуться к содержанию)
Чтобы эта страница оставалась небольшой и быстрой, вопросы и обсуждение этого сообщения можно найти на другой странице. здесь .
здесь .
- Амфотерицин имеет высокий уровень нефротоксичности, поэтому оставьте его для ситуаций, когда это действительно необходимо.
- Азоловые противогрибковые средства обычно хорошо переносятся, но участвуют во многих лекарственных взаимодействиях. Внимательно посмотрите на взаимодействия, прежде чем инициировать их (используйте инструмент взаимодействия лекарств, такой как 🧮 Средство проверки взаимодействия лекарств MedScape).
- Эхинокандины превосходны при кандидемии, но они не проникают в глаза. Для пациентов с поражением глаз может потребоваться альтернативное лечение.
- Для тяжелобольных пациентов с высокой вероятностью грибковой инфекции рассмотрите возможность эмпирического начала терапии до постановки окончательного диагноза. Существуют относительно нетоксичные препараты широкого спектра действия, которые можно начинать раньше, с положительным соотношением риск / польза.
Конфликт интересов: Нет
ссылки
- 12167683 Хербрехт Р.
 , Деннинг Д.В., Паттерсон Т.Ф. и др. Вориконазол по сравнению с амфотерицином B для первичной терапии инвазивного аспергиллеза. N Engl J Med . 2002; 347 (6): 408-415. DOI: 10.1056 / NEJMoa020191 [PubMed]
, Деннинг Д.В., Паттерсон Т.Ф. и др. Вориконазол по сравнению с амфотерицином B для первичной терапии инвазивного аспергиллеза. N Engl J Med . 2002; 347 (6): 408-415. DOI: 10.1056 / NEJMoa020191 [PubMed] - 17482982 Kuse ER, Chetchotisakd P, da Cunha CA, et al. Микафунгин в сравнении с липосомальным амфотерицином B при кандидемии и инвазивном кандидозе: рандомизированное двойное слепое исследование фазы III. Ланцет . 2007; 369 (9572): 1519-1527. DOI: 10.1016 / S0140-6736 (07) 60605-9 [PubMed]
- 1
90
Freifeld A, Proia L, Andes D, et al. Вориконазол применяют при эндемических грибковых инфекциях. Антимикробные агенты Chemother . 2009; 53 (4): 1648-1651. DOI: 10.1128 / AAC.01148-07 [PubMed] - 22761409 Park WB, Kim NH, Kim KH и др. Влияние терапевтического мониторинга лекарственных средств на безопасность и эффективность вориконазола при инвазивных грибковых инфекциях: рандомизированное контролируемое исследование.
 Clin Infect Dis . 2012; 55 (8): 1080-1087. DOI: 10.1093 / cid / cis599 [PubMed]
Clin Infect Dis . 2012; 55 (8): 1080-1087. DOI: 10.1093 / cid / cis599 [PubMed] - 26684607 Maertens JA, Raad II, Marr KA, et al. Сравнение исавуконазола и вориконазола для первичного лечения инвазивной плесени, вызываемой Aspergillus и другими мицелиальными грибами (SECURE): рандомизированное контролируемое исследование не меньшей эффективности, фаза 3. Ланцет . 2016; 387 (10020): 760-769. DOI: 10.1016 / S0140-6736 (15) 01159-9. [PubMed]
- 27169478 Thompson GR 3rd, Rendon A, Ribeiro Dos Santos R, et al. Исавуконазол Лечение криптококкоза и диморфных микозов. Clin Infect Dis . 2016; 63 (3): 356-362. DOI: 10.1093 / cid / ciw305 [PubMed]
- 232 Wilby KJ. Обзор клинической фармакокинетики и фармакодинамики исавуконазола. Eur J Drug Metab Pharmacokinet .2018; 43 (3): 281-290. DOI: 10.1007 / s13318-017-0445-7 [PubMed]
- 29304209 Мурад А, Perfect JR.
 Профиль переносимости действующего арсенала противогрибковых препаратов. J Antimicrob Chemother . 2018; 73 (Suppl_1): i26-i32. DOI: 10.1093 / jac / dkx446 [PubMed]
Профиль переносимости действующего арсенала противогрибковых препаратов. J Antimicrob Chemother . 2018; 73 (Suppl_1): i26-i32. DOI: 10.1093 / jac / dkx446 [PubMed] - 29534853 Denis J, Ledoux MP, Nivoix Y, Herbrecht R. Isavuconazole: новый азол широкого спектра действия. Часть 1: Активность in vitro. Дж. Mycol Med . 2018; 28 (1): 8-14. DOI: 10.1016 / j.mycmed.2018.02.005 [PubMed]
- 29551442 Ledoux MP, Denis J, Nivoix Y, Herbrecht R.Исавуконазол: новый азол широкого спектра действия. Часть 2: фармакокинетика и клиническая активность. Дж. Mycol Med . 2018; 28 (1): 15-22. DOI: 10.1016 / j.mycmed.2018.02.002 [PubMed]
- 29725999 McCarthy MW, Moriyama B, Petraitiene R, Walsh TJ, Petraitis V. Клиническая фармакокинетика и фармакодинамика исавуконазола. Клин Фармакокинет . 2018; 57 (12): 1483-1491. DOI: 10.1007 / s40262-018-0673-2 [PubMed]
- 30257597 Keane S, Geoghegan P, Povoa P, Nseir S, Rodriguez A, Martin-Loeches I.
 Систематический обзор терапии первой линии амфотерицином B у взрослых в критическом состоянии с кандидемией или инвазивным кандидозом. Expert Rev Anti Infect Ther . 2018; 16 (11): 839-847. DOI: 10.1080 / 14787210.2018.1528872 [PubMed]
Систематический обзор терапии первой линии амфотерицином B у взрослых в критическом состоянии с кандидемией или инвазивным кандидозом. Expert Rev Anti Infect Ther . 2018; 16 (11): 839-847. DOI: 10.1080 / 14787210.2018.1528872 [PubMed] - 30289478 Куллберг Б.Дж., Висколи С., Паппас П.Г. и др. Исавуконазол по сравнению с каспофунгином в лечении кандидемии и других инвазивных кандидозных инфекций: испытание ACTIVE. Clin Infect Dis . 2019; 68 (12): 1981-1989. DOI: 10.1093 / cid / ciy827 [PubMed]
- 31102782 Koehler P, Bassetti M, Kochanek M, Shimabukuro-Vornhagen A, Cornely OA. Ведение интенсивной терапии при аспергиллезе легких, ассоциированном с гриппом [опубликованная поправка опубликована в Clin Microbiol Infect. 2020 Апрель; 26 (4): 527]. Clin Microbiol Infect . 2019; 25 (12): 1501-1509. DOI: 10.1016 / j.cmi.2019.04.031 [PubMed]
- 31617055 Шателон Дж.
 , Кортегиани А., Хаммад Э, Кассир Н., Леоне М. Выбор правильного противогрибкового средства у пациентов в отделении интенсивной терапии. Adv Ther . 2019; 36 (12): 3308-3320. DOI: 10.1007 / s12325-019-01115-0 [PubMed]
, Кортегиани А., Хаммад Э, Кассир Н., Леоне М. Выбор правильного противогрибкового средства у пациентов в отделении интенсивной терапии. Adv Ther . 2019; 36 (12): 3308-3320. DOI: 10.1007 / s12325-019-01115-0 [PubMed] - 31789904 Póvoa P, Coelho L, Nora D, Martin-Loeches I. Использование противогрибковых средств у пациентов хирургического отделения интенсивной терапии. Curr Opin Anaesthesiol . 2020; 33 (2): 131-138. DOI: 10.1097 / ACO.0000000000000813 [PubMed]
- 32000291 Nivoix Y, Ledoux MP, Herbrecht R. Противогрибковая терапия: новые и развивающиеся методы лечения. Semin Respir Crit Care Med .2020; 41 (1): 158-174. DOI: 10.1055 / s-0039-3400291 [PubMed]
- 32722455 Wall G, Lopez-Ribot JL. Современные антимикотики, новые перспективы и будущие подходы к противогрибковой терапии. Антибиотики (Базель) .
 2020; 9 (8): E445. Опубликовано 25 июля 2020 г. doi: 10.3390 / antibiotics
2020; 9 (8): E445. Опубликовано 25 июля 2020 г. doi: 10.3390 / antibiotics - 45 [PubMed]
The Internet Book of Critical Care — это онлайн-учебник, написанный Джошем Фаркасом (@PulmCrit), доцентом кафедры легочной медицины и реанимации Университета Вермонта.
Обзор антибактериальной, противовирусной и противогрибковой активности куркумина
Curcuma longa L. (семейство Zingiberaceae) и его полифенольное соединение куркумин были подвергнуты различным антимикробным исследованиям из-за широкого традиционного использования и слабых побочных эффектов. Сообщалось об антимикробной активности куркумина и экстракта корневища C. longa против различных бактерий, вирусов, грибов и паразитов. Обнадеживающие результаты антимикробной активности куркумина сделали его хорошим кандидатом для усиления ингибирующего эффекта существующих противомикробных агентов за счет синергизма.Действительно, были проведены различные исследования для увеличения антимикробной активности куркумина, включая синтез различных химических производных для повышения его растворимости в воде, а также для повышения уровня потребления куркумина клетками. Этот обзор призван обобщить предыдущие антимикробные исследования куркумина с целью его применения в будущих исследованиях в качестве естественного противомикробного агента.
Этот обзор призван обобщить предыдущие антимикробные исследования куркумина с целью его применения в будущих исследованиях в качестве естественного противомикробного агента.
1. Введение
Куркумин или диферулоилметан с химической формулой (1,7-бис (4-гидрокси-3-метоксифенил) -1,6-гептадиен-3,5-дион) (Рисунок 1) и другие куркуминоиды составляют основные фитохимические вещества Curcuma longa L.(Семейство Zingiberaceae) корневище с общим названием куркума [1]. Это полифенольное соединение, благодаря разнообразной биологической активности, привлекло значительное внимание исследователей во всем мире [2–5]. Куркума, древняя красящая специя Азии, в качестве основного источника куркумина традиционно используется для многих лечебных средств [6]. Как показано на рисунке 2, куркумин из-за множества специфических характеристик в последние годы вызывает интерес ученых. Как и во многих других растительных материалах, существуют различия в содержании куркумина для Curcuma longa из разных географических регионов, и это может быть связано с гибридизацией с другими видами Curcuma , что может быть важным фактом для выбора растения с более высоким содержанием куркумина. [4].
[4].
Корневище Curcuma longa традиционно использовалось как противомикробное средство, а также как репеллент от насекомых [7]. В нескольких исследованиях сообщалось об антимикробной активности широкого спектра куркумина, включая антибактериальное, противовирусное, противогрибковое и противомалярийное действие. Из-за расширенной антимикробной активности куркумина и его свойств безопасности даже при высоких дозах (12 г / день), оцененных в ходе клинических испытаний на людях, он был использован в качестве структурного образца для разработки новых противомикробных агентов с модифицированной и увеличенной антимикробной активностью посредством синтеза различных производных куркумина [8, 9].Его даже изучали как антимикробное средство, подходящее для текстильных материалов. Результаты показали, что куркумин в сочетании с алоэ вера и хитозаном может быть потенциальным подавителем роста микробов в хлопке, шерсти и шерсти кроликов, оцененных методом истощения [10]. Либо непрерывный, либо периодический процесс окрашивания куркумином обеспечивал ткани с антимикробными свойствами, помимо цвета. Шерсть, обработанная куркумином, обладала антимикробной активностью, менее устойчивой к воздействию света, чем домашняя стирка, с 45% и 30% степенью ингибирования против Staphylococcus aureus и Escherichia coli , соответственно, после 30 циклов домашней стирки [11].Смесь куркумина с другими антимикробными агентами используется для разработки антимикробных гелей и эмульсий для кожи с улучшенными защитными свойствами кожи и перевязочными свойствами [12]. Композиция куркумина с наночастицами гидрогеля серебра используется для усиления функции нанокомпозитов гидрогеля серебра в качестве маркированных веществ для антимикробных применений и перевязки ран [12]. Нагруженная куркумином микроэмульсия миристиновой кислоты с 0,86 мкг г / мл куркумина, подходящего для потребления через кожу, ингибирует 50% S.epidermidis рост как один из внутрибольничных инфекционных агентов.
Либо непрерывный, либо периодический процесс окрашивания куркумином обеспечивал ткани с антимикробными свойствами, помимо цвета. Шерсть, обработанная куркумином, обладала антимикробной активностью, менее устойчивой к воздействию света, чем домашняя стирка, с 45% и 30% степенью ингибирования против Staphylococcus aureus и Escherichia coli , соответственно, после 30 циклов домашней стирки [11].Смесь куркумина с другими антимикробными агентами используется для разработки антимикробных гелей и эмульсий для кожи с улучшенными защитными свойствами кожи и перевязочными свойствами [12]. Композиция куркумина с наночастицами гидрогеля серебра используется для усиления функции нанокомпозитов гидрогеля серебра в качестве маркированных веществ для антимикробных применений и перевязки ран [12]. Нагруженная куркумином микроэмульсия миристиновой кислоты с 0,86 мкг г / мл куркумина, подходящего для потребления через кожу, ингибирует 50% S.epidermidis рост как один из внутрибольничных инфекционных агентов. Он показал в 12 раз более сильный ингибирующий эффект по сравнению с активностью куркумина, растворенного в диметилсульфоксиде (ДМСО) [13].
Он показал в 12 раз более сильный ингибирующий эффект по сравнению с активностью куркумина, растворенного в диметилсульфоксиде (ДМСО) [13].
2. Антибактериальная активность
Бактериальные инфекции относятся к числу важных инфекционных заболеваний. Таким образом, более чем за 50 лет были начаты обширные исследования для создания новых противомикробных препаратов, выделенных из различных источников. Несмотря на прогресс в разработке антибактериальных средств, все еще существует особая потребность в поиске новых антибактериальных средств из-за развития бактерий с множественной лекарственной устойчивостью [14].Антибактериальное исследование водного экстракта корневища C. longa продемонстрировало значение MIC (минимальная ингибирующая концентрация) от 4 до 16 г / л и значение MBC (минимальная бактерицидная концентрация) от 16 до 32 г / л против S. epidermis ATCC 12228, Staph. aureus ATCC 25923, Klebsiella pneumoniae ATCC 10031 и E. coli ATCC 25922 [15]. Метанольный экстракт куркумы показал значения МПК 16 мк г / мл и 128 мк мкг / мл против Bacillus subtilis и Staph.aureus соответственно [16]. Исследование гексанового и этанольного экстракта куркумы и куркуминоидов (из этилацетатного экстракта куркуминоидов, выделенных из C. longa с содержанием куркумина 86,5%) против 24 патогенных бактерий, выделенных из курицы и креветок, показало наивысшую антимикробную активность этанольного экстракта с Значение MIC от 3,91 до 125 ppt [17]. Гексановый и метанольный экстракты C. longa продемонстрировали антибактериальный эффект против 13 бактерий, а именно, Vibrio harveyi, V.alginolyticus, V. vulnificus, V. parahaemolyticus, V. cholerae, Bacillus subtilis, B. cereus, Aeromonas hydrophila, Streptococcus agalactiae, Staph. aureus, Staph. промежуточный, Staph. epidermidis, и Edwardsiella tarda . Однако куркуминоиды проявляли ингибирующую активность против 8 бактерий Str. agalactiae, Staph.
Метанольный экстракт куркумы показал значения МПК 16 мк г / мл и 128 мк мкг / мл против Bacillus subtilis и Staph.aureus соответственно [16]. Исследование гексанового и этанольного экстракта куркумы и куркуминоидов (из этилацетатного экстракта куркуминоидов, выделенных из C. longa с содержанием куркумина 86,5%) против 24 патогенных бактерий, выделенных из курицы и креветок, показало наивысшую антимикробную активность этанольного экстракта с Значение MIC от 3,91 до 125 ppt [17]. Гексановый и метанольный экстракты C. longa продемонстрировали антибактериальный эффект против 13 бактерий, а именно, Vibrio harveyi, V.alginolyticus, V. vulnificus, V. parahaemolyticus, V. cholerae, Bacillus subtilis, B. cereus, Aeromonas hydrophila, Streptococcus agalactiae, Staph. aureus, Staph. промежуточный, Staph. epidermidis, и Edwardsiella tarda . Однако куркуминоиды проявляли ингибирующую активность против 8 бактерий Str. agalactiae, Staph. промежуточный, Staph. epidermidis, Staph. aureus, A. hydrophila, B. subtilis, B. cereus, и Ed. тарда. Гексановый экстракт и куркуминоиды показали значения MIC от 125 до 1000 ppt и 3.От 91 до 500 п.п. соответственно [17]. Действительно, было показано, что добавление 0,3% (мас. / Об.) Водного экстракта куркумина к сыру вызывало снижение количества бактерий Salmonella typhimurium, Pseudomonas aeruginosa, и E. coli 0157: H7 . Более того, это уменьшило Staph. aureus , B. cereus, и Listeria monocytogenes , заражение через 14 дней хранения в холодильнике [18]. Масло куркумы как побочный продукт производства куркумина также оказалось эффективным против B.subtilis, B. coagulans, B. cereus, Staph. aureus, E. coli, и P. aeruginosa [19]. Куркумин также проявляет ингибирующую активность в отношении метициллин-устойчивого стафилококка . aureus (MRSA) со значением МИК 125–250 мк мкг / мл [20]. in vitro исследование 3 новых соединений куркумина, а именно куркумин индия, диацетил куркумин индия и диацетил куркумин, по сравнению с Staph.
промежуточный, Staph. epidermidis, Staph. aureus, A. hydrophila, B. subtilis, B. cereus, и Ed. тарда. Гексановый экстракт и куркуминоиды показали значения MIC от 125 до 1000 ppt и 3.От 91 до 500 п.п. соответственно [17]. Действительно, было показано, что добавление 0,3% (мас. / Об.) Водного экстракта куркумина к сыру вызывало снижение количества бактерий Salmonella typhimurium, Pseudomonas aeruginosa, и E. coli 0157: H7 . Более того, это уменьшило Staph. aureus , B. cereus, и Listeria monocytogenes , заражение через 14 дней хранения в холодильнике [18]. Масло куркумы как побочный продукт производства куркумина также оказалось эффективным против B.subtilis, B. coagulans, B. cereus, Staph. aureus, E. coli, и P. aeruginosa [19]. Куркумин также проявляет ингибирующую активность в отношении метициллин-устойчивого стафилококка . aureus (MRSA) со значением МИК 125–250 мк мкг / мл [20]. in vitro исследование 3 новых соединений куркумина, а именно куркумин индия, диацетил куркумин индия и диацетил куркумин, по сравнению с Staph. aureus, S. epidermis, E. coli, и P. aeruginosa показали, что куркумин индия обладает лучшим антибактериальным действием по сравнению с самим куркумином и может быть хорошим соединением для дальнейших исследований in vivo .Однако диацетилкуркумин не проявлял антибактериального действия против тестируемых бактерий [21]. Эти результаты продемонстрировали многообещающую антибактериальную активность различных производных куркумина. Стабильность и сборка протофиламентов FtsZ как решающий фактор бактериального цитокинеза вводятся в качестве возможной лекарственной мишени для антибактериальных агентов. Куркумин подавлял цитокинез B. subtilis за счет индукции филаментации. Это также без значительного влияния на сегрегацию и организацию нуклеоидов заметно подавляло образование цитокинетического Z-кольца у B.subtilis [22]. Было продемонстрировано, что куркумин снижает связывание протофиламентов FtsZ, связанных со способностью связывания с FtsZ, с константой диссоциации 7,3 мк М.
aureus, S. epidermis, E. coli, и P. aeruginosa показали, что куркумин индия обладает лучшим антибактериальным действием по сравнению с самим куркумином и может быть хорошим соединением для дальнейших исследований in vivo .Однако диацетилкуркумин не проявлял антибактериального действия против тестируемых бактерий [21]. Эти результаты продемонстрировали многообещающую антибактериальную активность различных производных куркумина. Стабильность и сборка протофиламентов FtsZ как решающий фактор бактериального цитокинеза вводятся в качестве возможной лекарственной мишени для антибактериальных агентов. Куркумин подавлял цитокинез B. subtilis за счет индукции филаментации. Это также без значительного влияния на сегрегацию и организацию нуклеоидов заметно подавляло образование цитокинетического Z-кольца у B.subtilis [22]. Было продемонстрировано, что куркумин снижает связывание протофиламентов FtsZ, связанных со способностью связывания с FtsZ, с константой диссоциации 7,3 мк М. Было показано, что куркумин посредством ингибирования динамики сборки FtsZ в Z-кольце может, возможно, подавлять бактериальный пролиферация клеток как один из вероятных механизмов антибактериального действия [22]. Исследование на E. coli и B. subtilis продемонстрировало, что куркумин за счет ингибирующего действия против полимеризации FtsZ может подавлять сборку FtsZ, что приводит к нарушению деления прокариотических клеток [23].
Было показано, что куркумин посредством ингибирования динамики сборки FtsZ в Z-кольце может, возможно, подавлять бактериальный пролиферация клеток как один из вероятных механизмов антибактериального действия [22]. Исследование на E. coli и B. subtilis продемонстрировало, что куркумин за счет ингибирующего действия против полимеризации FtsZ может подавлять сборку FtsZ, что приводит к нарушению деления прокариотических клеток [23].
Кроме того, куркумин показал значительную антибактериальную активность со значениями МИК от 5 до 50 мкг мкг / мл против 65 клинических изолятов Helicobacter pylori [41] . Куркумин также оказывает ингибирующее действие на активацию NF- κ B и, как следствие, на высвобождение IL-8 и рассеяние клеток, что привело к снижению воспаления в ткани желудка, что является основным последствием для H. pylori в желудок. Он ингибирует деградацию I κ B α , активность связывания ДНК NF- κ B и киназы I κ B α и β (IKK α и β ) [ 42]. Действительно, куркумин подавлял активность матриксной металлопротеиназы-3 и металлопротеиназы-9 (ММР-3 и ММР-9) как воспалительных молекул, участвующих в инфекции H. pylori у мышей и в культуре клеток, дозозависимым образом [43] . Куркумин показал более эффективный терапевтический индекс, чем обычная тройная терапия H. pylori на MMP-3 и MMP-9 за счет снижения активатора белка-1 и активации провоспалительных молекул в тканях желудка, инфицированных H. pylori [43]. Исследование in vivo антибактериального действия куркумина на H. pylori по сравнению с лечением OAM (омепразол, амоксициллин и метронидазол) показало низкую активность в отношении эрадикации H. pylori (5,9% против 78,9% для лечения OAM). Снижение продукции воспалительных цитокинов не было зарегистрировано у инфицированных pylori пациентов, получавших куркумин [44]. in vivo исследование недельной неантибиотической терапии, включающей куркумин, пантопразол, N-ацетилцистеин и лактоферрин против H.
Действительно, куркумин подавлял активность матриксной металлопротеиназы-3 и металлопротеиназы-9 (ММР-3 и ММР-9) как воспалительных молекул, участвующих в инфекции H. pylori у мышей и в культуре клеток, дозозависимым образом [43] . Куркумин показал более эффективный терапевтический индекс, чем обычная тройная терапия H. pylori на MMP-3 и MMP-9 за счет снижения активатора белка-1 и активации провоспалительных молекул в тканях желудка, инфицированных H. pylori [43]. Исследование in vivo антибактериального действия куркумина на H. pylori по сравнению с лечением OAM (омепразол, амоксициллин и метронидазол) показало низкую активность в отношении эрадикации H. pylori (5,9% против 78,9% для лечения OAM). Снижение продукции воспалительных цитокинов не было зарегистрировано у инфицированных pylori пациентов, получавших куркумин [44]. in vivo исследование недельной неантибиотической терапии, включающей куркумин, пантопразол, N-ацетилцистеин и лактоферрин против H. pylori оказалась неэффективной для уничтожения H. pylori . Тем не менее, снижение иммунологических критериев воспаления желудка и симптомов диспепсии было зарегистрировано после 2 месяцев лечения [45]. Тем не менее, введение куркумина крысам с вызванным H. pylori- воспалением желудка выявило значительное снижение утечки макромолекул и активации NF- κ B [46]. В исследовании in vivo с участием мышей C57BL / 6, инфицированных H. pylori , которым вводили куркумин, проявился огромный терапевтический потенциал и выраженный эффект эрадикации против H.pylori , ассоциированная с восстановлением повреждения желудка [41] .
pylori оказалась неэффективной для уничтожения H. pylori . Тем не менее, снижение иммунологических критериев воспаления желудка и симптомов диспепсии было зарегистрировано после 2 месяцев лечения [45]. Тем не менее, введение куркумина крысам с вызванным H. pylori- воспалением желудка выявило значительное снижение утечки макромолекул и активации NF- κ B [46]. В исследовании in vivo с участием мышей C57BL / 6, инфицированных H. pylori , которым вводили куркумин, проявился огромный терапевтический потенциал и выраженный эффект эрадикации против H.pylori , ассоциированная с восстановлением повреждения желудка [41] .
2.1. Синергетическая антимикробная активность
Вспышка устойчивых к лекарствам штаммов микробов требует исследований синергических эффектов антибиотиков в сочетании с производными растений для разработки противомикробного коктейля с более широким спектром действия и снижения неблагоприятных побочных эффектов антимикробных агентов. Staph. aureus увеличивается устойчивость к пенициллиновой группе антибиотиков, что связано с появлением побочных эффектов, таких как гиперчувствительность и анафилактические реакции [47].Синергетическая активность комбинации куркуминоидов и ампициллина продемонстрировала выраженное снижение МПК ампициллина против клинического штамма или стафилококка . aureus штамм АТСС 25923. Бактериоцин субтилозин, выделенный из B. amyloliquefaciens в комбинации с инкапсулированным куркумином, показал частичный синергизм против штаммов дикого типа и чувствительных к низину штаммов L. monocytogenes Scott A [48]. В другом исследовании in vivo с использованием 500 мкл г / диск куркумина против клинического изолята Staph.aureus показана синергическая активность с антибиотиками цефиксима, цефотаксима, ванкомицина и тетрациклина [49]. Результаты доказали, что потребление куркумы во время лечения Staph. aureus , вызванные этими антибиотиками, особенно цефиксимом, могут быть полезны.
Staph. aureus увеличивается устойчивость к пенициллиновой группе антибиотиков, что связано с появлением побочных эффектов, таких как гиперчувствительность и анафилактические реакции [47].Синергетическая активность комбинации куркуминоидов и ампициллина продемонстрировала выраженное снижение МПК ампициллина против клинического штамма или стафилококка . aureus штамм АТСС 25923. Бактериоцин субтилозин, выделенный из B. amyloliquefaciens в комбинации с инкапсулированным куркумином, показал частичный синергизм против штаммов дикого типа и чувствительных к низину штаммов L. monocytogenes Scott A [48]. В другом исследовании in vivo с использованием 500 мкл г / диск куркумина против клинического изолята Staph.aureus показана синергическая активность с антибиотиками цефиксима, цефотаксима, ванкомицина и тетрациклина [49]. Результаты доказали, что потребление куркумы во время лечения Staph. aureus , вызванные этими антибиотиками, особенно цефиксимом, могут быть полезны. Куркумин также продемонстрировал синергетический эффект в сочетании с некоторыми антибиотиками, включая ампициллин, оксациллин и норфлоксацин, против метициллин-устойчивого стафилококка . aureus (MRSA) [20].Сообщалось также о синергетическом эффекте куркумина и ципрофлоксацина против MRSA, хотя есть доказательства его антагонистической активности против S. typhi и S. typhimurium в сочетании с ципрофлоксацином [49, 50].
Куркумин также продемонстрировал синергетический эффект в сочетании с некоторыми антибиотиками, включая ампициллин, оксациллин и норфлоксацин, против метициллин-устойчивого стафилококка . aureus (MRSA) [20].Сообщалось также о синергетическом эффекте куркумина и ципрофлоксацина против MRSA, хотя есть доказательства его антагонистической активности против S. typhi и S. typhimurium в сочетании с ципрофлоксацином [49, 50].
Сильно связанные комплексы металлов с противомикробными агентами вводятся как еще один возможный путь синергетического действия соответствующих противомикробных агентов за счет усиления их связывающего эффекта со стенками бактерий. Комплексы куркумина с наночастицами кобальта показали повышенную антибактериальную активность в отношении E.coli [51]. Кроме того, изготовление серебряных нанокомпозитных пленок, пропитанных куркумином, показало более сильную антибактериальную активность против E. coli . Было показано, что бактерицидная активность натрий-карбоксиметилцеллюлозно-серебряных нанокомпозитных пленок (SCMC SNCF) в качестве эффективного антибактериального материала была улучшена за счет загрузки куркумина SCMC SNCF [52].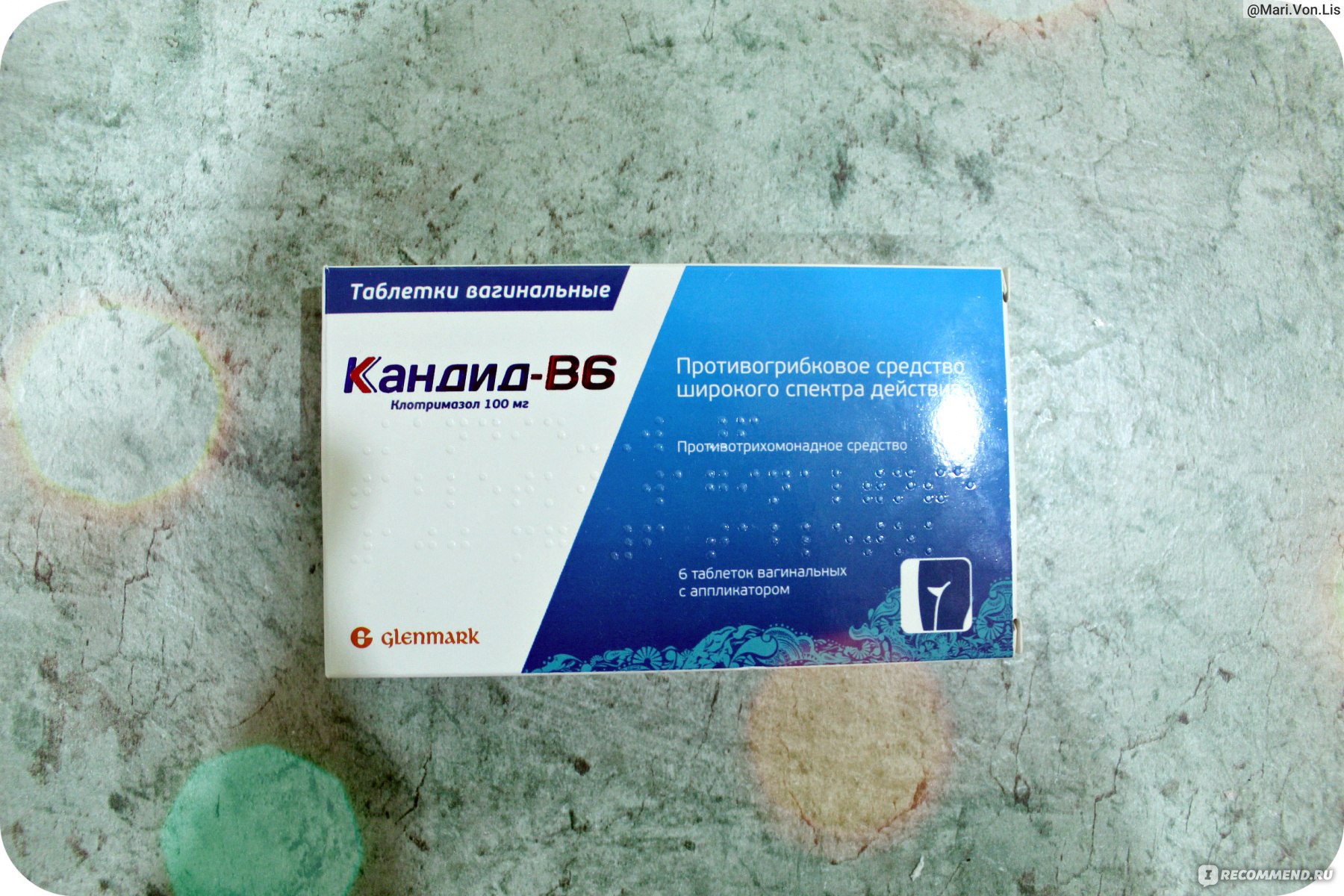 В другом исследовании in situ был показан синергетический эффект инкапсулированных куркумином пленок хитозана [поливинилового спирта] серебра нанокомпозитов.Новые противомикробные пленки с ярко выраженной антимикробной активностью против E. coli оказались потенциальным антибактериальным материалом для лечения инфекций или перевязки ран [53].
В другом исследовании in situ был показан синергетический эффект инкапсулированных куркумином пленок хитозана [поливинилового спирта] серебра нанокомпозитов.Новые противомикробные пленки с ярко выраженной антимикробной активностью против E. coli оказались потенциальным антибактериальным материалом для лечения инфекций или перевязки ран [53].
2.2. Активность против биопленок
Секреция альгината экзополисахарида с помощью различных стимуляторов, таких как аминогликозиды и потребление имипенема, вызвала увеличение объема биопленки у P. aeruginosa . Активность куркумина против биопленки в отношении двух штаммов P. aeruginosa , выделенных из образцов глубокого ротоглоточного обмена у двух пациентов с муковисцидозом, со значениями MIC 16 μ г / мл исследовали методом окрашивания кристаллическим фиолетовым.Обработка штаммов куркумином с концентрациями МИК не выявила заметного повышения оптической плотности биопленок [54]. Кроме того, в другом исследовании куркумин продемонстрировал потенциал для снижения генов инициации биопленки, ингибирования 31 гена, чувствительного к кворуму (QS), и подавления факторов вирулентности, включая производство ацилгомосеринлактон (HSL), активность эластазы / протеазы и биосинтез пиоцианина. Антимикробная активность привела к снижению патогенности у Arabidopsis thaliana и Caenorhabditis elegans в моделях, инфицированных целыми растениями и животными P.aeruginosa [7]. Результаты показали, что куркумин может быть потенциальным кандидатом на инфекцию P. aeruginosa при особых инфекциях, характеризующихся образованием биопленок, хотя для одобрения необходимы дальнейшие комплексные исследования.
Антимикробная активность привела к снижению патогенности у Arabidopsis thaliana и Caenorhabditis elegans в моделях, инфицированных целыми растениями и животными P.aeruginosa [7]. Результаты показали, что куркумин может быть потенциальным кандидатом на инфекцию P. aeruginosa при особых инфекциях, характеризующихся образованием биопленок, хотя для одобрения необходимы дальнейшие комплексные исследования.
В некоторых случаях было показано побочное действие куркумина против различных антибиотиков. Ципрофлоксацин — самый эффективный антибиотик против тифоидной и нетифоидной инфекции, вызываемой сальмонеллой . Основным механизмом антибактериальной активности ципрофлоксацина является SOS-ответ, индукция фрагментации хромосом и продукция ROS в бактериальной клетке.Исследования in vivo и in vitro куркумина вместе с ципрофлоксацином показали, что, вмешиваясь в активность ципрофлоксацина, он вызывает повышение пролиферации Salmonella typhi и Salmonella enterica серовар Typhimurium typhimurium ( S. . Хотя куркумин не мог подавить индуцированное ципрофлоксацином ингибирование гиразы, он защищал Salmonella от окислительного взрыва, вызванного интерфероном γ (IFN γ ) или ципрофлоксацином, благодаря сильному антиоксидантному эффекту.Результаты продемонстрировали, что куркумин, подавляя антибактериальный эффект IFN γ или ципрофлоксацин, может увеличивать патогенез Salmonella [55]. Исследование активности куркумина на мышиной модели брюшного тифа показало повышение патогенности Salmonella typhimurium на и повышенную устойчивость к антимикробным агентам, включая антимикробные пептиды, азотные формы и реактивный кислород. Повышенная регуляция генов, участвующих в антиоксидантной функции, таких как mntH, sitA и sodA, а также других генов, участвующих в устойчивости к антимикробным пептидам, включая pmrD и pmrHFIJKLM, рассматривалась как возможная причина упомянутой повышенной толерантности.Куркумин также индуцировал повышающий эффект на гены SPI2, участвующие во внутриклеточном выживании, и понижающую активность генов SPI1, участвующих в проникновении в эпителиальные клетки.
. Хотя куркумин не мог подавить индуцированное ципрофлоксацином ингибирование гиразы, он защищал Salmonella от окислительного взрыва, вызванного интерфероном γ (IFN γ ) или ципрофлоксацином, благодаря сильному антиоксидантному эффекту.Результаты продемонстрировали, что куркумин, подавляя антибактериальный эффект IFN γ или ципрофлоксацин, может увеличивать патогенез Salmonella [55]. Исследование активности куркумина на мышиной модели брюшного тифа показало повышение патогенности Salmonella typhimurium на и повышенную устойчивость к антимикробным агентам, включая антимикробные пептиды, азотные формы и реактивный кислород. Повышенная регуляция генов, участвующих в антиоксидантной функции, таких как mntH, sitA и sodA, а также других генов, участвующих в устойчивости к антимикробным пептидам, включая pmrD и pmrHFIJKLM, рассматривалась как возможная причина упомянутой повышенной толерантности.Куркумин также индуцировал повышающий эффект на гены SPI2, участвующие во внутриклеточном выживании, и понижающую активность генов SPI1, участвующих в проникновении в эпителиальные клетки. Эта информация доказала, что неизбирательное использование куркумина, вероятно, должно ингибировать патогенез Salmonella [55]. Кроме того, куркумин также в дозе 500 мкл г / диск показал антагонистическую активность в отношении бактерицидного действия налидиксовой кислоты против клинического штамма Staph. aureus исследовали диско-диффузионным методом [49].
Эта информация доказала, что неизбирательное использование куркумина, вероятно, должно ингибировать патогенез Salmonella [55]. Кроме того, куркумин также в дозе 500 мкл г / диск показал антагонистическую активность в отношении бактерицидного действия налидиксовой кислоты против клинического штамма Staph. aureus исследовали диско-диффузионным методом [49].
3. Противовирусная активность
Отсутствие эффективных терапевтических средств для большинства вирусных заболеваний, возникновение устойчивости к противовирусным препаратам и высокая стоимость некоторых противовирусных препаратов требуют поиска новых эффективных противовирусных соединений [56, 57]. Кроме того, существующие противовирусные методы лечения не всегда хорошо переносятся или достаточно эффективны и удовлетворительны [58]. Следовательно, возрастающая потребность в противовирусных веществах будет более подчеркнута. Растения как богатый источник фитохимических веществ с различной биологической активностью, в том числе противовирусной, представляют интерес для ученых [59, 60]. Было продемонстрировано, что куркумин как производное растения обладает широким спектром противовирусной активности против различных вирусов. Фермент инозинмонофосфатдегидрогеназа (IMPDH) из-за ограничивающей скорость активности в синтезе гуаниновых нуклеотидов de novo предлагается в качестве терапевтической мишени для противовирусных и противораковых соединений. Среди 15 различных полифенолов куркумин за счет ингибирующей активности против эффекта IMPDH либо неконкурентным, либо конкурентным образом предлагается в качестве мощного противовирусного соединения посредством этого процесса [61].Изучение различных биоконъюгатов куркумина, а именно ди- O -триптофанилфенилаланин куркумин, ди- O -деканоил куркумин, ди- O -памитоил куркумин, ди- O -90- бис9 ( γ γ ) фолил куркумин, C 4 -этил- O — γ -фолил куркумин и 4- O -этил- O — γ -фолил куркумин против различных вирусов, включая вирус парагриппа типа 3 (PIV-3), вирус инфекционного перитонита кошек (FIPV), вирус везикулярного стоматита (VSV), вирус простого герпеса (HSV), птичий вирус (FHV) и респираторно-синцитиальный вирус (RSV) по оценке с помощью теста MTT показали мощную противовирусную активность куркумина и его биоконъюгатов против различных вирусных патогенов для дальнейших исследований.
Было продемонстрировано, что куркумин как производное растения обладает широким спектром противовирусной активности против различных вирусов. Фермент инозинмонофосфатдегидрогеназа (IMPDH) из-за ограничивающей скорость активности в синтезе гуаниновых нуклеотидов de novo предлагается в качестве терапевтической мишени для противовирусных и противораковых соединений. Среди 15 различных полифенолов куркумин за счет ингибирующей активности против эффекта IMPDH либо неконкурентным, либо конкурентным образом предлагается в качестве мощного противовирусного соединения посредством этого процесса [61].Изучение различных биоконъюгатов куркумина, а именно ди- O -триптофанилфенилаланин куркумин, ди- O -деканоил куркумин, ди- O -памитоил куркумин, ди- O -90- бис9 ( γ γ ) фолил куркумин, C 4 -этил- O — γ -фолил куркумин и 4- O -этил- O — γ -фолил куркумин против различных вирусов, включая вирус парагриппа типа 3 (PIV-3), вирус инфекционного перитонита кошек (FIPV), вирус везикулярного стоматита (VSV), вирус простого герпеса (HSV), птичий вирус (FHV) и респираторно-синцитиальный вирус (RSV) по оценке с помощью теста MTT показали мощную противовирусную активность куркумина и его биоконъюгатов против различных вирусных патогенов для дальнейших исследований. Кроме того, ди- O триптофанилфенилаланин куркумин и ди- O -деканоил куркумин показали замечательную противовирусную активность против VSV и FIPV / FHV со значениями EC 50 0,011 мк M и 0,029 мк M, соответственно. Однако биоконъюгаты не проявляли значительной противовирусной активности против штаммов III B и ROD вируса иммунодефицита человека 1 типа (ВИЧ-1) в клетках МТ-4 [62]. Таблица 1 суммирует противовирусную активность C. longa и куркумина и возможные механизмы, лежащие в основе ингибирующих эффектов.
Кроме того, ди- O триптофанилфенилаланин куркумин и ди- O -деканоил куркумин показали замечательную противовирусную активность против VSV и FIPV / FHV со значениями EC 50 0,011 мк M и 0,029 мк M, соответственно. Однако биоконъюгаты не проявляли значительной противовирусной активности против штаммов III B и ROD вируса иммунодефицита человека 1 типа (ВИЧ-1) в клетках МТ-4 [62]. Таблица 1 суммирует противовирусную активность C. longa и куркумина и возможные механизмы, лежащие в основе ингибирующих эффектов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Длинный концевой повтор вируса (LTR) играет критическую роль в транскрипции провирус вируса иммунодефицита человека (ВИЧ-1) типа 1. Ингибирование активности LTR может быть возможным путем для кандидатов в противовирусные препараты для блокирования репликации ВИЧ-1 [63, 64]. Куркумин оказался эффективным соединением для подавления экспрессии гена, направленного на LTR ВИЧ-1, без какого-либо серьезного воздействия на жизнеспособность клеток [24]. Куркумин и его производные, а именно восстановленный куркумин, аллил-куркумин и токоферил-куркумин, выявили от 70% до 85% ингибирования трансактивации белка Tat LTR ВИЧ-1, измеренного с помощью β -галактозидазной активности клеток HeLa, которые в ВИЧ- 1 LTR был слит с индикатором гена lacZ .Токоферил-куркумин продемонстрировал наибольшую ингибирующую активность с 70% ингибированием при 1 нМ по сравнению с 35% ингибированием куркумина при этой концентрации [25]. Кроме того, куркумин значительно ингибировал ацетилирование белка Tat ВИЧ с помощью p300, связанного с подавлением размножения ВИЧ-1. Куркумин, воздействуя на белки ацетилтрансферазы p300 / CREB-связывающего белка (CBP), может быть мощным соединением для комбинаторной терапии ВИЧ [28].
Ингибирование активности LTR может быть возможным путем для кандидатов в противовирусные препараты для блокирования репликации ВИЧ-1 [63, 64]. Куркумин оказался эффективным соединением для подавления экспрессии гена, направленного на LTR ВИЧ-1, без какого-либо серьезного воздействия на жизнеспособность клеток [24]. Куркумин и его производные, а именно восстановленный куркумин, аллил-куркумин и токоферил-куркумин, выявили от 70% до 85% ингибирования трансактивации белка Tat LTR ВИЧ-1, измеренного с помощью β -галактозидазной активности клеток HeLa, которые в ВИЧ- 1 LTR был слит с индикатором гена lacZ .Токоферил-куркумин продемонстрировал наибольшую ингибирующую активность с 70% ингибированием при 1 нМ по сравнению с 35% ингибированием куркумина при этой концентрации [25]. Кроме того, куркумин значительно ингибировал ацетилирование белка Tat ВИЧ с помощью p300, связанного с подавлением размножения ВИЧ-1. Куркумин, воздействуя на белки ацетилтрансферазы p300 / CREB-связывающего белка (CBP), может быть мощным соединением для комбинаторной терапии ВИЧ [28]. Куркумин оказался ингибитором протеазы ВИЧ-1 и ВИЧ-2 с IC 50 из 100 мк М и 250 мк М, соответственно.Комплексы куркумин-бор продемонстрировали заметное ингибирование, сниженное до значения IC 50 , равного 6 мк M, с зависящей от времени активностью. Повышенное сродство борных производных куркумина, возможно, связано с присоединением ортогональных доменов соединения к пересекающимся сайтам внутри субстрат-связывающей полости протеазы [26]. Интеграза, как еще один важный фермент для репликации ВИЧ-1, ингибируется куркумином со значением IC 50 , равным 40 мк M.Ингибирование делеционного мутанта интегразы, содержащего только аминокислоты 50–212, указывает на то, что куркумин, возможно, взаимодействует с каталитическим ядром фермента. Изучение минимизации энергии и структурных аналогов куркумина показало, что внутримолекулярная укладка двух фенильных колец куркумина, возможно, отвечает за антиинтегразную активность за счет сближения гидроксильных групп [27]. Однако розмариновая кислота и дикаффеоилметан как два аналога куркумина показали заметную ингибирующую активность против интегразы ВИЧ-1 со значениями IC 50 менее 10 мк M с низкой скоростью связывания с ферментом, оцененной кинетическими исследованиями [65] .Однако в ходе клинических испытаний куркумина как соединения против ВИЧ у 40 пациентов за восемь недель было показано, что не наблюдается снижения вирусной нагрузки или повышения количества CD4. Но пациенты утверждали, что предпочитают куркумин, чтобы перенести незначительные желудочно-кишечные расстройства и почувствовать себя лучше [29]. Это продемонстрировало, что клинические испытания могут дать результаты, полностью отличные от результатов исследований in vitro и исследований. Клинические испытания прозрачного жидкого мыла, содержащего 0.5% этанольный экстракт корневища C. longa у ВИЧ-инфицированных уменьшал раневые инфекции и на 100% уменьшение симптомов зуда, а также влиял на абсцесс, превращаясь в струпья сухости (78,6%) в течение 2 недель [16].
Куркумин оказался ингибитором протеазы ВИЧ-1 и ВИЧ-2 с IC 50 из 100 мк М и 250 мк М, соответственно.Комплексы куркумин-бор продемонстрировали заметное ингибирование, сниженное до значения IC 50 , равного 6 мк M, с зависящей от времени активностью. Повышенное сродство борных производных куркумина, возможно, связано с присоединением ортогональных доменов соединения к пересекающимся сайтам внутри субстрат-связывающей полости протеазы [26]. Интеграза, как еще один важный фермент для репликации ВИЧ-1, ингибируется куркумином со значением IC 50 , равным 40 мк M.Ингибирование делеционного мутанта интегразы, содержащего только аминокислоты 50–212, указывает на то, что куркумин, возможно, взаимодействует с каталитическим ядром фермента. Изучение минимизации энергии и структурных аналогов куркумина показало, что внутримолекулярная укладка двух фенильных колец куркумина, возможно, отвечает за антиинтегразную активность за счет сближения гидроксильных групп [27]. Однако розмариновая кислота и дикаффеоилметан как два аналога куркумина показали заметную ингибирующую активность против интегразы ВИЧ-1 со значениями IC 50 менее 10 мк M с низкой скоростью связывания с ферментом, оцененной кинетическими исследованиями [65] .Однако в ходе клинических испытаний куркумина как соединения против ВИЧ у 40 пациентов за восемь недель было показано, что не наблюдается снижения вирусной нагрузки или повышения количества CD4. Но пациенты утверждали, что предпочитают куркумин, чтобы перенести незначительные желудочно-кишечные расстройства и почувствовать себя лучше [29]. Это продемонстрировало, что клинические испытания могут дать результаты, полностью отличные от результатов исследований in vitro и исследований. Клинические испытания прозрачного жидкого мыла, содержащего 0.5% этанольный экстракт корневища C. longa у ВИЧ-инфицированных уменьшал раневые инфекции и на 100% уменьшение симптомов зуда, а также влиял на абсцесс, превращаясь в струпья сухости (78,6%) в течение 2 недель [16].
Куркумин проявил противогриппозную активность против вирусов гриппа PR8, h2N1 и H6N1. Результаты показали снижение выхода вируса в культуре клеток более чем на 90% при использовании 30 мкл М куркумина. Тест на уменьшение зубного налета выявил приблизительное значение EC 50 , равное 0.47 μ M для куркумина против вирусов гриппа [30]. В подтипах h2N1, а также H6N1 ингибирование взаимодействия гемагглютининов отражало прямое влияние куркумина на инфекционность вирусных частиц, и это было доказано во время экспериментов с наркозависимостью. Кроме того, в отличие от амантадина, вирусы не проявляли устойчивости к куркумину. Метоксильные производные куркумина также не показали заметной роли в гемагглютинации [30]. Эти результаты доказали значительный потенциал куркумина в подавлении гриппа.
In vitro исследование куркумина и его производных, а именно галлий-куркумин и Cu-куркумин, продемонстрировало замечательную противовирусную активность против вируса простого герпеса типа 1 (HSV-1) в культуре клеток с IC 50 , равным 33,0 мкг. / мл, 13,9 мкг / мл и 23,1 мкг / мл соответственно. 50% цитотоксическая концентрация (CC 50 ) соответствующих соединений в клеточной линии Vero составила 484,2 мк мкг / мл, 255,8 мк мкг / мл и 326,6 мк мкг / мл соответственно [31 ].Куркумин значительно снижал экспрессию гена немедленного раннего (IE) и инфекционность HSV-1 в анализах клеточных культур. Куркумин оказывает влияние на привлечение РНК-полимеразы II к промоторам гена IE через посредничество вирусного трансактиваторного белка VP16, независимый процесс эффекта гистонацетилтрансферазы p300 / CBP [32]. In vitro репликация HSV-2 могла быть уменьшена куркумином со значением ED 50 , равным 0,32 мг / мл [32]. Более того, исследование in vivo на мышиной модели с интравагинальным заражением HSV-2 показало значительную защиту от инфекции HSV-2 из-за введения куркумина.Это исследование показало, что куркумин может быть хорошим кандидатом для разработки противовирусных продуктов, используемых женщинами интравагинально для защиты от инфекции вируса герпеса, передаваемой половым путем [33]. Действительно, металло-травяной комплекс куркумина с медью (Cu 2+ ) продемонстрировал микробицидный эффект для дальнейших исследований вагинального геля с противовирусной активностью [66].
Вирусы Коксаки вызывают различные заболевания, такие как дилатационная кардиомиопатия и миокардит. Вирус Коксаки B3 (CVB3), несмотря на обширные исследования, по-прежнему остается основным патогеном человека без специального эффективного и одобренного лечения [67, 68].Куркумин проявлял противовирусную активность против вируса Коксаки за счет снижения экспрессии вирусной РНК, синтеза белка и титра вируса. Кроме того, было обнаружено, что он оказывает защитное действие на клетки против вирус-индуцированного апоптоза и цитопатической активности. Анализ различных путей показал, что куркумин усиливает свой мощный противовирусный эффект в ингибировании репликации вируса Коксаки за счет нарушения регуляции убиквитин-протеасомной системы (UPS) [34]. Недавние исследования доказали, что модификация или деградация белка, опосредованная UPS, является важным фактором в регуляции репликации вируса Коксаки [69].
Болезни печени, связанные с вирусными инфекциями, являются серьезными пандемиями [70]. Тот факт, что вирус гепатита В (HBV) увеличивает вероятность развития гепатоцеллюлярной карциномы (ГЦК) примерно в 100 раз и 695 900 смертей от цирроза печени и ГЦК во всем мире в 2008 г. обусловливают необходимость поиска новых противовирусных препаратов против вирусов гепатита [71, 72]. Изучение противовирусного действия водного экстракта ризомы Curcuma longa против HBV в клетках HepG 2.2.15, содержащих геномы HBV, показало подавление секреции HBsAg клетками печени без какого-либо цитотоксического действия.Он также подавлял продукцию частиц HBV и скорость продукции мРНК HBV на инфицированных клетках. Экстракт Curcuma longa подавлял репликацию HBV за счет увеличения скорости белка p53 за счет повышения стабильности белка, а также трансактивации транскрипции гена p53. Было понятно, что экстракт подавляет энхансер I HBV и промотор X, что приводит к репрессии транскрипции гена HBx за счет воздействия на p53 [35]. Исследование in vitro противовирусной активности клеток репликона Huh7 куркумина, экспрессирующих вирус гепатита С (ВГС), показало, что куркумин может быть сильным анти-ВГС соединением.Результаты показали снижение экспрессии и репликации гена HCV за счет подавления пути Akt-SREBP-1. Кроме того, смесь куркумина и IFN α в качестве известной терапии против HCV индуцировала выраженную ингибирующую активность в отношении репликации HCV и продемонстрировала, что куркумин, возможно, можно использовать в качестве дополнительной терапии для HCV [36].
Инфекция вирусом папилломы человека (ВПЧ) высокого риска через экспрессию вирусных онкопротеинов E6 и E7 играет решающую роль в развитии рака шейки матки.Куркумин проявлял ингибирующую активность против экспрессии генов Е6 и Е7 ВПЧ-16 и ВПЧ-18 как двух основных высокоонкогенных вирусов папилломы человека [37]. Фактор транскрипции AP-1 является критическим фактором регуляции транскрипции ВПЧ высокого риска, таких как ВПЧ-16 и ВПЧ-18. Куркумин подавляет активность связывания AP-1 в клетках HeLa, снижая влияние на транскрипцию HPV-18 [38]. Результаты показали, что куркумин посредством модуляции апоптоза, а также предотвращения транслокации NF κ B и AP-1, связанной с подавлением вирусных онкогенов и снижением транскрипции ВПЧ, может быть хорошим кандидатом для лечения высокоонкогенных инфекций ВПЧ [37, 38].
Вирус японского энцефалита (ЯЭ) как важный эндемический арбовирус в Юго-Восточной Азии является основной причиной острой энцефалопатии, которая обычно поражает детей и приводит к смерти у одной трети пациентов. Постоянное психоневрологическое осложнение является осложнением для многих выживших после ЯЭ из-за неэффективных терапевтических мер [73]. Исследование противовирусной активности куркумина на клеточной линии Neuro2a, инфицированной JEV, показало снижение продукции инфекционных вирусных частиц за счет ингибирования убиквитин-протеасомной системы.Результаты исследования in vitro показали, что куркумин за счет модуляции клеточных уровней белков, связанных со стрессом, снижения проапоптотических сигнальных молекул, восстановления целостности клеточной мембраны и уменьшения количества активных форм кислорода на клеточном уровне, обеспечивает нейрозащиту и может быть потенциалом для дальнейшего исследования [39].
Онкогенез вируса Т-клеточного лейкоза человека 1 типа как этиологический фактор Т-клеточного лейкоза взрослых (ATL) критически зависит от активации белка-активатора 1 (AP-1) [74].Связывание ДНК и транскрипционный эффект AP-1 в HTLV-1-инфицированных линиях Т-клеток подавлялись обработкой куркумином. Куркумин также ингибировал экспрессию белка JunD как важного фактора в комплексе AP-1-ДНК в Т-клетках, инфицированных HTLV-1, а также индуцированный HTLV-1 Tax транскрипционный эффект AP-1. Было обнаружено, что остановка клеточного цикла и индукция апоптоза являются возможными механизмами против репликации HTLV-1 в инфицированной линии Т-клеток куркумином. Подавление активности AP-1, возможно, за счет снижения экспрессии белка JunD, рассматривается как возможный путь анти-ATL активности куркумина [40].
4. Противогрибковая активность
Вещества и экстракты, выделенные из различных природных ресурсов, особенно растений, всегда были богатым арсеналом для борьбы с грибковыми инфекциями и порчей. В связи с широким традиционным использованием куркумы в пищевых продуктах, были проведены различные исследования с целью изучения куркумы и куркумина с целью контроля порчи, связанной с грибками, и грибковых патогенов. Изучение добавления порошка куркумы в культуру тканей растений показало, что куркума на уровне 0.8 и 1,0 г / л обладали заметной ингибирующей активностью против грибковых загрязнений [75]. Метанольный экстракт куркумы продемонстрировал противогрибковую активность против Cryptococcus neoformans и Candida albicans со значениями МИК 128 и 256 мк мкг / мл соответственно [16]. Исследование гексанового экстракта C. longa в концентрации 1000 мг / л продемонстрировало противогрибковый эффект против Rhizoctonia solani , Phytophthora infestans, и Erysiphe graminis .Также было показано, что 1000 мг / л этилацетатного экстракта C. longa проявляет ингибирующий эффект против R. solani , P. infestans, Puccinia recondita, и Botrytis cinerea. Куркумин в концентрации 500 мг / л также проявил противогрибковую активность против R. solani, , Pu. recondita, и P. infestans [76]. Куркумин и масло куркумы обладают противогрибковым действием против двух грибов-фитофагов, а именно, Fusarium solani и Helminthosporium oryzae .Масло куркумы показало наиболее эффективную противогрибковую активность против F. solani и H. oryzae с IC 50 19,73 и 12,7 мк г / мл соответственно [77]. Неочищенный метанольный экстракт C. longa оказывает ингибирующее действие на некоторые клинические изоляты дерматофитов. Было продемонстрировано, что свежеперегнанное масло 18-месячного возраста, выделенное из корневища C. longa , показало наиболее сильный противогрибковый эффект против 29 клинических изолятов дерматофитов со значениями MIC 7.2 и 7,8 мг / мл соответственно [78]. Trichophyton rubrum , T. mentagrophytes , Epidermophyton floccosum, и Microsporum gypseum подавлялись разведением 1: 40–1: 320 масла куркумы. Исследование in vivo на морских свинках, инфицированных T. rubrum , показало, что кожное нанесение масла куркумы (разведение 1:80) вызывает улучшение заживления поражений через 2–5 дней и вызывает поражения через 6 дней. 7 дней расхода пропадать.Масло куркумы также показало активность против патогенных плесневых грибов, таких как Sporothrix schenckii , Exophiala jeanselmei , Fonsecaea pedrosoi, и Scedosporium apiospermum со значениями МИК 114,9, 459,6, 114,930 и 909,6 соответственно. [79]. Однако куркумин показал более значительный эффект против Paracoccidioides brasiliensis , чем флуконазол, хотя он не повлиял на рост видов Aspergillus [80].Было обнаружено, что возможный механизм, лежащий в основе упомянутого противогрибкового эффекта, заключается в подавлении активности десатуразы (ERG3), что приводит к значительному снижению эргостерола в грибковых клетках. Снижение продукции эргостерола приводит к накоплению биосинтетических предшественников эргостерола, что приводит к гибели клеток через образование АФК [81]. Снижение секреции протеиназы и изменение связанных с мембранами свойств активности АТФазы — другие возможные критические факторы противогрибковой активности куркумина [82].
Развитие устойчивых штаммов среди видов Candida против существующих противогрибковых препаратов стало критической проблемой для терапевтических стратегий. Таким образом, поиск новых веществ против Candida представляется решающим [83]. Изучение куркумина против 14 штаммов Candida, включая 4 штамма ATCC и 10 клинических изолятов, показало, что куркумин является мощным фунгицидным соединением против видов Candida со значениями MIC от 250 до 2000 мк г / мл [82]. В другом исследовании антикандидозная активность куркумина была продемонстрирована против 38 различных штаммов Candida, включая некоторые устойчивые к флуконазолу штаммы и клинические изоляты C.albicans , C. glabrata, C. krusei, C. tropicalis, и C. guilliermondii . Значения MIC 90 для чувствительных и устойчивых штаммов составляли 250–650 и 250–500 мк мкг / мл соответственно. Внутриклеточное закисление посредством ингибирования H + -экструзии было идентифицировано как возможный механизм гибели клеток Candida видов [84]. Было доказано, что куркумин ингибирует развитие гиф, воздействуя на глобальный супрессор захвата тимидина 1 (TUP1) [81, 85].Куркумин также проявил ингибирующее действие на Cryptococcus neoformans и C. dubliniensis при значении МИК 32 мг / л [80]. Одним из основных осложнений при лечении хронической астмы является кандидоз ротоглотки. Куркумин как потенциальный кандидат для лечения кандидоза с противовоспалительной активностью был изучен на мышиной модели астмы. Пероральный прием куркумина более эффективен, чем дексаметазон, в снижении грибковой нагрузки у мышей BALB / c. Это также значительно уменьшило патологические изменения при астме [86].Адгезия видов Candida, выделенных от больных СПИДом, к клеткам буккального эпителия также заметно ингибируется куркумином, и было обнаружено, что он более эффективен по сравнению с флуконазолом [80].
Исследование воздействия куркумина на фотодинамическую терапию может снизить биомассу биопленок C. albicans , C. glabrata, и C. tropicalis . Результаты продемонстрировали, что ассоциация четырех светодиодов для возбуждения света с концентрацией куркумина 40 мкМ M при 18 Дж / см 2 ингибировала до 85% метаболической активности тестируемых видов Candida.Использование куркумина
Противогрибковые препараты
Ресурс исследования
- Исследовать
- Искусство и гуманитарные науки
- Бизнес
- Инженерная технология
- Иностранный язык
- История
- Математика
- Наука
- Социальная наука
Лучшие подкатегории
- Продвинутая математика
- Алгебра
- Основы математики
- Исчисление
- Геометрия
- Линейная алгебра
- Предалгебра
- Предварительный камень
- Статистика и вероятность
- Тригонометрия
- другое →
Лучшие подкатегории
- Астрономия
- Астрофизика
- Биология
- Химия
- Науки о Земле
- Наука об окружающей среде
- Здравоохранение
- Физика
- o
Синонимы противогрибковых агентов, антонимы противогрибковых агентов
«Нам срочно нужны новые классы противогрибковых средств от кандидозного вагинита», — сказал он.Луликоназол является одним из наиболее мощных противогрибковых средств широкого спектра действия, находящихся в стадии разработки, и в настоящее время в США он перейдет в фазу 3 клинических разработок Caspofungi: противогрибковое средство на основе эхинокандина. Clin Ther 2002; 24: 351-377.MYCAMINE является представителем нового класса противогрибковых агентов, эхинокандинов. AmBisome — единственный противогрибковый агент, показанный для лечения фебрильной нейтропении с подозрением на грибковую инфекцию. Пациенты в исследовании, которые был профинансирован Medicis, соблюдал режим избегания и применял противогрибковое средство широкого спектра действия циклопирокс 0.77% лосьон два раза в день в течение 6-12 недель. Его открытия привели к разработке нового противовоспалительного препарата компанией Pharmacia и уникального противогрибкового средства для защиты зерновых культур от Monsanto. Однако даже исследование KOH может вводить в заблуждение. если пациент недавно самостоятельно вводил местное противогрибковое средство. В этой статье описывается различный вид инфекций опоясывающего лишая в зависимости от их анатомического расположения, а также дается описание тщательного изучения. Еще одна линия доказательств основана на экспериментальном противогрибковом препарате лептомицин B.подразделение здравоохранения потребителей и McNeil Consumer Products Co., дочерняя компания Johnson & Johnson (J&J), завершили сделку по приобретению противогрибкового средства Nasalcrom и Pediacare, линии детских лекарств от кашля / простуды от McNeil and Micatin. , из J & J.SCY-078, исследуемое противогрибковое средство, которое является полусинтетическим производным натурального продукта энфумафунгина, находится в клинической разработке для лечения нескольких серьезных грибковых инфекций, включая инвазивный кандидоз, инвазивный аспергиллез, рефрактерные инвазивные грибковые инфекции, и кандидозный вульвовагинит.объявили сегодня, что Sato Pharma и Eisai будут совместно продвигать новое пероральное противогрибковое средство класса триазола (код разработки: BFE1224, «агент»), содержащее активный ингредиент фосравуконазол L-лизинэтанолат («фосравуконазол») в Японии на основе соглашения Препарат представляет собой доступное перорально противогрибковое средство, которое ингибирует металлоферментную мишень, названную грибковым CYP51. ВАЙКОЛОА, Гавайи — Известный пероральный триазольный противогрибковый агент итраконазол активно исследуется для неожиданного использования: в качестве дополнительной терапии у пациентов с местным запущенная или метастатическая базальноклеточная карцинома.Было показано, что за исключением времени начала противогрибковой терапии, адекватность применяемого противогрибкового средства оказывает значительное влияние на эффективность лечения.
| Срок | Определение
| ||
| Срок | Определение
| ||
Термин
| Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Срок | Определение | ||
Термин
| Определение
| ||
| Срок | Определение
| ||
| Срок | Определение
| ||
| Posted in Разное | |||



 Это Тербинафин, Итраконазол, Флуконазол.
Это Тербинафин, Итраконазол, Флуконазол. Они быстро уничтожают патогенные микроорганизмы, обитающие не только на ногтях и коже, но и на слизистой оболочке.
Они быстро уничтожают патогенные микроорганизмы, обитающие не только на ногтях и коже, но и на слизистой оболочке.



 (31789904)
(31789904)
 Однако пероральный вориконазол остается безопасным при почечной дисфункции.
Однако пероральный вориконазол остается безопасным при почечной дисфункции.





 (29725999)
(29725999) parapsilosis и C. guilliermondii. Среди C. glabrata (особенно штаммов, устойчивых к флуконазолу) редко можно обнаружить устойчивость.
parapsilosis и C. guilliermondii. Среди C. glabrata (особенно штаммов, устойчивых к флуконазолу) редко можно обнаружить устойчивость.

 (29304209)
(29304209)
 Однако изавуконазол здесь является более безопасным вариантом, если он доступен.
Однако изавуконазол здесь является более безопасным вариантом, если он доступен.

 , Деннинг Д.В., Паттерсон Т.Ф. и др. Вориконазол по сравнению с амфотерицином B для первичной терапии инвазивного аспергиллеза. N Engl J Med . 2002; 347 (6): 408-415. DOI: 10.1056 / NEJMoa020191 [PubMed]
, Деннинг Д.В., Паттерсон Т.Ф. и др. Вориконазол по сравнению с амфотерицином B для первичной терапии инвазивного аспергиллеза. N Engl J Med . 2002; 347 (6): 408-415. DOI: 10.1056 / NEJMoa020191 [PubMed] Clin Infect Dis . 2012; 55 (8): 1080-1087. DOI: 10.1093 / cid / cis599 [PubMed]
Clin Infect Dis . 2012; 55 (8): 1080-1087. DOI: 10.1093 / cid / cis599 [PubMed] Профиль переносимости действующего арсенала противогрибковых препаратов. J Antimicrob Chemother . 2018; 73 (Suppl_1): i26-i32. DOI: 10.1093 / jac / dkx446 [PubMed]
Профиль переносимости действующего арсенала противогрибковых препаратов. J Antimicrob Chemother . 2018; 73 (Suppl_1): i26-i32. DOI: 10.1093 / jac / dkx446 [PubMed] Систематический обзор терапии первой линии амфотерицином B у взрослых в критическом состоянии с кандидемией или инвазивным кандидозом. Expert Rev Anti Infect Ther . 2018; 16 (11): 839-847. DOI: 10.1080 / 14787210.2018.1528872 [PubMed]
Систематический обзор терапии первой линии амфотерицином B у взрослых в критическом состоянии с кандидемией или инвазивным кандидозом. Expert Rev Anti Infect Ther . 2018; 16 (11): 839-847. DOI: 10.1080 / 14787210.2018.1528872 [PubMed] , Кортегиани А., Хаммад Э, Кассир Н., Леоне М. Выбор правильного противогрибкового средства у пациентов в отделении интенсивной терапии. Adv Ther . 2019; 36 (12): 3308-3320. DOI: 10.1007 / s12325-019-01115-0 [PubMed]
, Кортегиани А., Хаммад Э, Кассир Н., Леоне М. Выбор правильного противогрибкового средства у пациентов в отделении интенсивной терапии. Adv Ther . 2019; 36 (12): 3308-3320. DOI: 10.1007 / s12325-019-01115-0 [PubMed] 2020; 9 (8): E445. Опубликовано 25 июля 2020 г. doi: 10.3390 / antibiotics
2020; 9 (8): E445. Опубликовано 25 июля 2020 г. doi: 10.3390 / antibiotics