Основы. ОГК. Рак лёгкого. Лучевая диагностика периферического рака легкого. Видео. +
(Новости лучевой диагностики 2001 1-2: 4-10)
Лучевая диагностика периферического рака легкого.
Голуб Г. Д., Серова Т. Н.
НИИ онкологии и медицинской радиологии им. Н.Н.Александрова, г. Минск.
Периферический рак составляет от 12 до 37,5 % всех опухолей легких. Опухоль развивается из эпителия бронхов IV-VI порядка и более мелких ветвей и постепенно разрастается в виде узла. Макроскопически он имеет вид сероватого округлого образования с более или менее четкими границами. Нередко в центре опухоли (независимо от ее величины) имеется размягчение ткани – некроз или полость распада. Раковый узел может располагаться в кортикальной (субплевральная форма), в центральной и в срединной зонах. Наиболее частой локализацией периферического рака легкого является верхняя доля (70%), реже это заболевание встречается в нижней доле (23%) и еще реже — в средней (7%).![]()
Клиническое течение периферического рака бессимптомно до тех пор, пока опухоль не войдет в соприкосновение с соседними структурами или более крупными бронхами, сдавление или прорастание которых может повлечь за собой появление тех или иных симптомов. В связи с этим своевременное выявление периферического рака — в первую очередь прерогатива рентгенологического исследования.
Классическая рентгенологическая картина периферического рака общеизвестна: шаровидной или сферической формы неоднородная тень с неровными, часто волнистыми (бугристыми), нечеткими контурами.
Важно, однако, подчеркнуть, что общепринятое мнение о шаровидной форме периферического рака справедливо только по отношению к относительно большим узлам, диаметр которых превышает 3-4 см. Большинство более мелких опухолей не имеет шаровидной формы и приобретает таковую только по мере роста новообразования.
Важным скиалогическим признаком периферического рака являются нечеткие контуры опухолевого узла и наличие лучистых теней, направленных от него в легочную ткань.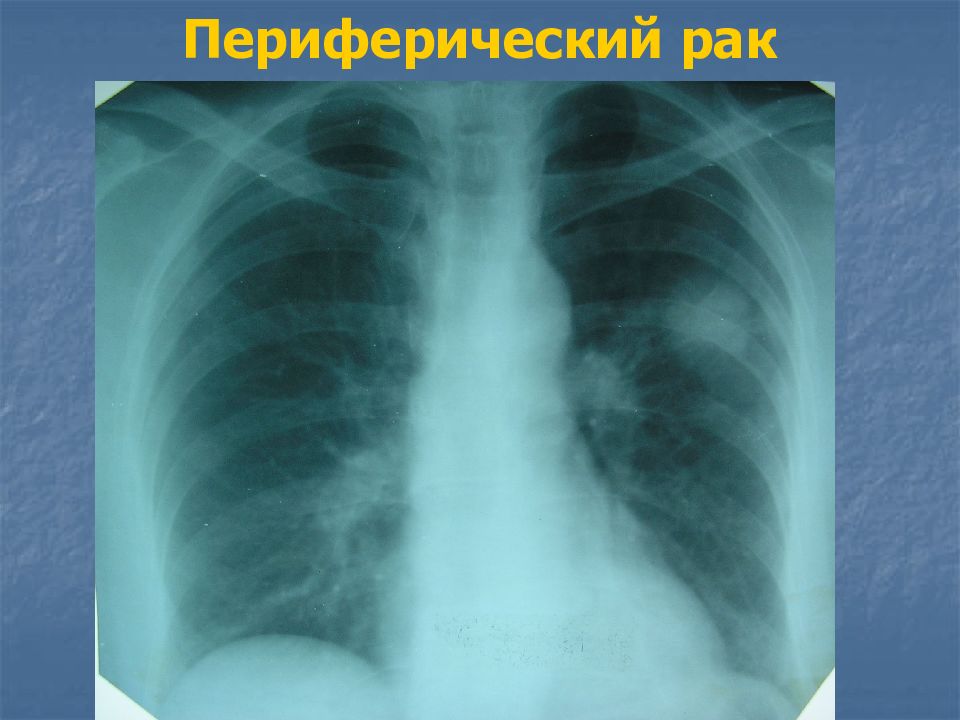 Образование “лучистого венчика”, “шипов” вокруг опухоли связано с распространением ее вдоль стенок бронхов, лимфатических и кровеносных сосудов и отражает инфильтративный характер роста.
Образование “лучистого венчика”, “шипов” вокруг опухоли связано с распространением ее вдоль стенок бронхов, лимфатических и кровеносных сосудов и отражает инфильтративный характер роста.
Следует обратить внимание на нежный, радиально направленный рисунок “лучистого венчика” при периферическом раке в отличие от неравномерных и неодинаковых по толщине тяжей, которые являются отображением рубцовых процессов. Примером может служить фокус хронической пневмонии, который, имея шаровидную форму, на фоне подобных тяжей может напоминать злокачественную опухоль. В связи с этим анализ “венчика” должен быть проведен очень тщательно.
Контуры опухоли не только нечеткие, но и волнистые, что является отображением бугристой поверхности опухолевого узла. При анализе рентгенологической картины периферического рака существенное значение имеет симптом многоузловатости, заключающийся в отсутствии единой однородной тени опухоли; она состоит как бы из нескольких небольших образований, сливающихся в общий конгломерат (Б.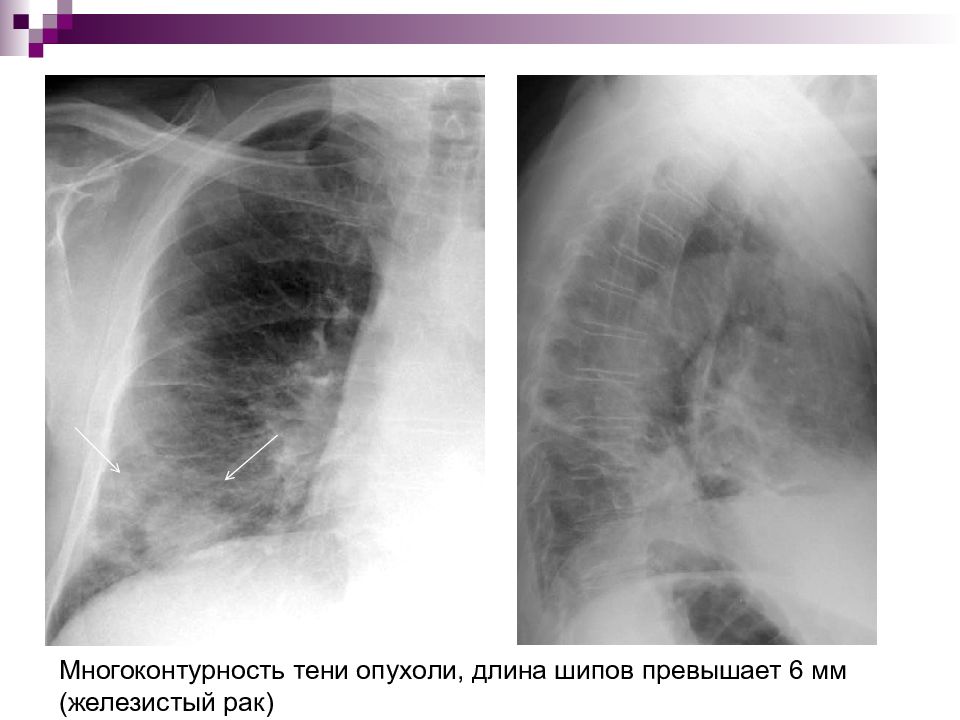 К. Шаров, 1974).
К. Шаров, 1974).
В редких случаях, когда контуры раковой опухоли могут быть четкими, а не бугристыми, дифференциальная диагностика с доброкачественными опухолями представляет значительные трудности.
Интенсивность тени зависит в основном от размеров опухолевого узла и степени его плотности. Структура тени при периферическом раке чаще неоднородная. Нередко она представляет собой как бы слившиеся между собой отдельные, прилежащие друг к другу плотные округлые тени. По-видимому, неравномерность роста отдельных участков опухоли, бугристость поверхности, различные сроки возникновения распада обусловливают подобную неоднородную структуру теневого изображения.
Почти у 30 % больных периферическим раком легкого встречается распад в опухолевом узле, связанный в основном с несоответствием медленного образования сосудов и интенсивного роста опухоли, в результате чего наступает некроз опухолевой ткани. Это не единственная причина, поскольку наблюдаются очень большие узлы без выраженного распада и значительно меньшего размера – с наличием распада.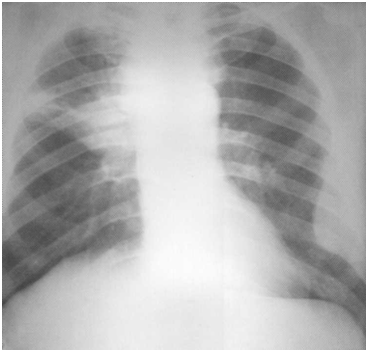
Полости распада бывают мелкими, одиночными и множественными. Они имеют причудливую форму с неровными и нечеткими очертаниями. Мелкофокусный распад может переходить в крупнофокусный и заканчиваться образованием крупной солитарной, центрально расположенной полости, стенки которой имеют различную толщину – полостная, кавернозная форма рака. В редких случаях стенки опухоли могут быть тонкими, а сама опухоль напоминать кисту (Рис. 1).
Периферический рак может иметь различные размеры, что зависит от сроков выявления новообразования и темпов его роста, отражающих агрессивность опухолевых клеток.
В последние годы появилось большое число работ, посвященных скорости роста опухоли, при этом для учета ее используют показатель времени удвоения объема (ВУО) новообразования. При периферическом раке этот показатель колеблется, по данным разных авторов, от 20 до 300-400 дней, при доброкачественных опухолях ВУО превышает 500 дней.
Величина ВУО при раке легкого зависит от многих факторов, в том числе и, возможно, в значительной степени от гистологической структуры опухоли и даже степени дифференцировки клеток.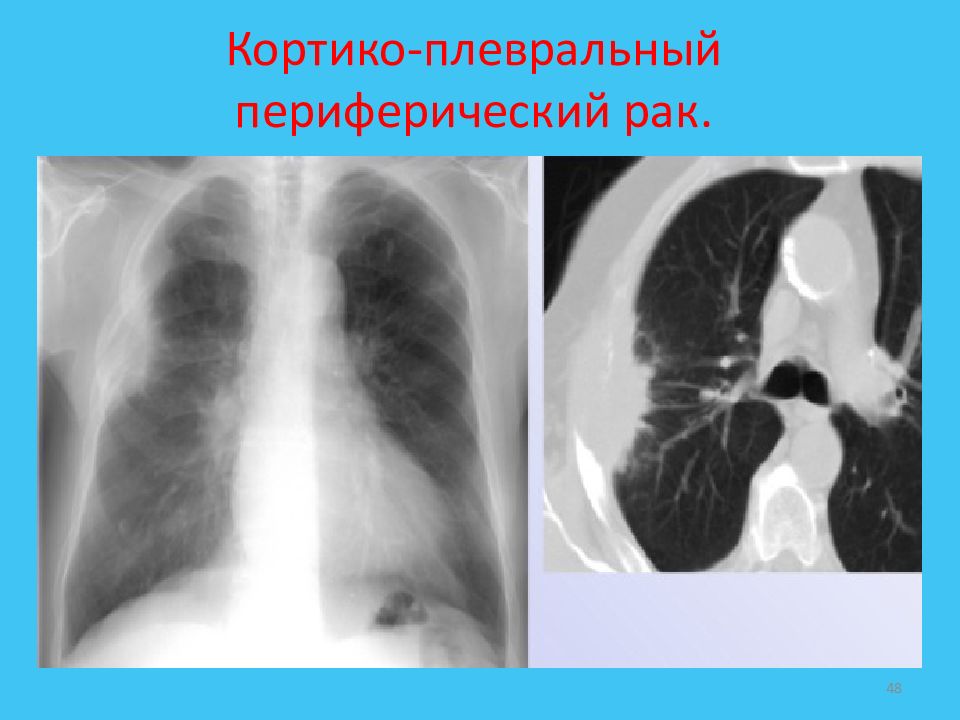
По данным K. Kerr и D. Jamb (1984), ВУО при плоскоклеточном раке составляет в среднем 146 дней, тогда как при аденокарциноме — 72 дня, при мелкоклеточном – только 66 дней, а по некоторым данным даже 29 дней.
Имеется определенная связь скорости роста опухоли и возраста больных: быстрорастущие опухоли чаще отмечаются у лиц более молодого возраста. Среди больных с медленным ростом периферического рака легкого преобладают лица пожилого возраста.
Быстрое увеличение размеров тени узла в легком в большинстве случаев является признаком злокачественности опухоли, в то же время медленное ее увеличение не позволяет исключить рак. Опыт показывает, что у больных периферическим раком, не оперированных по различным причинам, на протяжении многих месяцев можно наблюдать почти стабильную картину без заметного увеличения размеров опухолевого узла или на протяжении нескольких лет — незначительное, постепенное увеличение размеров тени опухоли.
Распространение опухоли по сосудам по ходу лимфооттока в сторону корня дает картину “дорожки к корню легкого”.
Различают два вида дорожек: одна из них — в виде неоднородной тяжистости за счет периобронхиальной и периваскулярной опухолевой инфильтрации, вторая – однородная, широкая, связанная с цепочкой метастатически измененных лимфоузлов или с ростом самой опухоли.
Симптом “дорожки к корню” для постановки диагноза периферического рака самостоятельного значения не имеет, т.к. может встречаться и при других заболеваниях (туберкулезе, хронической пневмонии). Отмечается, что при раке (в отличие от туберкулеза) в дорожке редко виден дренирующий бронх.
Окружающая опухоль легочная ткань может быть совершенно нормальной или измененной предшествующими воспалительными заболеваниями. В настоящее время считают, что у 4/5 больных периферическим раком опухоль развивается на фоне старого гиалинизированного рубца (Рис. 2).
Установлена определенная зависимость между рентгенологической картиной и гистоструктурой периферического рака легкого.
Для плоскоклеточного рака характерна неоднородная структура, полость распада, лучистые контуры.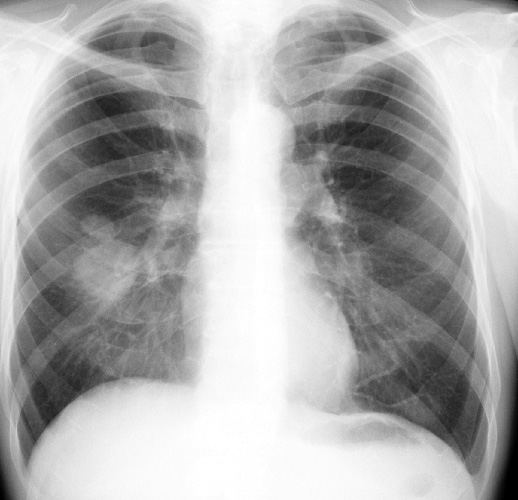 Так
Так
называемые “шипы” либо вовсе не образуются, либо бывают короткими – не более 6 мм (Рис. 3).
При железистом раке отмечается многоконтурность тени опухоли, длина шипов превышает 6 мм (Рис. 4).
По данным НИИО и МР им. Н.Н. Александрова, 5-тилетняя выживаемость больных раком легкого, получивших радикальные лечение, составляет при I стадии заболевания 60,5-60,8 % (в зависимости от характера лечения), при II стадии 41,0-52,7% при III стадии 20,5-27,5 % соответственно (В.В. Жарков, В.П. Курчин, П.И. Моисеев, 1999).
Поэтому основной задачей рентгенологического исследования является выявления и диагностика ранних и малых форм рака легкого.
К раннему периферическому раку (согласно TNM классификации злокачественных опухолей) относятся новообразования не более 3 см в наибольшем измерении, без признаков инвазии в плевру и при отсутствии метастазов в лимфоузлах (T1N0M0). Термин “малый рак” уточняет только размеры первичного очага опухоли.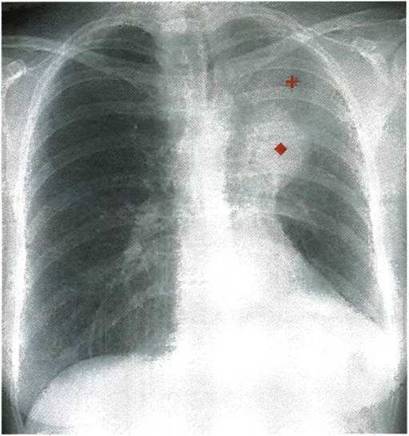 Однако, чем меньше размеры новообразования, тем, как правило, меньше вероятность метастазирования.
Однако, чем меньше размеры новообразования, тем, как правило, меньше вероятность метастазирования.
Только у 30% больных начальный рак с самого начала имеет округлую форму. Чаще всего это небольшая, малоинтенсивная тень неправильной, полигональной формы (Рис. 5) с нечеткими или с не совсем четкими контурами. В некоторых случаях тень удлиненной формы напоминает участок фиброза легочной ткани. Первыми признаками рака могут быть грубые тяжистые тени и (или) резкая деформация и сгущение легочного рисунка на ограниченном участке (Рис. 6).
При полостной форме начального рака опухоль может определяться в виде полости небольших размеров с относительно тонкими, неровными контурами. С течением времени отмечается увеличение размеров как самой тени, так и полости, а стенки ее приобретают бугристый внутренний контур. Периодически полость может заполняться опухолевыми массами, а затем появляться вновь (Рис. 7).
Бронхиолоальвеолярный рак на начальной стадии развития имеет вид инфильтративной тени, на фоне которой выявляются небольшие, округлые просветления с четкими контурами.
Изображения маленьких (не более 1-1,5 см в диаметре) раковых опухолей часть накладываются на тени ребер. При этом небольшой участок ребра оказывается более интенсивным (Рис. 8). При такой картине необходимо выполнить контрольную рентгеноскопию.
Ведущее значение в детализации скиалогической картины при подозрении на периферический рак имеет томография, особенно прицельная под визуальным контролем на современных аппаратах с цифровой обработкой изображения типа Siregraph СF фирмы Siemens.
С помощью этого метода более четко, чем на обычной рентгенограмме, выявляется структура тени, ее контуры, состояние окружающих тканей, а также удается выявить метастазы в лимфоузлах корней легких и частично средостения. На томограммах хорошо определяется тень междолевой плевры, что позволяет уточнить локализацию опухоли, переход ее на соседние доли и поражение междолевой плевры. С помощью томографии можно более четко установить связь периферического рака, расположенного в плащевом слое, с висцеральной плеврой. Следует лишь отметить, что, по данным рентгенологического исследования, не всегда можно разграничить опухолевое поражение висцеральной плевры и воспалительный или фиброзный процесс.
Следует лишь отметить, что, по данным рентгенологического исследования, не всегда можно разграничить опухолевое поражение висцеральной плевры и воспалительный или фиброзный процесс.
При размерах новообразования более 3 см, а также при поражении висцеральной или междолевой плевры опухоль обозначается символом Т2.
По мере роста периферического рака опухоль метастазирует в регионарные (N1) и медиастианальные (N 2) лимфоузлы с той же стороны, а также лимфоузлы с противоположной стороны (N3), отдаленные органы (М1), может прорастать окружающие ткани, структуры средостения (Т3, Т4), а также бронхи разного калибра (централизация опухоли), вызывая все клинико-рентгенологические признаки центрального рака, что значительно усложняет проведение лечения, а в некоторых случаях делает его невозможным.
Значительно более информативным методом определения степени распространения опухолей является компьютерная томография. Только с помощью этого неинвазивного метода можно выявить небольшие (2 см и больше) метастазы в лимфоузлах средостения, прорастание опухоли в крупные сосуды, перикард и сердце.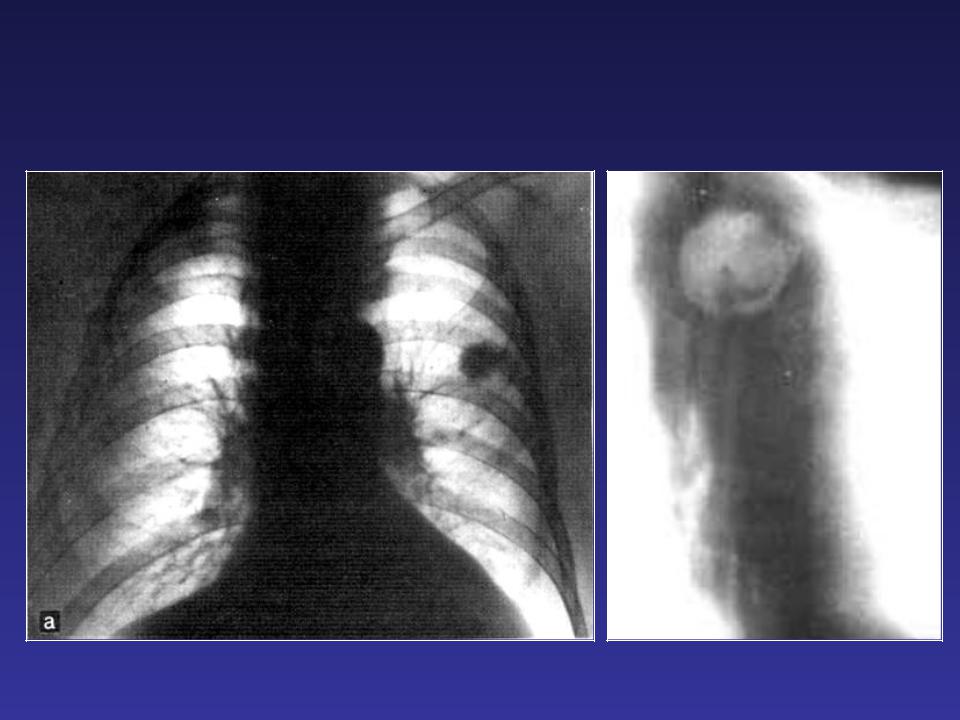
К периферическому раку относятся также верхушечный и кортико-плевральный рак, имеющие характерные клинико-рентгенологические проявления.
Верхушечный рак легкого (опухоль Пэнкоста).
В современном понимании — это стелющийся периферический рак I сегмента легкого, прорастающий окружающие ткани, приводящий к разрушению I, II, иногда III ребер и верхних грудных позвонков.
В начале заболевания клиническая картина скудна и проявляется болями в верхней конечности без других неврологических симптомов, что приводит к диагностическим ошибкам и безуспешному лечению по поводу плексита или бурсита.
Рентгенологическая картина опухоли Пэнкоста в этот период также не характерна. В некоторых случаях отмечается лишь понижение прозрачности верхушки легкого, в других — малоинфонсивная плоская тень без четких контуров, симулирующая апикальные плевральные наложения.
На определенном этапе роста опухоли нижний край затемнения на верхушке становится более четким, а сама тень более интенсивной и оформленной.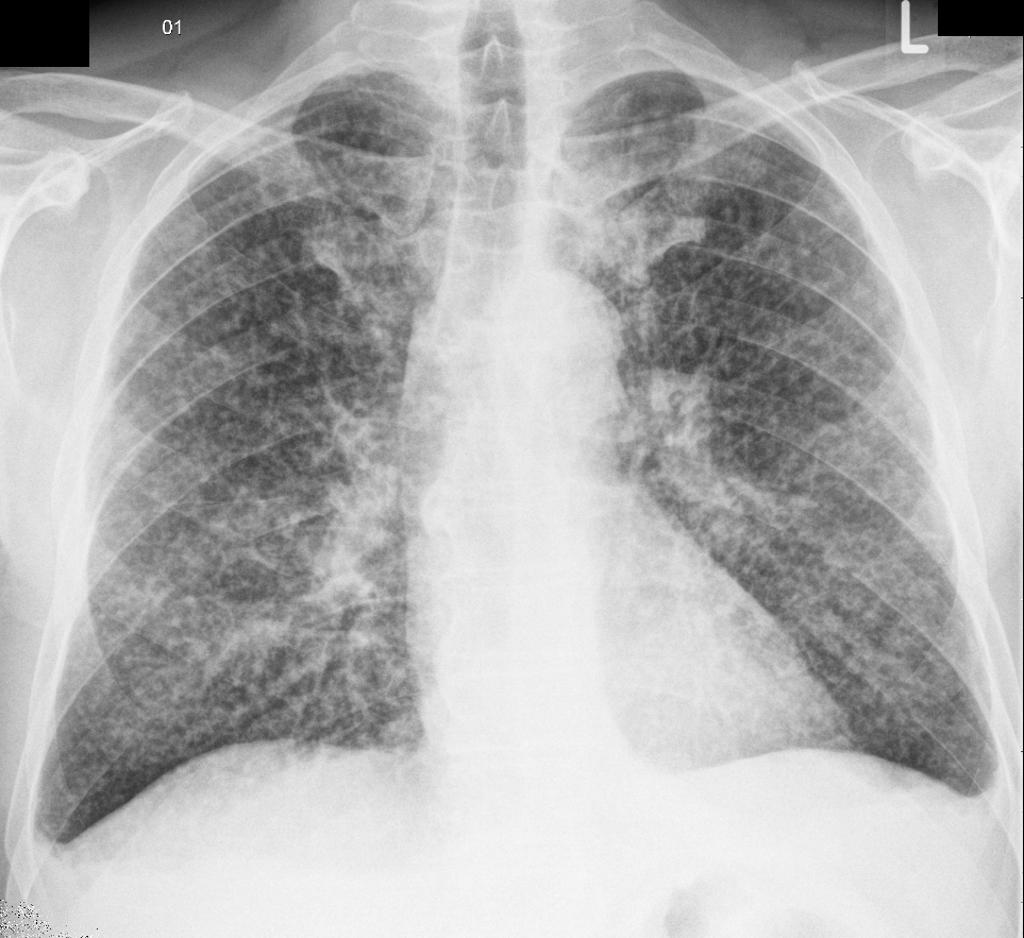 Изменения со стороны ребер не выявляются. Клинически отмечаются нарастающие боли в верхней конечности и грудной клетке.
Изменения со стороны ребер не выявляются. Клинически отмечаются нарастающие боли в верхней конечности и грудной клетке.
Для уточнения характера поражения у больных с такой клинико-рентгенологической картиной необходимо использовать томографию.
В дальнейшем опухоль прорастает ребра, позвонки, плечевое сплетение. Сдавление подключичных сосудов может вызвать отек конечности, при поражении пограничного симпатического ствола развивается синдром Горнера — птоз, энофтальм, миоз.
В этой стадии заболевания на рентгенограммах выявляется интенсивное затемнение верхушки легкого с дугообразной нижней границей. Очертания верхней части тени четко не выявляются. Определяется разрушение I-III ребер — от узурации небольших участков до полной деструкции на большом протяжении, а также поражение боковых поверхностей тел и поперечных отростков позвонков.
Важно подчеркнуть, что при наличии интенсивного затемнения верхушек легких, необходимо тщательно изучать состояние ребер, особенно их задних отрезков.
Кортико-плевральный рак (этот термин признается не всеми онкологами, но, с нашей точки зрения, имеет право на существование) также является периферическим раком, но исходящим из плащевого слоя легкого непосредственно у позвоночника. Опухоль растет не узлом, а стелется по плевре, врастая в поперечные отростки, дужки и тела позвонков. По нашим данным, основным симптомом такой опухоли являются нарастающие боли в грудном отделе позвоночника, не поддающиеся терапии. В последующем может развиваться клиника, обусловленная поражением спинного мозга.
Поражения легких и позвоночника на стандартных рентгенограммах вначале могут вообще не выявляться, а болевые ощущения рассматриваются как следствие дегенеративно-дистрофических изменений в позвонках (Рис. 9).
Только на компьютерных томограммах определяется небольшая дополнительная мягкотканная тень бугристого образования в виде «нашлепки» на боковой поверхности тела позвонка (Рис. 10).
В дальнейшем на рентгенограммах появляется деструкция тела позвонков, поперечных отростков, а иногда и ребер, которая (без данных продольной или компьютерной томографии) расценивается как метастатическое поражение. В других случаях опухоль стелется вдоль позвоночника на значительном протяжении. При этом интенсивная гомогенная, расположенная парамедиастинально (паравертебрально) тень с довольно четким наружным контуром может на передне-задних рентгенограммах легких симулировать картину плеврита.
По мере роста опухоль может распространяться и на верхушку легкого. Деструкция ребер и позвонков к этому времени выявляется уже на обычных рентгенограммах и продольных томограммах.
Как видно из приведенных данных, диагностика периферического рака представляет подчас значительные трудности. Поэтому больных с выявленными округлыми тенями в легких, без достоверных признаков туберкулеза (типичный инфильтрат, очаговые изменения) следует направлять в онкологические учреждения для уточнения диагноза и назначения адекватного лечения. Направлению в онкологические учреждения подлежат также больные с достаточно большим распространением опухоли и метастазами в лимфоузлах средостения. Успехи хирургии и химио-лучевой терапии значительно расширяют возможности лечения даже таких больных. Однако основной задачей лучевой диагностики является выявление ранних форм рака легкого.
Направлению в онкологические учреждения подлежат также больные с достаточно большим распространением опухоли и метастазами в лимфоузлах средостения. Успехи хирургии и химио-лучевой терапии значительно расширяют возможности лечения даже таких больных. Однако основной задачей лучевой диагностики является выявление ранних форм рака легкого.
ПЕРИФЕРИЧЕСКАЯ УЗЛОВАЯ САРКОМА ЛЕГКОГО: СЛУЧАЙ ИЗ ПРАКТИКИ И КРАТКИЙ ОБЗОР ЛИТЕРАТУРЫ / 2-й номер / 2015 год
- Номера журналов
- 2015 год
- 2-й номер
- ПЕРИФЕРИЧЕСКАЯ УЗЛОВАЯ САРКОМА…
УДК 616.24-006.3.04
© Игнатьева Т.П., 2015
Поступила 08.04.2015 г.
Т.П. ИГНАТЬЕВА
ПЕРИФЕРИЧЕСКАЯ УЗЛОВАЯ САРКОМА ЛЕГКОГО:
СЛУЧАЙ ИЗ ПРАКТИКИ И КРАТКИЙ ОБЗОР ЛИТЕРАТУРЫ
Новочебоксарская городская больница, Новочебоксарск
Приведены данные литературы и собственное клиническое наблюдение периферической узловой саркомы легкого у пациента 75 лет, отмечены особенности лучевой семиотики и подчеркнута редкость данной патологии среди злокачественных новообразований легких.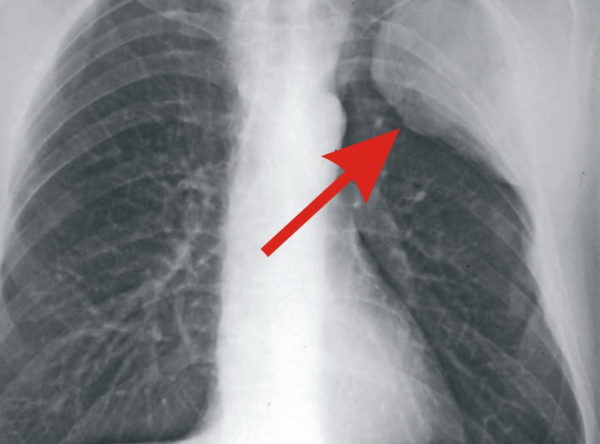
Ключевые слова: узловая периферическая саркома легкого, лучевая семиотика при обычном рентгенологическом исследовании, рентгеновская компьютерная томография.
Введение. Саркома легкого — первичная злокачественная опухоль неэпителиального происхождения, возникающая из элементов мезенхимы, встречается крайне редко [1, 4, 5, 6, 7] в отличие от эпителиальных злокачественных опухолей, рака легкого, возникающего из бронхиального эпителия и характеризующегося инфильтрирующим ростом с прорастанием бронхов, локальной инвазией, распространением через лимфатические и кровеносные сосуды, агрессивным ростом, быстрым метастазированием с системным распространением в 2/3 случаев на момент проявления заболевания [2]. В отличие от рака легкого узловая периферическая саркома, даже при больших размерах, обычно не прорастает в бронхи, а оттесняет и раздвигает их [5, 6].
К 1968 г. в мировой литературе описано немногим более 200 наблюдений сарком легкого [4].
Существуют центральные и периферические (кортикоплевральные, внутридолевые) формы сарком легких. Чаще, до 81% случаев [6], встречаются периферические формы сарком. Соотношение мужчин и женщин одинаково. Клинико-анатомически периферические формы подразделяются на одноузловые, многоузловые, пневмониоподобные (инфильтративные) и множественные пневмониоподобные инфильтраты.
На основе гистологической классификации (ВОЗ, 1999) выделяют наиболее часто встречающиеся основные морфологические группы мягкотканных сарком легких: миогенные (лейомиосаркома, рабдомиосаркома), ангиогенные (злокачественная гемангиоперицитома или гемангиоэндотелиома), злокачественная фиброзная гистиоцитома, злокачественная шваннома, фибросаркома, липосаркома. Возникает опухоль в соединительной ткани — перибронхиальной, периваскулярной, междольковой. Конкретная гистологическая природа сарком легких не может быть определена как при классическом, рентгенологическом исследовании, так и при рентгеновской компьютерной томографии (РКТ), но рентгенологическая картина саркомы имеет свои отличительные особенности.
Обычное рентгенологическое исследование. В отличие от рака легких особенностью периферической узловой формы сарком при обычном рентгенологическом исследовании является четкая очерченность контуров, как это бывает при доброкачественных образованиях. Выраженная изолированность опухолевых теней, резкие очертания, тенденция переходить границу долей — все это служит до известной степени опорными пунктами, чтобы отдать предпочтение диагнозу саркомы перед раком [1]. При больших размерах узловых сарком контуры становятся бугристыми, бронхи оттесняются и смещаются. Рентгеносемиотика центральной саркомы идентична таковой при немелкоклеточном раке легкого. Рентгенологически периферическая саркома легкого выявляется в виде однородного шаровидного или овоидного образования с четкими, волнистыми, редко полициклическими контурами. Пораженная доля увеличивается в объеме, может давать картину лобита. Саркоме свойственно переходить границы доли, оттесняя и компремируя ткань окружающего легкого.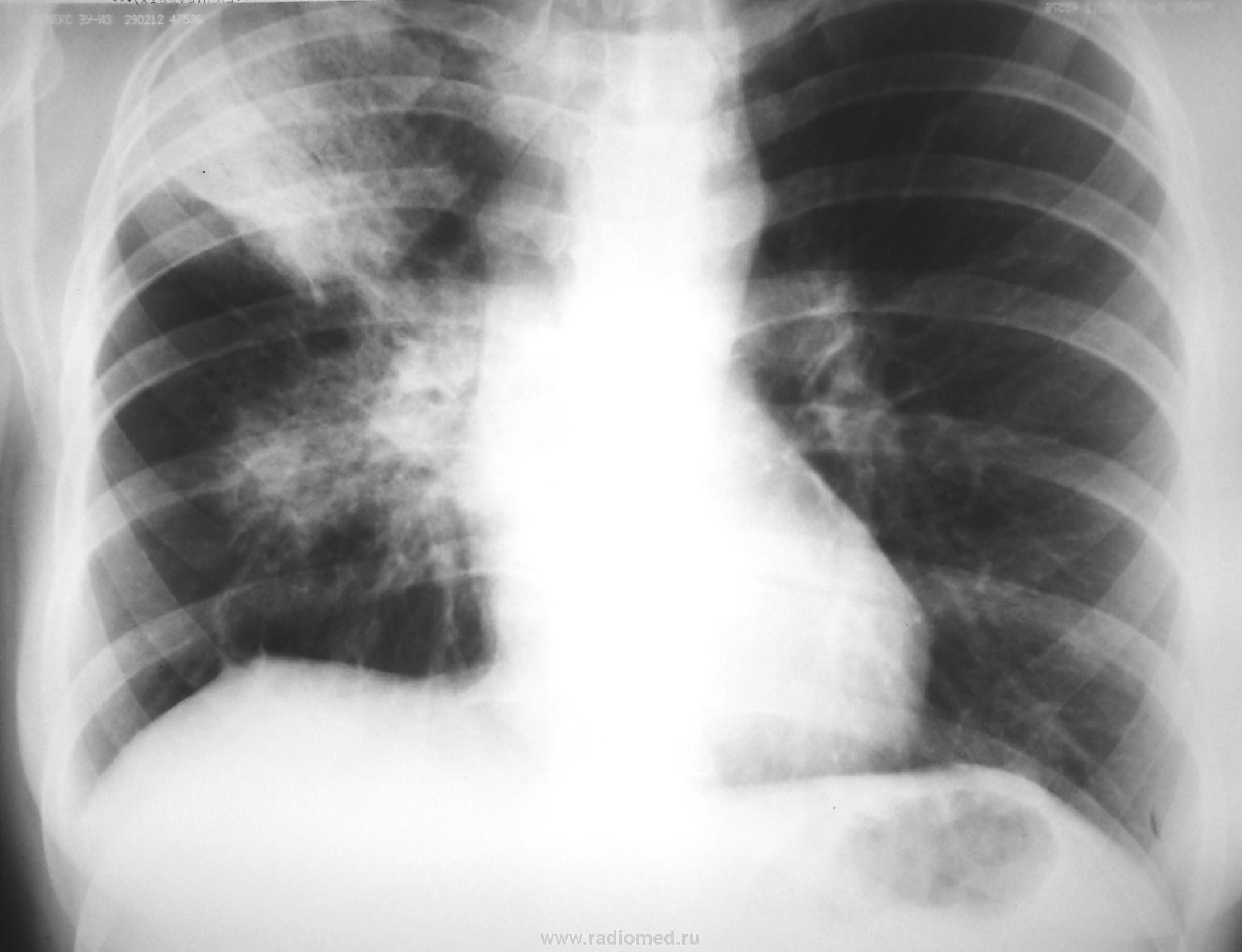
Обтурационный ателектаз развивается крайне редко [7], поскольку опухоль не врастает в просвет бронха, локализуясь в периферических отделах легкого субплеврально, и лишь при переходе в инфильтрирующую фазу роста возникает ателектаз соответствующих отделов легкого, сегментов или доли. По мнению Ф.Г. Углова [7], это должно быть главным моментом в дифференциальной диагностике между саркомой и раком легкого. Метастазирует саркома легкого поздно, несмотря на большие и огромные размеры. Частота метастазирования во внутригрудные лимфатические узлы небольшая, в 10% [6]. Сопутствующие пневмонии при саркоме в отличие от рака встречаются редко [5].
Особенности клинической картины. Трудности диагностики саркомы вызваны длительным бессимптомным течением. Пациенты обращаются лишь тогда, когда саркома достигает больших размеров, переходя из длительного экспансивного периода роста в инфильтрирующую фазу, прорастает в грудную клетку, крупные бронхи, при этом появляются кашель, боль в груди, кровохарканье.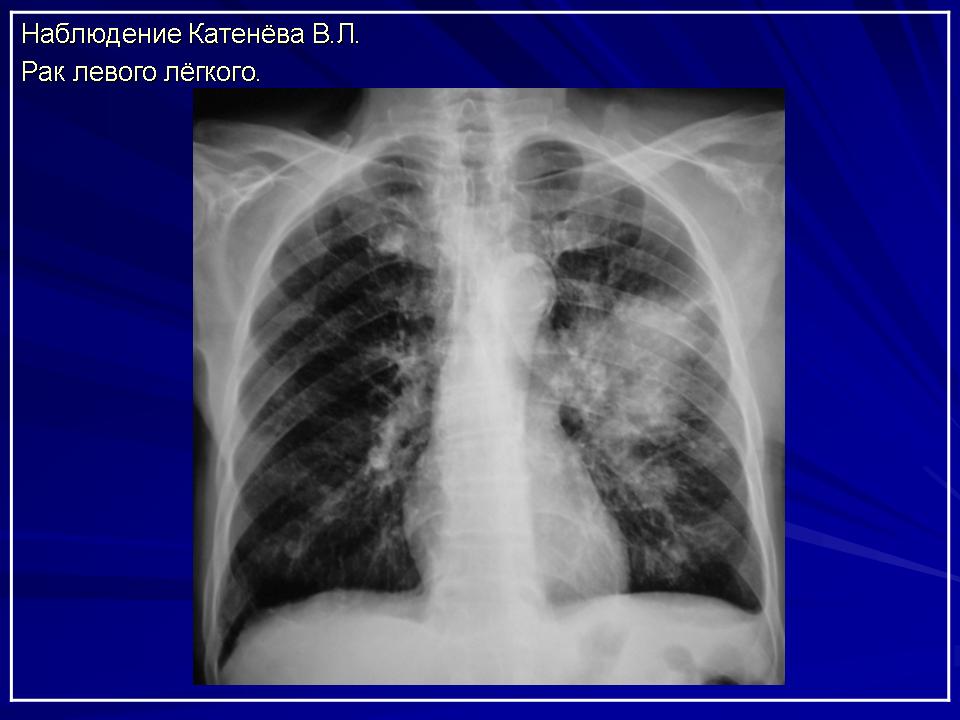 Считается, что боли в груди — первые клинические проявления саркомы из-за ее субплевральной локализации в периферических отделах легких, инкапсулирования. Характерен медленный длительный экспансивный рост, четкое отграничение от окружающих тканей. Инкапсуляция узла, длительное отсутствие метастазирования позволяют провести оперативное удаление даже огромной опухоли в отличие от рака легкого. Период выживания при этом более продолжителен, чем при мелкоклеточных формах рака легкого.
Считается, что боли в груди — первые клинические проявления саркомы из-за ее субплевральной локализации в периферических отделах легких, инкапсулирования. Характерен медленный длительный экспансивный рост, четкое отграничение от окружающих тканей. Инкапсуляция узла, длительное отсутствие метастазирования позволяют провести оперативное удаление даже огромной опухоли в отличие от рака легкого. Период выживания при этом более продолжителен, чем при мелкоклеточных формах рака легкого.
Клинический случай. Приводим собственное наблюдение. Пациент С., 75 лет, пенсионер, до пенсии работал монтажником, 28.08.2014 г. поступил по «03» в приемное отделение Новочебоксарской городской больницы по направлению вызванного на дом участкового терапевта. Сразу же при поступлении была выполнена рентгенограмма органов грудной клетки и обнаружено субтотальное затенение левой половины грудной клетки с небольшим просветлением в нижнем отделе. Пациент госпитализирован в одно из терапевтических отделений с диагнозом: Внебольничная тотальная пневмония левого легкого, тяжелое течение. Дыхательная недостаточность II степени. Сопутствующий диагноз: Цирроз печени. Злоупотребление суррогатами алкоголя. Жалобы пациента при поступлении на повышение температуры до 39°С, головные боли, отсутствие аппетита, редкий малопродуктивный кашель, общую слабость. Анамнез болезни: заболел остро неделю назад, когда появились вышеперечисленные жалобы. Принимал самостоятельно парацетамол, но самочувствие не улучшалось. Заболевания, перенесенные в течение жизни: редкие ОРВИ. Со слов жены, злоупотребляет суррогатами алкоголя много лет до 3 раз в день. При объективном обследовании общее состояние тяжелое, положение пассивное. Сознание сохранено, но контакту доступен с трудом из-за глухоты и некоторых психических изменений, разговор не по существу. Выражение лица спокойное. Команды выполняет. Питание крайне снижено — истощен. Кожные покровы серые. В области наружного вертела правого бедра имеются поверхностные пролежни с корочкой 2х3 см. Лимфатические периферические узлы не увеличены. Мышечная система, костно-суставная система без видимой патологии.
Дыхательная недостаточность II степени. Сопутствующий диагноз: Цирроз печени. Злоупотребление суррогатами алкоголя. Жалобы пациента при поступлении на повышение температуры до 39°С, головные боли, отсутствие аппетита, редкий малопродуктивный кашель, общую слабость. Анамнез болезни: заболел остро неделю назад, когда появились вышеперечисленные жалобы. Принимал самостоятельно парацетамол, но самочувствие не улучшалось. Заболевания, перенесенные в течение жизни: редкие ОРВИ. Со слов жены, злоупотребляет суррогатами алкоголя много лет до 3 раз в день. При объективном обследовании общее состояние тяжелое, положение пассивное. Сознание сохранено, но контакту доступен с трудом из-за глухоты и некоторых психических изменений, разговор не по существу. Выражение лица спокойное. Команды выполняет. Питание крайне снижено — истощен. Кожные покровы серые. В области наружного вертела правого бедра имеются поверхностные пролежни с корочкой 2х3 см. Лимфатические периферические узлы не увеличены. Мышечная система, костно-суставная система без видимой патологии. Грудная клетка правильной формы. Органы дыхания: грудная клетка безболезненная при пальпации, перкуторный звук притуплен слева. Аускультативно: дыхание в правом легком жесткое, в левом ослабленное, сухие хрипы в нижних отделах. ЧД − 24 в 1 мин. Органы кровообращения: область сердца без видимой патологии, тоны сердца приглушены ритмичные, учащены. АД − 90/60 мм. рт. ст., ЧСС − 98 в 1 мин, Sp O2 91-82%. Органы пищеварения: печень + 6,0 см из-под края реберной дуги. Мочеполовая и нервная система без существенных отклонений от нормы. Клинический анализ крови: Hb − 86 г/л, Er − 3,01х1012, L 12,3х109, п/я − 1%, с/я − 63%, л − 35%, м − 11%. СОЭ − 61 мм/ч. Биохимический анализ крови: билирубин − 30,0 мкм/л, АлАт − 18 Ед/л, АсАт − 71 Ед/л. С-реактивный белок − 77 мг/л, Fe − 3,1 мкм/л, общая Fe связывающая способность снижена до 25,2 мкм/л (при норме 38,5 − 85,5). Мокрота на КУБ — отрицательна. Состояние на 01.09.2014 г.: активно жалоб не предъявляет, некритичен к своему состоянию, путается в датах, событиях.
Грудная клетка правильной формы. Органы дыхания: грудная клетка безболезненная при пальпации, перкуторный звук притуплен слева. Аускультативно: дыхание в правом легком жесткое, в левом ослабленное, сухие хрипы в нижних отделах. ЧД − 24 в 1 мин. Органы кровообращения: область сердца без видимой патологии, тоны сердца приглушены ритмичные, учащены. АД − 90/60 мм. рт. ст., ЧСС − 98 в 1 мин, Sp O2 91-82%. Органы пищеварения: печень + 6,0 см из-под края реберной дуги. Мочеполовая и нервная система без существенных отклонений от нормы. Клинический анализ крови: Hb − 86 г/л, Er − 3,01х1012, L 12,3х109, п/я − 1%, с/я − 63%, л − 35%, м − 11%. СОЭ − 61 мм/ч. Биохимический анализ крови: билирубин − 30,0 мкм/л, АлАт − 18 Ед/л, АсАт − 71 Ед/л. С-реактивный белок − 77 мг/л, Fe − 3,1 мкм/л, общая Fe связывающая способность снижена до 25,2 мкм/л (при норме 38,5 − 85,5). Мокрота на КУБ — отрицательна. Состояние на 01.09.2014 г.: активно жалоб не предъявляет, некритичен к своему состоянию, путается в датах, событиях. Осмотр невролога: цереброваскулярная болезнь. Дисциркуляторная энцефалопатия II-III ст. смешанного генеза (атеросклеротического, дисметаболического) с цефалгическим, вестибулопатическим синдромом, когнитивными нарушениями. Рекомендованы магнитно-резонансная томография головного мозга, ультразвуковая диагностика головы, дуплексное сканирование брахиоцефальных артерий. Состояние на 01.09.2014 г.: активно жалоб не предъявляет, разговор не по существу, но отмечает влажный кашель. Мокроту из-за выраженных когнитивных нарушений не сдает. УЗИ почек: повышение эхогенности коркового вещества. Заключение: диффузные изменения почек. УЗИ брюшной полости: гепатомегалия, диффузные изменения печени с нарушением архитектоники (цирроз). Расширение воротной и селезеночной вены до 17 мм и 13 мм соответственно. Реканализация пупочной вены. Реактивные изменения желчного пузыря.
Осмотр невролога: цереброваскулярная болезнь. Дисциркуляторная энцефалопатия II-III ст. смешанного генеза (атеросклеротического, дисметаболического) с цефалгическим, вестибулопатическим синдромом, когнитивными нарушениями. Рекомендованы магнитно-резонансная томография головного мозга, ультразвуковая диагностика головы, дуплексное сканирование брахиоцефальных артерий. Состояние на 01.09.2014 г.: активно жалоб не предъявляет, разговор не по существу, но отмечает влажный кашель. Мокроту из-за выраженных когнитивных нарушений не сдает. УЗИ почек: повышение эхогенности коркового вещества. Заключение: диффузные изменения почек. УЗИ брюшной полости: гепатомегалия, диффузные изменения печени с нарушением архитектоники (цирроз). Расширение воротной и селезеночной вены до 17 мм и 13 мм соответственно. Реканализация пупочной вены. Реактивные изменения желчного пузыря.
08.09.2014 г. выполнена рентгенограмма легких в вынужденном положении лежа, в динамике — без положительных изменений. Кровь на ВИЧ от 08. 09.2014 г. (согласно приказу №295) − отрицательна. Кровь на стерильность — стерильна. Цитологическое исследование мокроты на атипические клетки: сплошные тяжи целых и лизированных лейкоцитов, единичные макрофаги, отмечаются единичные разрозненные клетки эпителия с реактивными изменениями до уровня дисплазии II ст. Проводилось комплексное лечение пневмонии, направленное на подавление инфекции, восстановление общей и легочной резистентности, улучшение дренажной функции бронхов, лечение сопутствующей патологии. Динамический эпикриз от 10.09.2014 г. — незначительная положительная динамика, стал более активен, ходит до туалета, понемногу ест. В легких динамика отрицательная — появились хрипы под правой лопаткой. В анализах крови сохраняются лейкоцитоз, анемия с тенденцией дальнейшего снижения гемоглобина. Назначена компьютерная томография легких в целях уточнения диагноза.
09.2014 г. (согласно приказу №295) − отрицательна. Кровь на стерильность — стерильна. Цитологическое исследование мокроты на атипические клетки: сплошные тяжи целых и лизированных лейкоцитов, единичные макрофаги, отмечаются единичные разрозненные клетки эпителия с реактивными изменениями до уровня дисплазии II ст. Проводилось комплексное лечение пневмонии, направленное на подавление инфекции, восстановление общей и легочной резистентности, улучшение дренажной функции бронхов, лечение сопутствующей патологии. Динамический эпикриз от 10.09.2014 г. — незначительная положительная динамика, стал более активен, ходит до туалета, понемногу ест. В легких динамика отрицательная — появились хрипы под правой лопаткой. В анализах крови сохраняются лейкоцитоз, анемия с тенденцией дальнейшего снижения гемоглобина. Назначена компьютерная томография легких в целях уточнения диагноза.
11.09.2014 г. выполнена компьютерная томография легких № 5396: в левом легком определяется гигантское объемное патологическое образование, занимающее всю значительно увеличенную верхнюю долю, имеющее форму узла неправильно овальной формы (рис. 1, 2, 3, 4), размером 140х80х157 мм. Плотность узла гетерогенная (от -20 до +10 ед. Х.) из-за многочисленных воздушных пузырьков, местами сливающихся в более крупные воздушные полости за счет распада в тканях узла. Контуры объемного образования четкие, волнистые. Окружающая легочная ткань оттеснена, сдавлена за счет провисания гигантского узла книзу. Грудная аорта и трахея также сдавлены и оттеснены вправо. Частично сохранена пневматизация сегментов нижней доли, в которой прослеживаются цилиндрические ателектазы. Воздушные просветы бронхов правого легкого сохранены. В плевральных полостях жидкость, больше ее слева. Жидкость в полости перикарда. Увеличены медиастинальные лимфатические узлы всех групп. Свободная жидкость в брюшной полости. Заключение: РКТ картина соответствует экспансивно растущей узловатой периферической саркоме верхней доли левого легкого. Медиастинальная лимфоаденопатия. Двусторонний плевральный выпот, гидроперикард. Асцит. Проведена консультация онколога, его заключение: учитывая значительный объем поражения, запущенность процесса, наличие выраженной сопутствующей патологии и низкие функциональные показатели, радикальному лечению не подлежит.
1, 2, 3, 4), размером 140х80х157 мм. Плотность узла гетерогенная (от -20 до +10 ед. Х.) из-за многочисленных воздушных пузырьков, местами сливающихся в более крупные воздушные полости за счет распада в тканях узла. Контуры объемного образования четкие, волнистые. Окружающая легочная ткань оттеснена, сдавлена за счет провисания гигантского узла книзу. Грудная аорта и трахея также сдавлены и оттеснены вправо. Частично сохранена пневматизация сегментов нижней доли, в которой прослеживаются цилиндрические ателектазы. Воздушные просветы бронхов правого легкого сохранены. В плевральных полостях жидкость, больше ее слева. Жидкость в полости перикарда. Увеличены медиастинальные лимфатические узлы всех групп. Свободная жидкость в брюшной полости. Заключение: РКТ картина соответствует экспансивно растущей узловатой периферической саркоме верхней доли левого легкого. Медиастинальная лимфоаденопатия. Двусторонний плевральный выпот, гидроперикард. Асцит. Проведена консультация онколога, его заключение: учитывая значительный объем поражения, запущенность процесса, наличие выраженной сопутствующей патологии и низкие функциональные показатели, радикальному лечению не подлежит. Рекомендовано: 1) встать на учет у онколога, 2) симптоматическое лечение под наблюдением участкового терапевта. Диагноз: злокачественная опухоль левого легкого (саркома). Стадия Т 4. N 2. М 0.
Рекомендовано: 1) встать на учет у онколога, 2) симптоматическое лечение под наблюдением участкового терапевта. Диагноз: злокачественная опухоль левого легкого (саркома). Стадия Т 4. N 2. М 0.
Рис. 1. РКТ органов грудной клетки, фронтальный срез. Узловая мягкотканная саркома верхней доли левого легкого. Смещение сердца и других органов вправо массивным новообразованием
Рис. 2. РКТ органов грудной клетки , сагиттальный срез. Саркома легкого , продолжение. Компремирующее воздействие на сердце
Рис. 3. РКТ органов грудной клетки, аксиальный срез на уровне дуги аорты. Саркома легкого, продолжение. Оттеснение органов средостения вправо
Рис. 4. РКТ органов грудной клетки, аксиальный срез ниже дуги аорты. Сужение правого гемиторакса
15.09.2014 г. выписан домой с небольшой положительной динамикой. Продолжает сохраняться субфебрильная температура 37,5оС.
Заключение. Как известно, до 60 гг. ХХ столетия традиционная рентгенография была основным и по существу единственным методом дооперационной диагностики заболеваний и повреждений органов грудной клетки.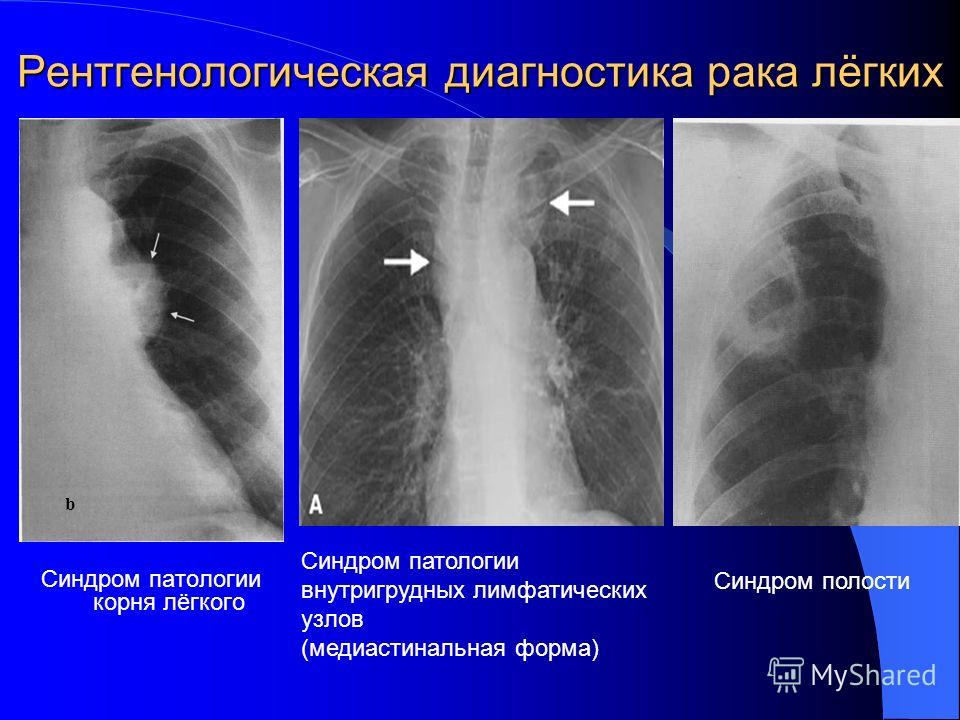 Были разработаны достаточно полновесные для того времени методика и семиотика рентгенологической диагностики, в настоящее время дополненные РКТ, позволяющей решать самые трудные задачи, недоступные традиционной рентгенографии, а именно получить изображение органов грудной клетки на любом уровне, изучить состояние пораженной легочной ткани, воздухопроводящие пути, оценить поверхности реберной, диафрагмальной, медиастинальной и междолевой плевры, обнаружить наличие плевральной и медиастинальной жидкости, состояние лимфатических узлов, выявить деструктивные изменения в ребрах и позвонках, инвазию прилежащих сосудистых структур, компрессию окружающей легочной ткани, а также ответить на многие вопросы, интересующие врача-клинициста. Разумеется, любой диагноз онкологического заболевания нуждается в гистологической верификации, но современная онкология не может существовать без современных методов медицинской визуализации, имеющих решающее значение в выявлении злокачественных образований и дополняющих представление о характере патологии.
Были разработаны достаточно полновесные для того времени методика и семиотика рентгенологической диагностики, в настоящее время дополненные РКТ, позволяющей решать самые трудные задачи, недоступные традиционной рентгенографии, а именно получить изображение органов грудной клетки на любом уровне, изучить состояние пораженной легочной ткани, воздухопроводящие пути, оценить поверхности реберной, диафрагмальной, медиастинальной и междолевой плевры, обнаружить наличие плевральной и медиастинальной жидкости, состояние лимфатических узлов, выявить деструктивные изменения в ребрах и позвонках, инвазию прилежащих сосудистых структур, компрессию окружающей легочной ткани, а также ответить на многие вопросы, интересующие врача-клинициста. Разумеется, любой диагноз онкологического заболевания нуждается в гистологической верификации, но современная онкология не может существовать без современных методов медицинской визуализации, имеющих решающее значение в выявлении злокачественных образований и дополняющих представление о характере патологии.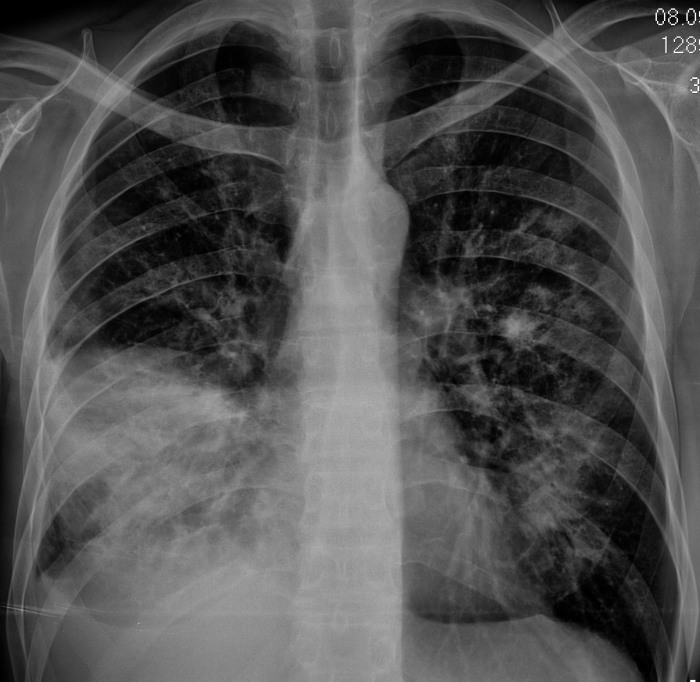
СПИСОК ЛИТЕРАТУРЫ
- Богуславская Т.В. К казуистике первичных сарком легкого / Т.В. Богуславская // Врачебное дело. — 1954. — № 9-10.
- Ланге С. Лучевая диагностика заболеваний органов грудной клетки / С. Ланге, Д. Уолш; пер. с англ. под ред. акад. РАМН С.К.Тернового, проф. А.И. Шехтера — М.: ГЭОТАР-Медиа, 2010. — С. 188-190.
- Прокоп М. Спиральная и многослойная компьютерная томография: учеб. пособие. В 2 т. Т. 2. / М. Прокоп, М. Галански; пер. с англ. под ред. А.В. Зубарева, Ш.Ш. Шотемора. — М.: Медпресс- информ, 2007. — С. 94-108.
- Розенштраух Л.С. Доброкачественные опухоли легких / Л.С. Розенштраух, А.И. Рождественская. — М.: Медицина, 1968. — 169 с.
- Розенштраух Л.С. Рентгенодиагностика заболеваний органов дыхания: руководство для врачей / Л.С. Розенштраух, Н.И. Рыбакова, М.Г. Виннер. — М.: Медицина, 1987. — С. 439-441.
- Чиссов В.И. Опухоли легкого / В.
 И. Чиссов, А.Х. Трахттенберг, К.И. Колбанов: под общ. ред. В.С. Савельева // 80 лекций по хирургии. — М.: Литтера, 2008. — С. 650-652.
И. Чиссов, А.Х. Трахттенберг, К.И. Колбанов: под общ. ред. В.С. Савельева // 80 лекций по хирургии. — М.: Литтера, 2008. — С. 650-652. - Углов Ф.Г. Рак легкого / Ф.Г. Углов. — М.: Ленинград. отд. Медгиза, 1962. — 256 с.
СВЕДЕНИЯ ОБ АВТОРЕ:
Игнатьева Татьяна Павловна
врач-рентгенолог высшей квалификационной категории рентгенологического отделения БУ «Новочебоксарская городская больница» Минздравсоцразвития Чувашии
Адрес для переписки:
429959, Чувашская Республика, г. Новочебоксарск, ул. Пионерская, д. 20
Тел.: +7(8352) 73-81-21;
E-mail: [email protected]
INFORMATION ABOUT THE AUTHOR:
Tatyana Pavlovna Ignatyeva
radiologist of higher qualification category at the radiology department of BI «Novocheboksarsk municipal hospital» the Health Care and Social Development Ministry of Chuvashia
Correspondence address:
Pionerskaya str. , 20, Novocheboksarsk, the Chuvash Republic, 429959
, 20, Novocheboksarsk, the Chuvash Republic, 429959
Tel.: +7 (8352) 73-81-21
E-mail: [email protected]
T.P. IGNATYEVA
PERIPHERAL NODE-BASED LUNGS SARCOMA:
PRACTICAL CASE AND LITERATURE REVIEW
Novocheboksarsk Municipal Hospital, Novocheboksarsk
The article deals with the literature review and own clinical observation of peripheral node-based lung sarcoma in a 75 year-old patient, the peculiarities of radiation semiotics and rarity of this disease among malignant tumors of the lungs.
Key words: peripheral node-based lung sarcoma, radiation semiotics of the ordinary X-ray examination, X-ray computed tomography.
Рак Легкого Рентгенограмма
Онкологические заболевания коварны своим скрытым развитием: по статистике более трети раковых опухолей обнаруживаются случайно уже на поздних стадиях.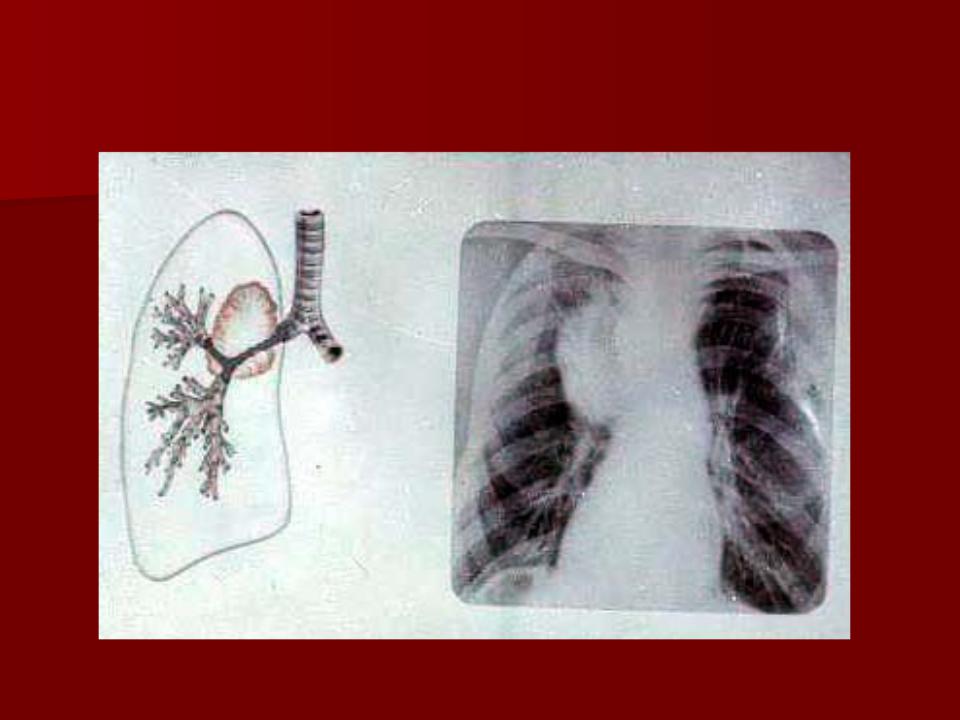 В органах грудной клетки злокачественные новообразования обнаруживаются случайно чаще всего, так как эта область организма регулярно обследуется с помощью рентгена. Скрининг позволяет своевременно выявить онкологическое заболевание, даже если оно протекает бессимптомно. Большинство пациентов, проходящих регулярные профилактические исследования, считает, что рак легких на рентгене виден недостаточно четко. По словам рентгенологов, использование современной цифровой аппаратуры позволяет увидеть незначительные по размеру опухоли на снимке и дифференцировать их от туберкулеза и других патологий. Скрининговый рентген при раке легких не является основным инструментом диагностирования заболевания.
В органах грудной клетки злокачественные новообразования обнаруживаются случайно чаще всего, так как эта область организма регулярно обследуется с помощью рентгена. Скрининг позволяет своевременно выявить онкологическое заболевание, даже если оно протекает бессимптомно. Большинство пациентов, проходящих регулярные профилактические исследования, считает, что рак легких на рентгене виден недостаточно четко. По словам рентгенологов, использование современной цифровой аппаратуры позволяет увидеть незначительные по размеру опухоли на снимке и дифференцировать их от туберкулеза и других патологий. Скрининговый рентген при раке легких не является основным инструментом диагностирования заболевания.
Как считать ребра и анализировать рентген легких, если вы не радиолог:
Рак легкого на рентгене может не обнаруживаться на начальных стадиях. Это обусловлено тем, что патологическое образование на протяжении роста протекает в 3 этапа: Рентгенограмма ..jpg) 11/22/ · Рентген-диагностика при раке легких: показания, преимущества, недостатки, что показывает, альтернативные методики. Как выглядит периферический и центральный рак на рентгенограмме?5/5(1). Рентгенограмма позволяет судить о состоянии костных структур, легких, плевры. рак легкого бывает центральный (см статью «Рентгенография: Центральный рак легкого.
11/22/ · Рентген-диагностика при раке легких: показания, преимущества, недостатки, что показывает, альтернативные методики. Как выглядит периферический и центральный рак на рентгенограмме?5/5(1). Рентгенограмма позволяет судить о состоянии костных структур, легких, плевры. рак легкого бывает центральный (см статью «Рентгенография: Центральный рак легкого.
Рентген легких при онкологическом заболевании не всегда оказывается информативным, то есть способен демонстрировать затемнение или просветление. Кроме того, первая степень патологии также определяется далеко не всегда, за счет незначительных размеров новообразования до 5 мм. Несмотря на это, рентгенография является одним из самых достоверных методов диагностики рака на любой стадии. Для того чтобы результаты оказались максимально достоверными, рекомендуется осуществлять исследование не только в прямой, но и в боковой проекции. Успешность постановки диагноза на представленном этапе напрямую ассоциируется с корректным применением рентгеновского оборудования.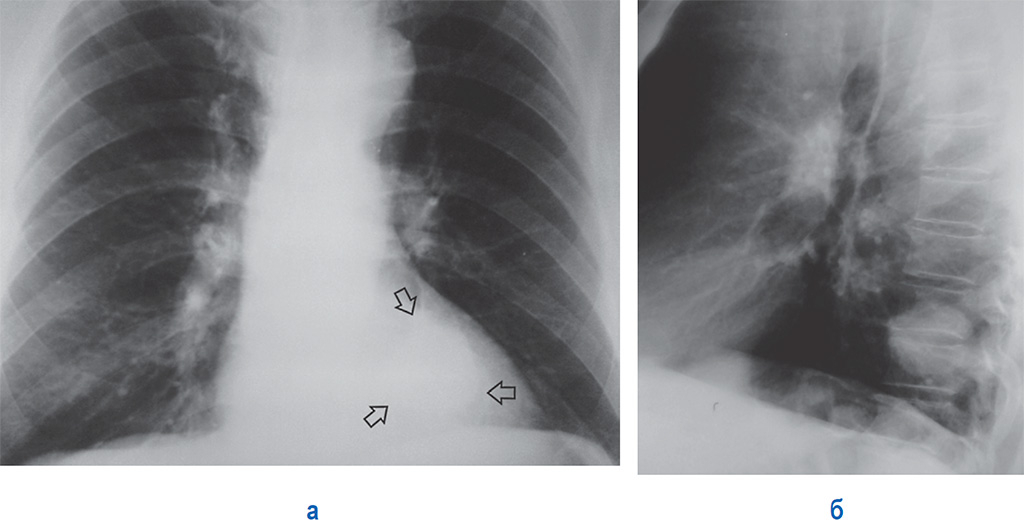 Также очень важно правильно предположить локализацию новообразования на основе существующих симптомов. Следует учитывать, что именно ранняя идентификация патологии способна сохранить человеческую жизнь. Именно поэтому специалисты настаивают на ряде дополнительных обследований, которые вместе с описываемым методом, сформируют полноценную картину.
Также очень важно правильно предположить локализацию новообразования на основе существующих симптомов. Следует учитывать, что именно ранняя идентификация патологии способна сохранить человеческую жизнь. Именно поэтому специалисты настаивают на ряде дополнительных обследований, которые вместе с описываемым методом, сформируют полноценную картину.
КАК ЧИТАТЬ РЕНТГЕН ЛЁГКИХ: ИНТЕРПРЕТАЦИЯ СНИМКА ГРУДНОЙ КЛЕТКИ:
У мужчин рак легких встречается в 7 10 раз ча Рак лёгкого является мультифакторным заболе не дифференцироваться на рентгенограммах. Своевременная диагностика рака легкого – серьезная и сложная задача для Периферический рак легкого на рентгенограмме имеет шаровидную. Рентгенограмма левого легкого. Периферический рак, развившийся на фоне рубца. Установлена определенная зависимость между рентгенологической.
Рентген легких при раке не всегда показывает затемнение или просветление. Локализация патологического образования за пределами грудной клетки средостения, задние синусы не позволяет четко отследить опухоль даже больших размеров. Для своевременной диагностики раковых образований нужно обязательно выполнять рентгенографию лёгких в прямой и боковой проекциях. Рак легких на рентгене определяется на ранних стадиях при правильном использовании этого метода рентгенодиагностики. Успех диагностики гарантируется правильным использованием рентгеновского обследования и предположением локализации опухоли на основе клинических симптомов. Раннее выявление рака гарантирует сохранение жизни человеку. Если тень узла располагается внутрибронхиально, оно не показывает затемнение на рентгеновском фото снимке.
Локализация патологического образования за пределами грудной клетки средостения, задние синусы не позволяет четко отследить опухоль даже больших размеров. Для своевременной диагностики раковых образований нужно обязательно выполнять рентгенографию лёгких в прямой и боковой проекциях. Рак легких на рентгене определяется на ранних стадиях при правильном использовании этого метода рентгенодиагностики. Успех диагностики гарантируется правильным использованием рентгеновского обследования и предположением локализации опухоли на основе клинических симптомов. Раннее выявление рака гарантирует сохранение жизни человеку. Если тень узла располагается внутрибронхиально, оно не показывает затемнение на рентгеновском фото снимке.
Современная диагностика рака легких: как определить, что у вас рак?:
Обнаружение рака лёгких на снимке. Обнаружить наличие онкологии при рентгеноскопии не так просто, ведь визуализируется опухоль от полусантиметра в диаметре, которая не загораживается тенью от других. 12/11/ · Как проявляется на рентгене центральный рак легких? Такая опухоль легкого на первых стадиях проявляется в виде следующих изменений: Появляется затемнение.4/5(1). Как обнаружить рак легких на рентгене. Рентгеновский снимок показывает рак легкого, который в размерах превышает 5 мм и не закрывается более интенсивными тенями (грудиной и сердцем).
В случае присутствия новообразования злокачественного характера на рентгене будет заметно просветление или затемнение. На начальной стадии, когда диаметр опухоли составляет менее 5 мм, заболевание может быть незаметно при таком методе диагностирования. Рентгенография является одним из наиболее точных методов диагностирования злокачественных опухолей. Обычно при подозрении раковых процессов процедура выполняется в двух проекциях: прямой и боковой. Сложность определения ракового процесса в легких на первой стадии с помощью рентгеновского снимка заключается в том, что маленькие опухоли могут попросту никак себя не проявлять. Но диагностика онкологии на ранних стадиях очень важна. Ее успех в данном случае во многом зависит от оценки клинических симптомов, относительно которых предполагается локализация опухоли.
Трудности рентгенологической диагностики пневмонии Тюрин И Е:
Рак лёгкого (бронхогенный рак, бронхогенная карцинома, разг. рак легких) Рентгенограмма грудной клетки, демонстрирующая опухоль в лёгких. Рак легкого (бронхогенная карцинома) стал одним из самых грозных заболеваний человека в последние годы. По своей частоте в. Рентген картина при центральном раке — наличие опухолевых масс в области корня легкого; гиповентиляция одного или нескольких сегментов легкого;.
Наиболее эффективным и доступным средством выявления легочных заболеваний на ранней стадии остается рентген. В результате специалист получает двухмерное изображение, на котором в белом цвете представлены плотные ткани, в черном — окружающее воздушное пространство. Важно понимать разницу между рентгеном и классической флюорографией. Он предназначен для получения изображений с разрешением более высокого уровня, благодаря чему их можно увеличивать до требуемых размеров. В результате обследования можно выявить как онкологические новообразования, так и проявления туберкулеза, паразитарных поражений, различные патологии органов дыхания и сердечно-сосудистой системы. От ее качества во многом зависит достоверность результатов. Все они считаются отклонением от нормы.
Метод исследования: рентген
И.Е. Тюрин — Визуализация рака легкого
Лучевая диагностика немелкоклеточного рака легкого
Какие результаты рентгенографии грудной клетки характерны для немелкоклеточного рака легкого (НМРЛ)?
Рак легкого: немелкоклеточный: статистика. Cancer.Net. Доступно по адресу https://www.cancer.net/cancer-types/lung-cancer-non-small-cell/statistics. Январь 2019; Дата обращения: 27 августа 2019 г.
Спиро С.Г., Гулд М.К., Колис Г.Л., Американский колледж грудных врачей. Первоначальная оценка пациента с раком легких: симптомы, признаки, лабораторные исследования и паранеопластические синдромы: руководящие принципы клинической практики, основанные на фактических данных ACCP (2-е издание). Сундук . 2007 сентябрь 132 (3 доп.): 149S-160S. [Медлайн].
Ravaioli A, Papi M, Pasquini E, Marangolo M, Rudnas B, Fantini M и др. Монотерапия липоплатином: испытание фазы II второй линии лечения метастатического немелкоклеточного рака легкого. Дж. Chemother . 2009 21 февраля (1): 86-90. [Медлайн].
Ohba T, Yamasaki T, Endo Y, Furuie M, Ohtani Y, Inase N и др. Фаза I исследования TS-1 плюс карбоплатин у пациентов с распространенным немелкоклеточным раком легкого. Дж. Chemother . 2009 21 февраля (1): 80-5. [Медлайн].
Ricciardi S, Tomao S, de Marinis F. Токсичность таргетной терапии при лечении немелкоклеточного рака легкого. Clin рака легких . 2009 10 (1): 28-35. [Медлайн].
Хербст Р.С., Линч Т.Дж., Сандлер А.Б. Помимо двойной химиотерапии для запущенного немелкоклеточного рака легкого: комбинация таргетных агентов с химиотерапией первой линии. Clin рака легких . 2009 Янв.10 (1): 20-7. [Медлайн].
[Рекомендации] Группа экспертов по торакальной визуализации:., De Groot PM, Chung JH, Ackman JB, Berry MF, Carter BW, et al. Критерии соответствия ACR ® Неинвазивная клиническая стадия первичного рака легкого. Дж. Ам Колл Радиол . 2019 май. 16 (5S): S184-S195. [Медлайн]. [Полный текст].
Martini N, Bains MS, Burt ME, et al. Частота местных рецидивов и вторичных первичных опухолей при резектированном раке легкого I стадии. J Thorac Cardiovasc Surg . 1995 Январь 109 (1): 120-9. [Медлайн].
Рек М., фон Павел Дж., Затлоукал П., Рамлау Р., Горбунова В., Хирш В. и др. Испытание фазы III цисплатина в сочетании с гемцитабином с плацебо или бевацизумабом в качестве терапии первой линии при не плоскоклеточном немелкоклеточном раке легкого: AVAil. Дж. Клин Онкол . 2009 10 марта. 27 (8): 1227-34. [Медлайн].
Фидиас П.М., Дахил С.Р., Лисс А.П., Леш Д.М., Уотерхаус Д.М., Бромунд Дж.Л. и др.Исследование фазы III немедленного по сравнению с отсроченным доцетакселом после первичной терапии гемцитабином плюс карбоплатин при распространенном немелкоклеточном раке легкого. Дж. Клин Онкол . 2009 г., 1. 27 (4): 591-8. [Медлайн].
Ханна Н., Нойбауэр М., Яннуцос С., МакГарри Р., Арсено Дж., Ансари Р. и др. Исследование фазы III цисплатина, этопозида и одновременного облучения грудной клетки с или без консолидированного доцетаксела у пациентов с неоперабельным немелкоклеточным раком легкого III стадии: Hoosier Oncology Group и U.С. Онкология. Дж. Клин Онкол . 2008 декабрь 10. 26 (35): 5755-60. [Медлайн].
Guerra L, Meregalli S, Zorz A, Niespolo R, De Ponti E, Elisei F и др. Сравнительная оценка целевого объема планирования (PTV) на основе КТ и респираторно-управляемой ПЭТ / КТ в определении планирования лучевой терапии при раке легкого: предварительные результаты. евро J Nucl Med Mol Imaging . 1 ноября 2013 г. [Medline].
Дейн Б, Гречушкин В, Планка А, Мур В, Бильфингер Т.Сравнение ПЭТ / КТ и КТ без контрастирования для наблюдения через 1 год после лобэктомии немелкоклеточного рака легкого I стадии. Am J Nucl Med Mol Imaging . 2013 19 сентября. 3 (5): 408-16. [Медлайн]. [Полный текст].
[Рекомендации] Mazzone PJ, Silvestri GA, Patel S, et al. Скрининг рака легких: Руководство CHEST и отчет экспертной комиссии. Сундук . 2018 Апрель 153 (4): 954-985. [Медлайн].
[Рекомендации] Национальная комплексная онкологическая сеть.Руководство NCCN по клинической практике в онкологии. Немелкоклеточный рак легкого (НМРЛ). Версия 5.2019. Доступно на https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf. 7 июня 2019 г .; Дата обращения: 27 июля 2019 г.
Мэттес М.Д., Мощинский А.Б., Ахсануддин С., Ризк Н.П., Фостер А., Ву А.Дж. и др. Отношение лимфатического узла к первичной опухоли SUV на ПЭТ / КТ точно предсказывает узловую злокачественность при немелкоклеточном раке легкого. Clin рака легких . 2015 15 июня. [Medline].
Mattes MD, Weber WA, Foster A, Moshchinsky AB, Ahsanuddin S, Zhang Z и др.Модель прогнозирования поражения лимфатических узлов злокачественными новообразованиями на ПЭТ / КТ при немелкоклеточном раке легкого. J Thorac Oncol . 2015 10 августа (8): 1207-12. [Медлайн].
Наир В.С., Геваерт О., Давидзон Г., Напел С., Грейвс Е.Е., Хоанг С.Д. и др. Прогностические особенности визуализации захвата ПЭТ 18F-ФДГ связаны с серьезными онкогеномными изменениями у пациентов с удаленным немелкоклеточным раком легкого. Cancer Res . 2012 г. 1. 72 (15): 3725-34. [Медлайн]. [Полный текст].
[Рекомендации] Postmus PE, Kerr KM, Oudkerk M, Senan S, Waller DA, Vansteenkiste J, et al. Ранний и местно-распространенный немелкоклеточный рак легкого (НМРЛ): Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2017 июл 1. 28 (suppl_4): iv1-iv21. [Медлайн]. [Полный текст].
Миллер В.Т. Значение истории болезни. AJR Am J Roentgenol . 1990 сентябрь 155 (3): 653-4. [Медлайн].
Свенсен С.Дж., Браун Л.Р., Колби ТВ.Увеличение узелков в легких на КТ: предполагаемые результаты. Радиология . 1996 Ноябрь 201 (2): 447-55. [Медлайн].
Hellwig D, Baum RP, Kirsch C. FDG-PET, PET / CT и процедуры традиционной ядерной медицины в оценке рака легких: систематический обзор. Нуклеармедизин . 2009 14 января. 48 (1): [Medline].
Fried DV, Mawlawi O, Zhang L, Fave X, Zhou S, Ibbott G, et al. Стадия III немелкоклеточного рака легкого: прогностическая ценность ФДГ-ПЭТ. Функции количественной визуализации в сочетании с клиническими прогностическими факторами. Радиология . 2015 15 июля. 142920. [Medline].
Деппен С.А., Блюм Дж. Д., Кенсингер С.Д., Морган А.М., Олдрич М.С., Массион П.П. и др. Точность FDG-PET для диагностики рака легких в зонах с инфекционными заболеваниями легких: метаанализ. JAMA . 2014 24 сентября. 312 (12): 1227-36. [Медлайн].
Рекомендация: Рак легкого: скрининг | Целевая группа профилактических служб США
Объем проверки
Чтобы обновить свою рекомендацию 2013 года, USPSTF заказала систематический обзор 24,25 точности скрининга на рак легких с помощью НДКТ, а также преимуществ и вреда скрининга на рак легких.В обзоре также оценивалось, различаются ли преимущества скрининга в зависимости от подгруппы (например, от расы или пола) или от количества или частоты сканирований LDCT, и отличается ли вред, связанный со скринингом и оценкой легочных узелков, при использовании Lung-RADS , Международная программа действий по борьбе с раком легких (I-ELCAP) или аналогичные подходы (например, для уменьшения количества ложноположительных результатов). Кроме того, в обзоре оценивалось, улучшает ли использование моделей прогнозирования риска для выявления взрослых с повышенным риском смертности от рака легких баланс преимуществ и вреда от скрининга по сравнению с использованием критериев приемлемости для исследования или вариантов критериев предыдущих рекомендаций USPSTF.
В дополнение к систематическому обзору доказательств USPSTF заказала совместные исследования моделирования из CISNET 14,15 , чтобы предоставить информацию об оптимальном возрасте для начала и окончания скрининга, оптимальном интервале скрининга, а также относительной пользе и вреде различных стратегии скрининга, в том числе стратегии, основанные на факторах риска, с использованием возраста, годовой истории курения и лет после отказа от курения для бывших курильщиков, по сравнению с модифицированными версиями многомерных моделей прогнозирования риска.Исследования по моделированию дополняют доказательства, которые предоставляет систематический обзор.
Точность отборочных тестов
USPSTF провела обзор нескольких РКИ и когортных исследований, в которых сообщалось о чувствительности, специфичности или прогностической ценности НДКТ, используя возможную диагностику рака легких в качестве эталона. 24,25 Не во всех рассмотренных исследованиях представлены все данные о точности испытаний. В исследованиях, в которых сообщалось, чувствительность варьировалась от 59% до 100%, специфичность — от 26.От 4% до 99,7%, прогностическая ценность положительного результата варьировалась от 3,3% до 43,5%, а прогностическая ценность отрицательного результата — от 97,7% до 100%.
В испытаниях NLST 26 и NELSON 11 сообщенная чувствительность составила 93,1% и 59% соответственно, а заявленная специфичность — 76,5% и 95,8% соответственно. Хотя отрицательные прогностические значения были схожими для испытаний NLST и NELSON (99,9% и 97,7% соответственно), прогностические значения положительных результатов сильно различались (3,3% и 43.5% соответственно). Это несоответствие в значительной степени объясняется разными определениями клинических испытаний положительного результата и протоколов скрининга — в исследовании NELSON использовался объемный подход и добавлена категория неопределенных результатов по узелкам (т. Е. Неопределенный результат не считался положительным результатом, даже если он приводил к до дополнительного тестирования). NLST использовал подход максимального диаметра без неопределенной категории (т.е. любой узелок, отвечающий критериям диаметра, считался положительным результатом).
В трех ретроспективных исследованиях сравнивалось, как различные подходы к классификации конкреций могут повлиять на точность НДКТ. 21,27,28 Первое исследование продемонстрировало, что использование Lung-RADS в NLST повысит специфичность при одновременном снижении чувствительности. 21 В двух других исследованиях было обнаружено, что использование критериев I-ELCAP (увеличение порогового значения размера узелков до среднего диаметра 5 мм, 6 мм или более) может повысить положительную прогностическую ценность. 27,28
Преимущества раннего выявления и лечения
USPSTF рассмотрел 7 РКИ, в которых оценивали скрининг рака легких с помощью НДКТ. 24,25 NLST 9 и исследование NELSON 11 были единственными испытаниями, обладающими достаточной мощностью для выявления преимущества в отношении смертности от рака легких.
В NLST, самом крупном на сегодняшний день РКИ (n = 53 454), приняли участие участники в возрасте от 55 до 74 лет на момент рандомизации, которые употребляли табак не менее 30 упаковок лет и курили в настоящее время или бросили курить в прошлом 15 лет. Средняя продолжительность курения в пачках у участников NLST составила 56 пачко-лет. 9 В испытание NELSON (n = 15 792) приняли участие участники в возрасте от 50 до 74 лет, которые употребляли табак не менее 15 сигарет в день (три четверти пачки в день) в течение более 25 лет или 10 сигарет в день. день (половина пачки в день) более 30 лет и курили в настоящее время или бросили курить в течение последних 10 лет.Средняя продолжительность курения в течение пачкового года у участников испытания NELSON составляла 38 пачко-лет. 11
NLST сообщил об относительном снижении риска смертности от рака легких на 20% (95% ДИ, 6,8–26,7%) 9; последующий анализ данных NLST с дополнительным наблюдением и проверкой конечных точек показал снижение относительного риска на 16% (95% ДИ, 5-25%). 10 Через 10 лет наблюдения в исследовании NELSON было зарегистрировано 181 смертельный исход от рака легких среди участников в группе скрининга и 242 случая смерти в контрольной группе (коэффициент заболеваемости [IRR], 0.75 [95% ДИ, 0,61-0,90]). 11,24 NLST также обнаружил снижение смертности от всех причин при скрининге LDCT по сравнению с рентгенографией грудной клетки (IRR, 0,93 [95% ДИ, 0,88–0,99]). Результаты других испытаний были неточными, без каких-либо статистически значимых различий между скринингом с помощью НДКТ и рентгенографией грудной клетки или без скрининга. 24
Доказательства интервала между скринингами получены из исследований NLST и NELSON, а также исследований моделирования CISNET. NLST проводится ежегодно в течение 3 лет. 9 Исследование NELSON проводилось с интервалом в 1 год, затем 2 года, затем 2,5 года. 11 Исследования моделирования CISNET показывают, что ежегодный скрининг с помощью LDCT дает больше преимуществ в снижении смертности от рака легких и увеличения продолжительности жизни по сравнению со скринингом раз в два года. 14
Несколько линий доказательств предполагают, что скрининг на рак легких у лиц с меньшим количеством пачко-лет курения (т. Е. Критерием правомочности участия в 30 пачках по рекомендации USPSTF 2013 г.) и в более раннем возрасте может повысить эффективность скрининга.Как уже отмечалось, в испытании NELSON участвовали люди в возрасте от 50 до 74 лет (около четверти участников были моложе 55 лет), у которых накопилось меньше паковок курения (половина пачки в день в течение более 30 лет или трех- четверти пачки в день более 25 лет). 11 Это исследование предоставляет эмпирические доказательства преимуществ скрининга рака легких с помощью НДКТ у лиц в возрасте от 50 до 55 лет и с более легким стажем курения в течение года.
Исследования моделирования CISNET также предоставили данные, которые помогли определить критерий годности для проведения скрининга на рак легких и возраст, в котором следует начинать и прекращать скрининг.USPSTF сосредоточился на программах скрининга в когорте рожденных 1960 г. (более представительных для нынешних моделей курения по сравнению с более ранними когортами), которые привели к снижению смертности от рака легких, по крайней мере, столь же значительному, как и программа скрининга USPSTF 2013 г. (A-55-80-30-15) . Для программ скрининга, которые обеспечивают такой уровень снижения смертности, а также максимизируют или близки к максимальному, как предотвращенные смерти от рака легких, так и увеличенные годы жизни для любого заданного уровня скрининга НДКТ, по крайней мере, в 3 из 4 моделей CISNET (т. Е. «Консенсус-эффективных» программ), большинство (52%) имеют минимальный критерий права на получение пакета в год, равный 20 годам пакета.Почти у всех есть начальный возраст 50 или 55 лет, и у всех конечный возраст 80 лет. 14,15
По сравнению с программой скрининга USPSTF 2013 года (A-55-80-30-15), анализ моделирования CISNET предполагает, что ежегодный скрининг людей в возрасте от 50 до 80 лет, которые курят не менее 20 лет и в настоящее время курят или бросили курить. за последние 15 лет (A-50-80-20-15) будет связано со снижением смертности от рака легких на 13,0% по сравнению с 9,8%, с предотвращением 503 случаев смерти от рака легких по сравнению с 381 и увеличения количества лет жизни на 6918 лет по сравнению с 4882 жизнями. -летний выигрыш на 100 000 человек населения в возрасте от 45 до 90 лет за всю жизнь скрининга. 14 Таким образом, эта программа скрининга будет связана с существенным сокращением смертности от рака легких и увеличением продолжительности жизни по сравнению с предыдущей рекомендацией и поддерживается новыми данными испытаний и исследованиями моделирования CISNET.
Скрининг на рак легких у лиц в более раннем возрасте и с меньшим количеством пачко-лет курения (т. Е. 20 пачко-лет) также может помочь частично уменьшить расовые различия в критериях отбора. Данные показывают, что курящие чернокожие имеют более высокий риск рака легких, чем белые, и эта разница в рисках более очевидна при более низких уровнях интенсивности курения. 7 Один недавний анализ участников когортного исследования южного сообщества показал, что 17% курящих чернокожих имели право на скрининг на рак легких на основе критериев отбора USPSTF 2013 года по сравнению с 31% курящих белых. В том же исследовании среди лиц с диагнозом рака легких значительно меньший процент курящих чернокожих (32%) соответствовал критериям отбора, чем белые (56%). 29 Данные также предполагают, что курящие латиноамериканцы / латиноамериканцы накапливают меньше ста лет жизни, чем курящие белые. 30,31 Стратегия ежегодного скрининга людей в возрасте от 50 до 80 лет, которые курят не менее 20 пачок в год и в настоящее время курят или бросили курить в течение последних 15 лет (A-50-80-20-15) увеличить относительный процент лиц, имеющих право на скрининг, на 87% в целом — 78% среди взрослых белых неиспаноязычных, 107% среди взрослых чернокожих неиспаноязычных и 112% среди взрослых испаноязычных по сравнению с критериями USPSTF 2013 года (A-55-80- 30-15). 14 Точно так же будет расширяться стратегия скрининга лиц в возрасте от 50 до 80 лет, которые курят не менее 20 упаковок лет и в настоящее время курят или бросили курить в течение последних 15 лет (A-50-80-20-15). относительный процент людей, имеющих право на скрининг, на 80% у мужчин и на 96% у женщин, 14 , потому что они накапливают меньше стаи лет, чем мужчины. 32
Симуляционные исследования показывают, что модели прогнозирования риска для определения права на скрининг рака легких могут быть связаны с уменьшением смертности от рака легких и количеством участников, необходимых для скрининга, чтобы предотвратить 1 смерть от рака легких. Таким образом, в исследованиях моделирования CISNET, заказанных USPSTF, сравнивались преимущества и вред программ скрининга, основанных на моделях прогнозирования риска, и скрининга на основе факторов риска (т. Е. С использованием возраста и истории курения). Используемые модели прогнозирования риска были модифицированными версиями модели PLCOm2012, 33 , модели инструмента оценки риска смерти от рака легких (LCDRAT), 34 и модели Баха, 35 с ограничениями по возрасту, полу (для тех моделей, которые включают пол как переменная, такая как модели LCDRAT и Баха), интенсивность курения и продолжительность курения (и установка других потенциальных переменных, таких как раса, образование, индекс массы тела, личный анамнез рака или семейный анамнез рака легких, для их ссылки значение).Поскольку возраст является важным фактором риска рака легких, эти модели прогнозирования риска перенесли скрининг на людей старшего возраста и увеличили число предотвращенных смертей от рака легких, но скрининг проводится в более старшем возрасте, когда остается меньше лет. Таким образом, некоторые программы скрининга, основанные на модели прогнозирования риска, были связаны с небольшим увеличением продолжительности жизни, в то время как некоторые не были связаны или были связаны даже с небольшим сокращением продолжительности жизни. Модели прогнозирования риска также были связаны с увеличением числа чрезмерно диагностированных случаев рака легких, которые чаще встречаются у пожилых людей. 14
Возможно, что использование более сложной модели прогнозирования риска для определения права на участие может создать препятствие для более широкого внедрения и использования скрининга на рак легких, услуги, которая в настоящее время не пользуется большой популярностью. В настоящее время нет исследований, которые проспективно сравнивали бы использование критериев USPSTF с учетом возраста, годовой истории курения и количества лет с момента отказа от курения с моделями прогнозирования риска в качестве критериев для скрининга рака легких, поэтому неясно, следует ли использовать прогнозирование риска. модель улучшит обнаружение рака легких и клинические результаты.Международное исследование легких (ILST), проспективное когортное исследование, в котором сравнивается точность модели PLCOm2012 с критериями USPSTF 2013 года для выявления рака легких, может предоставить некоторые доказательства по этому поводу. 36 Таким образом, определение права на скрининг рака легких с использованием более сложных моделей прогнозирования риска может представлять собой препятствие для реализации, и в настоящее время недостаточно данных для оценки того, улучшит ли скрининг на основе модели прогнозирования риска результаты по сравнению с простым использованием факторов риска возраст и история курения.
Вред скрининга и лечения
Вред скрининга может включать ложноположительные результаты, ведущие к ненужным тестам и инвазивным процедурам, гипердиагностику, радиационно-индуцированный рак, случайные находки и усиление стресса или беспокойства.
По данным NLST, частота ложноположительных результатов составила 26,3% для исходного уровня, 27,2% для 1 года и 15,9% для 2-го года. В исследовании NELSON сообщалось о частоте ложноположительных результатов 19,8% на исходном уровне, 7,1% в 1 год, 9,0% для мужчин. в год 3 и 3.9% для мужчин в 5.5 год скрининга. 11,37 Исследование внедрения, проведенное Управлением здравоохранения ветеранов, показало, что на исходном уровне уровень ложноположительных результатов составил 28,9% ветеранов, имеющих право на скрининг (58% от тех, кто действительно прошел скрининг). 38 Оба этих исследования были проведены до использования протокола Lung-RADS для классификации узлов, использование которого может уменьшить количество ложноположительных результатов, хотя и за счет некоторых ложноотрицательных результатов. В одном ретроспективном исследовании оценивалось, как использование Lung-RADS могло бы изменить частоту ложноположительных результатов в NLST, и было обнаружено, что среди исходных результатов для Lung-RADS, равных 12, частота ложноположительных результатов.8% (95% ДИ, 12,4–13,2%) против 26,6% (95% ДИ, 26,1–27,1%) для подхода NLST. 21
Дальнейшая обработка ложноположительных результатов может привести к значительному ущербу, например, при дополнительной визуализации, биопсии или хирургических вмешательствах. В четырнадцати исследованиях сообщалось об оценке ложноположительных результатов. Среди всех пациентов, прошедших скрининг, процент ложноположительных результатов пункционной биопсии колебался от 0,09% до 0,56%. Частота осложнений при игольчатой биопсии для ложноположительных результатов варьировалась от 0.От 03% до 0,07% всех обследованных пациентов. О хирургических процедурах из-за ложноположительных результатов сообщили от 0,5% до 1,3% всех прошедших скрининг участников. 24
В NLST ложноположительные результаты привели к инвазивным процедурам (пункционная биопсия, торакотомия, торакоскопия, медиастиноскопия и бронхоскопия) у 1,7% обследованных пациентов. Осложнения возникли у 0,1% обследованных пациентов, а смерть в течение 60 дней после наиболее инвазивной процедуры, выполненной для оценки ложноположительного результата, наступила у 0.007% опрошенных. 9 Одно исследование показало, что использование критерия Lung-RADS предотвратило бы 23,4% инвазивных процедур из-за ложноположительных результатов. 21
В исследованиях моделирования CISNET частота ложных срабатываний варьировалась в зависимости от критериев отбора. По сравнению с критериями USPSTF 2013 года (A-55-80-30-15), критерии USPSTF 2021 года (A-50-80-20-15) приведут к 2,2 ложноположительным результатам против 1,9 на человека в течение всей жизни скрининга. . 14 Обратите внимание, что программы скрининга, которые начинаются в более молодом возрасте или используют более низкий годовой пакет отбора, большее общее количество людей.
Определение частоты гипердиагностики в скрининговых испытаниях является сложной задачей, потому что продолжительность последующего наблюдения влияет на расчет избыточного, потенциально избыточно диагностированного рака в группах скрининга по сравнению с контрольными группами. Первоначально NLST сообщил о 119 дополнительных случаях рака легких (1060 общих случаев рака с LDCT против 941 с рентгенографией грудной клетки) после 3 раундов скрининга и 6,5 лет наблюдения (IRR, 1,12 [95% ДИ, 1,02–1,22]). 9,24 При расширенном последующем наблюдении NLST не обнаружил статистически значимых различий между группами по общей заболеваемости раком легких; тем не менее, это исследование имело некоторые методологические ограничения, в том числе использование другого метода установления диагноза во время последующего наблюдения после исследования, отсутствие информации о любом последующем скрининге, который мог иметь место в группе НДКТ или рентгенографии грудной клетки, а также отсутствующие данные. 39 В исследовании NELSON после заранее запланированных 10 лет наблюдения в группе LDCT было зарегистрировано 40 дополнительных случаев рака легких (344 рака в группе LDCT по сравнению с 304 в контрольной группе); после 11 лет наблюдения было зарегистрировано 14 случаев рака с НДКТ. 11
В исследованиях моделирования CISNET, которые учитывают последующее наблюдение в течение всей жизни, программа скрининга USPSTF 2013 года (A-55-80-30-15) приведет к тому, что 6,3% выявленных скрининговых случаев рака легких будут сверх диагностированы по сравнению с 6.0% случаев рака легких гипердиагностируются программой скрининга 2021 года (A-50-80-20-15). 14
В 9 публикациях, в которых сообщается о радиационном воздействии, связанном с НДКТ, 24 облучение, связанное с 1 сканированием НДКТ, варьировалось от 0,65 до 2,36 мЗв. Для контекста, среднегодовое радиационное облучение в США составляет 2,4 мЗв. В двух исследованиях оценивалась кумулятивная лучевая нагрузка на участников, проходящих скрининг с помощью НДКТ. Используя оценочную дозу облучения, полученную в результате скрининга и последующих оценок, а также оценки риска смерти от рака, вызванного радиацией, Итальянское испытание по скринингу рака легких (ITALUNG) оценило пожизненный риск смертельного рака равным 0.11 случаев на 1000 человек для LDCT после 4 раундов скрининга, 40 и исследования «Постоянное наблюдение курящих субъектов» оценили пожизненный риск серьезных раковых заболеваний от 2,6 до 8,1 на 10 000 человек, прошедших скрининг после 10 раундов ежегодного скрининга. 41
Моделирование CISNET показало, что оценки смертности от рака легких в течение жизни варьировались в зависимости от критериев отбора для прохождения скрининга. По сравнению с рекомендацией USPSTF 2013 года (A-55-80-30-15) рекомендация USPSTF 2021 года (A-50-80-20-15) будет связана примерно с 38.6 против 20,6 смертей от рака легких, связанных с радиацией, на 100 000 человек в общей численности населения в возрасте от 45 до 90 лет, или 1 смерть на каждые 13,0 против 18,5 случаев смерти от рака легких, которых удалось избежать с помощью скрининга. 14
При сравнении групп LDCT с контрольными группами по результатам прекращения курения или воздержания, данные не указывают на то, что скрининг приводит к более низким показателям отказа от курения или продолжающемуся воздержанию или к более высоким показателям рецидивов. Несколько исследований показывают, что по сравнению с отсутствием скрининга люди, проходящие скрининг НДКТ, не имеют более низкого качества жизни, связанного со здоровьем, беспокойства или дистресса в течение 2 лет наблюдения.Однако участники скрининга, получившие истинно положительные или неопределенные результаты, могут в краткосрочной перспективе испытывать ухудшение качества жизни, связанное со здоровьем, беспокойство или дистресс. 24
В исследованиях сообщалось о широком диапазоне случайных результатов, связанных со скринингом, которые были признаны значимыми или требовали дальнейшей оценки (от 4,4% до 40,7%), отчасти из-за непоследовательных определений того, что является случайным обнаружением и какие результаты были клинически значимыми. 24 Старший возраст ассоциировался с большей вероятностью случайных находок.Общие случайные находки включали кальцификацию коронарной артерии, аневризмы аорты, эмфизему, а также инфекционные и воспалительные процессы. Другими частыми находками были образования, узелки или кисты почек, груди, надпочечников, печени, щитовидной железы, поджелудочной железы, позвоночника и лимфатических узлов. Рак почек, щитовидной железы или печени в конечном итоге был диагностирован у 0,39% участников NLST в группе LDCT во время скрининга. 42
Случайные находки привели к последующей оценке, включая консультации, дополнительную визуализацию и инвазивные процедуры с соответствующими затратами и трудностями.Польза случайного выявления онкологических состояний, не связанных с легкими, и баланс пользы и вреда случайных результатов скрининга НДКТ, остаются неопределенными.
Ответ на общественное обсуждение
Предварительная версия этого заявления о рекомендации была размещена для общественного обсуждения на веб-сайте USPSTF с 7 июля 2020 г. по 3 августа 2020 г. Большинство комментариев в целом согласились с проектом рекомендации, хотя некоторые просили расширить критерии приемлемости для скрининга рака легких и другие отметили, что существуют дополнительные факторы риска рака легких, помимо курения, или что рак легких может возникнуть у людей, которые никогда не курили.В ответ USPSTF признает, что помимо курения существуют факторы риска рака легких; однако имеющиеся данные не подтверждают включение этих факторов риска в качестве детерминант права на скрининг рака легких. USPSTF также признает, что рак легких может возникать у людей, которые никогда не курили, или у лиц, которые в настоящее время курят или курили ранее, но не соответствуют критериям отбора. Тем не менее, курение является основным фактором риска рака легких, все испытания скрининга на рак легких проводились среди лиц, которые курили или были бывшими курильщиками, а данные испытаний и моделирования подтверждают текущую рекомендацию USPSTF как предлагающую разумный баланс пользы и вреда. .
В некоторых комментариях предлагалось использовать более сложные модели прогнозирования риска для определения права на скрининг рака легких. В ответ USPSTF разъяснил, что использование этих моделей прогнозирования рисков может затруднить реализацию, и что в настоящее время не существует испытаний по скринингу рака легких, в которых можно было бы проспективно сравнивать критерии соответствия USPSTF с моделями прогнозирования риска. USPSTF также добавила ссылку на ILST, проспективное когортное исследование, посвященное этой проблеме.
В ответ на комментарии USPSTF также добавила информацию о низкой в настоящее время распространенности скрининга на рак легких и данные о влиянии текущей рекомендации на соответствие критериям отбора для лиц латиноамериканского / латиноамериканского происхождения. Наконец, USPSTF добавила и обновила ресурсы и ссылки на веб-сайты в разделе «Дополнительные инструменты и ресурсы».
Как доказательства согласуются с биологическим пониманием?
Рак легкого — это распространение злокачественных клеток, происходящих из ткани легких.Курение — самый сильный фактор риска рака легких. Пожилой возраст также связан с увеличением заболеваемости раком легких. Рак легкого подразделяется на 2 основные категории в зависимости от типа клеток, иммуногистохимических и молекулярных характеристик: НМРЛ, который в совокупности включает аденокарциному, плоскоклеточный рак и крупноклеточный рак, а также мелкоклеточный рак легкого. Скрининг направлен на раннее выявление НМРЛ, а не на мелкоклеточный рак легкого, поскольку последний встречается гораздо реже и обычно распространяется слишком быстро, чтобы его можно было надежно обнаружить на ранней потенциально излечимой стадии путем скрининга.
В настоящее время у 79% пациентов рак легких распространился на регионарные лимфатические узлы или метастазировал в отдаленные места. Только 17% пациентов имеют локализованное заболевание. Пациенты с локализованным заболеванием имеют 5-летнюю выживаемость 59% по сравнению с 32% для пациентов с региональным распространением и 6% для пациентов с отдаленными метастазами. 1 Скрининг на рак легких, ведущий к более раннему выявлению и лечению, может дать пациентам больше шансов на излечение.
Скрининг и диагностика рака легких
Цель скрининга рака легких — спасти жизни.Central Maine Healthcare стремится максимально упростить проверку всех членов нашего сообщества, которые подвержены высокому риску заболевания. Тест занимает всего 10 минут и покрывается большинством страховок. А если вы не застрахованы, мы можем предложить льготный тариф. Это небольшая цена, чтобы подхватить эту болезнь, прежде чем она станет смертельной.
Свяжитесь с нашим специалистом по легким по телефону 207-753-3954, чтобы узнать больше о скрининге на рак легких. Или найдите специалиста по легким в любое время онлайн.
Зачем нужен скрининг рака легких?
При раке легких симптомы обычно не проявляются до тех пор, пока болезнь не прогрессирует, поэтому обследование так важно для пациентов из группы высокого риска.Central Maine Healthcare предлагает компьютерную томографию с низкой дозой облучения, революционный новый инструмент, который может выявить рак легких до появления симптомов. Во время этого простого теста рентгеновский аппарат сканирует тело, используя низкие дозы радиации, чтобы сделать подробные снимки легкого. Это безопасно, безболезненно и, как было доказано, снижает риск смерти от рака легких на 20%.
Вы подвержены высокому риску рака легких?
КТ легких с низкой дозой рекомендуется для следующих групп людей с высоким риском рака легких:
- Люди в возрасте 55-80 лет
- Кто курит не менее 30 пачек в год
- Люди, которые все еще курят или бросили курить в течение последних 15 лет
Что такое КТ-сканирование с низкой дозой?
Во время этого простого теста рентгеновский аппарат сканирует все тело, используя низкие дозы радиации, чтобы сделать подробные снимки легкого.Это позволяет нашим врачам обнаруживать даже самые маленькие опухоли и предлагает множество преимуществ для пациентов с высоким риском рака легких:
- Эффективный: Исследования показывают, что КТ с низкой дозой в четыре раза чаще позволяет выявить опухоль, чем при традиционном рентгене грудной клетки. Он также оказался не менее эффективным в спасении жизней, чем обследования при маммографии и колоноскопии.
- Safe: При КТ-сканировании рака легких используется на 90% меньше излучения, чем при обычном КТ-сканировании грудной клетки.
- Безболезненно: Это неинвазивно и занимает всего несколько минут.
- Удобно: КТ доступны в трех наших офисах: Центральном медицинском центре штата Мэн, больнице Бриджтона и больнице Рамфорда.
Если мы обнаружим какие-либо отклонения от нормы, наша специализированная команда организует последующее тестирование и, при необходимости, тесно сотрудничает с вами, чтобы разработать индивидуальный план лечения рака, который поможет вам вернуть хорошее здоровье.
Уход, которому можно доверять
Центр скрининга рака легких CMMC — одна из семи больниц в штате Мэн, официально признанных Центрами скрининга рака легких.Так что вы можете быть уверены, что ваш скрининг на рак легких будет безопасным и эффективным.
Визуализация и радиология | Государственное здравоохранение Пенсильвании,
Просмотр детской визуализации и радиологии
Медицинский подход штата Пенсильвания к радиологии и визуализации
Группа радиологии и визуализации в Penn State Health предоставляет полный спектр услуг визуализации для поиска и лечения заболеваний и травм. Являясь единственным академическим медицинским центром в центральной Пенсильвании, мы предлагаем передовые услуги квалифицированной и знающей команды.Мы используем новейшее оборудование, которое дает точные и быстрые результаты — часто в течение 48 часов. Это означает, что ваш врач может раньше начать лечение и помочь вам быстрее почувствовать себя лучше.
Мы обеспечиваем безопасную, ориентированную на пациента медицинскую помощь и используем сложное оборудование, в том числе машины, которые позволяют нам регулировать уровни излучения и магнитную силу. Это позволяет нам делать самые безопасные и качественные изображения для каждого человека. У нас также есть МРТ-сканеры с самыми большими отверстиями для большего комфорта.Наша обученная и опытная команда ставит ваше здоровье, безопасность и благополучие на первое место.
Когда вы приедете сюда, вы можете рассчитывать на высококачественный уход от преданной своему делу команды.
Экспертные службы радиологии и визуализации
Penn State Health предлагает новейшее оборудование и методы для визуализации и радиологии, позволяющие получить точные и высококачественные результаты в кратчайшие сроки. Наша команда также выполняет процедуры интервенционной радиологии, включая биопсию под визуальным контролем (образцы тканей), инъекции, дренирование и абляцию (лечение для разрушения опухолей).
Мы предлагаем полный спектр услуг, от обычного рентгена и компьютерной томографии до малоинвазивного лечения для снятия боли при опухолях позвоночника. Ежегодно мы проводим более 400 000 диагностических исследований в наших многочисленных центрах в Пенсильвании. Наша лаборатория 3D-визуализации предоставляет подробные реконструкции внутренних областей вашего тела, чтобы помочь врачам спланировать операции с большей точностью. Мы сотрудничаем со специалистами Penn State Health, чтобы обеспечить комплексное лечение.
.

 И. Чиссов, А.Х. Трахттенберг, К.И. Колбанов: под общ. ред. В.С. Савельева // 80 лекций по хирургии. — М.: Литтера, 2008. — С. 650-652.
И. Чиссов, А.Х. Трахттенберг, К.И. Колбанов: под общ. ред. В.С. Савельева // 80 лекций по хирургии. — М.: Литтера, 2008. — С. 650-652.