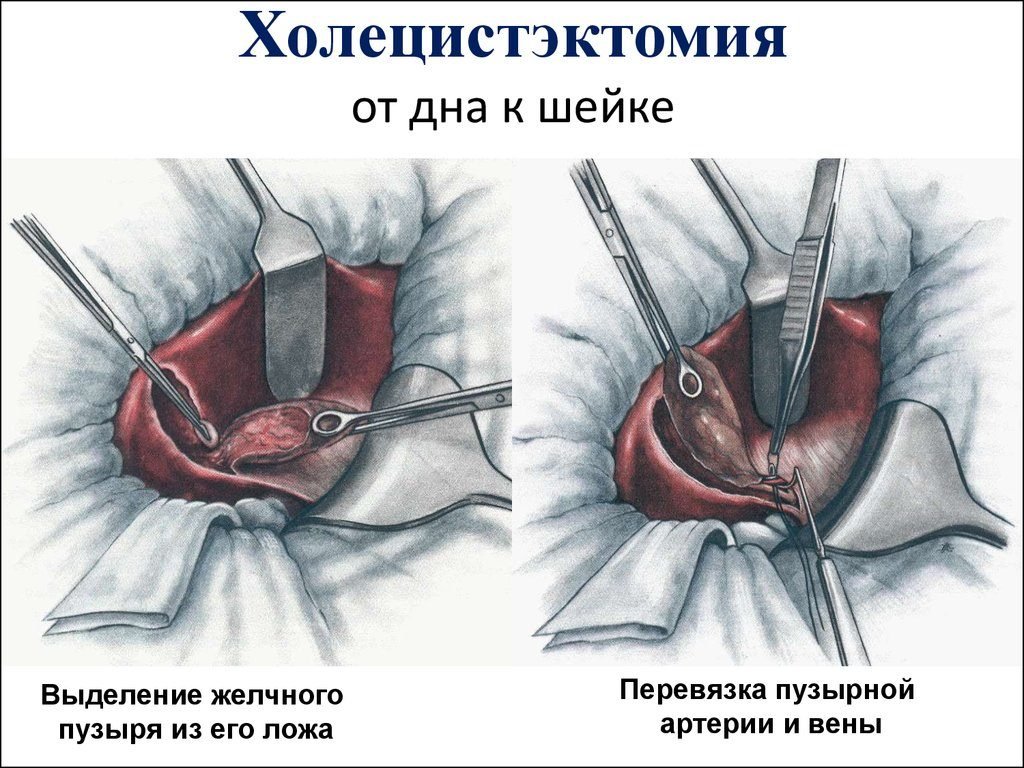
Однопортовая лапароскопическая хирургия и однопортовая холецистэктомия
Однопортовая лапароскопическая хирургия (SILS — single incision laparoscopic surgery) – это результат современной эволюции малоинвазивной хирургии.
При этом типе лапароскопических операций все инструменты и троакары устанавливаются через один доступ, чаще всего через пупок.
Возможны варианты установки троакара в эпигастральной области, в подреберье, в подвздошных ямках, я так же над лоном.
Наиболее часто для установки доступа используется пупок, т.к. это природный рубец, почти не содержащий подкожно-жировой клетчатки.
ТЕХНИЧЕСКИЕ ОСОБЕННОСТИ ОДНОПОРТОВОЙ ЛАПАРОСКОПИИ
Для проведения лапароскопических операций необходима триангуляция – это размещение инструментов и камеры так, чтобы угол между рабочими инструментами был 90º и больше с камерой между ними. Триангуляция между инструментами позволяет осуществить тракцию анатомических структур с последующих их разделением.
При однопортовой лапароскопии инструменты и камера располагаются параллельно друг другу , что существенно снижает возможность «правильной тракции. Поэтому для проведения такого рода лапароскопических операций используются специальные изогнутые лапароскопические инструменты, которые позволяют увеличить тракцию.
Найболее часто выполняется однопортовая лапароскопическая холецистэктомия (LESS) – лапароскопическое удаление желчного пузыря через один небольшой доступ в пупке, от 2 до
3-х см. Также, однопортовая холецистэктомия показана при наличии пупочной грыжи.
Все противопоказаниядля проведения однопортовой лапароскопической холецистэктомии делятся на абсолютные и относительные.
АБСОЛЮТНЫЕ ПРОТИВОПОКАЗАНИЯ К ОДНОПОРТОВОЙ ЛАПАРОСКОПИИ
- Острый холецистит.
- Выраженный спаечный процесс в области шейки желчного пузыря и треугольника Калло.

- Наличие перивезикального воспаления.
ОТНОСИТЕЛЬНЫЕ ПРОТИВОПОКАЗАНИЯ
- Индекс массы тела = 40 и более
- По мировым данным частота осложнений возникает у пациентов, возраст которых более 45 лет.
ПРЕИМУЩЕСТВА ОДНОПОРТОВОЙ ЛАПАРОСКОПИИ
- Уменьшение операционной травмы и болевого синдрома.
- Прекрасный косметический эффект.
- Уменьшается риск инфекционных осложнений.
ЭТАПЫ ПРОВЕДЕНИЯ ЛАПАРОСКОПИЧЕСКОЙ ОДНОПОРТОВОЙ ХОЛЕЦИСТЭКТОМИИ
1. Выполняется местная анестезия кожи пупка, что уменьшает болевой синдром в послеоперационном периоде (Фото 1).
Фото 1. Выполнение местной анестезии кожи пупочного кольца.
2. Выделение рубцовых тканей или грыжевого мешка (при наличии пупочной грыжи) и установка специального рабочего порта для однопортовой лапароскопии (фото 2,3).
Фото 2. Подготовка тканей для установки специально порта.
Фото 3. Установка рабочего порта.
3. После установки рабочего порта (фото 4) – выполняется собственно удаление желчного пузыря: выделение и клипирование и пересечение протоки желчного пузыря, клипирование и пересечение артерии желчного пузыря, выделение пузыря от ложа и его извлечение.
4. Зашивание рани в области пупка косметическим швом, в результате чего достигается прекрасный косметический эффект (фото 4):
Фото 4. Вид пупка через 2 месяца после удаления желчного пузыря через один порт.
Предлагаю Вашему вниманию видео одной из операций проведения лапароскопической однопортовой холецистэктомии (видео 1):
youtube.com/embed/qHPXQyTNiyM»/>
Видео 1. Однопортовая лапароскопическая холецистэктомия.
Следует сказать, что хирурги всего мира делают упор на то, что выполнять SILS операции должен хирург, уверенно владеющий лапароскопической техникой проведения различного рода вмешательств на органах брюшной полости. Хирург должен быть готов к работе в условиях «нехватки» поля для манипуляций.
разработка учебной программы с использованием средств виртуального отображения
Состояние проблемы. Внедрение учебной программы на основе квалификационной оценки, предполагающей использование средств виртуального отображения (ВО), может способствовать снижению количества ошибок во время выполнения реальных хирургических вмешательств. В данном исследовании для разработки учебной программы с применением симуляции лапароскопической холецистэктомии использовались научные методы.
Методы. К исследованию были привлечены начинающие (выполнившие <10 лапароскопических холецистэктомий), квалифицированные (выполнившие от 20 до 50 холецистэктомий) и высококвалифицированные (выполнившие >100 холецистэктомий) хирурги. Конструктная валидность определялась способностью дифференцирования 3 уровней опыта на основании показателей, полученных с помощью средств ВО, для 9 основных навыков, 4 дидактических заданий, моделирующих этапы оперативного вмешательства, и полной лапароскопической холецистэктомии на симуляторе с высокой достоверностью воспроизведения реального процесса. С целью анализа кривой обучаемости начинающие хирурги выполняли 10 повторов. Эталоном при определении уровня профессионализма служили показатели, полученные в ходе работы высококвалифицированных хирургов.
Результаты. В исследование были включены 30 начинающих, 11 квалифицированных и 16 высококвалифицированных хирургов. Конструктно валидными были признаны 8 из 9 основных навыков и 3 из 4 дидактических заданий, моделирующих этапы оперативного вмешательства. При выполнении полной версии виртуального оперативного вмешательства были выявлены значимые межгрупповые отличия показателей времени (1541, 673 и 816 с; p=0,002), количества движений (1021, 595 и 638; p=0,006) и длины пути (2038, 1235 и 1303 см; p=0,033). Кривые обучения вышли на уровень плато между 2-м и 9-м сеансами.
При выполнении полной версии виртуального оперативного вмешательства были выявлены значимые межгрупповые отличия показателей времени (1541, 673 и 816 с; p=0,002), количества движений (1021, 595 и 638; p=0,006) и длины пути (2038, 1235 и 1303 см; p=0,033). Кривые обучения вышли на уровень плато между 2-м и 9-м сеансами.
Заключение. Результаты исследования свидетельствуют о том, что последовательное использование научных методов позволяет описать и разработать программу для обучения лапароскопической холецистэктомии с применением средств ВО.
Обучение в условиях операционной часто происходит бесструктурно, эпизодично и зависит от случайных факторов, связанных с пациентами и их заболеванием. Не вызывает сомнений, что для достижения определенного уровня компетентности в выбранной области начинающим хирургам необходимо совершенствовать практические навыки. Для объяснения большей продолжительности выполнения оперативного вмешательства, большей частоты осложнений и даже более высокого показателя смертности в течение такого периода совершенствования навыков неоднократно использовался термин «кривая обучения» [1, 2]. Хотя процесс обучения проходит под контролем опытных специалистов, а пациент предоставляет информированное согласие, в современной медицинской практике подобный подход не приемлем с экономической и этической точек зрения. Таким образом, необходимо исследовать, определить и внедрить способы совершенствования хирургических навыков, которые позволят не подвергать пациента риску и предотвратить устранимые ошибки хирурга [3].
Для совершенствования технических навыков на ранних этапах обучения была предложена симуляция с виртуальным отображением (ВО) и компьютерным моделированием [4]. В недавно выполненном систематическом обзоре обосновывалась необходимость перехода к использованию имитации оперативного вмешательства в области лапароскопии и эндоскопии, поскольку при этом удается «обеспечить безопасный, эффективный и этичный путь приобретения хирургических навыков» [5]. Тем не менее авторы указывают, что качество рассмотренных исследований сильно варьировало, и в них использовалось значительное количество различных стратегий обучения участников. Было сделано заключение о том, что обучающие модули предпочтительно свести к стандартной учебной программе [6].
Тем не менее авторы указывают, что качество рассмотренных исследований сильно варьировало, и в них использовалось значительное количество различных стратегий обучения участников. Было сделано заключение о том, что обучающие модули предпочтительно свести к стандартной учебной программе [6].
Цель учебной программы — приобретение обучающимися навыков определенного уровня, необходимых для перехода к оперированию более сложных случаев. Это не просто работа на симуляторе, но и особый режим обучения, который определяет степень перенесения навыков в условиях операционной. Этот режим состоит из обучения, основанного на имеющихся теоретических знаниях, пошагового усвоения технических навыков, получения обратной связи и развития профессиональных навыков с дальнейшим применением их в реальных условиях [7].
Цель данного исследования — разработка научно обоснованной пошаговой учебной программы с ВО для приобретения технических навыков выполнения лапароскопической холецистэктомии (ЛХ). Хотя программы обучения для приобретения основных и специальных навыков на симуляторах с ВО были описаны ранее [8, 9], это первый случай применения последовательного научного метода для анализа средства ВО ЛХ в полном объеме с целью разработки учебной программы. Основная трудность состояла в определении иерархической модели тренинга, подкрепленной объективным измерением уровня профессионализма, а конечная цель — демонстрация значимого снижения длительности и наклона кривой обучения во время выполнения ЛХ реальным пациентам.
Методы
Участвовавшие в исследовании субъекты были распределены на 3 группы: высококвалифицированные хирурги, выполнившие >100 ЛХ, квалифицированные хирурги, выполнившие от 20 до 50 ЛХ, и начинающие хирурги, выполнившие <10 ЛХ. Для включения в группы начинающих хирургов субъекты, которые не выполнили ни одной ЛХ, должны были выполнять роль первых ассистентов не менее чем в 5 ЛХ. Набор в исследование проводился лишь на основании собеседования. Единственным критерием исключения был опыт предшествующего использования лапароскопических симуляторов любого вида, включая тренажеры-коробки.
Набор в исследование проводился лишь на основании собеседования. Единственным критерием исключения был опыт предшествующего использования лапароскопических симуляторов любого вида, включая тренажеры-коробки.
Технические средства виртуального отображения
Лапароскопический хирургический симулятор для ВО LAP Mentor™ (Simbionix Corporation, Cleveland, Ohio, США) предполагает отработку основных навыков, необходимых для лапароскопии, выполнение заданий, специфичных для оперативных вмешательств данного типа, и полную симуляцию операций холецистэктомии. Имеется 9 основных навыков (таких как манипуляции обеими руками, рис. 1А), 4 дидактических задания, моделирующих этапы оперативного вмешательства (например, диссекция тканей в проекции треугольника Кало, рис. 1Б) и 18 полных симуляций операций ЛХ. Полные версии операций ЛХ отличаются особенностями анатомии билиарной системы и выраженностью воспаления. В рамках данного исследования, целью которого была разработка программы обучения начинающих хирургов-эндоскопистов, использовался лишь первый тип ЛХ, легендой которого являлся пациент с желчной коликой в анамнезе и стандартной анатомией билиарной системы.
Субъекты выполняли манипуляции на виртуальных тканях с помощью пары лапароскопических инструментов через устройство, моделирующее тактильный ответ. Тип инструмента (зажим, ножницы, клипатор, диатермический крючок и т. п.) выбирали с помощью экранного меню. Подробное описание предлагаемых симулятором заданий представлено на табл. 1.
Предложенные задания
Каждый из 9 базовых навыков, 4 дидактических задания, моделирующих этапы операции, и симуляция полной ЛХ были выполнены в ходе 2 сеансов квалифицированными и высококвалифицированными хирургами-участниками, и в ходе 10 сеансов — начинающими хирургами. Перед началом выполнения задания каждому участнику предоставлялась возможность непосредственно ознакомиться с симулятором под руководством опытного оператора. Перед каждым заданием опытный оператор демонстрировал технику его выполнения, при этом субъект-участник имел возможность задать интересующие его вопросы. Длительность ознакомительного периода составляла примерно 30 мин. Во время непосредственного выполнения заданий помощь участникам не предоставлялась.
Перед каждым заданием опытный оператор демонстрировал технику его выполнения, при этом субъект-участник имел возможность задать интересующие его вопросы. Длительность ознакомительного периода составляла примерно 30 мин. Во время непосредственного выполнения заданий помощь участникам не предоставлялась.
Все сеансы были разделены перерывом длительностью не менее 1 ч, а начинающие хирурги-участники выполняли не более 2 сеансов за день.
Оценка результативности
Данные по каждому выполняемому заданию объективно оценивались симулятором в фоновом режиме. Регистрировались различные данные, в том числе затраченное время, показатели экономности движений и аккуратности, время прижигания и балловая оценка ошибок. Данные сохранялись программным обеспечением симулятора в виде электронных таблиц Excel™ (Microsoft Corporation, Redmond, Washington, США).
Конструктная валидность — это тестирование модели на способность к дифференцированию различных уровней опыта и, следовательно, на ее пригодность для оценки результативности [7]. Конструктная валидность каждого виртуального задания и обоснованность использования определенных виртуальных условий, созданных симулятором, для оценки технических навыков, необходимых при выполнении лапароскопии, определяли путем сравнения средних показателей результативности трех групп хирургов в ходе первых двух сеансов обучения. Статистический анализ кривых обучения начинающих хирургов-эндоскопистов использовали для выяснения, могут ли повторные занятия приблизить продемонстрированные ими показатели к соответствующим показателям опытных хирургов. Эталонные точки, которые должны быть достигнуты перед переходом к следующему этапу учебной программы, определяли, рассчитывая средний показатель в баллах для каждого параметра во время второго сеанса выполнения заданий каждым опытным хирургом. Предполагалось, что при выполнении второй попытки задания опытные хирурги уже освоились со симулятором, который был им не знаком во время первой попытки.
Характер прохождения начинающими хирургами этих ясно обозначенных этапов (результаты сравнения показателей, полученных с помощью симулятора, т. е. конструктной валидности, анализа кривой обучения и определения эталонных точек) позволяет составить программу для обучения технике операции, опираясь на доказательную базу, а не на предположения. Таким образом, программа подготовки начинающих хирургов является профессионально и научно обоснованной.
Статистический анализ
Выбор количества субъектов в группе (не менее 10) осуществлялся с учетом двустороннего критерия с α=0,05 и мощностью (1-β)=0,80 и предполагаемым уменьшением времени, затраченного на завершение заданий опытными хирургами, на 30%, по сравнению с соответствующим показателем для неопытных хирургов (по данным ранее проведенных исследований с использованием средств ВО) [8, 9]. Расчетное количество — 8 субъектов — было увеличено до 10 с поправкой на возможное выпадение или на техническую неисправность симулятора. В исследование были привлечены 30 неопытных хирургов, при этом 10 субъектов прошли 10 сеансов обучения 9 основным навыкам, другие 10 субъектов практиковались лишь в выполнении 4 дидактических заданий, моделирующих этапы оперативного вмешательства, и еще 10 субъектов практиковались в выполнении виртуальной холецистэктомии в полном объеме. Было необходимо убедиться, что начинающие хирурги не пройдут 10 сеансов обучения на одном модуле ВО с последующим переходом к другому, что могло бы нежелательно исказить результаты исследования. Подобная проблема не возникала при тренинге квалифицированных и высококвалифицированных хирургов, поскольку они выполняли лишь 2 повтора каждого задания.
Полученные данные были проанализированы при помощи SPSS® версии 16.0 (SPSS, Chicago, Illinois, США) с использованием непараметрических критериев. Сравнение показателей результативности в группах начинающих, квалифицированных и высококвалифицированных субъектов проводили с использованием критерия Краскела-Уоллиса и U-критерия Манна-
Уитни в соответствии с необходимостью. Данные кривой обучения были проанализированы с помощью критерия Фридмана (непараметрический дисперсионный анализ с повторными измерениями). Затем были выполнены множественные сравнения для определения момента выхода показателей на плато. Статистическая значимость была установлена на уровне p<0,05.
Данные кривой обучения были проанализированы с помощью критерия Фридмана (непараметрический дисперсионный анализ с повторными измерениями). Затем были выполнены множественные сравнения для определения момента выхода показателей на плато. Статистическая значимость была установлена на уровне p<0,05.
Результаты
В исследование были привлечены 57 субъектов, из них 16 были высококвалифицированными, 11 обладали средним уровнем квалификации и 30 были начинающими хирургами. Из 16 высококвалифицированных хирургов 9 субъектов дважды выполнили задания на развитие 9 основных навыков, 11 субъектов выполнили 4 дидактических задания, моделирующих этапы оперативного вмешательства, и 10 субъектов выполнили виртуальную холецистэктомию в полном объеме. 30 начинающих хирургов были разделены на 3 равные группы. Участники 1-й группы 10 раз выполнили упражнения на развитие 9 основных навыков, участники 2-й группы — 4 дидактических задания, моделирующих этапы оперативного вмешательства, а 3-й — 10 раз выполнили виртуальную холецистэктомию в полном объеме.
Основные навыки
8 из 9 основных навыков оказались конструктно валидными, преимущественно в отношении показателей затраченного времени и скорости завершения (табл. 2). Начинающие, квалифицированные и высококвалифицированные хирурги выполняли упражнение «Клипирование и захватывание» со значимыми различиями в показателях времени (161, 120 и 111 с соответственно, p=0,009) и общей скорости (5,6; 7,4 и 7,9 см/с, p=0,011). При выполнении упражнения «Манипуляции обеими руками» имелось межгрупповое различие в показателях времени (171, 107 и 102 с; p=0,001), общей скорости (6,3; 6,7 и 7,3 см/с; p=0,049), общего количества движений (239, 128 и 128; p=0,007) (рис. 2) и общей длины пути (673, 484 и 512 см; p=0,016), пройденного концами инструментов. Кроме того, разница по этим показателям была значима для двух навыков между группами начинающих и квалифицированных хирургов, а также между группами начинающих и высококвалифицированных хирургов, однако разницы между группами квалифицированных и высококвалифицированных хирургов не отмечалось.
Анализ кривых обучения для группы начинающих хирургов выявил значимый уровень улучшения в упражнениях «Клипирование и захватывание» и «Манипуляции обеими руками» для вышеупомянутых валидных показателей, кроме общей скорости для последнего навыка. Все показатели вышли на уровень плато между 6-м и 9-м сеансами для данной группы, однако показатель общей скорости в упражнении «Клипирование и захватывание» вышел на плато на 2-м обучающем сеансе.
Дидактические задания
По данным, зарегистрированным симулятором, показатели, определяемые при выполнении задания «Клипирование и рассечение тканей — ретракция желчного пузыря» субъектами трех разных групп, не отличались. При выполнении задания «Клипирование и рассечение тканей — манипуляции двумя руками» значимые различия имелись лишь в показателе общей скорости (3,5 см/с у начинающих хирургов, 4,1 см/с у квалифицированных хирургов и 4,7 см/с у высококвалифицированных хирургов, p=0,049). Для задания «Диссекция тканей в проекции треугольника Кало» показатели затраченного времени (p<0,001), общего количества движений (p=0,002),общей длины пути (p=0,011), общей скорости (p=0,001), показатель аккуратности (p=0,002), общее время прижигания (p=0,003) и общее время прижигания без контакта с тканью (p<0,001) после 1-го сеанса значимо отличались среди начинающих, квалифицированных и высококвалифицированных хирургов. При выполнении задания «Выделение желчного пузыря» у всех начинающих хирургов были отмечены статистически значимые кривые обучения всех конструктно валидных показателей с плато на 4-м сеансе (рис. 3).
Анализ кривых обучения для группы начинающих хирургов выявил значимый уровень улучшения в упражнениях «Клипирование и захватывание» и «Манипуляции обеими руками» для вышеупомянутых валидных показателей, кроме общей скорости для последнего навыка. Все показатели вышли на уровень плато между 6-м и 9-м сеансами для данной группы, однако показатель общей скорости в упражнении «Клипирование и захватывание» вышел на плато на 2-м обучающем сеансе.
Дидактические задания
По данным, зарегистрированным симулятором, показатели, определяемые при выполнении задания «Клипирование и рассечение тканей — ретракция желчного пузыря» субъектами трех разных групп, не отличались. При выполнении задания «Клипирование и рассечение тканей — манипуляции двумя руками» значимые различия имелись лишь в показателе общей скорости (3,5 см/с у начинающих хирургов, 4,1 см/с у квалифицированных хирургов и 4,7 см/с у высококвалифицированных хирургов, p=0,049). Для задания «Диссекция тканей в проекции треугольника Кало» показатели затраченного времени (p<0,001), общего количества движений (p=0,002),общей длины пути (p=0,011), общей скорости (p=0,001), показатель аккуратности (p=0,002), общее время прижигания (p=0,003) и общее время прижигания без контакта с тканью (p<0,001) после 1-го сеанса значимо отличались среди начинающих, квалифицированных и высококвалифицированных хирургов. При выполнении задания «Выделение желчного пузыря» у всех начинающих хирургов были отмечены статистически значимые кривые обучения всех конструктно валидных показателей с плато на 4-м сеансе (рис. 3).
Выполнение виртуальной холецистэктомии в полном объеме
При выполнении виртуальной холецистэктомии в полном объеме были продемонстрированы значимые различия между субъектами трех групп по показателям затраченного времени (1541, 673 и 816 с, p=0,002), времени до выделения желчного пузыря (1487, 635 и 768, p=0,002), общего количества движений (1021, 565 и 768, p=0,006) и общей длины пути (2038, 1235 и 1303 см; p=0,033). Все конструктно валидные показатели также характеризовались значимыми кривыми обучения с плато на 2-м и 3-м сеансах (p<0,001).
Составление учебной программы
Результаты исследования, кратко изложенные в табл. 3, были использованы для составления учебной программы. Были исключены 2 показателя — общая скорость в упражнении «Клипирование и захватывание», поскольку обучение, направленное на повышение скорости было сочтено нецелесообразным, и время до выделения желчного пузыря во время выполнения виртуальной холецистэктомии в полном объеме, поскольку оно было практически идентично показателю затраченного времени и не служило мерой роста профессионализма. Итогом проведения исследования послужило создание квалификационно обоснованной учебной программы на основе виртуальной ЛХ, выполняемой в полном объеме (рис. 4).
Итогом проведения исследования послужило создание квалификационно обоснованной учебной программы на основе виртуальной ЛХ, выполняемой в полном объеме (рис. 4).
Обсуждение
В данном исследовании был задействован пошаговый анализ модулей и показателей средства виртуального отображения, по результатам которого была разработана учебная программа на основе виртуальной ЛХ, выполняемой в полном объеме. Конструктную валидацию модулей выполняли путем сравнения производительности действий участников, разделенных по уровню хирургического опыта на 3 группы. Далее были получены кривые обучения, свидетельствующие о том, что повторный тренинг на самом деле улучшает измерявшуюся симулятором производительность действий начинающих хирургов. Технические навыки, приобретенные в ходе тренинга на симуляторе, релевантны для ЛХ и способствуют сокращению периода, требуемого для достижения профессионального уровня, необходимого для выполнения реальных оперативных вмешательств.
Согласно учебной программе, подготовка начинается с модулей основных навыков, с двумя сеансами повторения заданий на развитие 9 базовых навыков. Далее следует наработка двух наиболее тяжело усваиваемых (по данным кривых обучения) навыков. Переход к выполнению дидактических заданий, моделирующих этапы операции, требует достижения эталонных критериев производительности, рассчитанных на основании данных о производительности действий опытных хирургов. Структура учебной программы идентична для 4 дидактических заданий, моделирующих этапы операции, которые подготавливают обучаемого к модулю выполнения виртуальной ЛХ в полном объеме. При этом перед завершением тренировочного периода к обучающемуся также предъявляются требования, касающиеся достижения критериев производительности. Следует отметить, что учебная программа следует скорее принципу дистрибутивности, а не массивности, при этом в день проводится не более 2 обучающих сеансов, разделенных перерывом длительностью не менее 1 ч [10, 11].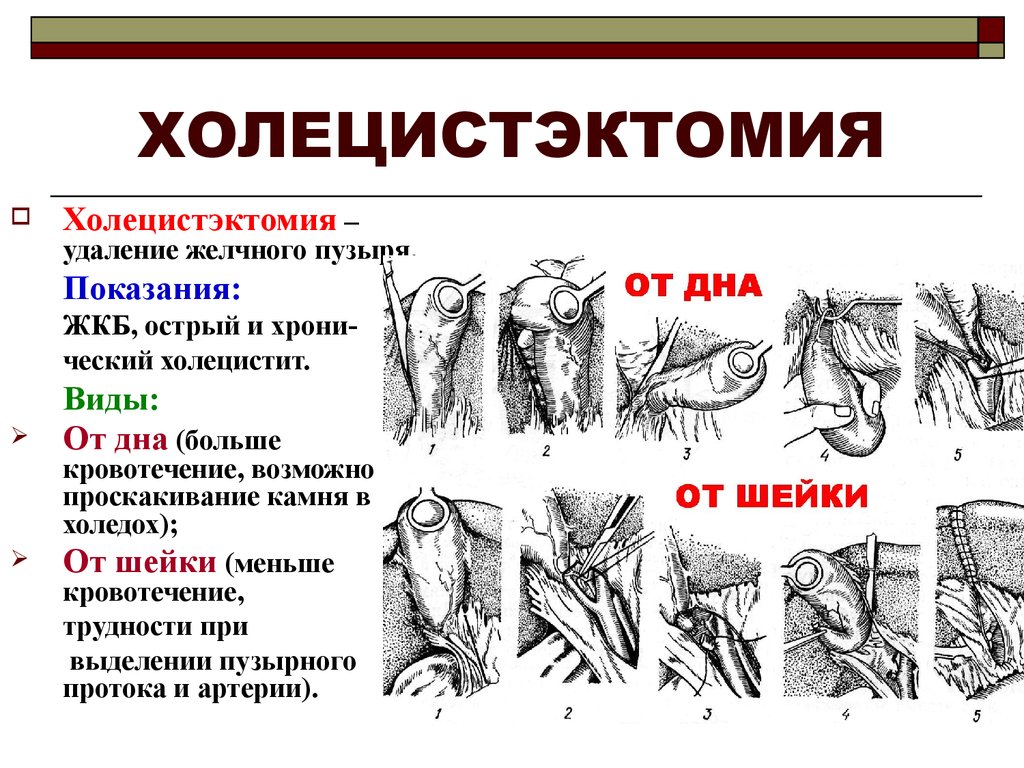 Наконец, для того чтобы гарантировать закономерное, а не случайное получение высокого балла, достижение каждого эталонного показателя необходимо продемонстрировать в течение 2 последовательных сеансов.
Наконец, для того чтобы гарантировать закономерное, а не случайное получение высокого балла, достижение каждого эталонного показателя необходимо продемонстрировать в течение 2 последовательных сеансов.
Данные, полученные в ходе этого исследования, четко подтвердили конструктную валидность и прогрессирование кривой обучения модулей стимулятора. Интересно, что между показателями производительности квалифицированных и высококвалифицированных хирургов при работе на симуляторе значимых различий не наблюдалось. Это наблюдение подтверждает факт того, что группа квалифицированных хирургов приближается к фазе плато своей кривой обучения ЛХ. Таким образом, занятия, согласно программе обучения, с большей вероятностью принесут пользу начинающим хирургам. Кроме того, заслуживает внимания тот факт, что тенденция к сходству результатов при повышении уровня опыта и на фоне повторного тренинга начинающих хирургов.
Конструктная валидность упражнения для развития основных навыков на симуляторе для ВО LAP MentorTM изучалась и в ходе других исследований. McDougall и соавт. [12] анализировали эффективность деятельности субъектов, разделенных по уровню опыта на 4 группы, согласно сумме баллов для каждого навыка [12]. Хотя исходы в отношении конструктной валидности основных навыков были положительными, пока не ясно, насколько произвольный подсчет баллов, предложенный производителем симулятора, приемлем для определения степени овладения навыками. Необходимо разработать доказательства удельного веса различных компонентов, которые составляют этот балловый показатель. В то же время в соответствии с результатами McDougall и соавт. [12], Zhang и соавт. [13] представили хорошие доказательства конструктной валидности основных навыков, касающихся времени и общего баллового показателя.
В нескольких ранее проведенных исследованиях оценивались валидность и кривые обучения других устройств ВО [14, 15].
Однако выработанные базовые принципы использования симуляции в программе клинического обучения не были объединены в последовательную и преемственную систему квалификационно обоснованного обучения.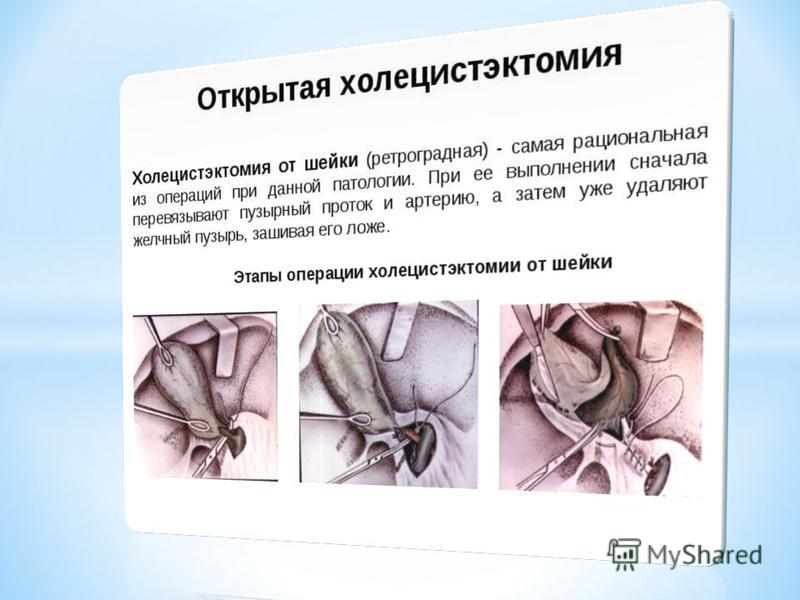 Результаты систематического обзора, выполненного Sturm и соавт., свидетельствовали о наличии нескольких стратегий обучения на основе ВО, используемых для подготовки к реальным оперативным вмешательствам. В большинстве исследований субъектов готовили на основе предписанного количества повторений; при использовании квалификационной оценки применялись изолированные модули, основанные на показателях эффективности, продемонстрированных опытными хирургами [16, 17]. Для того чтобы расширить сферу использования обучающих симуляторов в программах подготовки хирургов-интернов следует предоставить руководство по использованию симулятора, являющееся рекомендованной программой обучения. Это позволит стандартизировать подходы в лапароскопической хирургии и послужит гарантией того, что начинающие хирурги перейдут к выполнению оперативных вмешательств реальным пациентам лишь после достижения рекомендованных уровня квалификации.
Результаты систематического обзора, выполненного Sturm и соавт., свидетельствовали о наличии нескольких стратегий обучения на основе ВО, используемых для подготовки к реальным оперативным вмешательствам. В большинстве исследований субъектов готовили на основе предписанного количества повторений; при использовании квалификационной оценки применялись изолированные модули, основанные на показателях эффективности, продемонстрированных опытными хирургами [16, 17]. Для того чтобы расширить сферу использования обучающих симуляторов в программах подготовки хирургов-интернов следует предоставить руководство по использованию симулятора, являющееся рекомендованной программой обучения. Это позволит стандартизировать подходы в лапароскопической хирургии и послужит гарантией того, что начинающие хирурги перейдут к выполнению оперативных вмешательств реальным пациентам лишь после достижения рекомендованных уровня квалификации.
Общими препятствиями к внедрению учебной программы являются высокая стоимость приобретения и эксплуатации симулятора, необходимость выделения дополнительного пространства для проведения тренинга и дополнительных учебных часов для включения учебной программы с применением средств ВО в учебный план подготовки врачей-интернов [18]. Возможно, сокращение кривой обучения во время выполнения реальных оперативных вмешательств будет способствовать снижению общей стоимости подготовки каждого отдельного интерна-хирурга. Что касается графика занятий, согласно учебной программе, рекомендуется проводить не более 2 учебных сеансов в день с перерывом длительностью не менее 1 ч между занятиями. Необходимость распределять занятия во времени очевидна, однако пока неясно, как часто следует их проводить: 1 раз в день или 1 раз в неделю [10, 11]. Внедрение данной учебной программы потребует определенных компромиссов при назначении учебных сеансов, однако при этом не следует забывать о важности приобретения навыков, поскольку выполнение учебной программы предполагает достижение определенных показателей квалификации.
Данная учебная программа не предназначена для замещения работы в операционной, однако она позволит части кривой обучения сформироваться в лабораторных условиях [4]. При разработке учебной программы не учитывался ранее имевшийся опыт выполнения оперативных вмешательств или владение техническими навыками и не проводилось объективное измерение этих показателей перед зачислением начинающих хирургов на обучающий курс. В качестве начальной части программы обучения целесообразно внедрить модуль для развития когнитивных навыков, наподобие того, который используется для ЛХ в Английском королевском хирургическом колледже [19]. Завершение данной учебной программы основывается на координационных навыках, а не на балловой оценке безопасности и не на показателях клинического исхода. Важным направлением исследований является использование шкал оценки технических навыков с их последующей интеграцией в программное обеспечение симулятора [20].
Крайне важно распространить данную учебную программу среди других пользователей средств ВО, что позволит выполнить внешнюю валидацию учебной программы и оценить ее простоту и применимость, а также окончательно определить, на самом ли деле она позволяет подготовленным с ее помощью начинающим хирургам с большей легкостью и сноровкой переходить к выполнению лапароскопических оперативных вмешательств реальным пациентам. Таким образом, когда другие хирургические центры тоже перейдут к системе обучения на основе средств ВО с объективным измерением показателей квалификации перед выполнением оперативных вмешательств, — лишь вопрос времени.
Литература/References
1. Reichenbach D.J., Tackett A.D., Harris J., Camach D., et al. Laparoscopic colon resection early in the learning curve: what is the appropriate setting? Ann Surg. 2006; Vol. 243: 730-5.
2. Watson D.I., Baigrie R.J., Jamieson G.G. A learning curve for laparoscopic fundoplication. Definable, avoidable, or a waste of time? Ann Surg. 1996; Vol. 224: 198-203.
1996; Vol. 224: 198-203.
3. Aggarwal R., Darzi A. Technical-skills training in the 21st century. N Engl J Med. 2006; Vol. 355: 2695-6.
4. Aggarwal R., Ward J., Balasundaram I., Sains P., et al. Proving the effectiveness of virtual reality simulation for training laparoscopic surgery. Ann Surg. 2007; Vol. 246: 771-9.
5. Sturm L.P., Windsor J.A., Cosman P.H., Cregan P., et al. A systematic review of skills transfer after surgical simulation training. Ann Surg. 2008; Vol. 248: 166-79.
6. Anastakis D.J., Wanzel K.R., Brown M.H., McIlroy J.H., et al. Evaluating the effectiveness of a 2-year curriculum in a surgical skills center. Am J Surg. 2003; Vol. 185: 378-85.
7. Aggarwal R., Grantcharov T.P., Darzi A. Framework for systematic training and assessment of technical skills. J Am Coll Surg. 2007; Vol. 204: 697-705.
8. Aggarwal R., Grantcharov T.P., Eriksen J.R., Blirup D., et al. An evidence-based virtual reality training program for novice laparoscopic surgeons. Ann Surg. 2006; Vol. 244: 310-4.
9. Aggarwal R., Grantcharov T., Moorthy K., Hance J., et al. A competency-based virtual reality training curriculum for the acquisition of laparoscopic psychomotor skill. Am J Surg. 2006; Vol. 191: 128-33.
10. Mackay S., Morgan P., Datta V., Chang A., et al. Practice distribution in procedural skills training: a randomized controlled trial. Surg Endosc. 2002; Vol. 16: 957-61.
11. Moulton C.A., Dubrowski A., Macrae H., Graham B., et al. Teaching surgical skills: what kind of practice makes perfect? a randomized, controlled trial. Ann Surg. 2006; Vol. 244: 400-9.
12. McDougall E.M., Corica F.A., Boker J.R., Sala L.G., et al. Construct validity testing of a laparoscopic surgical simulator. J Am Coll Surg. 2006; Vol. 202: 779-87.
13. Zhang A., Hunerbein M., Dai Y., Schlag P.M., et al. Construct validity testing of a laparoscopic surgery simulator (Lap Mentor): evaluation of surgical skill with a virtual laparoscopic training simulator. Surg Endosc. 2008; Vol. 22: 1440-4.
Surg Endosc. 2008; Vol. 22: 1440-4.
14. Gallagher A.G., Satava R.M. Virtual reality as a metric for the assessment of laparoscopic psychomotor skills. Learning curves and reliability measures. Surg Endosc. 2002; Vol. 16: 1746-52.
Операция по удалению желчного пузыря (холецистэктомия) в Новосибирске: цены, отзывы и адреса
Хирургическое лечение холецистита
Холецистэктомия — это вмешательство, при котором хирург полностью удаляет желчный пузырь открытым или закрытым способом. Поскольку при этом устраняется источник боли, инфекции и камней, операцию называют радикальной.
Холецистэктомия может быть:
- Экстренной, когда пациента оперируют сразу после госпитализации либо в течение 3 часов;
- Срочной, если ее выполняют в первые 24-48 часов после диагностики;
- Плановой, когда жизни пациента ничего не угрожает, и врач выбирает удобное для него время.
На сайте Med.Firmika.ru читайте, когда и как проводят холецистэктомию, какие техники использует хирург и сколько длится восстановление после нее.
Показания к холецистэктомии
Операцию назначают при остром и хроническом холецистите, если медикаментозное лечение неэффективно, симптомы нарастают и есть риск осложнений. Осложнения чаще возникают при калькулезном холецистите и механической желтухе, когда нарушается выделение желчи в двенадцатиперстную кишку, например, из-за желчного камня.
Холецистэктомию выполняют, если возникли:
- Перфорация — разрыв стенки желчного пузыря;
- Эмпиема — скопление гноя в его полости;
- Флегмона — разлитое воспаление его стенки;
- Гангрена — омертвение органа;
- Холепанкреатит — воспаление поджелудочной железы на фоне острого холецистита;
- Перипузырный инфильтрат — воспалительный отек между желчным пузырем и окружающими тканями;
- Подпеченочный абсцесс — гнойные полости в околопузырной клетчатке.

Холецистэктомия необходима и при невоспалительных болезнях желчного пузыря, например, при опухоли либо скоплении холестерина, из-за которых нарушается выделение желчи.
Когда не удаляют желчный пузырь
Открытую операцию выполняют по жизненным показаниям, если есть риск воспаления брюшины. Закрытую операцию не выполняют в тяжелых случаях, поскольку хирург не может осмотреть всю брюшную полость и выполнить дополнительные манипуляции, ее не выполняют в тяжелых случаях. Закрытый метод, например, противопоказан при:
- Перитоните;
- Ожирении 4 степени;
- Поздних сроках беременности;
- Механической желтухе;
- Рубцовых изменениях;
- Остром панкреатите;
- Злокачественных опухолях.
Также закрытая операция противопоказана при выраженных сердечно-легочных болезнях, нарушении свертывания крови и остром холецистите, который длится дольше 48 часов.
Как проходит операция по удалению желчного пузыря
Перед вмешательством хирург обследует пациента, делает УЗИ, рентген и назначает лабораторные анализы. Затем выбирает одну из техник холецистэктомии — открытую, мини-лапаротомическую или лапароскопическую.
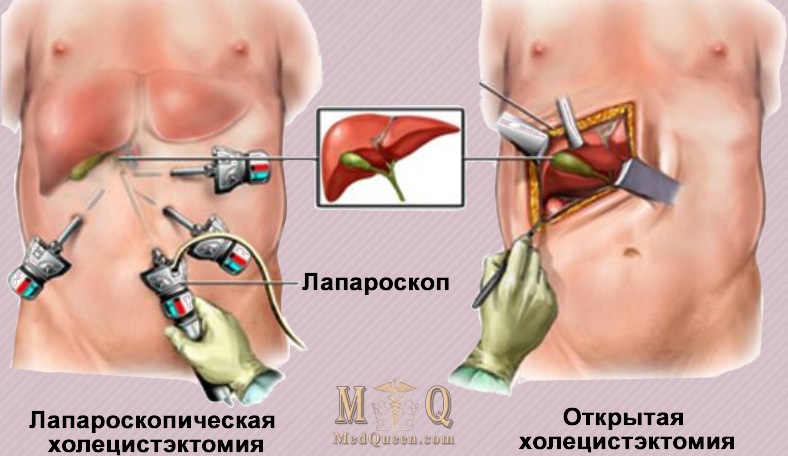
При открытой или полостной операции хирург:
- Делает широкий разрез от грудины до пупка либо под правым подреберьем;
- Проводит ревизию подпеченочной области и оценивает состояние соседних органов;
- Выделяет пузырный проток и клипирует его металлическими клипсами, чтобы желчь из печени сразу поступила в общий желчный проток;
- Чтобы не возникло кровотечения, перевязывает артерии, питающие желчный пузырь;
- Разрезает спайки, отделяет его от окружающей клетчатки и извлекает;
- Обрабатывает ложе органа антисептиками;
- Прижигает мелкие артерии лазером;
- Ставит дренаж и ушивает операционную рану.
При разрыве желчного пузыря и гнойных осложнениях врач удаляет воспалительную жидкость из подпеченочного пространства и брюшной полости.
Лапароскопическая холецистэктомия
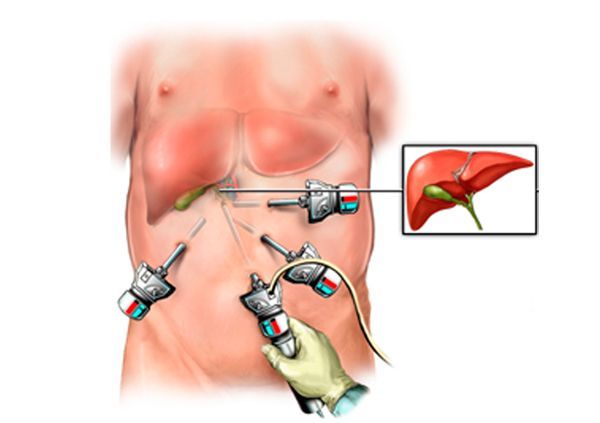
При лапароскопии брюшную полость не вскрывают. Операцию проводят следующим образом:
- Хирург делает 4 прокола на передней брюшной стенке: 2 между пупком и грудиной и 2 под правой реберной дугой;
- Вводит видеоэндоскоп и оценивает состояние тканей;
- Чтобы раздвинуть органы и обеспечить доступ к воспаленному органу, наполняет полость живота газом;
- Вводит лапароскопические инструменты и выполняет те же этапы холецистэктомии, что и при открытом методе;
- Отделенный желчный пузырь удаляет через прокол на стенке живота.
Лапароскопическая холецистэктомия длится 1-2 часа. Если в желчном пузыре есть камни, врач дробит их лазером прямо во время операции, чтобы их было легче было удалить.
Холецистэктомия минидоступом
При минилапаротомии врач делает небольшой разрез — около 3-7 см — под правой реберной дугой. Ее выполняют при спайках или перипузырном инфильтрате, когда лапароскопическая операция противопоказана, но не нужно широко вскрывать брюшную полость.
Осложнения после холецистэктомии
После операции изменяется функция желчевыводящих путей и тонус сфинктера Одди, который контролирует поступление желчи в двенадцатиперстную кишку. При его дисфункции развивается постхолецистэктомический синдром. Из-за спазма сфинктера больного беспокоят боли, а нарушение выделения желчи приводит к проблемам с пищеварением и резкому похудению.
Реабилитация после удаления желчного пузыря
На следующий день после холецистэктомии хирург удаляет дренажную трубку, обрабатывает швы и послеоперационную рану антисептиками и назначает обезболивающие и противовоспалительные препараты.
После выписки следует придерживаться диеты — исключить жареные, копченые и жирные блюда. Нужно питаться дробно, небольшими порциями, поскольку желчь будет выделяться небольшими порциями и ее может не хватить, если постоянно переедать. При нарушении пищеварения врач назначает ферментные препараты и желчегонные.
Сколько стоит холецистэктомия в Новосибирске
Стоимость операции зависит от патологии, техники вмешательства и категории сложности. Цены открытой холецистэктомии:
- Начинаются от 20 500₽;
- Доходят до 35 300₽;
- В среднем составляют 27 150₽.
Лапароскопическая холецистэктомия обойдется в 30 100-55 400₽. Общая сумма будет больше, если нужно отдельно удалить камни из желчевыводящих путей либо раздробить их на мелкие.
Источники для статьи:
- Ивашкин В.Т. И соавт. «Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению желчнокаменной болезни» — 2016
- Кузин М.И «Хирургические болезни» — 2002
Автор статьи:
Мариам Арутюновна Арутюнян
Копирайтер информационного портала Firmika.ru.
Специализация на переводах и авторских статьях по медицине и стоматологии.
Опыт лапароскопической холецистэктомии при патологии желчного пузыря.
Заболеваемость желчнокаменной болезнью (ЖКБ) и количество связанных с нею осложнений неуклонно возрастают. Н сегодняшний день доля ЖКБ достигает 40% среди всех заболеваний желудочно-кишечного тракта. Всего же желчнокаменной болезнью страдают около 10% населения мира, причем с возрастом число больных существенно увеличивается и после 70 лет достигает 30% и более в популяции. Заболеваемость желчнокаменной болезнью в России всегда была высокой.
По данным клинических наблюдений в последние 40 лет заболеваемость холелитиазом в течение каждых 10 лет удваивалась, а по некоторым данным, за последние 25 лет она выросла примерно в 2,8 раза.
Основной метод лечения ЖКБ в настоящее время – хирургический. Каждый год в мире производится до 2,5 миллионов операций на желчном пузыре и желчевыводящих путях, и среди них неуклонно увеливается число видеолапароскопических холецистэктомий. (ЛХЭ).
Операция ЛХЭ предпринята у 610 больных в возрасте от 15 до 76 лет.
У 598 (98%) пациентов она была успешной, а в 12 наблюдениях (2%) произведена конверсия на традиционную операцию
Среди 598 пациентов, перенесших ЛХЭ, старше 60 лет было 91 человек (15%), мужчин было 50 (8,3%), женщин – 107 (91,7%).
Основным показанием к ЛХЭ считалось наличие хронического калькулезного холецистита и полипоза желчного пузыря.
Так ЛХЭ выполнена: при холецистолитиазе у 552 (92,3%) пациентов, при полипозе желчного пузыря – 46 (7,7%).
Противопоказания к ЛХЭ мы традиционно разделяем на общие и местные.
К общим относятся: наличие у пациента выраженных нарушений деятельности сердечно-сосудистой и дыхательной систем, не позволяющих выполнить ЛХЭ даже в условиях ненапряженного пневмоперитонеума (Р=6-7 мм РТ.ст), а так же нарушение свертывающей системы крови, явление перитонита, поздние сроки беременности. Ожирение I и II степени мы считали относительным противопоказанием только на этапе освоения методики. В настоящее время имеется опыт выполнения лапароскопических операций у пациентов с превышение массы тела на 50-60% от идеальной для них. Так, в нашей практике, пациентов с установленным диагнозом ожирения II и III степени было до 20%.
Мы не считаем противопоказание к ЛХЭ ранее перенесенные операции на органах нижнего этажа брюшной полости. Каждый третий оперированный пациент перенес аппендэктомию, грыжесечение, гинекологические вмешательства. Однако в данной ситуации пневмоперитонеум накладывался открытым способом, после введения первого троакара, под контролем зрения, не используя иглы Вереша.
Общеизвестно, что успех проведения операции ЛХЭ на 50% предопределяется тщательным отбором пациентов во время до операционных консультаций. Так, наличие частых признаков острого холецистита в сочетании с клинической картиной «механической желтухи», перенесенные операции на органах верхнего этажа брюшной полости должны предостеречь хирурга о возможны трудностях в выполнении операций, а порой склонить его к отказу о проведении ЛХЭ. Это подчеркивает мудрость специалиста, а не его боязливость.
Это подчеркивает мудрость специалиста, а не его боязливость.
При отборе пациентов для ЛХЭ, помимо общепринятых анализов, в предоперационном обследовании ведущее место занимает УЗИ и фибро-гастродуоденоскопия. Причем УЗИ должно производиться в максимально приближенные сроки к дате операции. Что касается ФГДС, то этот метод предоперационного обследования позволил за отчетный период выявить 52 случая «немых» язв или эрозий желудка и 12-перстной кишки. Все эти пациенты были направлены к врачу-терапевту для лечения язвенной болезни, и в дальнейшем большинству из них выполнена ЛХЭ без осложнений в послеоперационном периоде.
Все операции ЛХЭ выполнены под эндотрахеальным наркозом. Операционная бригада состояла из хирурга, ассистента и операционной сестры. Этапы ЛХЭ традиционные: наложение пневмоперитонеума, введение троакаров, ревизия брюшной полости, холецистэктомия и удаление желчного пузыря из брюшной полости.
Дренирование брюшной полости одной или двумя трубками считаем обязательным на 1-2 суток. В большинстве случаев дренаж удаляется на следующий день при отсутствии активных выделений (серозная жидкость, желчь) из брюшной полости. У двух пациенток на вторые сутки после операций по дренажной трубке стала активно выделяться желчь. Однако перитонеальные явления отсутствовали, желчеистечение прекратилось на 5-6-ые сутки, дренаж удален на 7-8-ые сутки соответственно. В дальнейшем выздоровление.
Карбокси (пневмо) перитонеум поддерживался автоматически на уровне 11-12 мм. рт. ст. в период освоения методики, в последнее время используемое давление в брюшной полости – 8-10 мм. рт. ст., а у пациентов с сопутствующей сердечно-легочной патологией на уровне 6-7 мм рт.ст. Последние три года мы перестали использовать карбоксиперитонеум и перешли на применение воздуха, нагнетаемого в брюшную полость компрессором. В результате чего отмечает снижение задымленности операционного поля, отсутствие риска при работе с баллонами с углекислым газом повышенного давления. Отрицательного воздействия пневмоперитонеума в сравнении с карбоксиперитонеумом отмечено не было, наоборот количество случаев болей в области плеч у больных в послеоперационном периоде (френикус-симптом) значительно уменьшилось.
Отрицательного воздействия пневмоперитонеума в сравнении с карбоксиперитонеумом отмечено не было, наоборот количество случаев болей в области плеч у больных в послеоперационном периоде (френикус-симптом) значительно уменьшилось.
При обработке пузырного протока и артерии используется методика «хобота слона». Раздельное клиппирование и пересечение элементов шейки производится только после их четкой дифференцировки, при рассыпном типе кровоснабжения желчного пузыря мелкие ветви пузырной артерии коагулируются без клиппирования. На культю пузырного протока в обязательном порядке накладываются две клипсы.
Во время первых операций мы расценивали как интраоперационное осложнение истечение желчи из перфорированного желчного пузыря в брюшную полость. Однако в последующем убедились, что адекватная санация подпеченочного пространства предупреждает возникновение послеоперационных осложнений.
Причинами отказа от ЛХЭ на операционном столе были выраженные рубцово-воспалительные изменения в области шейки желчного пузыря в девяти случаях, в одном случае диагностированный синдром Мирризи, в одном случае интенсивное кровотечение из ложа желчного пузыря и в одном случае конверсия произведена на последних минутах операции из-за отказа аппаратуры.
Длительность операции ЛХЭ колебалась от 25 до 185 минут в зависимости от характера морфологических изменений органов и тканей, в среднем 40-60 минут. Следует отметить, что в 18 случаях предпринятых операций ЛХЭ видеолапароскопическая картина желчного пузыря оценена как активное воспаление (острый флегмонозный холецистит). В 14 случаях видеолапароскопически диагностирована водянка желчного пузыря, и ЛХЭ выполнена после предварительной пункции эвакуации водяночной жидкости.
Осложнения в раннем послеоперационном периоде после ЛХЭ возникли у 10 пациентов (1,7%):
· нагноение умбиликальной раны -1;
· инфильтрат эпигастральной раны – 3;
· подпеченочный инфильтрат -1;
· послеоперационный панкреатит -1;
· желчеистечение по дренажу -2;
· желчный перитонит, обусловленный подтеканием желчи из хода Люшка в ложе желчного пузыря – 1;
· полное пересечение холедоха -1;
В двух последних случаях на вторые сутки после ЛХЭ предпринята релапаротомия. При пересечении холедоха, которое произошло при синдроме Мирризи, произведена гепатикоеюностомия. В обоих случаях – выздоровление.
При пересечении холедоха, которое произошло при синдроме Мирризи, произведена гепатикоеюностомия. В обоих случаях – выздоровление.
В связи с незначительностью травмы, наносимой передней брюшной стенке, послеоперационный период у пациентов после ЛХЭ протекает легче, чем после аналогичной традиционной хирургической операции, выполненной посредством лапаротомии. Уже в первые сутки, после вмешательства боли со стороны живота беспокоят больных умеренно, что позволяет сократить дозировку наркотических анальгетиков или вообще отказаться от их применения. Использование антибиотиков решается индивидуально. Тошнота и рвота после ЛХЭ отмечены у 11% больных, боли в плечах (френикус-симптом) – у 15%.
На вторые сутки больные начинали ходить, функция кишечника восстанавливалась на третьи сутки после операции.
Общее состояние больных позволяло выписать их на 3-4 сутки после ЛХЭ, однако мы выписывали больных на 5-6-ые сутки, учитывая, что некоторые осложнения могут появиться в более поздний период.
Таким образом, клиническая практика подтверждает высокую эффективность ЛХЭ при лечении хронического калькулезного холецистита, полипоза желчного пузыря.
Тем не менее, при всех несомненных преимуществах, применение ЛХЭ требует взвешенности при отборе больных, а оперативная техника – тщательности и специализированной подготовки.
Меркушев С.П, Черешнев О.Ю, Мусаткин А.В.
АРИТМИЧЕСКАЯ АКТИВНОСТЬ МИОКАРДА НА РАЗНЫХ ЭТАПАХ АНЕСТЕЗИИ И ПЕРИОПЕРАЦИОННОГО ПЕРИОДА У ПАЦИЕНТОВ, ПОДВЕРГАЕМЫХ ХОЛЕЦИСТЭКТОМИИ | Сумин
1. Балыкова Л. А., Балашов В. П. Антиоксидантная защита при нарушениях ритма сердца // Антиоксиданты в профилактике и комплексной терапии свободнорадикальных патологий: сб. материалов науч. симп. IX Рос. нац. конгр. «Человек и лекарство». – М., 2002. – С. 45–49.
2. Булашова О. В., Малкова М. И. Прогнозирование риска развития сердечно-сосудистых осложнений после холецистэктомии // Казанский медицинский журнал. – 2011. – Т. XCII, № 2. – С. 232–236.
Булашова О. В., Малкова М. И. Прогнозирование риска развития сердечно-сосудистых осложнений после холецистэктомии // Казанский медицинский журнал. – 2011. – Т. XCII, № 2. – С. 232–236.
3. Ветшев П. С., Сулимов В. А., Ногтев П. В. Холецистокардиальный синдром в клинической практике // Клинические перспективы гастроэнтерологии, гепатологии. – 2004. – № 6. – С. 15–19.
4. Демидова М. М., Тихоненко В. М. Циркадная ритмика показателей вариабельности сердечного ритма у здоровых обследуемых // Вестн. аритмологии. – 2001. – № 23. – С. 61–66.
5. Зильбер А. П. Влияние анестезии и операции на основные функции организма. Операционный стресс и пути его коррекции. В кн.: Руководство по анестезиологии / под ред. А. А. Бунятяна. – М.: Медицина, 1994. – С. 314–340.
6. Кровообращение и анестезия. Оценка и коррекция системной гемодинамики во время операции и анестезии / под ред. К. М. Лебединского. – СПб.: Человек, 2012. – 1076 с.
7. Малышев В. Д., Потапов А. С. Нарушения процессов перекисного окисления липидов у хирургических больных на этапах лечения // Анестезиология и реаниматология. – 1994. – № 6. – С. 53–59.
8. Меньшикова Е. Б., Ланкин В. З., Зенков Н. К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. М.: Фирма «Слово», 2006. – 554 с.
9. Михин В. П., Цитопротекция в кардиологии: достигнутые успехи и перспективы. Часть 1. // Архив внутренней медицины. ‒ 2014. – № 1. – С. 44– 50.
10. Морган-мл. Дж. Эдвард. Клиническая анестезиология: пер. с англ. / Дж. Э. Морган-мл., М. С. Михаил, М. Дж. Марри. – 4-е изд. – М.: БИНОМ, 2014. – 1203 с.
Морган-мл. Дж. Эдвард. Клиническая анестезиология: пер. с англ. / Дж. Э. Морган-мл., М. С. Михаил, М. Дж. Марри. – 4-е изд. – М.: БИНОМ, 2014. – 1203 с.
11. Ольбинская Л. И., Литвицкий П. Ф. Коронарная и миокардиальная недостаточность. Патофизиология, диагностика, фармакотерапия. – М.: Медицина, 1986. – 272 с.
12. Сумин С. А., Шаповалов К. Г. Анестезиология-реаниматология: Учебник для подготовки кадров высшей квалификации в 2 томах. − М.: ООО «Издательство «Медицинское информационное агентство», 2018. − Т. I. − 968 с.: ил.
13. Трухан Д. И., Викторова И. А. Современные возможности консервативной терапии желчнокаменной болезни. Школа клинициста // Мед. вестн. – 2011. – № 12. – С. 553.
14. ACC/AHA/ESC 2006. Guidelines for management of patients with ventricular arrythmias and the prevention of sudden cardiac death // Europace. – 2006. – Vol. 8. – P. 746–837.
15. ESC Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery // Eur. Heart Jour. – 2009. – Vol. 30. P. 2769–2812.
16. Heintz K. M., Hollenberg S. M. Perioperative cardiac issues: Postoperative arrhythmias // Surgical Clinics of North America. – 2005. – Vol. 85. – P. 1103–1114.
17. Mahla E., Rotman B., Rehak P. et al. Perioperative ventricular dysrhythmias in patients with structural heart disease undergoing noncardiac surgery // Anesth. Analg. – 1998. – Vol. 86. – P. 16–21.
18. Miller’s Anesthesia, 7th Edition. By Ronald D. Miller, Lars I. Eriksson, Lee A. Fleisher, MD, Jeanine P. Wiener-Kronish, and William L. Young, 2012. – р. 398–404.
Miller’s Anesthesia, 7th Edition. By Ronald D. Miller, Lars I. Eriksson, Lee A. Fleisher, MD, Jeanine P. Wiener-Kronish, and William L. Young, 2012. – р. 398–404.
Лапароскопическая холецистэктомия Текст научной статьи по специальности «Клиническая медицина»
УДК 616.381.366-089.87-072.1
Л.Е. СЛАВИН
Казанская государственная медицинская академия
Лапароскопическая холецистэктомия
I Славин Лев Ефимович
доктор медицинских наук,
профессор кафедры эндоскопии, общей и эндоскопической хирургии 420000, г. Казань, Сибирский тракт, д. 23, кв. 65, тел.: 8-917-391-53-45
В лекции представлена история развития лапароскопической холецистэктомии, обсуждены показания, противопоказания к выполнению данной операции. Особое внимание уделено безопасной технике и профилактике интраоперационных осложнений.
Ключевые слова: лапароскопическая холецистэктомия, показания, техника, осложнения.
L.E. SLAVIN
Kazan State Medical Academy
Laparoscopic cholecystectomy
In the lecture provides the history of laparoscopic cholecystectomy, discussed indications, contraindications to perform this operation. Particular attention is paid to safety technique and prevention of intraoperative complications.
Keywords: laparoscopic cholecystectomy, indications, technique, complications.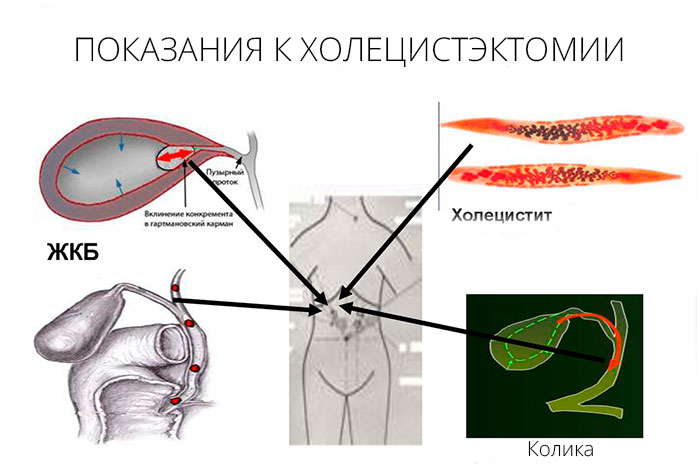
Современная история лечения ЖКБ насчитывает немногим более 100 лет с момента, когда в 1882 году Лангенбух выполнил первую холецистэктомию. Прогресс в лечении этого заболевания до начала семидесятых годов нашего столетия в основном был связан с общим развитием медицины — открытием антибиотиков, разработкой принципов общей анестезии, развитием лучевых методов диагностики. Однако в последние десятилетия начался новый этап в лечении холелитиаза. Особый интерес к этой проблеме связан с чрезвычайно высоким ростом заболеваемости ЖКБ в развитых странах (каждое послевоенное десятилетие этот показатель удваивается). На сегодняшний день желчекаменной болезнью страдает 10-12% населения в странах Запада и 3-4% азиатского населения. Двадцать миллионов американцев имеют конкременты в желчном пузыре, хирурги в этой стране ежегодно выполняют 600 000 холецистэктомий. Ежегодные медицинские затраты составляют 1 млрд долларов, и это без потери зарплаты, производительности труда и стоимости лечения послеоперационных осложнений. С другой стороны, технический прогресс и успехи фундаментальных наук нашли свое приложение в клинической медицине, что привело к пересмотру стратегии и тактики лечения ЖКБ.
Основные изменения коснулись не только лечебной, но и диагностической программ. Если до семидесятых годов в распоряжении врача были только рентгенография как метод диагностики и открытая операция как метод лечения, то за последние 20-25 лет были разработаны УЗИ, КТ и прямые способы контрастирования желчных путей. В лечении, кроме «открытой» операции, стали использовать лапароскопические
вмешательства. Появились такие методы консервативного лечения, как медикаментозное растворение и экстракорпоральная литотрипсия. Возник вопрос — какой метод диагностики и лечения следует избрать для конкретного больного?
До недавнего времени «золотым стандартом» в лечении ЖКБ была «открытая» холецистэктомия (ОХЭ), с результатами которой и сравнивали другие методы лечения. Летальность при плановых ОХЭ не превышала 0,5%. Количество осложнений в зависимости от характера заболевания и общего состояния пациента составляло 5-15%. Большинство из них не были опасны для жизни. Внедрение в практику оперативной лапароскопии произвело переворот во взглядах на хирургическое лечение ЖКБ. Показательны данные Американского института здоровья, где произведено сравнение различных способов лечения ЖКБ (табл. 1.)
Летальность при плановых ОХЭ не превышала 0,5%. Количество осложнений в зависимости от характера заболевания и общего состояния пациента составляло 5-15%. Большинство из них не были опасны для жизни. Внедрение в практику оперативной лапароскопии произвело переворот во взглядах на хирургическое лечение ЖКБ. Показательны данные Американского института здоровья, где произведено сравнение различных способов лечения ЖКБ (табл. 1.)
Показания к лапароскопической холецистэктомии:
1. Хронический калькулезный холецистит,
2. Холестероз желчного пузыря,
3. Полипоз желчного пузыря,
4. Острый холецистит.
В период внедрения показания к этой операции были весьма ограничены. В последующем, по мере накопления опыта, показания к ЛХЭ стали шире и в настоящее время практически приближаются к таковым в «открытой» хирургии. Лапароскопическим доступом выполняют не только изолированную ЛХЭ, но и интраоперационную холангиографию, холедохотомию с эксплорацией ОЖП, наложение билиодигестивных анастомозов.
Таблица 1
Сравнение различных способов лечения ЖКБ
ОХЭ ЛХЭ
Возможность применения, % 98 90-95
Эффективность, % 100 100
Результаты
— летальность, % <1 <1
— осложнения, % 4-8 2-5
— повреждения ВЖП 0,1-0,2 0,2-0,6
— рецидив, % 0 0
Сроки лечения
— в стационаре 3-7 1-2
— амбулаторно 20-40 7-14
Дискомфорт выраженный слабый
ОХЭ — открытая холецистэктомия,
ЛХЭ — лапароскопическая холецистэктомия. Противопоказания к лапароскопической холецистэктомии Абсолютные противопоказания включают:
Противопоказания к лапароскопической холецистэктомии Абсолютные противопоказания включают:
1. Общие противопоказания к проведению лапароскопической операции.
2. Рак желчного пузыря.
3. Плотный инфильтрат в зоне «шейки» желчного пузыря.
4. Поздние сроки беременности.
Относительные противопоказания:
1. Холедохолитиаз, механическая желтуха, холангит.
2. Острый панкреатит.
3. Синдром Мириззи.
4. Склероатрофический желчный пузырь.
5. Цирроз печени.
6. Острый холецистит на сроках более 72 часов от начала заболевания.
7. Перенесенные операции на органах верхнего этажа брюшной полости.
8. Псевдотуморозный панкреатит.
9. Язвенная болезнь.
10. Ожирение Ш-1У степени.
Вопрос об относительных противопоказаниях в каждом случае следует рассматривать индивидуально, в зависимости от уровня подготовки хирурга и оснащенности его операционной.
Дооперационное обследование
Проводят для уточнения характера основного заболевания, выявления его осложнений и сопутствующей патологии со стороны других органов. При анализе полученных результатов могут быть выявлены противопоказания к ЛХЭ как со стороны гепатобилиарной системы, так и общего характера, связанные с непереносимостью интубационного наркоза или ПП.
1. УЗИ — основной метод диагностики ЖКБ [5, 6]. Позволяет определить:
— наличие конкрементов в желчном пузыре и их размеры;
— наличие конкрементов в общем желчном протоке или косвенные признаки холедохолитиаза;
— степень воспалительно-инфильтративных изменений и толщину стенки желчного пузыря;
— диаметр общего печеночного, общего желчного и пузырного протоков;
— расположение и размеры желчного пузыря;
— наличие спаечного процесса в подпеченочном пространстве.
2. Биохимические анализы. Важны для диагностики сопутствующего гепатита и желтухи. Определяют уровень билирубина (прямую и непрямую фракции), АЛТ, АСТ и ЩФ.
3. Ретроградная холангиопанкреатикография (РХПГ) — прямое трансдуоденальное эндоскопическое контрастирование желчевыводящих путей. РХПГ выполняют при подозрении на холедохолитиаз, для выяснения характера механической желтухи и для изучения анатомии протоков перед операцией. Показания к РХПГ должны быть строго аргументированы, так как это инвазивная процедура, частота осложнений при которой достигает 3%, а летальность — 0,1-0,2%. Основные осложнения: панкреонекроз, перфорация двенадцатиперстной кишки, кровотечение в просвет ЖКТ.
4. Обследование сердечно-сосудистой, дыхательной и выделительной систем для исключения противопоказаний к операции. При необходимости проводят предоперационную подготовку и коррекцию выявленных нарушений.
Доступ
Типичную ЛХЭ выполняют из 4 доступов. Технические особенности, например, гепатомегалия или внутрипеченочное расположение желчного пузыря, могут потребовать введения дополнительного, пятого троакара для отведения печени. Разработана косметическая модификация ЛХЭ из трех доступов для технически простых случаев [8].
Технические особенности, например, гепатомегалия или внутрипеченочное расположение желчного пузыря, могут потребовать введения дополнительного, пятого троакара для отведения печени. Разработана косметическая модификация ЛХЭ из трех доступов для технически простых случаев [8].
По одной из вышеописанных методик накладывают ПП. Первый троакар для лапароскопа вводят параумбиликаль-но по белой линии живота ниже пупка. У крупных и высоких пациентов удобнее ввести лапароскоп выше пупка. Последовательно осматривают брюшную полость. Все последующие инструменты вводят в брюшную полость строго под контролем видеомонитора.
Второй инструментальный троакар вводят в эпигастральной области как можно ближе к мечевидному отростку, чтобы угол между лапароскопом и троакаром приближался к 90°. Брюшную стенку пунктируют в косом направлении под углом в 45° так, чтобы стилет троакара появился в поле зрения правее круглой связки печени.
Третий и четвертый вспомогательные троакары вводят соответственно по среднеключичной линии на 4-5 см ниже реберной дуги и по передней подмышечной линии на уровне пупка. Важно, чтобы эти инструменты не находились на одной вертикальной линии.
Пятый троакар вводят при необходимости дополнительного отведения печени ретрактором. Брюшную стенку прокалывают в левом подреберье.
Осматривают печень и желчный пузырь. Уточняют диагноз и тактику.
Этапы операции
Тракция. Цель этого этапа — приподнять желчный пузырь, обнажить ворота печени и зону треугольника Кало для последующей препаровки.
На дно желчного пузыря накладывают мягкий анатомический зажим, введенный через доступ 4. Если из-за рубцового процесса или припаявшегося сальника дно желчного пузыря не визуализируется, выполняют препаровку тканей 1_-образным электродом или диссектором, введенным через доступ 2. Спайки между печенью и диафрагмой должны быть пересечены, так как затрудняют создание экспозиции. Зажимом дно желчного пузыря приподнимают, выполняя тракцию в цефалическом направлении и несколько латерально. Освобождают от спаек об-
Если из-за рубцового процесса или припаявшегося сальника дно желчного пузыря не визуализируется, выполняют препаровку тканей 1_-образным электродом или диссектором, введенным через доступ 2. Спайки между печенью и диафрагмой должны быть пересечены, так как затрудняют создание экспозиции. Зажимом дно желчного пузыря приподнимают, выполняя тракцию в цефалическом направлении и несколько латерально. Освобождают от спаек об-
ласть тела желчного пузыря. На карман Гартмана накладывают второй зажим, введенный через доступ 3. В процессе операции этот инструмент находится в левой руке хирурга. Последующая тракция возможна в двух вариантах — французском (А) и американском (Б):
А) В первом случае выполняют тракцию латерально, вниз и по направлению к передней брюшной стенке. Этот вариант расправляет треугольник Кало и открывает его обзору.
Б) Во втором случае выполняют тракцию вверх и латерально. При этом треугольник Кало сморщивается. Пузырный проток приближается к ОПП и становится непосредственным продолжением ОЖП. Именно такой вариант тракции — одна из причин высокого уровня повреждений ВЖП (до 1 %) в США в период освоения ЛХЭ.
Прицельному осмотру зоны «шейки» желчного пузыря может препятствовать нависающая увеличенная квадратная доля печени. Изменение положения тела и тракция, как правило, позволеют исправить ситуацию. При неэффективности этого приема через дополнительный 5 мм прокол в левом подреберье вводят ретрактор и приподнимают квадратную долю вверх. У полных пациентов осмотр и препаровка «шейки» желчного пузыря может быть затруднена из-за выраженной паравези-кальной клетчатки и увеличенных размеров большого сальника. Облегчить визуализацию ворот печени помогают ретрактор и лапароскоп со скошенной оптикой.
Рассечение брюшины. Мобилизацию начинают с рассечения брюшины 1_-образным электродом по переходной складке на уровне средней трети медиальной поверхности желчного пузыря. Далее 11-образный разрез продолжают над карманом Гартмана с переходом на латеральную стенку органа. Для сохранения принципа безопасности очень важно рассечь брюшину скорее дистально — в зоне кармана Гартмана, чем проксимально — над пузырным протоком или элементами гепатодуо-денальной связки. Рассекают только брюшину, без подлежащей клетчатки, захватывая и приподнимая ее электрохирургическим крючком. Ошибочный уровень рассечения брюшины нередко бывает первым звеном в цепи ошибок, приводящих в конечном счете к повреждению ВЖП [9].
Мобилизацию начинают с рассечения брюшины 1_-образным электродом по переходной складке на уровне средней трети медиальной поверхности желчного пузыря. Далее 11-образный разрез продолжают над карманом Гартмана с переходом на латеральную стенку органа. Для сохранения принципа безопасности очень важно рассечь брюшину скорее дистально — в зоне кармана Гартмана, чем проксимально — над пузырным протоком или элементами гепатодуо-денальной связки. Рассекают только брюшину, без подлежащей клетчатки, захватывая и приподнимая ее электрохирургическим крючком. Ошибочный уровень рассечения брюшины нередко бывает первым звеном в цепи ошибок, приводящих в конечном счете к повреждению ВЖП [9].
Препаровка треугольника Кало. Тупо, при помощи диссектора, тупфера или «пяточки» электрохирургического крючка рассеченную брюшину вместе с подлежащей жировой клетчаткой смещают проксимально, по направлению к гепатодуоде-нальной связке. Обнажают пузырный проток и артерию. Разделение тканей производят крючком или диссектором строго вдоль стенки желчного пузыря, не углубляясь в сторону ОПП. Пузырный проток и артерию очищают от спаек и жировой клетчатки, подготавливая к клипированию и пересечению.
Техника «хобот слона». Выделение элементов «шейки» желчного пузыря — один из наиболее ответственных моментов операции. В настоящее время наиболее безопасной признана техника «хобот слона», которая восстанавливает естественные топографические взаимоотношения между пузырным и общим желчным протоков в условиях тракции. Основной ее принцип состоит в том, что медиальную стенку желчного пузыря выделяют на протяжении 1/3 по всей окружности, не пересекая пузырный проток. Это чрезвычайно важно, так как именно здесь может проходить интимно спаянный с медиальной стенкой пузыря ОПП или правая ветвь печеночной артерии. Такую ситуацию часто наблюдают при склероатрофическом желчном пузыре или при его остром воспалении. Два правила, выработанные еще в начале ХХ века, следует строго соблюдать при выделении органа:
Два правила, выработанные еще в начале ХХ века, следует строго соблюдать при выделении органа:
Ни одно трубчатое образование, идущее к желчному пузырю, не должно быть пересечено до полного прояснения анатомии этой зоны.
Необходимо убедиться, что после выполнения обратимой мобилизации лишь два трубчатых образования — артерия и проток — подходят к желчному пузырю.
Пересечение артерии. Сосуд предварительно клипируют или коагулируют диссектором в 3-4 местах на протяжении, затем пересекают его около стенки желчного пузыря. В половине случаев ствол пузырной артерии не визуализируется, а терминальные веточки сосуда коагулируют при выделении медиальной стенки органа.
После пересечения артерии, проксимальная часть желчного пузыря вместе с пузырным протоком внешне напоминает хобот слона.
Пересечение пузырного протока. Выделяют пузырный проток по всему периметру. Размер клипсы (5 или 8 мм) выбирают в зависимости от диаметра протока. Первой накладывают дистальную клипсу как можно ближе к шейке пузыря. Затем накладывают две проксимальных клипсы. В момент клипиро-вания в поле зрения должны находиться пузырный проток и обе бранши аппликатора. Пузырный проток пересекают ножницами без коагуляции, оставляя 2 клипсы на проксимальной культе. Обращают внимание на то, что пересеченная структура имеет один просвет.
Холангиография. Основной метод интраоперационной диагностики холедохолитиаза при ЛХЭ. Различные хирургические школы придерживаются селективного (выборочного) и рутинного (обязательного) использования интраоперационной холангиографии (ИХ). Рутинное применение ИХ поддерживают не более 50% хирургов. Отказ от обязательного применения интраоперационной холангиографии объясняют следующими факторами:
а) облучение пациента и персонала операционной,
б) значительное (10-20%) количество ложноположительных результатов,
в) возможное повреждение магистральных протоков при выполнении интраоперационной холангиографии «любой ценой»,
г) высокая стоимость исследования.
Показания для селективного использования холангио-графии:
1. Широкий пузырный проток (более 5 мм).
2. Наличие мелких конкрементов в желчном пузыре и особенно в пузырном протоке.
3. Интраоперационная визуализация расширенного желчного протока, то есть когда имеется расхождение между данными дооперационного УЗИ и интраоперационной находкой. Для интраоперационного измерения диаметра пузырного и общего желчного протоков разработаны специальные инструменты.
4. Неясная анатомия в зоне треугольника Кало.
5. Невозможность при наличии соответствующих показаний дооперационного выполнения РХПГ или ЧЧХГ.
Селективные показания для выполнения интраоперацион-ной холангиографии имеют место у 13-20% пациентов. При рутинном использовании интраоперационной холангиогрфии частота резидуального холедохолитиаза достигает 1% [10].
Проблема холедохолитиаза
Частота холедохолитиаза при ЖКБ составляет около 10%. Нераспознанный и неизлеченный холедохолитиаз — одна из основных причин неудач в хирургии ЖКБ. Диагностику холе-дохолитиаза осуществляют до, во время и после ЛХЭ. Оптимальна дооперационная диагностика, что позволяет заранее выбрать адекватную и наименее опасную тактику лечения. Четыре основных фактора позволяют заподозрить холедохо-литиаз: холангит, расширение ВЖП по данным УЗИ более 8 мм,
повышение уровня трансаминаз и прямого билирубина. При сочетании всех четырех факторов вероятность холедохолитиаза достигает 99%. При их отсутствии частота холедохолитиаза равна 7% [15, 39].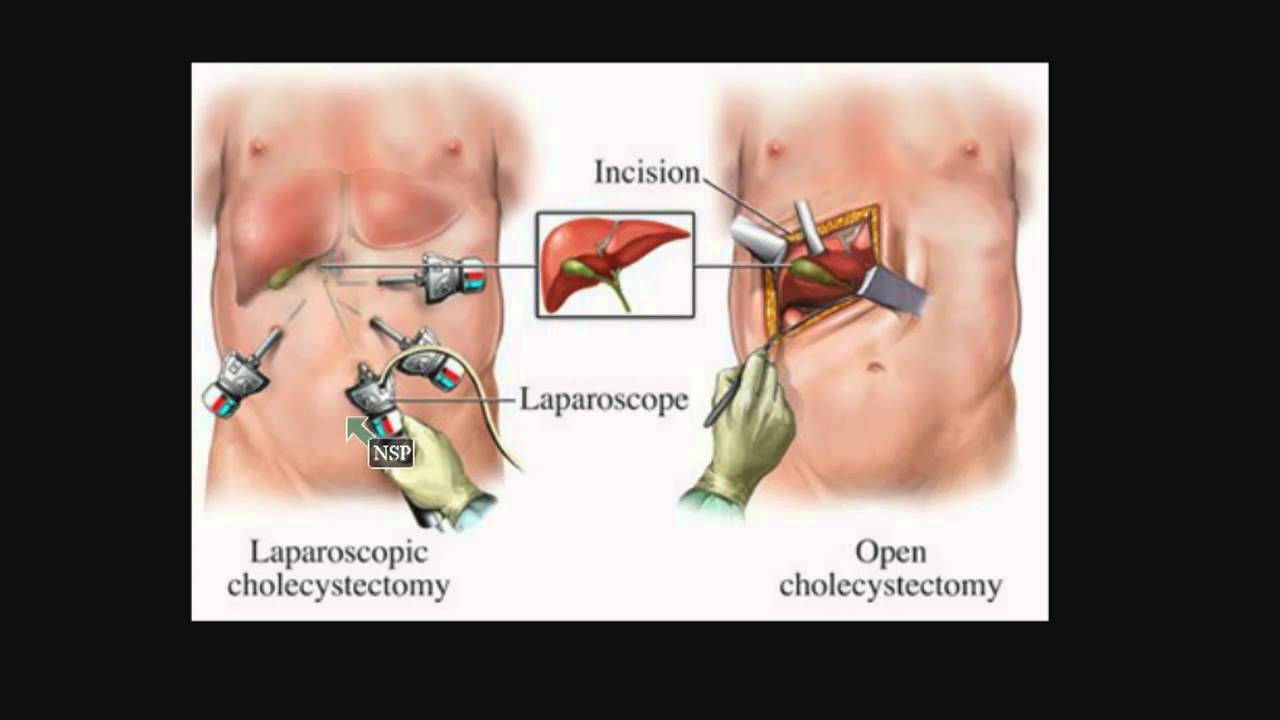
Диагностика холедохолитиаза.
Дооперационная диагностика
Диагноз базируется на стандартных обязательных исследованиях, которые включают:
1. Клиническое обследование — наличие при поступлении или в анамнезе желтухи и холангита, приступа желчекаменного панкреатита. Если проявления первых двух осложнений ЖКБ достаточно ясны, то дифференциальная диагностика различных форм панкреатита сложна. К главным факторам, свидетельствующим о билиарном характере панкреатита, помимо наличия конкрементов в желчном пузыре, относят:
а) повышение уровня щелочной фосфатазы свыше 300 ед/л,
б) возраст свыше 50 лет,
в) женский пол,
г) уровень аланинаминотрансферазы свыше 100 ед/л.
Простой подсчет показывает, что при полном отсутствии или
наличии только одного из перечисленных факторов в 90% всех случаев приступ панкреатита не связан с миграцией конкрементов и, наоборот, при наличии 3 и более признаков в 87% случаев речь идет о желчекаменном панкреатите [16].
2. Биохимические критерии. Для диагностики значимо повышение уровня билирубина (главным образом за счет прямой фракции) более чем в два раза.
3. Данные УЗИ. Холедохолитиаз при обычном исследовании обнаруживают не более чем у 30% пациентов, имеющих конкременты в желчных протоках. Косвенный фактор, свидетельствующий в пользу наличия конкрементов в протоке, — расширение гепатикохоледоха свыше 8 мм. УЗИ следует проводить не ранее, чем за 7 дней до операции, поскольку со временем картина может измениться. Для получения более точной информации сонографию желательно проводить в динамике, то есть 2-3 раза до операции. Необходим постоянный контакт между хирургом и оператором УЗИ с целью сравнения данных сонографии и интраоперационных находок.
Для получения более точной информации сонографию желательно проводить в динамике, то есть 2-3 раза до операции. Необходим постоянный контакт между хирургом и оператором УЗИ с целью сравнения данных сонографии и интраоперационных находок.
Возможно более детальное исследование протоковой системы при использовании трансдуоденального эндоскопического датчика УЗИ. Техника этого исследования состоит в следующем: положение пациента на левом боку. После стандартной для ФГДС подготовки, в двенадцатиперстную кишку до уровня большого дуоденального соска вводят эндоскоп, сопряженный с секторным ультразвуковым датчиком, работающим на частоте 7,5 или 12 мГц. Для обеспечения акустического соединения используют баллончик с жидкостью. Во время исследования датчик постепенно вытягивают в луковицу двенадцатиперстной кишки. Небольшие изменения положения датчика позволяют изучить проксимальную часть общего желчного протока и общий печеночный проток. Принципиальное значение имеет появление акустической тени в зоне действия датчика.
Показания для трансдуоденального УЗИ аналогичны показаниям для РХПГ Особое значение исследование приобретает в случаях, когда не удается канюлировать БДС, пациент не переносит контрастный препарат, или в анамнезе у него недавно перенесенный приступ острого панкреатита (РХПГ может вызвать обострение процесса).
Противопоказания к выполнению трансдуоденального УЗИ: исследование не показано, если дистальная часть общего желчного протока хорошо визуализируется при обычном трансабдоминальном УЗИ. В некоторых случаях проведение трансдуоденального УЗИ невозможно — при наличии стенози-
рующей язвы двенадцатиперстной кишки или при сдавлении кишки извне. Необходимо учитывать тот факт, что глубина проникновения при использовании датчика, работающего на частоте 7,5 мГц, не превышает б см. По точности диагностики холедохолитиаза трансдуоденальное УЗИ сравнимо с прямыми методами контрастирования ВЖП (РХПГ, ЧЧХГ) [18]. По данным Ю.Г Старкова и соавт., метод позволил выявить холедохолитиаз, недиагносцированный до операции, у 5% больных. Точность диагностики холедохолитиаза по данным интраоперационного УЗИ в этой ситуации составила 1GG%, тогда как информативность интраоперационной холангиографии — лишь 57% [19].
По точности диагностики холедохолитиаза трансдуоденальное УЗИ сравнимо с прямыми методами контрастирования ВЖП (РХПГ, ЧЧХГ) [18]. По данным Ю.Г Старкова и соавт., метод позволил выявить холедохолитиаз, недиагносцированный до операции, у 5% больных. Точность диагностики холедохолитиаза по данным интраоперационного УЗИ в этой ситуации составила 1GG%, тогда как информативность интраоперационной холангиографии — лишь 57% [19].
4. Внутривенная холангиография. Это исследование малоинформативно в диагностике холедохолитиаза. Тем не менее его можно использовать при наличии гепацитотропного контраста (билископин) и рентгеновского аппарата, позволяющего получать томограммы на уровне гепатикохоледоха [2G].
б. РХПГ относят к прямым методам контрастирования желчных путей. Контрастный препарат вводят ретроградно после эндоскопической катетеризации БДС. Точность этого исследования в отношении выявления холедохолитиаза близка к 1GG%. Однако вмешательства на БДС сопровождаются осложнениями, частота которых достигает 2-З% и летальностью в доли процента. К ним относят: острый панкреатит, кровотечение и перфорацию двенадцатиперстной кишки. Поэтому в большинстве клиник РХПГ перед ЛХЭ применяют селективно.
Показания для РХПГ:
а) желтуха или холангит при поступлении или в анамнезе;
б) повышение уровня печеночных проб в два и более раз;
в) желчекаменный панкреатит;
г) расширение гепатикохоледоха свыше 8 мм.
Выполнение РХПГ возможно у 8G-9G% пациентов. Трудности
при выполнении этой процедуры связаны с анатомическими аномалиями расположения БДС и наличием парафатериаль-ных дивертикулов [21].
6. Чрескожная чреспеченочная холангиография.
ЧЧХ также относят к прямым методам контрастирования желчных путей и выполняют по тем же показаниям, что и РХПГ. С целью диагностики холедохолитиаза ЧЧХ обычно применяют в случаях, когда РХПГ невыполнима. Эта процедура эффективна при расширении ВЖП и наличии желчной гипертензии. С 19б9 года для выполнения этого исследования применяют иглу Хиба. Под контролем рентгенотелевизионной установки иглу вводят в девятом межреберье по средне-подмышечной линии по направлению к воротам печени на глубину 12-15 см. При легком подтягивании иглы и одновременном введении контрастного вещества следят на экране за появлением изображения печеночных желчных ходов. Частота осложнений составляет G,9-4,9% [22]. Они включают:
1) желчеистечение в брюшную полость;
2) холангит;
3) подкапсульную гематому;
4) поддиафрагмальный абсцесс.
ЧЧХ уступает РХПГ по своей эффективности, поскольку извлечение конкрементов из протоков чреспеченочным доступом сложнее [23].
Интраоперационная диагностика холедохолитиаза
Как и при открытой холецистэктомии, основной способ ин-траоперационной диагностики холедохолитиаза при ЛХЭ — рентгенологическое исследование желчных путей. В эндохирургии значимость интраоперационной холангиографии возрастает из-за невозможности мануальной пальпации ВЖП. Холангиография во время ЛХЭ может быть успешно выполнена у 7G-95% пациентов.
Начиная с 1991 года, для интраоперационной диагностики холедохолитиаза стали применять интраоперационное УЗИ. Это исследование требует специального датчика, который вводят через 10 мм троакар. Преимущество интраоперационного УЗИ: — отсутствие вредного действия радиации на пациента и персонал. Главные недостатки — необходимость специального дорогостоящего оборудования и невозможность диагностировать конкременты в терминальном отделе общего желчного протока [24].
Это исследование требует специального датчика, который вводят через 10 мм троакар. Преимущество интраоперационного УЗИ: — отсутствие вредного действия радиации на пациента и персонал. Главные недостатки — необходимость специального дорогостоящего оборудования и невозможность диагностировать конкременты в терминальном отделе общего желчного протока [24].
Эффективный метод не только диагностики, но и лечения холедохолитиаза — лапароскопическая холедохоскопия.
Послеоперационная диагностика холедохолитиаза
Частота резидуального холедохолитиаза составляет 1-2%. Клинические признаки холедохолитиаза могут проявиться на различных сроках после ЛХЭ. В раннем послеоперационном периоде при нарушении желчеоттока возможно желчеистече-ние из ложа пузыря в брюшную полость.
На более поздних сроках превалируют симптомы желчной гипертензии: распирающие боли в правом подреберье, желтуха, сопровождающая приступы, холангит. Для диагностики холедохолитиаза используют РХПГ и ЧЧХГ.
Лечебная тактика при холедохолитиазе
1. Эндоскопическая папиллосфинктеротомия. Оптимальным способом коррекции холедохолитиаза считают доопера-ционную ЭПСТ с извлечением конкрементов из протоков [25]. Лучше выполнять процедуру не ранее, чем за 24 часа до операции. Это снижает до минимума вероятность миграции новых конкрементов из желчного пузыря.
Однако выполнение РХПГ возможно не у всех пациентов. Противопоказаниями служат: наличие парафатериальных дивертикулов, анатомические аномалии расположения БДС. Относительное противопоказание — хронический панкреатит. Нередко после выполнения РХПГ выясняется, что произвести ЭПСТ и извлечь конкременты не представляется возможным. Основными препятствиями служат тубулярный стеноз терминальной части общего желчного протока и крупные (более
Основными препятствиями служат тубулярный стеноз терминальной части общего желчного протока и крупные (более
1 см в диаметре) конкременты. В этой ситуации, при наличии соответствующего оборудования и опыта, показана лапароскопическая холедолитотомия или освобождение протоков чрезкожно-чрезпеченочным доступом.
К сожалению, ЭПСТ имеет свои недостатки. Анализ отдаленных результатов показал, что через 4-5 лет возрастает число больных с атрофией слизистой оболочки желудка, уменьшается диаметр папиллотомного отверстия. Явления холангита отмечены не только у больных с рестенозом большого дуоденального сосочка, но и при полном рассечении сфинктера Одди вследствие развития дуодено-билиарного рефлюкса [26].
2. Лапароскопическая холедохотолитотомия.
Для выполнения этого приема необходимы:
а) операционный холедохоскоп с набором инструментов для извлечения камней;
б) дренажи для лапароскопического дренирования желчных путей;
в) специалист, владеющий техникой эндохирургического шва.
Оперативная техника
Существует два варианта эксплорации и ревизии холедо-ха — через пузырный проток или путем холедохотомии. Преимущество доступа через пузырный проток — в сохранении целостности общего желчного протока. Однако этот способ требует применения баллонной дилятации пузырного протока для введения инструментов. Второе преимущество — отсут-
ствие необходимости в ушивании холедохотомического отверстия. После эксплорации холедоха конкременты извлекают с помощью корзинки Дормиа или катетера Фолея.
Процесс контролируют либо рентгенологически, либо визуально через гибкий холедохоскоп. В некоторых случаях возможно «проталкивание» конкрементов в двенадцатиперстную кишку. Завершают операцию дренированием общего желчного протока через пузырный проток или через холедохотомиче-ское отверстие по Керу. Герметичность проверяют введением физиологического раствора и контрольной холангиографией. Подпеченочное пространство дренируют отдельной трубкой.
Основное преимущество лапароскопической холедохоли-тотомии перед РХПГ и ЭПСТ — сохранение сфинктерного аппарата БДС. Для снижения травматичности процедуры предложено интраоперационное применение экстракорпоральной литотрипсии с целью измельчения конкрементов перед экстракцией [27, 28].
При отсутствии контроля за полнотой лапароскопической холедохолитотомии возможно эндохирургическое наложение холедоходуоденоанастомоза (ХДА)
3. Переход к «открытой» операции и ревизия ВЖП Основное показание для открытой эксплорации холедо-ха — невозможность по тем или иным причинам выполнения эндоскопической или лапароскопической холедохолитотомии при доказанном холедохолитиазе.
После разрешения принципиальных интраоперационных задач желчный пузырь электрохирургически выделяется из ложа, проводится контроль гемостаза, санация подпеченоч-ного пространства. Желчный пузырь извлекается через один из 10 мм доступов. В большинстве случаев брюшная полость дренируется на сутки трубкой.
Таблица 2
Результаты ЛХЭ в ведущих странах Европы и США в 1992 г.
Страна Выполнено ЛХЭ Переход к открытой операции % Повреждения ВЖП % Леталь- ность
Англия и Уэлс 3319 5,2 G,33 G,17
Бельгия 3244 б,5 G,5G G,G9
Франция 2955 4,8 G,6G G,G3
Шотландия 1б55 14,G G,7G G,5G
Швейцария 91G 8,1 G,5G G
США 776G4 3-8 G,59 G,G4
Переход к лапаротомии
Необходимость в конверсии по ходу ЛХЭ возникает в 3-7% случаев (табл.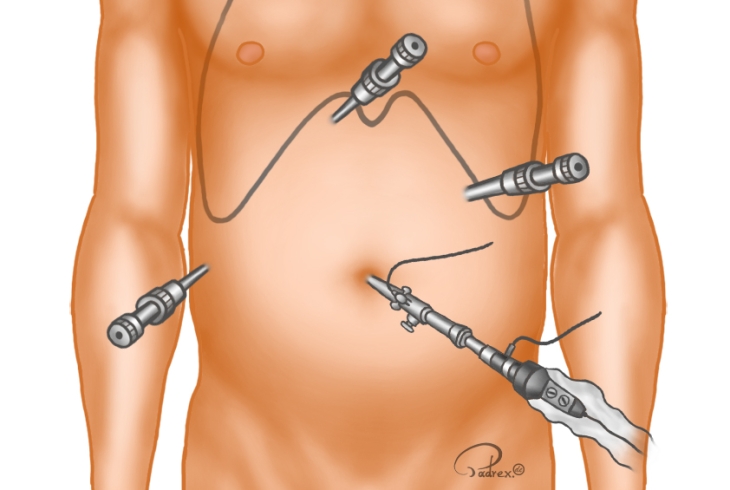 2). В частности, по данным 1_мпдз1оп Е.Н., Реде Р.У., уровень конверсий в США составляет 6,1% [25]. Показаниями служат:
2). В частности, по данным 1_мпдз1оп Е.Н., Реде Р.У., уровень конверсий в США составляет 6,1% [25]. Показаниями служат:
— неясная анатомия в зоне треугольника Кало;
— невозможность идентифицировать элементы ворот печени из-за выраженных инфильтративных или рубцовосклеротических изменений;
— интраоперационные осложнения: ранение ВЖП и кровотечение, которое невозможно остановить без риска повреждения элементов гепатодуоденалной связки;
— выявление по ходу лапароскопии заболеваний, не диа-гносцированных до операции. Чаще это опухолевый процесс с локализацией в ободочной кишке. По ходу ЛХЭ рак ободочной кишки обнаруживают в 0,5% случаев [12].
Переход к лапаротомии не является поражением хирурга, признаком его слабости и некомпетентности. Лапаротомия —
это почетное отступление, позволяющее предотвратить тяжелые, иногда фатальные осложнения.
По мнению J. Hunter, необходимо установить предел времени для пробной мобилизации желчного пузыря. За 30 минут от начала его выделения пузырный проток должен быть четко определен и подготовлен к клипированию. Лапароскопическая операция не может быть в несколько раз продолжительнее «открытой». Чревосечение должно быть выполнено до того, как хирург затратит слишком много сил и времени на лапароскопическую мобилизацию, когда переход к лапаротомии становится эмоционально невозможен [27].
Снижение порога перехода к лапаротомии — один из основных факторов профилактики осложнений в эндохирургии. Группа французских хирургов выполнила более 2000 ЛХЭ без единого повреждения ВЖП. Они добились этого, расширив показания к чревосечению на этапе освоения метода: на первые 100 ЛХЭ лапаротомия выполнена в 22 случаях, на вторую сотню — у 12, на третью — у 6 пациентов. Далее частота конверсии установилась на уровне 1-2%.
Далее частота конверсии установилась на уровне 1-2%.
Послеоперационное ведение
Эндоскопическая хирургия изменила принципы ведения больных после операции. Отсутствие болей в животе и мышцах брюшной стенки позволяет не ограничивать физическую активность пациента уже в первые сутки после операции. Наркотические аналгетики не назначают. Полноценная экскурсия диафрагмы предотвращает гипостатическую пневмонию. Перистальтика восстанавливается через несколько часов, самое позднее — через сутки после операции. Тошнота и рвота — редкое явление. В отличие от традиционной абдоминальной хирургии, напряжение мышц передней брюшной стенки отсутствует, незначительная локальная болезненность имеет место лишь в местах введения троакаров. Дефанс и вздутие живота настолько нетипичны для лапароскопических операций, что их появление всегда свидетельствует о послеоперационном осложнении (кровотечение, желчеистечение, повреждение кишечника и др.). Антибиотики назначают только при остром воспалении желчного пузыря или при дегерметизации органа в процессе ЛХЭ. Инфузионную терапию назначают только по показаниям. Кормление начинают со вторых суток. Длительность нахождения в стационаре составляет 1-7 дней, что зависит от особенностей заболевания и характера операции. Как правило, через 1-2 недели после вмешательства пациент может вернуться к привычному образу жизни, включая легкий физический труд и занятия спортом.
ЛИТЕРАТУРА
1. Gilliland T.M., Traverso L.W. Modern Standards for Comparison of Cholecystectomy with Alternative Treatments for Symptomatic Cholelithiasis with Emphasis on Long Term Relief of Symptoms. Surgery Gynecology and Obstetrics 1990; 170: 39-44.
2 Zacks S.L., Sandler R.S., Rutledge R., Brown R.S. A population-based cohort study comparing laparoscopic cholecystectomy and open cholecystectomy.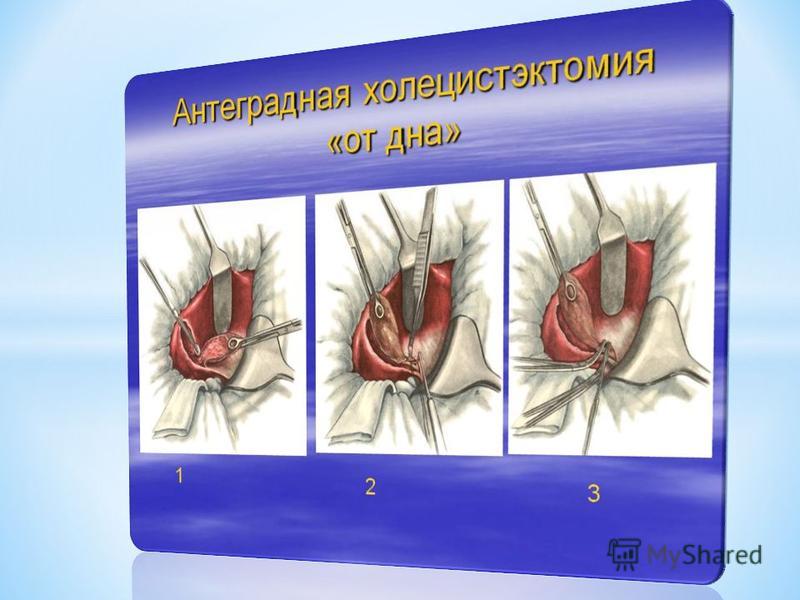 Am J Gastroenterol 2002; 97: 334-340.
Am J Gastroenterol 2002; 97: 334-340.
3. Kratzer W., Mason R.A., Kachele V. Prevalence of gallstones in sonographic surveys worldwide. J Clin Ultrasound 1999; 27:1-7.
4. Fahlke J., Ridwelski K., Manger T., Grote R., Lippert H. Diagnostic workup before laparoscopic cholecystectomy-which diagnostic tools should be used? Hepatogastroenterology 2001; 48: 59-65.
5. Lee C.L., Wu C.H., Chen T.K. et al: Prospective study of abdominal ultrasonography before laparoscopic cholecystectomy. J Clin Gastroenterol 1993; 16/2: 113-116.
6. Gai H., Thiele H. Sonographische Selektionskriterien fur die laparoskopische Cholecystektomie. Chirurg 1992; 63: 426-431.
7. Феденко В.В., Евдошенко В.В., Матвеев Н.Л., Владыкин Л.А. Косметическая модификация ЛХЭ для технически простых случаев. Эндоскопическая хирургия 1995; 2-3: 21-23.
8. Федоров И.В., Славин Л.Е. Повреждения желчных протоков при лапароскопической холецистэктомии. Казань, 1995. 72 с.
9. Ciair D.G. Brooks D.C. Laparoscopic choiangiography. The case for a seiective approach. Surg Ciin North Am 1994; 74/4: 9б1-9бб.
1G. Phiiiips EH, Carroii BJ, Pearistein AR et. ai. Laparoscopic choiedochoscopy and extraction of common biie duct stones. Worid J. Surg. 1993; 17: 22-28.
12. Trondsen E., Edwin B., Reiertsen O., Faerden A.E., Fagertun H., Rosseiand A.R. Prediction of common biie duct stones prior to choiecystectomy: a prospective vaiidation of a discriminant anaiysis function. Arch Surg 1998; 133(2): 1б2-1бб.
13.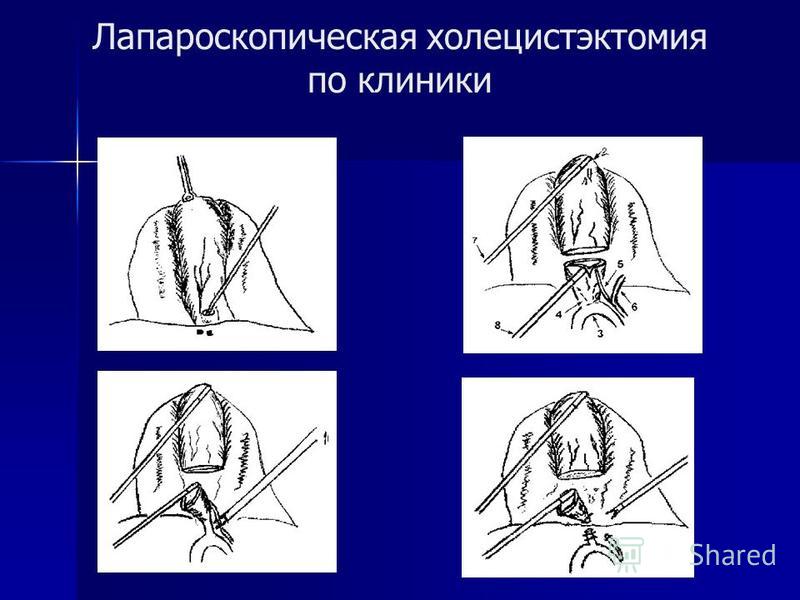 Edmundowicz S.A., Aiiperti G., Middieton W.D. Preiiminary experience using endoscopic uitrasonography in the diagnosis of choiedochoiithiasis. Endoscopy 1992; 24: 774-778.
Edmundowicz S.A., Aiiperti G., Middieton W.D. Preiiminary experience using endoscopic uitrasonography in the diagnosis of choiedochoiithiasis. Endoscopy 1992; 24: 774-778.
14. Старков Ю.Г., Стрекаловский В.П., Вишневский В.А. и др. Интраоперационное ультразвуковое исследование при лапароскопических вмешательствах. Анналы хирургической гепатологии 1997; 2: 94-1G2.
15. Saiky B., Bauer J. Intravenous choiangiography, ERCP, and seiective operative choiangiography in the performans of iaparoscopic choiecystectomy; Surg Endosc. 1994; 8: 289-291.
16. Bouiay J., Scheiienberg R., Brady P.G. Roie of ERCP and therapeutic biiiary endoscopy in asssociation with iaparoscopic choiecistectomy. Am. J. Gastroenteroi. 1992; 77: 7: 837-842.
17. Гальперин Э.И, Волкова Н.В. Заболевания желчных путей после холецистэктомиию. М.: Медицина, 1988. 2б5 с.
18. Ward E.M., LeRoy A.J., Bender C.E. et ai. Imaging of compiications of iaparoscopic choiecistectomy Abdom Imaging 1993; 18: 15G-155.
19. Ascher S.M., Evans S.R.T., Zeman R.K. Laparoscopic choiecystectomy: intraoperative uitrasound of the extrahepatic biiiary tree and the naturai history of postoperative transabdominai uitrasound findings. Seminars in Uitrasound, CT, and MRI, 1993, 14/5 331-337).
2G. Андреев А.Л., Рыбин Е.П., Учваткин В.Г., и др. Сравнительная оценка результатов одноэтапной и двухэтапной тактики лечения холедохолитиаза у 15G пациентов. Тезисы международной конференции «Применение сшивающих аппаратов в лапароскопической и торакоскопической хирургии»; 1997; Санкт-Петербург.
21. Котовский А. Е., Поздеев И.В., Тупикин Л.В. Отдаленные результаты эндоскопической папиллосфинктеротомии. Анналы хирургической гепатологии 1997; 2: 132-135.
Е., Поздеев И.В., Тупикин Л.В. Отдаленные результаты эндоскопической папиллосфинктеротомии. Анналы хирургической гепатологии 1997; 2: 132-135.
22. Carroii B., Phiiiips E. Laparoscopic removai of common duct stones. Gastrointestinai Endoscopy Ciinics North America 1993; 3/2: 239-248.
23. Phiiiips E., Carroi B., Pearistein R. et ai. Laparoscopic choiecystectomy and extraction of common biir duct stones. Worid J Surg. 1993;17: 22-28.
24. Ebner S., Rechner J., Beiier S., Erhart K., Riegier F.M., Szinicz G. Laparoscopic man agement of common biie duct stones. Surg Endosc 2GG4; 18(5): 7б2-7б5.
25. Livingston E.H., Rege R.V. A nationwide study of conversion from iaparoscopic to open choiecystectomy. Am J Surg 2GG4; 188: 2G5-211
26. Junger W., Junger WG, Hutter J., Miiier K, Moritz E. Deiay diagnosis of maiignant tumors missed at iaparoscopic choiecystectomy. Surg. Endosc. 1997; 11: 1G: 1G1G-1G13.
27. Hunter J.G. Commentary. Techniques of iaparoscopic choiecystectomy: The difficuit operation. Surg Ciin N Am 1994; 74/4: 777-78G
28. Randoux O., Desrousseaux B., Atat I., Sarkis P., Corman N., Ampe J. Les Laparotomies de Conversions au Cours des Choiecystectomies par Laparoscopie. J Chir 1992; 129/12: 519-522.
Сравнительная оценка методов дополнительного гемостаза при лапароскопической холецистэктомии
На правах рукописи
ЗРЯНИН АЛЕКСАНДР МИХАЙЛОВИЧ
СРАВНИТЕЛЬНАЯ ОЦЕНКА МЕТОДОВ ДОПОЛНИТЕЛЬНОГО ГЕМОСТАЗА ПРИ ЛАПАРОСКОПИЧЕСКОЙ ХОЛЕЦИСТЭКТОМИИ
(экспериментально — клиническое исследование) 14.01.17 — хирургия
1 П ‘ 1 * ~ «-.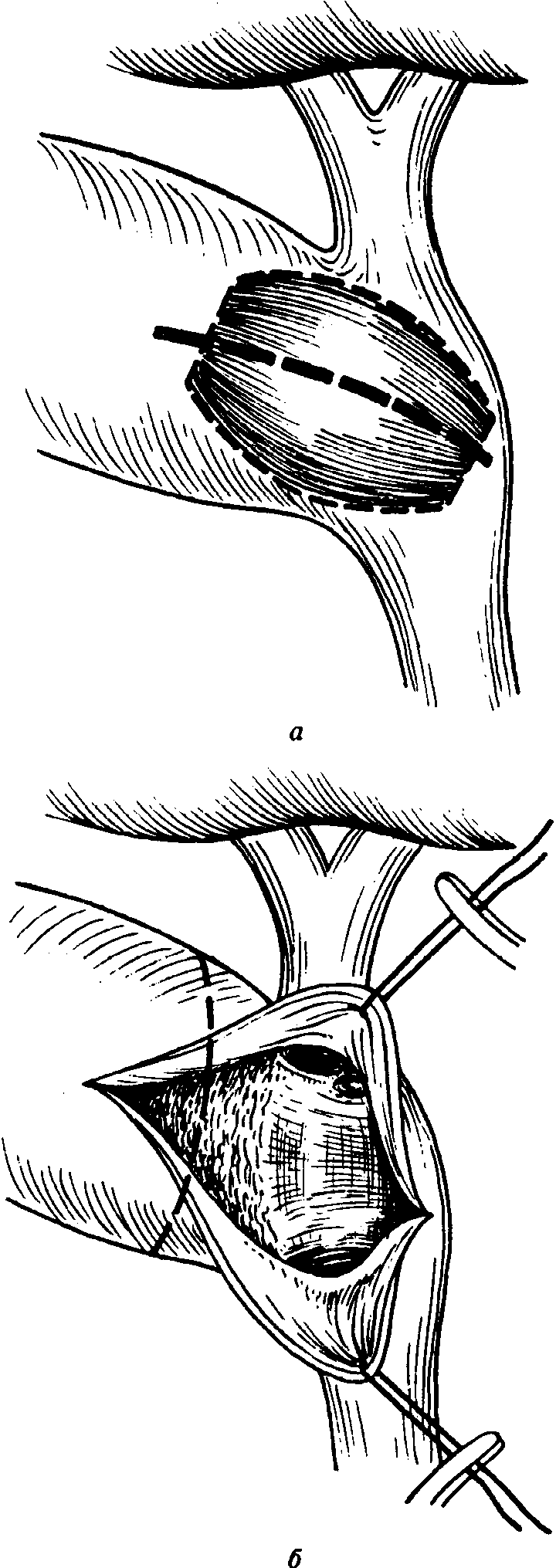 Р
Р
Актуальность проблемы
Лапароскопическая холецистэктомия (ЛХЭ) является одной из наиболее распространенных операций. Доля таких операций в ведущих клиниках достигает 92-96% [Е.И.Брехов, 2005; Д.И. Карлов, 2007; Э.И.Гальперин,Т.Г.Дюжева,2011; Б.М.ЗкаБЬещ е1 а1.,1996]. Однако, несмотря на очевидные преимущества малоинвазивных операций, ЛХЭ имеет свои особенности и «проблемные» этапы, одним из которых является отделение желчного пузыря от печени с последующей обработкой его ложа. Неправильно или недостаточно обработанное ложе желчного пузыря может стать источником кровотечения как во время операции, так и в послеоперационном периоде [А.Н.Прохин, 2002; В.С.Фомин,2008; М.ЕКУ/аЬзИ, 2002; Н. Гташига, 2003].
Технические сложности и осложнения при обработке ложа желчного пузыря наиболее часто возникают при выраженном инфильтративном процессе у больных деструктивным холециститом, при эмпиеме желчного пузыря, а так же у пациентов с рубцово-сморщенным желчным пузырем [В.П.Сажин, 2001; А.Б.Амосов, 2003; Н.А.Кузнецов,2003; 8.Така§1,2002]. Группу риска представляют так же пациенты с сопутствующими гепатитами различной природы и циррозом печени [М.М.Киладзе, 2001; С.М.Рпе1, 1999; К. БЫтасЬ, 2002].
Наиболее распространенный способ гемостаза в лапароскопической хирургии — коагуляция — далеко не всегда может обеспечить надежный гемостаз в ложе желчного пузыря и несет в себе опасность глубокого коагуляционного повреждения паренхимы [Ю.И.Галлингер, 2003; С.А.Совцов,2003;]. В особенности это относится к операциям при остром деструктивном холецистите. Кроме того, остановка возникшего кровотечения вблизи крупных желчных протоков и магистральных сосудов методом коагуляции чревата их повреждением [Кригер,1997].
Полезным дополнением или альтернативой известным методам гемостаза может служить простая в использовании коллагеновая пластина, покрытая компонентами фибринового клея, известная под названием «Тахокомб» [0,Г.Скипенко,2007; О.Егск^ап, 2008].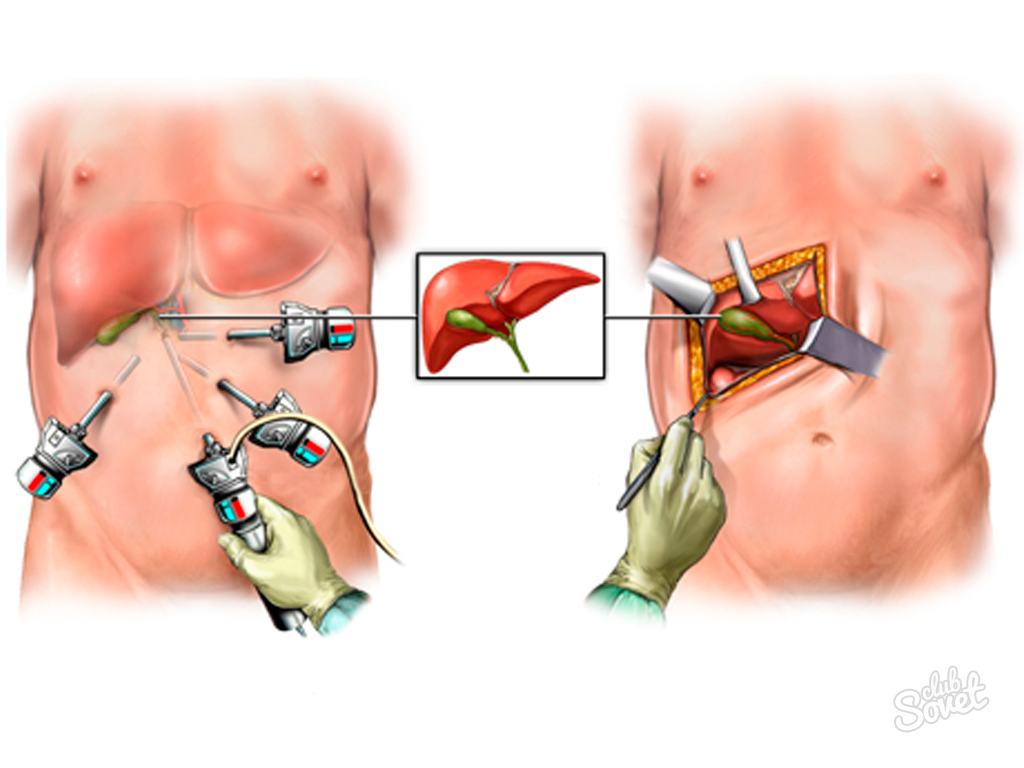 Однако опыт использования данной фибрин-коллагеновой субстанции в абдоминальной хирургии, в том числе и при ЛХЭ, невелик. Отсутствуют экспериментальные работы по изучению гемостатических возможностей субстанции в сравнении с препаратами желатина и целлюлозы. Остается неясным воздействие субстанции на подлежащую ткань. Недостаточно освещены вопросы техники аппликации препарата при лапароскопических операциях, и ряд других немаловажных вопросов. Поэтому исследование, посвященное сравнительной оценке
Однако опыт использования данной фибрин-коллагеновой субстанции в абдоминальной хирургии, в том числе и при ЛХЭ, невелик. Отсутствуют экспериментальные работы по изучению гемостатических возможностей субстанции в сравнении с препаратами желатина и целлюлозы. Остается неясным воздействие субстанции на подлежащую ткань. Недостаточно освещены вопросы техники аппликации препарата при лапароскопических операциях, и ряд других немаловажных вопросов. Поэтому исследование, посвященное сравнительной оценке
дополнительных методов гемостаза при лапароскопической холецистэктомии можно считать актуальным.
Целью настоящего исследования явилась сравнительная оценка методов дополнительного гемостаза во время лапароскопической холецистэктомии.
В соответствии с целью были поставлены следующие задачи:
1. Изучить в условиях острого эксперимента сравнительные возможности гемостатических препаратов на основе коллагена, желатина, целлюлозы, фибриногена, тромбина. Установить наиболее эффективное средство остановки кровотечения из паренхимы печени.
2. В хроническом эксперименте исследовать морфологическую особенность взаимодействия фибрин-коллагеновой субстанции с тканью печени.
3. Отработать технические аспекты применения фибрин-коллагеновой субстанции при лапароскопической холецистэктомии.
4. Провести сравнительную оценку гемостатической способности фибрин-коллагеновой субстанции при лапароскопической холецистэктомии в клинике.
Научная новизна
Произведено сравнительное исследование различных гемостатических средств, представляющих несколько биологических групп веществ — препаратов коллагена, целлюлозы, желатина, тромбина, фибриногена. Показано, что наиболее выраженными гемостатическими свойствами обладает препарат фибрин-коллагеновая субстанция (ФКС), при использовании которого для достижения гемостаза при ЛХЭ не требуется применения других средств остановки кровотечения. В экспериментальных условиях выявлена способность ФКС стимулировать регенерацию ткани печени.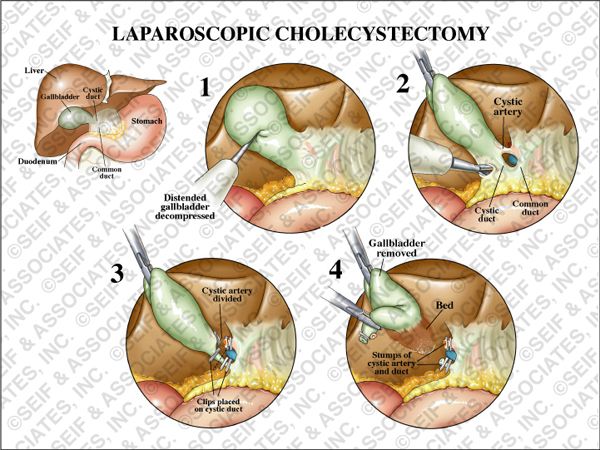 Впервые был установлен факт ранней стимуляции процессов ангиогенеза и фибробластической реакции, начинающихся уже на 3 сутки после аппликации ФКС на раны печени. Обнаружено свойство быстрого восстановления мезетелиального покрова исследуемых органов, которое начиналось к 7 суткам и завершалось на остатках клеевой композиции к 14 суткам послеоперационного периода. Установлены сроки и механизм рассасывания препарата ФКС в организме экспериментальных животных. Помимо гемостаза в ложе желчного пузыря препарат способен обеспечить остановку кровотечения из перихоледохеальных сосудов при операциях на желчных протоках.
Впервые был установлен факт ранней стимуляции процессов ангиогенеза и фибробластической реакции, начинающихся уже на 3 сутки после аппликации ФКС на раны печени. Обнаружено свойство быстрого восстановления мезетелиального покрова исследуемых органов, которое начиналось к 7 суткам и завершалось на остатках клеевой композиции к 14 суткам послеоперационного периода. Установлены сроки и механизм рассасывания препарата ФКС в организме экспериментальных животных. Помимо гемостаза в ложе желчного пузыря препарат способен обеспечить остановку кровотечения из перихоледохеальных сосудов при операциях на желчных протоках.
Практическая значимость
Использование ФКС при ЛХЭ позволяет останавливать кровотечения из ложа желчного пузыря значительно эффективнее, чем другие препараты. Риск возникновения послеоперационных осложнений при этом значительно снижается. Абсолютным показанием для применения препарата являются цирротическое перерождение
паренхимы печени и повышенная кровоточивость в результате возникновения нарушений системы гемостаза.
Внедрение в практику Методы, изложенные в диссертационной работе, внедрены в клиническую практику хирургических отделений города Москвы (ГКБ № 55, госпиталя ГУВД г. Москвы).
Апробация работы Основные положения и результаты проведенного исследования доложены на 14 Международном Конгрессе Ассоциации хирургов-гепатологов стран СНГ (Санкт-Петербург,2007), 1 Международной конференции по торако-абдоминальной хирургии (Москва, 2008), научно-практических конференциях в Москве, Красноярске, Владивостоке, Твери (2008), конференциях в ЦКБ РАН (Москва,2009) и госпитале ГУВД (Москва,2010). Материалы диссертации детально рассмотрены на научной конференции кафедры экспериментальной и клинической хирургии медико-биологического факультета Российского научно-исследовательского медицинского университета им. Н.И. Пирогова 27 декабря 2011 года.
Публикации
По теме диссертации опубликовано 11 научных работ, из них 3 — в центральной печати.
Основные положения, выносимые на защиту Наиболее эффективным из сравниваемых средств на основе коллагена, желатины, целлюлозы, фибриногена, тромбина является комбинированный препарат ФКС.
Препарат ФКС активно стимулирует регенерацию ран печени. Биодеградация препарата ФКС происходит в сроки от 30 до 60 суток путем замещения соединительной тканью.
Использование препарата ФКС при ЛХЭ показано: а) при массивных кровотечениях из ложа желчного пузыря в случае неэффективности традиционных методов гемостаза; б) в случаях цирротического поражения печени; в) при опасности нанесения коагуляционного повреждения магистральных желчных путей и сосудов.
Применение данного препарата позволяет избежать возникновения вторичных кровотечений, уменьшить риск развития послеоперационных осложнений.
Структура диссертации Диссертационная работа изложена на 118 страницах машинописного текста и состоит из введения, 4 глав, заключения, выводов, практических рекомендаций, указателя литературы. Последний включает 94 отечественных и 76 зарубежных источников. Диссертация иллюстрирована 14 таблицами и 32 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Исследование состояло из экспериментальной и клинической части. Экспериментальная часть выполнялась в Межфакультетском лабораторном университетском комплексе на 24 беспородных собаках массой тела от 12 до 16 кг в возрасте 3-4 года. Шесть животных брали в острый опыт, 18 — в хронический. Все эксперименты выполнялись в условиях адекватного обезболивания. После основного этапа эксперимента животных выводили передозировкой наркотического вещества в соответствии с требованиями Международного Хельсинского Соглашения о порядке проведения экспериментальных работ.
В работе использовались следующие биополимерные субстанции: коллагеновая гемостатическая губка (ГКГ), таботамп (ТБ), геласпон (ГС), тромбин (РТ), комбинированная фибрин-коллагеновая субстанция (ФКС).
Исследование кровоостанавливающих возможностей
биополимеров проводили в 2 сериях острого эксперимента: 1) при нанесении плоскостных ран печени; 2) на модели резекции печени. При этом в первой серии острым путем наносили одинаковые по площади (2×2 см) и по глубине (3 мм) раны печени, а во второй серии воспроизводили краевую резекцию печени, нанося раны одинаковой площади 4 кв. см. Интенсивность кровотечения оценивали методом взвешивания марлевых салфеток, пропитанных кровью, до и после аппликации препаратов. Время остановки кровотечения биополимерами сравнивали между собой и с кровотечением из контрольной раны. Для определения времени окончательной остановки кровотечения засекали момент прекращения выделения крови из-под препарата или контрольной раны в течение 10 минут.
В хроническом эксперименте исследовали морфологические характеристики биополимера ФКС (как наиболее эффективного средства гемостаза) и его влияния на заживление ран паренхиматозных органов, для чего выполняли одинаковые по площади (4 кв. см) и глубине плоскостные раны печени с аппликацией пластин клеевой субстанции. Препарат наносили в 1 слой. Забор материала на морфологию проводили на 1, 3, 7, 14, 30 и 60 сутки. При морфологическом исследовании особое внимание обращали на динамику сосудистой реакции, течение воспалительного процесса, реакцию фибробластов и инволюцию клеевой композиции.
Клинический этап исследования выполняли в клинике кафедры экспериментальной и клинической хирургии медико-биологического факультета РНИМУ им. Н.И.Пирогова, располагающейся на базе городской клинической больнице № 55 г. Москвы.
Всего было проанализировано 70 случаев лечения больных желчекаменной болезнью за 10 лет, когда во время ЛХЭ применялись дополнительные методы гемостаза. Проблемный гемостаз в ложе желчного пузыря наблюдали у 64 пациентов, при вмешательствах на холедохе — у 6 больных (таблица 1).
Таблица 1. Операции, выполненные у больных с проблемным гемостазом.
Операция Количество больных
Лапароскопическая холецистэктомия 64
Лапароскопическая холецистэктомия + холедохолитотомия 6
ВСЕГО 70
Мужчин было 8 (11,4%), женщин — 62 (88,6%) в возрасте от 19 до 82 лет. При анализе возраста пациентов установлено, что младше 40 лет было только 4 больных (5,7%). Основная возрастная ниша оперированных была представлена больными в возрасте от 40 до 59 лет (15 больных-21,4%) и от 60 до 74 лет (39 больных-55,7%). Старше 75 лет были 12 больных (17,2%).
При морфологической верификации диагноза установлено, что у 63 больных были деструктивные формы острого холецистита (у 51 -флегмонозный, у 12 — гангренозный), а у 1 больного — хронический холецистит.
Статистическую обработку полученных экспериментальных данных проводили непараметрическими критериями для малых чисел. Для проверки статистической гипотезы о наличии различия между значениями параметра до проведения исследования и после него применяли непараметрический знаково-ранговый критерий Вилкоксона. Гипотезу принимали с уровнем значимости « = 0,01 (или уровнем доверия р = \-а = 0,99). В клинической части работы использование Ь критерий для независимых выборок, по нему определялась статистическая значимость различия средних значений в выборках. В случаях, если групп больных было более 2-х, то сравнения проводились попарно по всем группам.
Результаты исследования Экспериментальный этап исследования
Изучение гемостатического эффекта препаратов при нанесении плоскостных повреждений печени
В таблице 2 представлены данные определения интенсивности кровотечения при использовании различных биополимеров, наносимых на раны печени и удерживаемых в течение 3 минут.
Таблица 2. Сравнительная интенсивность кровотечения из ран печени (в мг\мин)._
Препарат До аппликации После аппликации
ГКГ 1223,3±186,6 682,0±179,9*(р<0,01)
ТБ 1792,7+215,4 842,0±208,1 *(р<0,01)
ГС 1630,71136,4 1163,0+91,7*(р<0,01)
РТ 1230,8±321,5 1193,4±84,2
ФКС 1227,6±270,6 0*(р<0,01)
Контроль 1262,71136,1 1131,3±79,1
В случаях остановки кровотечения ГКГ и ГС интенсивность кровотечения через 3 мин. была значительной и приближалась к контролю. Несколько меньшим этот показатель был при аппликации ТБ. Интенсивность кровотечения снизилась почти в 2 раза (с 1792,7+215,4 до 842,0±208,1 мг\мин). При наложении тампонов с РТ интенсивность кровотечения практически не отличалась от контрольных ран. После наложения ФКС интенсивность кровотечения равнялась 0.
Для определения времени окончательной остановки кровотечения засекали момент прекращения выделения крови из-под препарата или контрольной раны в течение 10 минут. Результаты представлены на рисунке 1.
При использовании ГКГ через 3 минуты экспозиции отмечали подкравливание из-под краев препарата. В течение 5 минут ГКГ полностью намокала и через нее просачивалась кровь. Полная остановка кровотечения наступала через 13,4+0,6 минут. Пластины препарата легко снимались инструментом и кровотечение вновь возобновлялось.
Тромбин Контроль ФКС Геласпон Та бота мп ГКГ
0 5 10 15
Рис. 1. Сравнительные результаты времени окончательной остановки кровотечения из ран печени (в мин.).
После аппликации препарата ТБ отмечается активное пропитывание его кровью, а позже — просачивание крови через пластину и по краям. Окончательный гемостаз достигнут через 8,8+1,2 минут.
Все время после аппликации пластины ГС из-под нее наблюдалось активное кровотечение, которое прекратилось лишь на двенадцатой минуте (11,6±0,8) минуте. Препарат полностью не намокает. Кровью пропиталась лишь предлежащая к ране часть. При снятии пластины, что выполняется очень легко, кровотечение возобновляется.
При наложении тампонов с РТ окончательный гемостаз в течение 10 минут не наступил. При снятии тампона в контрольный срок кровотечение возобновляется. В течение первой минуты после аппликации ФКС отмечается подсачивание крови из-под верхнего края пластины, которое ко второй минуте полностью прекращается. Полный гемостаз наступил к 3 минуте (2,9±0,7) во всех образцах. Пластина снимается с усилием, кровотечение возобновляется в меньшем объеме.
При отведении марлевого тампона от контрольной раны на 3,5,7 и 10 минуте эксперимента — кровотечение продолжается. Окончательного гемостаза в течение 15 минут не наступает.
Таким образом, гемостатические возможности исследуемых биополимеров при нанесении их на раны печени оказались различными. 100% гемостатическую активность проявил препарат ФКС, наименьшую — препарат ГКГ. Интенсивность кровотечения в случае использования ТБ была ниже, чем у других препаратов. Гемостатическая активность ГКГ, РТ и ГС близка к контролю.
Изучение гемостатического эффекта препаратов при резекиии печени
В таблице 3 представлены результаты определения интенсивности кровотечения до и после аппликации биополимеров на раневые поверхности при резекции печени.
Таблица 3. Сравнительная интенсивность кровотечения при резекции печени (в мг\мин)._
Препарат До аппликации После аппликации
ГКГ 1298,31133,3 1117,3±103,9
ТБ 1652,0±77,6 1036,0+86,3*
ГС 1253,3±45,6 1064,0±41,1
РТ 1225,9±32,8 1099,4+86,5
ФКС 1050,7±183,4 13,3±13,3*
Контроль 1250,0±113,8 1318,0±76,4
* — достоверное различие результатов (р<0,01)
После аппликации ГКГ и ГС, а так же орошением РТ кровотечение из раны в течение 10 минут не прекращалось. Наблюдалось пропитывание кровью пластин ГКГ. Биополимер ГС полностью не промокал. Оба препарата снимались без усилий. Тампон, смоченный раствором тромбина не смог остановить кровотечение за 10 минут. ТБ останавливал кровотечение в течение 7,5+1,4 минут, ФКС — в течение 3,1 ±0,2 минут (рис. 2).
Рис. 2. Сравнительные результаты времени окончательной остановки кровотечения при резекции печени (в мин.).
Таким образом, гемостатическая активность биополимеров, применяемых при резекции печени, соответствовала ранее полученным экспериментальным данным при аппликации их на плоские раны печени. В результате и в этой серии экспериментов наиболее активным гемостатиком оказался биополимер ФКС.
Исследование заживления ран печени при аппликации биополимера ФКС в хроническом эксперименте
Результаты хронического эксперимента также подтвердили хороший гемостатический эффект биополимера ФКС — ни в одном случае не наблюдали возникновения повторного кровотечения.
Основным моментом выполненного исследования оказался факт обнаружения выраженного эффекта стимуляции процессов ангиогенеза, начинающегося уже к 3 суткам после аппликации биополимера на раны печени (рис. 3). Процесс образования сосудистых почек наблюдался во все исследуемые сроки (кроме 1 и 60 суток). Этот факт свидетельствует о значительной роли биополимера в подавлении воспалительной реакции подлежащей ткани и стимулирующем воздействии на регенерацию ран паренхиматозных органов.
При морфологическом исследовании микропрепаратов в ранние сроки (3 сутки) установлено быстрое развитие фибробластической реакции — рис. 4. В предлежащей к биополимеру ткани наблюдается
появление фибробластов, свидетельствующих о начальной реакции формирования соединительной ткани.
Рис. 3. Зона нанесения биополимера ФКС на ткань печени — 3 сутки.
Рис. 4. Зона нанесения биополимера ФКС на ткань печени — 7 сутки
При этом фибробластическая реакция имеет тенденцию к стиханию в срок 30 дней, а в 60 дней практически не наблюдается (рис. 6). Данный феномен имеет большое значение — с большой долей вероятности можно предположить, что ФКС не влияет на процессы онкогенеза в подлежащей ткани.
Кроме того, обнаружено свойство быстрого восстановления мезотелиального покрова на исследуемых участках печени, которое начиналось к 7 суткам и завершалось на остатках клеевой композиции к 14 суткам послеоперационного периода (рис. 5).
Рис. 5. Зона нанесения биополимера ФКС на ткань печени — 14 сутки
Рис. 6. Микропрепарат ткани печени на 60 сутки
Рассматривая сроки инволюции ФКС, установили, что в микропрепаратах остатки субстанции сохраняются до 30 дней. На 60 сутки обнаружено, что ткань печени восстановлена как за счет фиброза, так и малоклеточной фибриллярной основы с ангиоматозом, слабой
очаговой воспалительной инфильтрацией, отложениями гемосидерина, скоплениями макрофагов. Достоверных остатков клеевой композиции к этому сроку не выявлено (рис. 6).
Таким образом, изучение заживления ран печени, закрытых биополимером ФКС, показало, что воспалительная реакция в ранах носит асептический посттравматический характер и полностью стихает к 7 суткам после операции. Пластина ФКС не вызывает в тканях острого воспаления и местной токсической реакции. Биополимер стимулирует раннюю активацию фибробластической реакции и ангиогенез. Мезотелиальный покров восстанавливается на поверхности препарата к 14 суткам. Биодеградация ФКС наступает после 30 суток нанесения препарата на раны печени и происходит путем замещения коллагена нежной рубцовой тканью с дальнейшим поглощением макрофагами.
Клинический этап исследования
Проблемы с гемостазом в ложе желчного пузыря из-за неэффективности электрокоагуляции возникли у 64 пациентов. В целях окончательной остановки кровотечения использовали гемостатический тампон (ГТ) — 7 больных, подведение гемостатической коллагеновой губки (ГКГ) — 10 больных, орошение раствором тромбина (РТ) — 16 больных, аппликацию пластин фибрин-коллагеновой субстанции (ФКС) — 31 больной.
Марлевый тампон и пластины ГКГ вводили через дополнительный миниразрез в правом подреберье. Орошение РТ осуществляли посредством аквапуратора. ФКС накладывали с помощью лапароскопических аппликаторов «ЕМЕ)Ос1оск» (25 больных) и «АМКА» (2 больных).
Аппликация ФКС в двухмерном изображении, условиях замкнутого пространства и невозможности дигитальной манипуляции достаточно трудоемка и чревата порчей препарата. В настоящее время для аппликации ФКС используем специально созданные инструменты [Я.Т. СагЬоп,2004], которые значительно облегчают процесс введения препарата, манипуляции с ним в брюшной полости и фиксацию к тканям, а также исключают потери части клеящегося слоя в результате тракций эндозажимами.критерия значение р варьировало в диапазоне 0,672 -0,827. Это указывает на то, что ни в одной группе пациентов статистически значимых различий в параметрах коагулограммы не наблюдалось.
Окончательные сравнительные результаты остановки кровотечения различными гемостатическими агентами из ложа желчного пузыря при ЛХЭ представлены в таблице 4.
Таблица 4. Сравнительные результаты остановки кровотечения из ложа желчного пузыря при использовании различных методов гемостаза.
Метод гемостаза Количество больных Средняя продолжитель ность операции (в минутах). Средние сроки дренирования (в сутках) Осложнения
ГТ 7 123,5±10,3 2,9+0,7 2 нагноения раны
ГКГ 10 126,0±9,8 3,7±1,3 1 абсцесс, 1 инфильтрат
РТ 16 121,2±3,4 3,1 ±0,6 1 абсцесс
ФКС 31 94,3±5,6 1,9±0,4 Нет
Средняя продолжительность оперативного вмешательства у больных, которым для окончательного гемостаза использовали ГТ, ГКГ и РТ составила более 120 минут. При этом наибольшая продолжительность операции наблюдалась в группе больных с ГКГ -126,0+9,8 мин. В случаях аппликации ФКС длительность операции уменьшалась на одну треть и составляла 94,3+5,6 мин. При статистической обработке результатов, полученные данные свидетельствуют о том, что у пациентов первых трех групп статистически значимых различий в продолжительности операции не обнаружено (рП0,05). Единственная группа больных, где отмечено статистически значимое снижение времени операции, были пациенты, где в качестве метода дополнительного гемостаза использовалась ФКС.
Сравнивая среднюю продолжительность стояния дренажных трубок можно отметить, что этот показатель был больше у больных с ГКГ (3,7+1,3 дня) и меньше всех у пациентов, которым использовали ФКС (1,9±0,4 дня).
Одним из важнейших показателей, свидетельствующим об эффективности гемостаза являлась величина интраоперационной
кровопотери (рис. 7). Данный параметр оценивался общепринятым методом — подсчетом количества крови в хирургическом отсосе после операции.
Рис. 7. Средние показатели интраоперационной кровопотери у пациентов с различными методами дополнительного гемостаза (мл).
Величина интраоперационной кровопотери в группах пациентов варьировала в зависимости от использования метода дополнительного гемостаза. Наибольшие значения интраоперационной кровопотери зарегистрированы в группе пациентов, где в качестве метода дополнительного гемостаза использовался раствор тромбина. Кроме того, при статистической обработке результатов получены данные, которые говорят о том, что у пациентов где для дополнительного гемостаза использовался ГТ, ГКГ, РТ статистически значимых различий в величине кровопотери не обнаружено (рП0,05). Единственная группа больных, где при парном сравнении с остальными группами зафиксировано статистически значимое снижение кровопотери, были пациенты с ФКС.
В группах с ГТ, ГКГ и РТ возникло 5 осложнений (таблица 4): 2 нагноения раны, через которую вводился гемостатический тампон (группа с ГТ), по 1 абсцессу в подпеченочном пространстве в группах с ГКГ и РТ, инфильтрат брюшной полости в группе с ГКГ. Гнойные раны лечились общепринятыми методами, полости абсцессов были пунктированы под контролем ультразвука и дренированы. Сформировавшийся в подпеченочном пространстве в ближайшем послеоперационном периоде инфильтрат у больной с ГКГ регрессировал под действием антибактериальной терапии.
Наличие тампонов, которые удалялись на 6 — 7 сутки, и осложнений в виде нагноения послеоперационной раны у 2 больных привели к увеличению послеоперационного койко-дня в группе с ГТ до 15,1 (от 14 до 21). Средняя продолжительность пребывания на койке в послеоперационном периоде у больных с ГКГ и РТ была
приблизительно одинаковой и составила 9,1 и 8,6 койко-дня соответственно. В группе больных с ФКС осложнений не наблюдали, больные выписывались на 5-7 сутки, что в среднем составило 6,5 койко-дней.
Анализируя группу больных с ФКС, необходимо отметить, что у 24 человек препарат был использован по абсолютным показаниям. У этих больных наблюдались значительные кровотечения из ложа пузыря, которые было невозможно остановить другими методами, и в случае отсутствия гемостатика их ждала конверсия.
В остальных 7 случаях (больные с циррозом печени) мы не стали тратить время на длительную коагуляцию и применять другие методы, а сразу же воспользовались кровоостанавливающим действием ФКС и получили быстрый гемостатический эффект.
Во время лапароскопических операций на холедохе в ряде случаев возникают кровотечения из перихоледохеальных сосудов, остановить которые весьма сложно. Использование коагуляции вблизи протока чревато электротравмой, а прошивание их в условиях лапароскопического доступа достаточно трудоемко. При выполнении 46 лапароскопических холедохолитотомий мы столкнулись с 6 ситуациями, когда использование гемостатических возможностей ФКС помогли избежать конверсии и возможных осложнений. В 5 случаях кровотечение возникло из перихоледохеальных артерий — успешно остановлено аппликацией ФКС. В 1 случае было кровотечение из печеночной артерии, возникшее в результате ранения ее эндоиглой в момент ушивания раны холедоха после лапароскопической холедохолитотомии. Кровотечение так же было остановлено аппликацией пластины ФКС. Ни в одном случае не наблюдали значительной кровопотери и послеоперационного кровотечения. Следует подчеркнуть, что у 4 больных вмешательства на холедохе выполняли на фоне механической желтухи, следовательно, наблюдалась повышенная кровоточивость из-за гипокоагуляции.
Таким образом, необходимо отметить, что клинический опыт остановки кровотечения в различных ситуациях при лапароскопических операциях подтвердил экспериментальные данные о преимуществе гемостатических возможностей биополимера ФКС. Практически во всех случаях его использования был достигнут быстрый и надежный гемостаз.
Выводы
1. Биополимерные композиции, созданные на основе коллагена, желатины, целлюлозы, фибриногена, тромбина, обладают гемостатическим действием разной степени выраженности. Клеевая композиция ФКС позволяет добиться окончательной остановки
кровотечения из ран печени в достоверно более короткие сроки по сравнению с биополимерами других составов.
2. ФКС обладает свойством стимулировать регенерацию ран паренхиматозного органа за счет ускорения ангиогенеза и фибробластической реакции, что способствует более быстрому стиханию воспалительной инфильтрации тканей, восстановлению мезенхимальных клеток. Биодеградация ФКС происходит за счет замещения его соединительной тканью в месячный срок.
3. При неэффективности стандартных методов гемостаза во время ЛХЭ следует использовать ФКС. Аппликацию субстанции следует проводить специальными эндоскопическими инструментами.
4. Применение ФКС при ЛХЭ позволяет добиться быстрого окончательного гемостаза в ложе желчного пузыря, избежать вторичных кровотечений, а также снизить риск развития гнойных и деструктивных осложнений. Использование ФКС является безопасным и надежным методом в случае кровотечения из перихоледохеальных сосудов при лапароскопических вмешательствах на желчных путях.
Практические рекомендации
1. Использование препарата ФКС при ЛХЭ показано: а) при массивных кровотечениях из ложа желчного пузыря в случае неэффективности традиционных методов гемостаза; б) в случаях цирротического поражения печени; в) при опасности нанесения коагуляционного повреждения магистральных желчных путей и сосудов.
2. Применение стандартных инструментов для лапароскопической хирургии в целях аппликации ФКС на ложе желчного пузыря возможно, но трудоемко и может привести к недостаточному гемостазу.
3. Нанесение ФКС на ложе желчного пузыря облегчается использованием аппликатора «Эндодок». При аппликации клеевой субстанции ФКС следует строго соблюдать технические приемы, что позволит не только добиться успешного гемостаза, но так же избежать потери препарата.
4. Кровотечение, возникшее из перихоледохеальных сосудов при лапароскопической холедохотомии, легко и надежно останавливается аппликацией пластины ФКС, что позволяет предотвратить термическую травму желчных протоков при использовании электрокоагуляции в подобных ситуациях.
Список работ, опубликованных по теме диссертации:
1. В.А.Горский, Б.К.Шуркалин, А.П.Фаллер, А.В.Воленко, А.М.Зрянин/ Окончательный гемостаз при вмешательствах на паренхиматозных органах// Сборник материалов 14 Международного конгресса хирургов-гепатологов стран СНГ, С-Пб. 2007.- С.253.
2. В.А.Горский, В.К.Семенцов, А.М.Зрянин/ Дополнительные возможности гемостаза при лапароскопической холецистэктомии// Сборник материалов конференции «135 лет Военно-морскому клиническому госпиталю», Владивосток. 2008.- С. 157-158.
3. В.А.Горский, А.М.Зрянин / Сравнительная оценка дополнительных возможностей гемостаза при лапароскопической холецистэктомии// Сборник статей «Актуальные вопросы современной хирургии», Красноярск. 2008.- С. 134-136.
4. В.А.Горский, А.М.Зрянин / Дополнительные возможности гемостаза при лапароскопической холецистэктомии// Альманах Клинической медицины. 2008.- Том 17.- С. 103.
5. В.А.Горский, А.М.Зрянин / Дополнительные возможности гемостаза при лапароскопической холецистэктомии// 1 межд. Конференция по торако-абдоминальной хирургии., М. 2008. -С. 84.
6. Б.К.Шуркалин, В.А.Горский, А.В.Воленко, А.М.Зрянин/ Дополнительные возможности гемостаза при лапароскопической холецистэктомии// Материалы научно-практической конференции «Медико-биологические науки для теоретической и клинической медицины», М.2008,- С. 103.
7. В.А.Горский, Б.К.Шуркалин, А.В.Воленко, А.М.Зрянин/ Дополнительные возможности гемостаза при лапароскопической холецистэктомии// Материалы научно-практической конференции с международным участием «Успенские чтения», вып.5, Тверь. 2008.-С.171-172.
8. Б.К.Шуркалин, В.А.Горский, А.В.Воленко, А.М.Зрянин/ Вариант остановки кровотечения при лапароскопической холецистэктомии// Сборник научных трудов «Современные хирургические технологии» ЦКБ РАН, М. 2009,- С. 192-194.
9. Б.К.Шуркалин, В.А.Горский, А.П.Фаллер, И.В.Леоненко, А.М.Зрянин / Местный гемостаз в гепатобилиарной хирургии// Хирург. 2009.-JY® 10.-С. 5-14.
10.В.А.Горский, В.Ю.Мишин, А.М.Зрянин /Дополнительные возможности гемостаза при лапароскопической холецистэктомии// Сборник научных трудов «Современные технологии диагностики и лечения хирургических заболеваний», ГУВД Москвы, М. 2010.- С. 51-53.
11.В.А.Горский, М.А.Агапов, А.М.Зрянин/ Эффективность использования Тахокомба в гепатобилиарной хирургии// Современные технологии в медицине. 2011.- №2. -С. 61-68.
Список сокращений.
ГКГ — гемостатическая коллагеновая губка. ТБ — таботамп.
ГС — геласпон.
ФКС — фибрин-коллагеновая субстанция.
ГТ — гемостатический тампон.
РТ — раствор тромбина.
ЛХЭ — лапароскопическая холецистэктомия.
УЗИ — ультразвуковое исследование.
Зрянин Александр Михайлович (Россия)
Сравнительная оценка методов дополнительного гемостаза при лапароскопической холецистэктомии
Диссертация посвящена актуальной теме — окончательному гемостазу при лапароскопической холецистэктомии в случаях возникновения неконтролируемого кровотечения.
Работа основана на экспериментальном исследовании (24 собаки) гемостатических свойств фибрин-коллагеновой субстанции (ФКС) в сравнении с препаратами из коллагена, желатина, целлюлозы. В эксперименте показано, что наиболее активным гемостатиком оказалась ФКС.
Выполнено пилотное клиническое исследование у 64 больных с проблемным гемостазом в ложе желчного пузыря. В целях окончательной остановки кровотечения использовали гемостатический тампон (7), подведение коллагеновой губки (10), орошение раствором тромбина (16), аппликацию пластин ФКС (31). Клинический опыт подтвердил экспериментальные данные о преимуществе гемостатических возможностей ФКС.
Zryanin Aleksandr Mihaylovich (Russia) Comparative assessment of methods of additional hemostasis during laparoscopic cholecystectomy.
The dissertation is devoted to an actual problem — the final hemostasis during laparoscopic cholecystectomy in cases of uncontrolled bleeding.
The work is based on the experimental study (24 dogs) hemostatic properties of fibrin-collagen substance (FCS) in comparison with the drugs of collagen, gelatin, cellulose. The experiment shows that the most active haemostatic was FCS.
A pilot clinical study in 64 patients with problematic hemostasis in the bed of the gallbladder was completed.
In order to the final stop the bleeding hemostatic tampon (7), summing up the collagen sponge (10), irrigation with a solution of thrombin (16), application FCS plates (31) were used. The clinical experience has confirmed the advantages of experimental data about hemostatic opportunities FCS.
Заказ № 76-А/04/2012 Подписано в печать 17.04.12 Тираж 100 экз. Усл. п.л. 1
ООО «Цифровичок», тел. (495) 649-83-30 www.cfr.ru ; е-таИ:[email protected]
Каковы разные стадии желчнокаменной болезни (желчекаменной болезни)?
Автор
Дуглас М. Хойман, доктор медицины, FACP, FACG, AGAF Заведующий отделением гепатологии, Медицинский центр Департамента по делам ветеранов Хантера Холмса Макгуайра; Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский факультет Университета Содружества Вирджинии
Дуглас М. Хойман, доктор медицины, FACP, FACG, AGAF является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа врачей, Американская гастроэнтерологическая ассоциация
Раскрытие информации: Получены гранты / средства на исследования от Новартис для других целей; Получил грант / фонды на исследования от Bayer для других целей; Получал грант / средства на исследования от Otsuka ни на что; Получил грант / средства на исследования от Bristol Myers Squibb для других целей; Не получал ни одного от Scynexis ни за что; Получил грант / средства на исследования от Salix для других; Получил грант / средства на исследования от MannKind для других.
Соавтор (ы)
Анастасиос Михас, доктор медицинских наук, FACP, FACG Профессор, кафедра медицины, отделение гастроэнтерологии, Медицинский факультет Университета Содружества Вирджинии; Консультант, Больницы и клиники Университета Содружества Вирджинии; Руководитель клинических исследований GI, директор амбулаторной службы GI, заместитель директора отделения гепатологии, Медицинский центр по делам ветеранов Hunter Holmes McGuire
Анастасиос Михас, доктор медицинских наук, DMSc, FACP, FACG является членом следующих медицинских обществ: Американская ассоциация Исследование заболеваний печени, Американский колледж гастроэнтерологии, Американский колледж врачей, Американская гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта, Sigma Xi, Южное общество клинических исследований, Американская федерация клинических исследований, Группа исследований в области гастроэнтерологии
Раскрытие: Ничего не разглашать .
Джефф Аллен, доктор медицины Доцент кафедры хирургии Университета Луисвилля
Раскрытие информации: раскрывать нечего.
Главный редактор
BS Ананд, доктор медицины Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии , Американская гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не говорится.
Благодарности
Firass Abiad, MD Заведующий отделением общей и лапароскопической хирургии, Больница специализированного медицинского центра, Саудовская Аравия
Раскрытие: Ничего не нужно раскрывать.
BS Ананд, доктор медицины Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
.
Раскрытие: Ничего не нужно раскрывать.
Дэвид Эрик Бернштейн, доктор медицины Директор отделения гепатологии, Университетская больница Норт-Шор; Профессор клинической медицины, Медицинский колледж Альберта Эйнштейна
Дэвид Эрик Бернштейн, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
Раскрытие: Ничего не нужно раскрывать.
Барри Бреннер, доктор медицины, доктор философии, FACEP Профессор неотложной медицины, профессор внутренней медицины, директор программы неотложной медицины, Медицинский центр Case, университетские больницы, Медицинский факультет Университета Кейс Вестерн Резерв
Барри Бреннер, доктор медицинских наук, FACEP является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия неотложной медицины, Американский колледж грудных врачей, Американский колледж врачей неотложной помощи, Американский колледж врачей, Американская кардиологическая ассоциация, Американское торакальное общество, Медицинское общество Арканзаса, Нью-Йоркская медицинская академия, Нью-Йоркская академия наук и Общество академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Дэвид Ф. М. Браун, доктор медицины Доцент, Отделение неотложной медицины, Гарвардская медицинская школа; Заместитель председателя, Отделение неотложной медицины, Массачусетская больница общего профиля
Дэвид Ф.М. Браун, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Уильям К. Чианг, доктор медицины Доцент кафедры неотложной медицины Медицинской школы Нью-Йоркского университета; Начальник службы, отделение неотложной медицины, больничный центр Bellevue
Уильям К. Чианг, доктор медицины, является членом следующих медицинских обществ: Американской академии клинической токсикологии, Американского колледжа медицинской токсикологии и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Альфред Кушьери, MD, ChM, FRSE, FRCS , руководитель, профессор кафедры хирургии и молекулярной онкологии, Университет Данди, Великобритания
Раскрытие: Ничего не нужно раскрывать.
Имад С. Дандан, MD Хирург-консультант, отделение хирургии, отделение травм, больница Scripps Memorial
Имад С. Дандан, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации хирургии травм, Американского колледжа хирургов, Американской медицинской ассоциации, Американского общества травматологии, Калифорнийской медицинской ассоциации и Общества интенсивной терапии
Раскрытие: Ничего не нужно раскрывать.
Дэвид Гринвальд, доктор медицины Доцент клинической медицины, директор программы стипендий, отделение медицины, отделение гастроэнтерологии, Медицинский центр Монтефиоре, Медицинский колледж Альберта Эйнштейна
Дэвид Гринвальд, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж гастроэнтерологии, Американский колледж врачей, Американская гастроэнтерологическая ассоциация, Американское общество гастроэнтерологической эндоскопии и Нью-Йоркское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не нужно раскрывать.
Юджин Хардин, доктор медицины, FAAEM, FACEP Бывший председатель и доцент кафедры неотложной медицины Медицинского и научного университета Чарльза Дрю; Бывший председатель отделения неотложной медицины, Медицинский центр Мартина Лютера Кинга / Дрю
Раскрытие: Ничего не нужно раскрывать.
Faye Maryann Lee, MD , штатный врач, отделение неотложной медицины, Нью-Йоркский университет / больничный центр Bellevue
Фэй Мэриэнн Ли, доктор медицины, является членом следующих медицинских обществ: Phi Beta Kappa
Раскрытие: Ничего не нужно раскрывать.
Салли Сантен, директор программы MD , доцент кафедры неотложной медицины, Университет Вандербильта
Салли Сантен, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Assaad M Soweid, MD, FASGE, FACG Доцент клинической медицины, эндосонографии и современной терапевтической эндоскопии, директор отделения эндоскопии и бронхоскопии, отделение гастроэнтерологии, отделение внутренней медицины, Медицинский центр Американского университета Бейрута, Ливан
Assaad M Soweid, MD, FASGE, FACG является членом следующих медицинских обществ: Американский колледж гастроэнтерологии, Американский колледж врачей, Американский колледж врачей-Американское общество внутренней медицины, Американское гинекологическое и акушерское общество и Американская медицинская ассоциация.
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Различные этапы лапароскопической холецистэктомии
Контекст 1
… на первом этапе хирург с помощью скальпеля делает разрез кожи внутри или вблизи пупка пациента. Затем устанавливается многопортовый разъем, чтобы разрез оставался открытым (рис. 1а).Позже он будет использоваться для введения хирургических инструментов и удаления желчного пузыря. …
Контекст 2
… брюшная полость пациента накачивается газом (CO 2) путем подсоединения газовой трубки к порту. Это помогает легче просматривать содержимое брюшной полости (рис. 1b). Дополнительный порт (троакар) расположен сбоку от мульти-порта для введения дополнительных инструментов в брюшную полость (рис. 1c). …
Контекст 3
… помогает легче просматривать содержимое брюшной полости (рис. 1b). Дополнительный порт (троакар) расположен сбоку от мульти-порта для введения дополнительных инструментов в брюшную полость (рис. 1c). Однако этот шаг рассматривался как дополнительный шаг в лапароскопической хирургии с одним разрезом. …
Контекст 4
… инструменты управляются извне тела пациента, в то время как они работают внутри брюшной полости. После этого свет в операционной будет выключен, чтобы хирурги могли лучше видеть на хирургическом мониторе (рис. 1d)….
Контекст 5
… хирург наблюдает изображение с камеры на хирургическом мониторе, которое хорошо видно из-за тусклого света в комнате. На первом этапе фазы удаления желчного пузыря хирургу необходимо определить местоположение желчного пузыря (рис. 1e). Этот этап называется этапом локализации желчного пузыря. …
Контекст 6
… локализуя желчный пузырь, хирург должен идентифицировать треугольник Калота, который служит точкой визуальной ориентации для кистозной артерии и пузырного протока.Этот шаг завершается так называемым критическим обзором безопасности, когда соединения должны быть видны (рис. 1f). Более того, этот этап является этапом рассечения, который является одним из наиболее важных этапов холецистэктомии. …
Контекст 7
… этот этап является этапом рассечения, который является одним из наиболее важных этапов холецистэктомии. Затем хирург закрывает соединения зажимами и делает разрез (рис. 1g). Недостаток концентрации во время этих двух шагов приведет к кровотечению и серьезным травмам желчных протоков….
Контекст 8
… шаг не является обязательным и не всегда необходим. Наконец, желчный пузырь отделяется от печени (рис. 1h), упаковывается в мешок для извлечения и удаляется из брюшной полости через порт. Процесс отслоения желчного пузыря может различаться по продолжительности в зависимости от состояния желчного пузыря. …
Контекст 9
… извлечение желчного пузыря, необходимо открыть порт, чтобы газ вышел из брюшной полости, и включится хирургическое освещение.В этот момент хирурги меняют свой зрительный фокус на кровать (рис. 1i). …
Контекст 10
… газ выйдет из брюшной полости. Наконец, кожные разрезы закрывают внутрикожными швами и закрывают обычными тейпами (рис. 1j). …
Хирургические процедуры: холецистэктомия | OncoLink
Что такое холецистэктомия и как ее проводят?
Холецистэктомия — это операция по удалению желчного пузыря. Желчный пузырь находится в правой верхней части живота, под печенью.Желчь вырабатывается печенью и хранится в желчном пузыре. Затем желчь выделяется через общий желчный проток, когда это необходимо. Желчь — это пищеварительная жидкость, которая помогает переваривать жир. Общий желчный проток — это то, что соединяет желчный пузырь и печень с первой частью тонкой кишки.
Холецистэктомия может использоваться в некоторых случаях:
- Рак желчного пузыря.
- Холелитиаз (камни в желчном пузыре).
- Холедохолитиаз (камни в желчном протоке).
- Холецистит (воспаление желчного пузыря).
- Панкреатит (воспаление поджелудочной железы).
Холецистэктомию можно выполнить несколькими способами, в том числе:
- Простая холецистэктомия: Удаляется желчный пузырь и часть окружающих тканей. Это используется в случаях рака на ранней стадии или незлокачественных заболеваний. Процедура может быть сделана открытым или лапароскопическим способом:
- Открытая холецистэктомия: Желчный пузырь удаляется через большой (около 6 дюймов) разрез брюшной полости.Это не лучший метод, если известно или подозревается рак. В этих случаях большинству пациентов будет выполнена расширенная холецистэктомия (см. Ниже).
- Лапароскопическая холецистэктомия: На животе делается множество небольших разрезов (разрезов). Лапароскоп (трубка с подсветкой), вводимая через разрезы, используется для удаления желчного пузыря. Этот метод не используется, если известно или подозревается рак желчного пузыря.
- Расширенная (радикальная) холецистэктомия: Часто расширенная холецистэктомия применяется у пациентов с раком желчного пузыря для снижения риска рецидива.Это включает удаление желчного пузыря, части печени и нескольких лимфатических узлов. В некоторых случаях может потребоваться более обширная операция для удаления любого из следующего: большая часть печени (клиновидная резекция), вся доля печени (лобэктомия печени), общий желчный проток, определенные связки, дополнительные лимфатические узлы, поджелудочная железа, двенадцатиперстная кишка и любые другие области, где обнаружено заболевание.
Какие риски связаны с холецистэктомией?
Как и при любой операции, здесь есть риски и возможные побочные эффекты.Это могут быть:
- Реакция на анестезию (анестезия — это лекарство, которое вам дают, чтобы помочь вам уснуть во время операции, не вспоминать об этом и уменьшить боль. Реакции могут включать свистящее дыхание, сыпь, отек и низкое кровяное давление).
- Кровотечение.
- Инфекция.
- Тромбы.
- Рубцы и / или онемение в месте разреза.
- Послеоперационная грыжа (это когда ткань живота проталкивается через мышцу. Она может выглядеть как шишка и может вызывать болезненность или болезненность при прикосновении).
- Пневмония.
- Травма желчного протока, тонкой кишки и / или печени.
Что такое рекавери?
Восстановление после холецистэктомии будет зависеть от типа перенесенной вами процедуры. Иногда требуется 2-3-дневное пребывание в больнице.
Перед выпиской из больницы вам расскажут, как ухаживать за разрезами, а также все другие инструкции.
Ваша медицинская бригада обсудит с вами лекарства, которые вы будете принимать, например, от боли, тромбоза, инфекций и профилактики запоров и / или других состояний.
Ваш лечащий врач обсудит ваши ограничения активности. В общем:
Для тех, кто прошел лапароскопическую процедуру:
- Принимайте обезболивающие в соответствии с указаниями и не садитесь за руль, пока принимаете наркотические средства.
- Следуйте полученным инструкциям по принятию душа.
- Спросите своего врача, когда можно будет вернуться к работе.
- Ваша медицинская бригада проинструктирует вас, как ухаживать за разрезом.Не наносите на шрам антибиотики или кремы, если вам не сказали об этом.
Для тех, кто прошел открытую процедуру:
- Избегайте подъема тяжестей до получения инструкций от вашей медицинской бригады.
- Запрещается купание в ванне, джакузи или плавание.
- Принимайте обезболивающие в соответствии с предписаниями.
- При кашле / чихании можно надеть подушку на хирургический разрез, чтобы усилить поддержку послеоперационного разреза и уменьшить боль.
- Следуйте полученным инструкциям по уходу за разрезом.
Что мне понадобится дома?
- Термометр для проверки температуры, которая может быть признаком инфекции.
- Свободная одежда.
- Предметы послеоперационного ухода, часто поставляемые в больнице / кабинете врача.
Позвоните в медицинскую бригаду, если у вас возникла:
- Лихорадка. Ваша команда скажет вам, при какой температуре вам следует позвонить.
- Озноб.
- Ухудшение отека / вздутия живота.
- Любая новая или усиливающаяся боль.
- Дренаж, кровотечение и / или тепло в месте разреза.
- Затрудненное дыхание.
- Постоянный кашель, тошнота и / или рвота.
- Неспособность есть или пить.
- Пожелтение кожи или белков глаз (желтуха).
- Серый стул.
Как я могу о себе позаботиться?
Возможно, вам понадобится член семьи или друг, который поможет вам с повседневными задачами, пока вы не почувствуете себя лучше. Может пройти некоторое время, прежде чем ваша команда скажет вам, что вы можете вернуться к своей обычной деятельности.
Обязательно принимайте назначенные лекарства в соответствии с указаниями, чтобы предотвратить боль, инфекцию и / или запор. При появлении новых или ухудшающихся симптомов позвоните своей бригаде.
Есть способы справиться с запором после операции. Вы можете изменить свой рацион, пить больше жидкости и принимать лекарства, отпускаемые без рецепта. Перед тем, как принимать какие-либо лекарства от запора, поговорите со своим лечащим врачом.
Глубокие вдохи и отдых могут помочь справиться с болью, сохранить здоровье легких после анестезии и способствовать хорошему оттоку лимфатической жидкости.Попробуйте делать упражнения на глубокое дыхание и расслабление несколько раз в день в первую неделю или когда вы заметили, что сильно напряжены.
- Пример упражнения на расслабление: сидя, закройте глаза и сделайте 5-10 медленных глубоких вдохов. Расслабьте мышцы. Медленно покачивайте головой и плечами.
Эта статья содержит общую информацию. Обязательно поговорите со своей группой по уходу о вашем конкретном плане и выздоровлении.
Холецистэктомия связана с более высоким риском раннего рецидива и меньшей выживаемостью после радикальной резекции гепатоцеллюлярной карциномы на ранней стадии
ГЦК является ярким примером рака, связанного с воспалением, поскольку более 90% ГЦК возникает в контексте повреждения печени и воспаление, особенно в результате инфицирования вирусом гепатита B или C 28,29,30 .Считается, что хроническое воспаление после холецистэктомии связано с повышенным риском развития ГЦК 2,3,5,31 , но будет ли оно влиять на исход у пациентов с ГЦК, перенесших лечебную резекцию, еще предстоит выяснить. В этом исследовании стратифицированный анализ ОС в соответствии с системой стадирования BCLC не продемонстрировал существенной разницы между группой холецистэктомии и группой без холецистэктомии на ранней, промежуточной или продвинутой стадии, и только для пациентов на ранней стадии показатели RFS в группе холецистэктомии были значительными. хуже, чем в группе без холецистэктомии.
В настоящее время основной причиной неблагоприятного исхода ГЦК является высокая частота рецидивов, и общий прогноз во многом зависит от характера рецидивов 32 . Прогноз при раннем рецидиве намного хуже, чем при позднем рецидиве, поскольку ранний рецидив в основном опосредован внутрипеченочным метастатическим механизмом, который связан с сосудистой инвазией опухоли и повышенным ангиогенезом, тогда как большинство поздних рецидивов имеют многоцентровое происхождение 33,34 .В этом исследовании частота ранних рецидивов в группе холецистэктомии была значительно выше, чем в группе без холецистэктомии. Однако при стратификации по стадии BCLC разница была значимой только для пациентов на ранней стадии, но не для пациентов на поздней стадии.
Дальнейший многомерный анализ показал, что холецистэктомия является независимым фактором риска раннего рецидива, но не позднего рецидива у пациентов с ранней стадией ГЦК. Это означает, что влияние холецистэктомии на послеоперационный рецидив уменьшалось с увеличением времени после операции.Интересно, что подобное явление было обнаружено в ходе исследований риска развития рака пищеварительной системы после холецистэктомии. Сообщается, что коэффициенты заболеваемости раком пищеварительной системы были значительно высокими в первый год после холецистэктомии, но со временем быстро снизились и стали незначительными уже через два года после холецистэктомии 2,35,36,37 . Поскольку временной масштаб ассоциации слишком короткий, некоторые исследователи считают, что связь между холецистэктомией и последующим раком пищеварения вряд ли может быть причинной 37 .
Однако существует дополнительная гипотеза о том, что холецистэктомия приведет к воспалению и накоплению желчи, которые могут действовать как канцерогены, способствуя рецидиву рака. Исследования показывают, что удаление желчного пузыря приводит к дисфункции сфинктера Одди (SO), что, в свою очередь, вызывает расширение CBD, повышение давления в желчных протоках и последующий холестаз и хроническое воспаление 6,7,8,9,10, 11 . Опосредованный воспалением ангиогенез опухоли был подтвержден различными исследованиями, и высвобождение связанных с воспалением цитокинов, хемокинов, факторов роста играет решающую роль в инвазии, рецидивах и метастазах рака 5,16,17,18 .Кроме того, накопление желчных и вторичных желчных кислот, в частности дезоксихолевой кислоты, может действовать как канцерогены и способствовать рецидиву и возникновению рака 38,39 . Однако из-за внутренней компенсации SO может адаптироваться к изменениям, вызванным холецистэктомией, и моторика SO восстановится через несколько месяцев после холецистэктомии, чтобы избежать последующего холестаза, гипертензии CBD и воспаления 40,41 . Это может не только объяснить, почему большинство пациентов с постхолецистэктомическим синдромом выздоравливает через год после операции, но и объясняет краткосрочную связь холецистэктомии с повышенным риском онкогенеза или рецидива.
Похоже, что некоторые хирурги согласны с тем, что пациенты с ГЦК должны одновременно подвергаться холецистэктомии во время резекции по поводу ГЦК, не только потому, что выполнение последующей холецистэктомии пациенту, перенесшему ранее операцию на печени, технически сложно 42 , но также из-за опасения гангренозного холецистита после лечения транскатетерной артериальной химиоэмболизацией (ТАХЭ). Несмотря на то, что был зарегистрирован случайный рефлюкс эмболического материала в кистозную артерию после TACE 43 , метод суперселективной эмболизации значительно снизил риск холецистита, и сообщаемая частота составляет менее 5% 44 .В большинстве случаев лечение может быть консервативным, холецистэктомия не требуется 44 .
Кроме того, наиболее частыми внепеченочными метастазами ГЦК являются легкие, лимфатические узлы брюшной полости, кости и надпочечники, прямая инвазия или метастазы в желчный пузырь встречаются редко 42,45 . Было высказано предположение, что рак желчного пузыря может легко проникнуть в печень, потому что между желчным пузырем и печеночной ямкой нет брюшины. С другой стороны, ГЦК обычно не проникает в желчный пузырь, потому что ГЦК редко разрушает мышечный слой или коллагеновые волокна стенки желчного пузыря 42 .В соответствии с предыдущим исследованием 42 , распространенность инвазии или метастазов от ГЦК в желчный пузырь составляла всего 0,2% (9/3933) в нашем исследовании, такая низкая доза не требует рутинной холецистэктомии во время резекции по поводу ГЦК, за исключением случаев метастазирования в желчный пузырь. подозревается.
Насколько нам известно, ни одно из предыдущих исследований не рассматривало возможную связь между холецистэктомией и повышенным риском раннего рецидива ГЦК на ранней стадии. Поскольку холецистэктомия связана с ранним рецидивом и ухудшением RFS у пациентов с ранней стадией HCC, которые подверглись лечебной резекции, рутинного удаления нормального желчного пузыря во время резекции HCC можно избежать для пациентов на ранней стадии, а показания к холецистэктомии могут быть ограничены пациентами с заболеваниями желчного пузыря. или метастаз.Однако из-за ретроспективного характера этого исследования наши результаты должны быть подтверждены будущими проспективными исследованиями, прежде чем можно будет сделать выводы. Хотя еще слишком рано рассматривать какие-либо потенциальные клинические рекомендации, наши результаты ставят под сомнение показания к рутинной холецистэктомии во время резекции ГЦК.
Пациенты и методы
Популяция исследования
Это исследование было одобрено этическим комитетом больницы Чжуншань и больницы Цилу, выполнено в соответствии с утвержденными руководящими принципами, и от всех участников было получено информированное согласие.
Данные пациентов с ГЦК, получавших лечебную резекцию по поводу ГЦК в институте рака печени Университета Фудань и больнице Цилу Университета Шаньдун в период с января 1999 г. по декабрь 2009 г., были получены из проспективно собранной базы данных и подверглись ретроспективному анализу. Лечебная резекция определялась гистологическим исследованием как полная резекция всех опухолевых узлов и очищения поверхности разреза от рака; отсутствие злокачественного тромба в воротной вене, печеночных венах или желчном протоке; и без внепеченочных метастазов 46,47 .Все патологические образцы были изучены 2 патологами для подтверждения диагноза ГЦК. Гистологическая степень дифференцировки опухоли была присвоена по системе оценок Эдмондсона. Стадия опухолей определялась в соответствии с системой стадирования BCLC. Функцию печени оценивали по шкале Чайлд-Пью. Все пациенты с HBV-ассоциированным HCC не получали никакого лечения против HBV, кроме лечения IFN-a.
Факторы, которые могут потенциально иметь отношение к выживаемости и рецидиву, были выбраны в этом исследовании на основе предыдущих исследований, включая возраст (≤50 или> 50 лет), пол (мужской или женский), цирроз (да или нет), детский Оценка Пью (A или B), размер опухоли (≤5 или> 5 см), количество опухолевых узлов (одиночных или множественных), капсула опухоли (да или нет), сосудистая инвазия (да или нет), дифференциация опухоли (классификация Эдмондсона) I / II или III / IV), лечение ТАСЕ или IFN-α (да или нет).Предоперационные лабораторные показатели сывороточной аланинаминотрансферазы (ALT) (≤75 или> 75U / л), γ-глутамилтранспептидазы (GGT) (≤50 или> 50U / L) и концентрации α-фетопротеина (AFP) (≤20 или> 20 нг / мл) также были включены в анализ с использованием верхнего предела нормальных значений в нашей больнице в качестве пороговых значений. Все факторы, связанные с опухолью, определялись путем патологического исследования резецированной ткани.
Последующее наблюдение
Пациенты наблюдались каждые 2 месяца после операции в амбулаторных клиниках и проспективно контролировались на предмет рецидива по стандартному протоколу, который включал сывороточный АФП, функцию печени и ультразвуковое исследование или компьютерную томографию (КТ) с контрастным усилением.КТ брюшной полости проводилась каждые 6 месяцев. Если сообщалось о локальной боли в костях, проводилось сканирование костей или магнитно-резонансная томография (МРТ). Внутрипеченочный рецидив был определен как новое поражение в остаточной печени с типичным изображением на КТ / МРТ и повышенным уровнем АФП в соответствии с критериями, предложенными EASL для ГЦК. Тонкоигольная биопсия под контролем УЗИ иногда необходима для подтверждения диагноза, если визуализация нетипична. Рецидивирующие случаи были разделены на группы с ранним или поздним рецидивом, используя 1 год в качестве порогового значения, как было предложено в исследовании Пуна 34 .В это исследование был включен только первый рецидив.
Статистический анализ
Критерий χ 2 или точная вероятность Фишера использовался для категориальных переменных, а t-критерий Стьюдента использовался для непрерывных переменных. Кумулятивная общая выживаемость рассчитывалась методом Каплана-Мейера и сравнивалась с помощью лог-рангового теста. ОВ рассчитывали от даты резекции до даты смерти независимо от причины смерти. RFS рассчитывался от даты резекции до даты, когда был диагностирован рецидив опухоли, или от даты резекции до последнего посещения, если рецидив не был диагностирован, случаи были подвергнуты цензуре на дату смерти или последнюю дату наблюдения. вверх.Модель пропорциональных рисков Кокса использовалась для определения независимых факторов выживаемости и рецидивов. Статистический анализ был выполнен с помощью SPSS 19.0 (SPSS Inc., Чикаго, Иллинойс). Двусторонний P <0,05 считался статистически значимым.
Выживание | Рак желчного пузыря | Исследования рака, Великобритания
Выживание зависит от множества различных факторов. Так что никто не может сказать вам точно, сколько вы проживете. Зависит от вашего:
- тип и стадия рака
- уровень физической подготовки
- предыдущее лечение
Это общая статистика, основанная на больших группах пациентов.Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам дополнительную информацию о вашем собственном прогнозе. Вы также можете поговорить об этом с медсестрами отдела исследования рака Великобритании по бесплатному телефону 0808 800 4040 с 9 до 17 часов с понедельника по пятницу.
Выживание при раке желчного пузыря
В Великобритании нет национальных статистических данных по различным стадиям рака желчного пузыря или по различным методам лечения, которые прошли люди.
Некоторые из представленных здесь статистических данных для прогнозов по этапам являются международными и могут неточно отражать статистику Великобритании. Они собраны из различных источников, включая мнения и опыт экспертов, проверяющих нашу информацию.
Прогноз по этапам
Этап 0
Если рак поражает только слизистую желчного пузыря (стадия 0), 80 из 100 человек (80%) выживают в течение 5 или более лет после постановки диагноза.
1 этап
Если рак распространился на мышцу (рак желчного пузыря 1 стадии), только 50 из 100 человек (50%) выживут в течение 5 или более лет после постановки диагноза.
Некоторые хирурги считают, что удаление близлежащих лимфатических узлов и части ткани печени во время операции помогает остановить рецидив рака. Они считают, что это улучшит долгосрочные результаты для людей с раком желчного пузыря 1 стадии. Эта операция называется расширенной холецистэктомией.
2 этап
К сожалению, перспективы у людей с раком желчного пузыря 2 стадии менее благоприятны. Более 25 из 100 человек (более 25%) выживут в течение 5 и более лет после постановки диагноза.Если вам предстоит обширная холецистэктомия или более обширная операция, у вас может быть немного больше шансов прожить дольше, чем это.
3 этап
При раке желчного пузыря стадии 3 рак распространился на окружающие ткани или лимфатические узлы и обычно не может быть удален. В этой ситуации лечение может на какое-то время контролировать рак.
Почти 10 из 100 человек (почти 10%) с раком желчного пузыря 3 стадии выживают в течение 5 и более лет после постановки диагноза.
4 этап
Рак желчного пузыря стадии 4 означает, что рак перерос в один из основных кровеносных сосудов, ведущих в печень, или в лимфатические узлы или органы, находящиеся дальше от желчного пузыря.
Почти 5 из 100 человек (почти 5%) с раком желчного пузыря 4 стадии выживают в течение 5 и более лет после постановки диагноза.
Доказательная стадия рака желчного пузыря: изменение стадии рака посредством анализа данных из национальной базы данных по раку
Y Fong и др.
Annals of Surgery, 2006; 243 (6): страницы 767-774
Информация о лечении рака желчного пузыря
Национальный институт рака, США
Выживаемость на всех стадиях вместе
Выживаемость при раке желчного пузыря зависит от того, насколько развит рак на момент постановки диагноза (стадия рака).К сожалению, рак желчного пузыря часто диагностируется на более поздних стадиях, когда лечение вряд ли поможет его вылечить.
Обычно для людей с раком желчного пузыря в Англии:
- почти 45 из 100 человек (почти 45%) выживают после рака желчного пузыря в течение как минимум 1 года
- прогнозируется, что более 15 из 100 человек (более 15%) переживут рак желчного пузыря в течение как минимум 5 лет
- По прогнозам, 15 из 100 человек (15%) переживут рак желчного пузыря не менее 10 лет
Чистая выживаемость и вероятность смерти от рака от редких видов рака
П. Мюллер и другие от имени Группы по выживанию рака в Великобритании, Лондонской школы гигиены и тропической медицины
Июль 2016 г.
Эти цифры относятся к людям, диагностированным в Англии в период с 2009 по 2013 год.
Пяти- и десятилетняя выживаемость прогнозируется с использованием математической модели с использованием статистики годовой выживаемости пациентов с диагнозом рака желчного пузыря в 2009-2013 гг. В Англии.
Эти статистические данные относятся к чистой выживаемости. Чистая выживаемость оценивает количество людей, переживших рак, а не количество людей, у которых диагностирован рак, которые еще живы. Другими словами, это выживаемость больных раком с учетом того, что некоторые люди умерли бы от других причин, если бы у них не было рака.
Что означает выживание
Термин «5-летнее выживание» не означает, что вы проживете только 5 лет. Он относится к количеству людей, которые живут 5 и более лет после постановки диагноза рака.
Дополнительная статистика
Для получения более подробной информации о выживаемости и желчном пузыре перейдите в наш раздел статистики рака.
Клинические испытания
Участие в клинических испытаниях может улучшить прогноз для людей с раком желчного пузыря.
Нужна ли гистопатология всем?
Справочная информация. Лапароскопическая холецистэктомия считается золотым стандартом лечения симптоматических желчных камней. Обычно после операции каждый образец отправляется на гистопатологическое исследование. Случайное обнаружение рака желчного пузыря в этих образцах составляет около 0,5–1,1%. Целью данного исследования является выявление предоперационных и интраоперационных факторов у пациентов со случайным раком желчного пузыря, чтобы уменьшить ненужную рабочую нагрузку на патологоанатома и стоимость исследования, особенно в развивающихся странах. Методы. Ретроспективные записи были проанализированы с января 2005 г. по февраль 2015 г. в хирургическом отделении. Были записаны демографические данные, предоперационная визуализация, периоперационные данные, макроскопический вид и гистопатологические данные. Стенка желчного пузыря считалась утолщенной, если ≥3 мм на предоперационной визуализации или комментарии хирурга (результаты оперативного вмешательства) и гистопатологический отчет. Систему AJCC TNM использовали для определения стадии рака желчного пузыря. Результаты. 973 пациентам выполнена холецистэктомия по поводу симптоматической желчнокаменной болезни.Случайно рак желчного пузыря был обнаружен в 11 случаях. Макроскопические аномалии желчного пузыря были обнаружены у всех этих 11 пациентов. У пациентов с макроскопически нормальным желчным пузырем случаев рака желчного пузыря не было. Заключение. Предоперационные и оперативные данные играют ключевую роль в определении случайных шансов злокачественного новообразования желчного пузыря.
1. Введение
Большинство общих хирургических случаев связаны с желчнокаменной болезнью. Он поражает 15% жителей западного мира, ежегодная заболеваемость составляет 1 из 200 [1].В азиатском населении его распространенность составляет около 3–5%. У четырех из 100 пациентов с камнями в желчном пузыре наблюдаются самые разные симптомы — от простой желчной колики до связанных с ней осложнений. Лапароскопическая холецистэктомия в настоящее время является рекомендуемым золотым стандартом лечения пациентов с желчными камнями с симптомами [2].
В качестве рутинной стандартной практики практикующие врачи обязаны отправлять все желчные пузыри, удаленные хирургическим путем, на гистопатологию, чтобы исключить любые патологии желчного пузыря, которые могут оказать значительное влияние на лечение пациентов, например, злокачественные новообразования желчного пузыря.Одно из исследований, проведенных Королевским колледжем патологов, предполагает обязательную отправку всех образцов желчного пузыря на гистопатологию, поскольку многие серьезные патологии могут иметь нормальный морфологический вид [3]. Случайно обнаружение злокачественных новообразований в образцах желчного пузыря составляет около 0,5–1,1%, тогда как желчные камни присутствовали у 74–92% пациентов со злокачественными новообразованиями желчного пузыря [4, 5].
Было предметом обсуждения, что пациенты со случайным гистопатологическим обнаружением злокачественных новообразований желчного пузыря имеют подозрительные черты при обследованиях и предоперационных результатах.Таким образом, рутинная гистопатология может быть необязательной во всех случаях [6, 7]. Это исследование направлено на выявление этих предоперационных и интраоперационных особенностей у пациентов, у которых на основании гистопатологии диагностирован случайный рак желчного пузыря, чтобы снизить ненужную рабочую нагрузку на патолога и стоимость исследования, особенно в развивающихся странах.
2. Методы
Был проведен ретроспективный обзор всех пациентов, перенесших холецистэктомию с желчнокаменной болезнью или без нее за десятилетний период с января 2005 г. по февраль 2015 г. в одном хирургическом отделении.Были получены и проанализированы истории болезни пациентов: демографические данные, предоперационная визуализация и предоперационные данные. Пациенты с морфологическими отклонениями от нормы при предоперационной визуализации были исключены из исследования. Также были записаны макроскопические данные и гистопатологические данные. Стенка желчного пузыря считалась утолщенной, если ≥3 мм на предоперационной визуализации или комментарии хирурга (результаты оперативного вмешательства) и гистопатологический отчет. Нормальная толщина стенки желчного пузыря составляет 1-2 мм.Систему AJCC TNM использовали для определения стадии рака желчного пузыря. Данные вводились и анализировались с помощью SPSS 20.0.
3. Результаты
Девятьсот семьдесят три пациента перенесли холецистэктомию в течение периода исследования. Большинство из них составляли женщины 70,29% (681). Записи 9 пациентов либо отсутствовали, либо показывали грубые патологические проявления на предоперационной визуализации, предполагающие или имеющие подозрение на злокачественное новообразование желчного пузыря, поэтому они были исключены из исследования. Средний возраст пациентов составлял годы (от 26 до 68 лет).Обычными симптомами были боль в верхней части живота с последующей диспепсией, как показано в таблице 1.
| |||||||||||||||||||||||
Были собраны гистопатологические данные девятисот шестидесяти четырех пациентов. Было обнаружено, что хронический холецистит чаще встречается у 756 пациентов, ксантогранулематозный холецистит — в 12 случаях, острый холецистит — в 61 случае, холестероз — в 117 случаях и метаплазия / аденома / дисплазия — у 7 пациентов. Кстати, рак желчного пузыря был обнаружен у 11 (1.14%) пациентов, как показано в Таблице 2. 79 (8,1%) пациентов имели утолщение стенки желчного пузыря на предоперационной визуализации. 413 (42,8%) пациентов имели макроскопические аномалии, такие как утолщение стенки желчного пузыря, дефекты слизистой оболочки, язвы или полиповидные поражения.
| ||||||||||||||||||||||||
Из 11 случаев, у которых случайно была диагностирована карцинома желчного пузыря, 3 были мужчинами и 8 — женщинами.Средний возраст пациентов составлял 41–68 лет. Утолщение желчного пузыря было обнаружено у 6 (54,54%) пациентов при предоперационном визуализирующем исследовании. Всем пациентам была выполнена лапароскопическая холецистэктомия, но 4 из 11 пациентов были преобразованы в открытую из-за плотных спаек или трудностей с определением треугольника Кало. Во всех этих случаях были обнаружены макроскопические аномалии с неспецифическими признаками и симптомами. Узловатость / полиповидные выступы присутствовали в 4 случаях, а дефект слизистой оболочки — в 3 случаях из 11.У девяти пациентов наблюдается макроскопический вид утолщенной стенки желчного пузыря. Подробности каждого случая показаны в таблице 3.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Большинство случаев были T1 и T2 на промежуточной стадии TNM.Ни у одного из пациентов с нормальной морфологией и макроскопическим внешним видом не было обнаружено злокачественных новообразований желчного пузыря.
4. Обсуждение
Рак желчного пузыря обычно проявляется на поздних стадиях и имеет плохой прогноз. Это наиболее частое злокачественное новообразование внепеченочной билиарной системы [8]. Лечение злокачественного новообразования желчного пузыря зависит от стадии заболевания, на котором находится пациент. При опухолях стадии Tis и T1a простая холецистэктомия считается эффективным методом лечения. Лечение T1b противоречиво между простой и радикальной холецистэктомией.Для лечения прогрессирующих опухолей проводится радикальная резекция. Адъювантная терапия не играет роли в случаях прогрессирующего рака желчного пузыря [9, 10].
Все образцы отправляются на гистопатологию после выполнения холецистэктомии по поводу желчнокаменной болезни. Основным аргументом в пользу этого подхода является обнаружение случайно присутствующей карциномы желчного пузыря, которая составляет 0,5–1,1%. Сюда входят пациенты, у которых предоперационное обследование и интраоперационные данные не показали наличия рака желчного пузыря [4, 5].Также хронический холецистит и ранние стадии рака желчного пузыря проявляются утолщением стенки желчного пузыря, поэтому трудно судить о точной гистопатологии на основании толщины стенки [11].
В нашей серии из 973 случаев только у 11 пациентов был диагностирован случайный рак желчного пузыря. У всех этих 11 пациентов была толщина стенки желчного пузыря и макроскопические особенности, такие как узелки, папиллярные разрастания или язвы. Не было выявлено злокачественных новообразований у тех, у кого были нормальные изображения желчного пузыря и макроскопический вид.
Одно из исследований, проведенных Dix et al. обнаружили случайное злокачественное новообразование желчного пузыря у 0,38% пациентов. Во всех этих случаях были аномальные макроскопические данные, и у трех пациентов из 5 были аномальные результаты при предоперационных исследованиях изображений. Автор рекомендует, чтобы более избирательный подход к отправке гистопатологического исследования был основан на доказательствах [12]. Другое исследование Darmas et al. также пришли к выводу в пользу выборочной гистопатологии для холецистэктомии. Не было бы никакой случайной карциномы; действительно, для гистопатолога это будет рентабельно и отнимет много времени [6].
Грубые аномалии рака желчного пузыря можно разделить на инфильтративные, папиллярные, узловые или смешанные формы. Инфильтративная форма обычно проявляется в виде толстостенного желчного пузыря, в то время как полиповидные поражения наблюдались в случае папиллярных выступов. Узловатая форма обычно проявляется в виде обрезанных образований. Наиболее частая форма представления — инфильтративный узор, за которым следует папиллярный. Таким образом, обнаружив любое из этих макроскопических проявлений, можно было заподозрить вероятность рака желчного пузыря [13, 14].
Существовали опасения между дисплазией и ранними стадиями рака желчного пузыря, но лечение обоих этих состояний — простая холецистэктомия. Большинству пациентов в этой группе будет полезна простая холецистэктомия, и радикальные процедуры не потребуются [9, 10].
Были такие состояния, как ксантогранулематозный холецистит и синдром Мириззи, которые могут быть связаны с повышенным риском рака желчного пузыря. Рао и др. сообщили о 6% пациентов со злокачественными новообразованиями желчного пузыря, а Kwon и Sakaida сообщили о 10% [14].Гистопатологическое исследование должно проводиться в тех случаях, когда интраоперационные и макроскопические данные указывают на эти состояния [15].
Исследования показали, что около 40% ненужных исследований проводились в отсутствие грубых или макроскопических отклонений. Рутинная гистопатология не только увеличивает стоимость ухода за пациентами, но и увеличивает нагрузку на персонал патологоанатомов [16]. Средняя стоимость обработки образца в Пакистане варьируется в зависимости от больницы, но в среднем составляет около 20–40 долларов США (1 доллар США = 100), а среднее время, затрачиваемое патологом на один образец, составляет около 50–60 минут, включая отчет о результатах.В нашем исследовании 934 пациента имели хронический холецистит, острый холецистит и холестеролоз при обследовании, и если бы их хирургически удаленный образец не был отправлен на гистопатологическое исследование, это позволило бы сэкономить около 18000-37000 долларов США. Кроме того, снизится нагрузка на патологоанатомов, что сэкономит им 56000 минут.
Основными ограничениями наших исследований был ретроспективный характер исследования. Проспективное исследование будет означать применение селективной гистопатологии для хирургической резекции желчного пузыря при желчнокаменной болезни.
5. Заключение
Предоперационные и оперативные данные играют ключевую роль в определении случайных шансов злокачественного новообразования желчного пузыря. Более избирательный подход, основанный на предоперационной визуализации и макроскопическом внешнем виде, не только снизил бы стоимость, но и снизил бы рабочую нагрузку патологоанатома.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Авторское право
Авторское право © 2016 Vikash Talreja et al. Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Одноэтапное и двухэтапное лечение сопутствующих камней в желчном протоке и камнях общего желчного протока: проспективное рандомизированное исследование с долгосрочным наблюдением
Цель
Предпочтительный подход к лечению камней общего желчного протока (CBD) является неопределенным, поскольку обсуждаются одноэтапная лапароскопическая холецистэктомия и исследование CBD по сравнению с двухэтапным предоперационным эндоскопическим удалением CBD с последующей лапароскопической холецистэктомией. Для решения этой проблемы было проведено проспективное рандомизированное исследование, в котором сравнивались эти две стратегии ведения.
Методы
В период с января 2002 г. по декабрь 2005 г. пациенты с камнями в желчном пузыре и общим желчным протоком, диагностированные с помощью предоперационной ультрасонографии и магнитно-резонансной холангиопанкреатографии, были рандомизированы для одноэтапного лечения по сравнению с двухэтапным. В одноэтапной группе лапароскопическая холецистэктомия и исследование CBD проводились на одной операции, тогда как в двухэтапной группе эндоскопическое удаление камней сопровождалось лапароскопической холецистэктомией через 2–5 дней. Сравнивались ранний успех лечения и осложнения, а также более длительное наблюдение в двух группах.
Результаты
Двести двадцать один пациент был включен в исследование, 110 в одноэтапной группе и 111 в двухэтапной группе. Не было значительной разницы в частоте успеха клиренса CBD (93,6 против 94,6%, p = 0,76) или частоте осложнений (3,6 против 5,1%, p = 0,527) между группами.