Как остановить рост метастазов в печени: медикаменты, химиотерапия, питание
Если у человека начинает развиваться онкологическое заболевание, то на определенной стадии развития опухоли в организме начинают возникать метастазы. Это вторичные очаги заболевания, распространение которых важно остановить. Распространяются метастазы в печень, почки, желудок, лимфоузлы и т. д. Это происходит из-за того, что злокачественные клетки отрываются от первоначальной опухоли и через кровь или лимфу проникают в здоровые участки организма.
Как образуются?
Метастазы возникают в результате отделения клеток от материнской опухоли.
Вначале рост метастазов еще может сдерживать иммунитет человека, но после они быстро покрывают близлежащие к основной опухоли органы. Врачи отмечают рост клеток непосредственно в метастазах, за счет чего они разрастаются. К тому же со временем вокруг первоначальной опухоли образуется сеть капилляров. Таким образом, онкологические клетки могут легче попадать через кровь в другие части организма. Они также забирают большую часть полезных веществ, которые поступают с кровью. Это негативно сказывается на росте здоровых тканей органов.
Вернуться к оглавлению
Симптомы метастазов
Признаки воспаления различаются в зависимости от ее локализации. Метастазы ЖКТ характеризуются наличием асцита. Боли в теле и ломкость костей говорят о том, что имеет место рак костной ткани. Образование в головном мозге сопровождается потерей памяти, изменением характера, судорогами, сильными спазмами в области головы. Метастазы в печени проявляются болями в правом подреберье, желтизной кожных покровов и белков глаз, нарушением пищеварения.
Вернуться к оглавлению
Как диагностировать?
 Очень эффективные и неинвазивные методы диагностики.
Очень эффективные и неинвазивные методы диагностики.
Для начала надо провести тщательную диагностику. Это позволит определить локализацию воспаления, его размер, темп роста. Благодаря современным технологиям врач может четко определить на каких тканях и органах расположена меланомы. Во время лечения исследование помогает определить эффективность терапии, также можно выявить наличие гноя или распада клеток опухоли. Применяю такие методы диагностики:
- ультразвуковая;
- радиоизотопная;
- мегнитно-резонансная, позиронно-эмиссионная, компьютерная томография;
- рентгенография.
Вернуться к оглавлению
Лечение заболевания
Химиотерапия
Это наиболее частый метод лечения рака. Но он должен назначаться только в комплексе с медикаментами. Процедура проводится в несколько этапов, при этом препараты водиться больному внутривенно. Этот метод лечения предназначен для удаления опухолей на поздних стадиях болезни. Но если рак развился в костной ткани, то химиотерапия будет неэффективна.
Вернуться к оглавлению
Операция и медикаменты
Остановить рост болезни и предотвратить появление метастазов помогает хирургическое вмешательство. Но его применяют только на первом этапе заболевания, когда удаляют первичный очаг рака. На 3 или 4 стадии проводить операцию слишком рискованно для здоровья человека. Приостановить развитие опухоли возможно благодаря лекарственным препаратам. Кроме основных лекарств против опухоли, врач выписывает иммоностимулирующие, паллиативные средства и лекарства для восстановления работы органов.
Вернуться к оглавлению
Каким должно быть питание?
 Во время диеты полностью исключаются жирные и жареные продукты. Вместо этого, больному рекомендуется готовить пищу на пару или отваривать. До еды можно съедать сырые овощи и фрукты. Питаться надо небольшими порциями 5—6 раз в день. Для больного полезны постная рыба или мясо, бобовые, цельнозерновые мучные изделия, орехи, молочные продукты, овощи, свежевыжатые соки.
Во время диеты полностью исключаются жирные и жареные продукты. Вместо этого, больному рекомендуется готовить пищу на пару или отваривать. До еды можно съедать сырые овощи и фрукты. Питаться надо небольшими порциями 5—6 раз в день. Для больного полезны постная рыба или мясо, бобовые, цельнозерновые мучные изделия, орехи, молочные продукты, овощи, свежевыжатые соки.
Вернуться к оглавлению
Народные средства
Такие методы тоже используются для лечения метастазов. Но это не исключает применения стандартных способов терапии. Часто используют настойку из корня чистотела и спирта. Растение мелко режут, после смешивают со спиртом в пропорции 1:4. Пить надо неделю по 1 ст. л. после еды. Кроме этого, применяют рецепт настойки на очищенном керосине и с грецкими орехами. Ингредиенты смешивают, а после настаивают в течение 10 дней. Пить надо по 1 капле 1 раз в неделю.
Метастазы в печени, симптомы перед смертью и лечение
Автор Владимир Черкесов На чтение 5 мин.
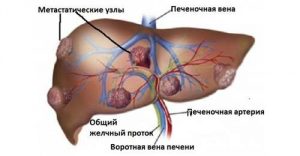
Метастаза в печени — это последствия рака любого органа организма человека. Как показывают наблюдения врачей, печень — самый частый орган, который поражается метастазами. Это обусловлено тем, что в нем происходит детоксикация, которая снабжает кровью весь организм.
Метастазы печени появляются при развитии онкологических процессов — злокачественных опухолей 4-ой стадии. Жизненно важному органу при таком состоянии организма очень сложно противостоять болезни из-за поступления большого объема кровотока. Что приводит к прогрессированию болезни, которая в большинстве случаев заканчивается летальным исходом.
Виды
Какие бывают метастазы в печени?
Основными видами метастазов являются:
- отдаленность — расположение в другой области, вдали от основного очага пораженного органа.
- гематогенность — перенос измененного патологией материала общим объемом крови.
- имплантационность — случайный перенос инфекции из злокачественных клеток в здоровые.
- лимфогенность — перенос измененного материала током лимфы.
- ортоградность — источник, возникающий через перенос измененного материала в сторону лимфы.
- ретроградность — обратная реакция тока крови или лимфы.

Причины
Чаще всего метастазирование органа происходит из-за хронических заболеваний, таких как: рак толстой кишки, поджелудочной, желудка, легких, молочных желез. Врачи отмечают, что метастазы характерны лишь при злокачественных опухолях, при доброкачественных они не появляются.
Редко, но все равно встречается, метастазирование встречается при раке яичников и циррозе печени.
Симптомы
Для самостоятельного определения данного недуга следует обратить особое внимание на свое здоровье. Как правило, при метастазах в печени, симптомы, перечисленные ниже, сигнализируют о раке 3-4 стадии, когда речь идет о борьбе за жизнь.
Основными симптомами, сигнализирующими о данном заболевании, являются:
- резкое похудение — беспричинное,
- болевые ощущения правого подреберья,
- чрезмерная слабость,
- повышение температуры и учащение частоты пульса,
- набухание груди,
- диарея,
- рвотные позывы,
- увеличение объемов печени,
- асцит,
- внутреннее кровотечение.
Поэтому обнаружив у себя какие-то из приведенных симптомов, немедленно обратитесь к врачу или вызовите скорую помощь. При таких симптомах Вам необходима госпитализация, с назначением должного и быстрого лечения, так как дорога каждая минута.
Диагностика
Если у Вас ранее был диагностирован рак, то следует каждые 3 месяца проводить ультразвуковое исследование (УЗИ) печени. По рекомендации врача можно и каждый месяц. Это необходимо для того, чтобы на ранних сроках выявить метастазы органа и приступить к лечению.
Своевременность диагностирования болезни повышает процент продолжительности жизни. Также для определения показателей билирубина назначается:
- биохимия крови — АЛТ и АСТ.
- иммуногистохимия — для установки первого очага поражения.
- КТ или МРТ — показывают полную картину болезни — локализация всех метастазов — данное исследование необходимо при проведении операции.
- ангиография — выявление сосудистой сети очагов.
- биопсия — определение неопластических образований.
Рост метастаз зависит от первоочередной причины их возникновения. Как правило метастазы в печени распространяются на несколько дней, максимум недель. Такой метод лечения как химиотерапия, способны приостановить распространение метастазов в жизненно важном органе. Но он имеет и ряд побочных эффектов, таких как выпадение волос и поражение друг соседних органов.
Лечение
Лечить рак 4-ой степени очень сложно, так как все равно полностью вылечить человека не удастся. Но комплексная терапия, состоящая из химического, иммунного, радиоактивного компонента, способна ввести рак в ремиссию. Как ни странно, но хирургически рак в последнее время мало кто лечит. На данный момент существует щадящий метод лечения:
- химиэмболизация — введение через катетер препарата, убивающего опухоль,
- радиочастотная абляция — воздействие на опухоль с помощью облучения,
- радиохирургическая методика,
- таргентная терапия — гормональная терапия, блокирующая рост раковых клеток.
Пораженный жизненно важный орган не может функционировать в полном объеме, фильтровать кровь от токсинов. Поэтому для того чтобы он работал более менее стабильно, необходимо соблюдать рекомендации врача, в частности по режиму дня и диете.
Сколько живут?
Своевременность определения раковых клеток и метастазов увеличивает шанс прожить продолжительную жизнь. Но по статистике с метастазами в печени люди живут от нескольких дней, до нескольких месяцев. Замечены редкие случаи, когда больные продержались год, при этом лечась и соблюдая диету.
Стоит отметить, что продолжительность жизни зависит не только от метастазов, но и от рака — от причины его появления. Если изначально болезнь не ликвидирована, то излечиться от метастазов практически нельзя. В этом случае речь уже идет о летальном исходе.
Народные средства
В некоторых случаях отчаявшиеся пациенты прибегают к самолечению — народным средствам, которые являются поддерживающим методом лечения болезни. Основная роль в избавлении недуга отдана медикаментозному лечению. Поэтому пить настои трав не запрещено. Но лучше всего перед их применением проконсультироваться с лечащим врачом. Так как у каждого метода лечения существуют свои противопоказания.
Существует великое множество настоек, способных улучшить работоспособность печени, что положительным образом влияет на воздействие медикаментов на печень.
Диета
Для поддержание положительной динамики болезни следует соблюдать режим дня и диету. Кушать маленькими порциями, но часто. Убрать из рациона острую и жареную пищу, не употреблять спиртные напитки. Больше пить свежевыжатых соков, но с осторожностью. Так как если у Вас рак желудка или поджелудочной, то свежевыжатые соки противопоказаны. В таком случае лучше пить морсы. Лучше всего исключить из еды мясо и рыбу. И заменить это детским питанием в банках, которое прошло термообработку. В таком случае отравиться от данной продукции не получится.
Правильное питание — залог здоровья, помните об этом!
Как остановить рост метастазов в печени медикаменты химиотерапия питание
Автор На чтение 51 мин. Опубликовано
Печень — это единственный орган, который фильтрует кровь. Поскольку из-за болезни она не справляется с этой функцией, то неминуемо наступает отравление организма токсинами и смерть.
Прогноз зависит от многих факторов:
- какая стадия;
- как давно обнаружена онкология;
- где находится первичный очаг;
- сколько метастазов.
В среднем у больных с установленным на четвертой стадии диагнозом «рак печени с метастазами» прогноз срока жизни составляет от 6 до 18 месяцев.
На то, сколько живут с метастазами в печени, влияет:
- своевременно ли установлен диагноз;
- получено ли эффективное лечение.
Резекция печени существенно продлевает жизнь. Но в случае если проведение хирургического вмешательства невозможно, средняя продолжительность жизни пациентов от 4 до 6 месяцев.
Выживаемость пациентов с метастазами в печени на 4 степени рака — не более 5%. Соответственно, из сотни больных 5 лет и дольше смогут прожить всего 5 человек.
Метастазы в печени: сколько живут, прогноз и сроки жизни, симптомы, лечение опухоли
4.6(92%) 5votes
В Греции аконит используют при лечении рака и саркомы с метастазами. Подходит для лечения недуга три вида аконита: метельчатый, пестрый и низкий. Применяют корень растения.
Печень – это излюбленное место метастазирования. Объясняется это тем, что орган обладает большой сосудистой сетью и снабжен огромной портальной веной. Вторичное поражение может быть следствием прорастания злокачественных опухолей легких, желудка, молочных желез, кишечника, поджелудочной железы.
Метастазы в печени – это глобальная проблема, над которой работают специалисты по всему миру. К сожалению, человек не сразу может обнаружить вторичное поражение. Раковые клетки проникают в орган лимфогенным или гематогенным (через кровь) путем. Опасность метастазирования заключается в том, что оно является явным признаком долгосрочного наличия раковой опухоли.
Все атипичные клетки изначально являются здоровыми и нормально функционирующими. Однако в результате генетического сбоя происходит их перерождение. Это может происходить под действием внутренних и внешних факторов. Раковые клетки начинают бесконтрольно делиться. Они формируют недееспособную ткань, повреждение стенки которой приводит к прорастанию и распространению опухоли.
Атипичные клетки сначала распространяются в смежные органы, а затем проникают в кровеносные сосуды, что приводит к тому, что они разносятся по всему организму. Не всем им удается выжить и имплантироваться в другие ткани. Лишь у незначительного числа раковых клеток получается это сделать. Однако именно они являются самыми злокачественными и с трудом поддаются лечению.
Метастазы бывают одиночными и множественными. Для второго варианта характерно быстрое прогрессирование патологии. Если опухоль одиночная, это совсем не означает, что она маленьких размеров. При быстром развитии процесса новообразование хорошо прощупывается и разительно отличается от здоровой паренхимы.
По мере увеличения атипичных клеток появляются неприятные симптомы, которые характерны и для многих других патологий печени и желчного пузыря. Люди жалуются на боли в правом подреберье, желтушность, тошноту, кожный зуд. Патологический процесс сопровождается повышением температура тела, потерей веса, бледностью.
Характерным симптомом является асцит (скопление жидкости в брюшине) и расширение вен на передней стенке абдоминальной полости. Небольшая продолжительность жизни таких пациентов объясняется длительным бессимптомным течением и, соответственно, поздним диагностированием. Однако метастазы в печени – это не приговор. Несмотря на то что патология сложно поддается лечению, при своевременных мерах можно надеяться на положительный прогноз.
Статистика последних пяти лет показала, что лечение рака с метастазами в печени улучшило свои показатели. В некоторых случаях выживаемость увеличилась на пятьдесят процентов. Далее мы получим ответ на главный вопрос нашей статьи о том, сколько живут с метастазами в печени.
К сожалению, онкологические заболевания возникают у людей различного возраста, нередко у детей и молодежи. Примечательно, что рак может возникнуть и у человека, ведущего здоровый образ жизни.
Причины образования опухолей до конца не изучены, на появление злокачественных новообразований влияет множество факторов. Первичная опухоль поражает какой-либо орган, причем очень часто на начальных стадиях она не беспокоит человека, из-за чего болезнь незаметно прогрессирует.
Очень часто при поражении различных внутренних органов метастазы обнаруживают в печени, поскольку этот орган выполняет функцию очищения организма от токсинов, ядов и принимает на себя огромную нагрузку, тем более при появлении в организме опухоли. Печень буквально пронизана кровеносными сосудами, поэтому с кровью к ней попадает достаточное количество раковых клеток.
К сожалению, сам факт появления у пациента, с
Метастазы в печени лечение народными средствами
При онкологических заболевания очаги отсева опухоли возникают в других органах. Опухолевые клетки мигрируют в легкие, почки и головной мозг. Но в подавляющем большинстве случаев возникают метастазы в печени лечение должно быть комбинированным, сочетать хирургические, медикаментозные и общеукрепляющие методы.
Причина вторичного опухолевого поражения печени кроется в особенности кровоснабжения. В этот орган отходит вся кровь из органов пищеварительной системы, селезенки, поджелудочной железы. Печень представляет собой биологический фильтр, который при онкологическом заболевании является барьером на пути свободно перемещающихся в кровяном русле раковых клеток.
Как только такая патологическая клетка попадает в печеночную ткань, она начинает неконтролируемо делиться. Возникает большой очаг новообразования.
Симптомы
При метастатическом поражении печени у человека возникает ряд симптомов:
- боль и чувство дискомфорта в правом подреберье;
- развитие печеночной недостаточности;
- возникновение желтухи;
- повышение кровоточивости, возникновение отеков;
- тошнота и рвота;
- горечь во рту;
- кожный зуд.
По мере роста опухоли, организм человека подвергается токсическому воздействию, возникают следующие признаки:
- потеря веса более 10% массы тела;
- повышение температуры тела;
- возникновение асцита;
- появление на коже живота венозных сплетений;
- кровотечения пищеварительного тракта.
Как видно из симптомов, необходимо как можно раньше диагностировать метастазы в печени, чтобы лечение не запоздало.
Диагностика
Выявить метастазы печени очень легко. Делается это при помощи инструментальных методов обследования:
- УЗИ органов брюшной полости;
- радиоизотопное исследование;
- диагностическая пункция для подтверждения диагноза.
Иногда печеночные метастазы находят раньше, чем первичную опухоль.
Кроме того, признаки поражения печени можно обнаружить в анализах крови. В общем анализе выявляется анемия, снижение количества тромбоцитов, повышении СОЭ.
В биохимическом анализе сыворотки крови обнаруживают повышение печеночных ферментов, снижение общего белка, увеличение билирубина.
Лечение
Лечение любых метастаз в печени всегда комбинированное. Кроме хирургического удаления очага используют химиотерапию, радиотерапию, общеукрепляющее и симптоматическое лечение. Из-за излишней травматичности от обширных операций постепенно отказываются в пользу малоинвазивных новых методик.
Используются следующие методы удаления очагов раковых отсевов печени:
- химиоэмболизация;
- радиочастотная абляция;
- радиохирургический способ удаления;
- метод электрорезекции;
- таргетная терапия;
- радиоэмболизация и др.
Подобное лечение могут предложить крупные онкологические центры. Также лечащий врач-онколог предлагает химиотерапию. Но лечение в стационарных условиях не единственный метод. Многие задаются вопросом, можно ли вылечить метастазы в печени народными средствами. Вылечить полностью не получится, но можно улучшить общее самочувствие пациента и состояние печени. С помощью народных средств можно избавиться от многих неприятных симптомов печеночного поражения и повысить качество жизни.
Чистотел помогает защитить печень от дальнейшего поражения. Использовать его лучше в настое. Приготовить легко, для этого нужно 3 ст. л. залить стаканом кипятка и настаивать 2 часа. Принимать достаточно по 1 ст. л. в сутки. Кроме настоя, можно готовить спиртовую настойку. Для приготовления понадобится измельчить несколько свежих растений и залить таким же количеством спирта. Дозировку при употреблении нужно постепенно увеличивать. Первую неделю употреблять нужно чайную ложку в сутки, следующие 7 дней – одну десертную и в последующие 3 недели употреблять нужно по столовой ложке.
Лечение метастазов в печени можно дополнить средствами из болиголова. При изготовлении лечебной настойки используется растение целиком. Для курса настойки достаточно одного зрелого большого растения. Его нужно измельчить, затем залить спиртом и настаивать до трех недель в темном месте. Лечебная доза такой настойки очень маленькая, измеряется каплями. В первый день принимают одну каплю настойки, каждый день увеличивая еще на одну. Через месяц приема лечебной настойки дозу вновь уменьшают на 1 каплю вплоть до полной отмены.
Лечение народными средствами было бы неполным без использования плауна булавовидного. Из него можно делать чай. Чтобы приготовить средство, которого хватит на сутки, нужно залить 5 ст. л. сухого растения литром кипятка. Пить нужно 1 стакан утром натощак, а затем в таком же количестве перед каждым приемом пищи.
Расторопша – традиционное средство в борьбе с заболеваниями печени. Оно обладает уникальным свойством защищать клетки печени от всяческих поражений. На основе ее сырья делают медикаменты. Но в домашних условиях возможно приготовить эффективные средства при метастатических поражениях печени.
Принимать можно мелко измельченные семена расторопши. Суточная доза – одна столовая ложка. Кроме того, дома можно изготовить сильнодействующую спиртовую настойку из семян растения. Для ее приготовления семена расторопши нужно измельчить в кофемолке. Полученный порошок надо залить спиртом в соотношении 1:5, затем поставить в темном месте на 3 суток. Принимать нужно до 5-7 небольших капель в день.
Диета
Помимо лекарственной поддержки, больную печень необходимо разгрузить. Вопросов о том, как лечить метастазы в печени, достаточно, но о пользе диеты не спорит никто. Изменение пищевых привычек также необходимо после хирургического удаления опухолевых очагов.
Изменить нужно режим питания. Стоит есть ограниченными порциями до пяти раз в сутки.
Начинать трапезу нужно с сырых фруктов и овощей, а термически обработанными горячими блюдами нужно завершать прием пищи.
Кисломолочные продукты очень желательно включить в рацион. Обязательно употребление творога – источника метионина. Это вещество обладает защитными свойствами для печени.
Полезно будет заменить животные масла растительными. Выбор стоит остановить на льняном и оливковом маслах холодного отжима.
Прием свежевыжатых соков приветствуется. Они позволяют доставить печени необходимые витамины.
Свежие овощи, фрукты и зелень, стоит употреблять в достаточном количестве, если нет проблем с кишечником.
Мясные и рыбные блюда употреблять обязательно. Они должны быть приготовлены на пару, или быть в отварном виде. Использовать нужно нежирные сорта для того, чтобы не перегружать печеночные клетки.
Исключение алкогольных напитков из рациона обязательно. Исключением является использование небольших количеств спиртовых настоек полезных трав.
Как распространяются метастазы и как можно их остановить
Рак несет особую опасность на поздних стадиях, когда начинается активный процесс метастазирования. При этом шансы больного избавиться от злокачественной патологии, сокращаются более чем в половину.
Для повышения эффективности лечения, учеными были разработаны методики, позволяющие остановить рост метастаз.
Определение
Метастазы – это вторичные злокачественные очаги, образованные от первичной опухоли, путем распространения раковых клеток по всему организму. Метастазы не имеют четкой локализации. Они могут возникать в тканях, прилегающих к пораженной области, так и в удаленных органах. Для метастаз характерен медленный темп развития на начальных этапах.
Пути распространения
Раковые клетки, образующие вторичные опухоли, имеют 3 пути распространения в любой участок организма:
- Лимфогенный. Клетки распространяются в лимфе по лимфатической системе.
- Гематогенный. Рак расходится по сосудам кровотока.
- Смешанный. Злокачественные клетки разносятся по всему организму по лимфогенному и гематогенному пути.
В этом видео специалист рассказывает о метастазировании более подробно:
Своевременная диагностика
Основным залогом успешного лечения является своевременная диагностика. По статистике, более 80% пациентов, смогли полностью избавиться от заболевания, благодаря выявлению рака на ранних стадиях. Для этого периода не характерно образование метастаз, и может быть применено хирургическое удаление опухоли, которое считается наиболее эффективным методом.
Наличие метастаз ограничивает использование и других методик, в результате чего снижается вероятность успешного результата лечения. Кроме того, вторичные опухоли ухудшают работу многих систем организма.
Это не позволяет использовать допустимые варианты лечения с максимально возможными дозировками и интенсивными схемами. Для выявления метастаз чаще всего применяют следующие диагностические методы:
- УЗИ;
- рентгенографию;
- КТ или МРТ;
- радиоизотопное исследование.
Данные методы позволяют определить метастазы на ранних этапах развития, с образованием опухоли около 0,5 см.
Процесс образования
Образование раковых клеток, готовых оторваться от основной опухоли, начинается с самого начала ее развития. Но самостоятельно распространяться по организму не дает особая форма клетки. К тому же, в первое время ее блокирует иммунитет.
При его снижении, злокачественные клетки начинают притягивать к себе тканевую трансглутаминазу – белок tTG. Данный белок соединяется с мембраной раковой клетки, образуя подобие щупалец, тем самым активизируя подвижность патологической клетки.
Щупальца нарушают межклеточную связь с основной опухолью, и помогают раковой клетке продвигаться вперед. В результате движения, она попадает в лимфо или кровоток, с помощью которых проникает в определенный орган и начинает там развиваться.
Белок теплового стресса Hsp70
Ученые на протяжении длительного времени не могли понять, что провоцирует скопление большого количества tTG у мембран раковых клеток. После многочисленных исследований и наблюдений, выяснили, что tTG притягивались к тем клеткам, в оболочках которых присутствует другой белок – Hsp70.
Данное вещество является белком теплового стресса и относится к высоко консервативной группе белковых. Hsp70 всегда вырабатывается в организме в небольшом количестве. Он выполняет роль надсмотрщика, защищающего белки от агрегации и восстанавливающего их повреждения.
В период стресса наблюдается продуцирование Hsp70 в больших количествах.
В качестве стрессовой ситуации, в данном случае выступает раковая опухоль, разрушающая здоровые клетки. Концентрация белка будет зависеть от степени стрессового воздействия и активности патологического процесса.
Белок Hsp70 имеет особое строение, позволяющее ему выстраивать сложные структуры, за счет которых раковая клетка легко отделяется от основного новообразования.
На основе полученных данных, исследователи спровоцировали угнетение выработки Hsp70, путем воздействия специфического ингибитора. После остановки процесса выработки белка, процесс скопления tTG у мембраны, остановился. Таким образом, удалось полностью остановить движение злокачественной клетки, и предотвратить образование метастаз.
Лечение
Как правило, хирургическое лечение может быть использовано только на ранних этапах метастазирования, когда вторичные опухоли образуются в региональных лимфатических узлах. Для повышения эффективности лечения, хирургический метод дополняют лучевой, гормональной и химиотерапией.
На более поздних сроках, с образованием удаленных метастаз, последние методы выполняют роль основного лечения.
Химиотерапия
Представляет собой лечение, при котором на раковую опухоль воздействуют токсичными веществами. В результате такого воздействия, нарушается синтез клеток и останавливается процесс их деления. На начальных этапах заболевания такой вид лечения позволяет снизить вероятность образования метастаз и остановить рост опухоли.
Как правило, препараты назначаются в виде таблеток, инфузий или инъекций. На этапе активного роста вторичных опухолей, применяют интенсивный вариант химиолечения, который позволяет не только купировать процесс разрастания, но и вызвать постепенный распад патологической ткани. При наличии множественных мелких метастазов, терапия способна привести к снижению их количество.
В этом случае, дополнительно применяют введение препаратов в общую печеночную артерию, которая доставляет основную часть лекарства в печень. В органе создается максимальная концентрация основного действующего вещества, в результате чего эффективность лечения повышается в несколько раз.
Единственный минус лечения токсическими препаратами в ограниченности их воздействия. Эффект от данной методики отсутствует при наличии метастаз головном мозге, костных структурах, печени.
Гормонотерапия
Выступает в качестве вспомогательного варианта лечения, который в обязательном порядке сочетают с другими противораковыми методами, кроме химиотерапии. Как правило, гормонотерапия назначается уже после проведения химиотерапии.
Суть лечения при данной методике заключается в воздействие на организм препаратов, подавляющих продуцирование гормона – эстрогена. Благодаря ему, активизируется рост и развитие гормонозависимой злокачественной опухоли. Подавление эстрогена приводит к нарушению питания клетки и разрушению ее мембраны.
Перед назначением лечения необходимо пройти обследование на выявление рецепторов опухоли на данный гормон. При наличии гормонозависимой опухоли, перед терапией проводят блокировку яичников, отключая их с помощью хирургического вмешательства, лучевой терапии или введения специальных препаратов.
В период лечения и после него наблюдается уменьшение опухоли и отсутствие метастаз. При наличии небольшой вторичной опухоли, отмечается уменьшение не только первичного образования, но и вторичного.
Лучевая терапия
Применяется в качестве дополнительного метода лечения после хирургического воздействия с целью предотвращения новых злокачественных образований, либо в качестве основного вида терапии при множественном метастазировании.
Как правило, ослабленным больным назначается дробное облучение с минимальными дозами, включающее несколько сеансов. Если у пациента отмечается положительная динамика и хороший прогноз, то применяют однократное облучение с усиленной дозировкой. При отсутствии метастаз, облучение проводят точным методом с дистанционным или прямым воздействием на опухоль.
Прямое воздействие подразумевает введение специального облучающего устройства через катетер в пораженные ткани и их облучение. При дистанционном локализованном воздействии, для облучения используют аппарат, направленный на патологическое образование и на расстоянии проводят облучение.
Наличие удаленных или множественных метастаз подразумевает использование крупнопольного варианта лучевой терапии, при котором облучают все тело, условно разделив его на 3 зоны: верхнюю, среднюю и нижнюю.
Сначала воздействуют на верхнюю зону, начиная от грудной клетки и заканчивая гребнем подвздошной кости. Затем облучают область до полости таза. И в заключении, воздействуют на малый таз и кости бедер. Количество процедур и дозировка облучения всегда подбираются в индивидуальном порядке.
Народная медицина
Многие пациенты с раковой патологией, не останавливаются на традиционном лечении и прибегают к методам народной медицины. Большинство медиков считают данный вариант бесполезной тратой времени и, к тому же, опасным экспериментом, который может привести к ухудшению общего самочувствия или активизации роста опухоли.
Несмотря на это, действенность народных методов лечения подтверждена людьми, которые победили рак. Подобные случаи, врачи объясняют следующим образом:
Иммунизация. Большое количество растений, входящих в противоопухолевые рецепты, обладают мощными иммуномодулирующими свойствами. Благодаря этому, активизируется работа лейкоцитов, направленных уничтожать раковые клетки.
Такое лечение на самом деле может оказать положительное влияние на купирование патологии, но только в случае, если каждое средство будет подбираться лечащим врачом.
Токсическое действие. Некоторые растения, применяемые для лечения рака в народных рецептах, имеют выраженное токсическое действие на весь организм, включая и злокачественную опухоль. Длительное употребление таких средств губительно действует на злокачественные клетки, приводя к их распаду.
Но, при лечении ядовитыми растениями необходимо точно высчитывать дозировку, что в отношении отваров и настоек, сделать очень трудно. Это может привести к отравлению и полностью нарушить работу жизненно важных систем.
- Эффект пустышки, основанный на самовнушении. Больной, начиная использовать народные методы, настолько уверен в их действии, что постепенно наступает улучшение, или даже полное выздоровление.
При грамотном подходе, народная медицина действительно может помочь при лечении рака. Но при этом не следует отказываться от традиционных вариантов лечения.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Метастазы в печени, прогноз срока жизни при наличии метастаз в печени
При обнаружении метастаз в печени прогнозировать срок жизни довольно тяжело. Что такое метастазы, какими способами можно остановить рост метастаз, можно ли вылечить метастатический рак, насколько помогает розекция и каковы прогнозы по сроку жизни – вот основные вопросы, которые появляются у некоторых онкологических пациентов.
Но давайте обо всем по порядку и начнем с печени. Печень представляет собой один из наиболее важных и многофункциональных внутренних органов. Она состоит из миллиарда клеток, которые обеспечивают и поддерживают работу таких систем, как пищеварение, обмен веществ и циркуляция крови. Отличительной чертой печени является её способность к самовосстановлению.

Что представляют собой метастазы
Метастазы в печени являются вторичными очагами, которые были образованы раковыми клетками, распространившиеся, в большинстве своём, через кровь. Онкология существенно повышает вероятность образования метастаз в печени у человека, страдающего от рака. Вызвано это довольно интенсивным кровообращением, ведь за 1 минуту сквозь печень проходит более 1,5 литра крови.
Причины
В большинстве случаев, метастазирование происходит из-за попадания раковых клеток в кровеносную систему и поток крови переносит патологию в различные органы, печеночная ткань в их числе. В случае отдельного появления метастаз в печени, скорее всего, опухолевые образования запущены и достигли четвёртой стадии.
К сожалению, избавиться в подобных ситуациях от рака печени не представляется возможным и о выживаемости онкобольного говорить не приходится. Чаще всего, метастазы, обнаруженные в печени, являются следствием первоначального рака желудка, поджелудочной железы, лёгких.
Поражённый кишечник, меланома и патология молочных желез также часто вызывают появление метастаз в печёночных тканях.
Симптомы
Процесс формирования раковых клеток, метастазирующих в печёночную ткань, может выдать себя не сразу. Симптоматическая картина появившихся метастаз в печени проявляется:

- потерей веса,
- лихорадочным состоянием,
- увеличением и болезненностью печени,
- появлением пальпируемых узелков,
- расстройствами в работе желудка,
- общей слабостью и постоянной усталостью,
- землистым оттенком кожного покрова,
- появлением горького привкуса,
- постоянным зудом кожи,
- желтухой,
- светлым цветом кала,
- тёмным оттенком мочи,
- появлением боли в районе груди при вдохе.
При появлении одного или нескольких признаков, прислушайтесь к своему самочувствию. Нелишним будет посетить врача и проконсультироваться с ним по поводу текущего состояния здоровья.
Классификация
Метастазы, как и иные патологии делятся по нескольким критериям. По способу проникновения они бывают:
- отдалёнными – развивающими вдали от основного очага заболевания,
- гематогенными – появляющимися из-за попадания поражённых клеток в кровеносную систему человека,
- лимфогенными – перенесёнными в здоровую ткань при помощи лимфы,
- ретроградными – имеющими противоположное движение оттоку из лимфоузлов или крови,
- имплантационными – образовавшимися вследствие случайного проникновения клеток поражённой ткани.
По локализации метастазы классифицируют на унилобарные (при поражении только одной доли печёночной ткани) и билобарные (при поражении сразу двух долей), а по количеству – на множественные и единичные.
Помимо этого, метастазирование печени делят на стадии:
- Для 1-й стадии характерно единичное поражение органа менее ¼ от общего объёма.
- 2-я стадия диагностируется при билобарных множественных очагах с объёмом поражённой ткани менее ¼ или же при единичном очаге, занимающим более ¼ объёма.
- На 3-ей стадии у пациента обнаруживают билобарные множественные очаги, поразившие от ¼ до ½ части объёма или единичные очаги с объёмом более ½ печени.
Диагностика
Своевременные диагностические способы позволяют точно определить, куда метастазирует поражённый орган, классифицировать патологию и подобрать эффективное средство борьбы с метастазами. Высокой информативностью обладают ультразвуковое исследование и проведение томографии с контрастом.
Данные процедуры отображают лишь размеры и локализацию карциномы печени. Для получения более точных и обширных данных лечащий врач назначает биопсию, анализы крови, а также рентгенографические исследования печени и жёлчных путей.
Химиотерапия

Химиотерапия, проводимая при метастазах в печени, помогает избавиться от образований в печёночной ткани около 20% пациентов, страдающих от рака печени. Также стоит отметить, что в половине всех случаев пациенты прекращают страдать и начинают чувствовать себя значительно лучше.
В силу того, что печёночные карциномы снабжаются кровью из переносной артерии, химиоперпараты вводятся напрямую в саму опухоль, а для их удержания применяются специальные гели или микросферы.
Это позволяет существенно снизить вероятность появления побочных эффектов и увеличивать при необходимости дозировку. При этом опухоли полностью лишаются питательных микроэлементов, так как кровоток блокируется при помощи специальных губок.
В большинстве случаев онкобольным назначается «Флуксоридин», «Иринотекан», «Ралтитрексид» и цитотоксические средства, а курсы по продолжительности составляют около двух недель. Процедура проходит исключительно в стационаре и под местной анестезией.
После окончания лечебного курса пациенту необходимо ещё как минимум сутки находится в лежачем положении с целью предотвращения возможного кровотечения. Противопоказанием к данному способу терапии является наличие проблем в работе печени.
Лучевая терапия
Рак печени, осложнённый метастазами, периодически лечится путём использования лучевой терапии. При помощи специальных программ и учёта индивидуальных особенностей пациента, рассчитывается конфигурация и доза радиоактивного излучения.
Основной луч попадает в самый центр образования, максимально щадя при этом периферийные здоровые клетки.
Стоит отметить, что методы лечения рака печени путём лучевой терапии применяется нечасто в связи с риском повреждения органа радиацией. Кроме того, от радиации практически у каждого пациента начинаются проблемы с кожным покровом и появляется постоянная усталость.
Хирургическая операция
Удаление метастаз хирургическим путём разумно лишь при незначительном появлении метастаз и сохранении печенью своих естественных функций. В случае множественности образований и остатку здоровых тканей менее 1/5 от общего объёма операция не имеет смысла. Изначально хирург удаляет одиночные метастазы, а затем проводится розекция, после проведения которой вероятность выживания существенно возрастает. Стоит отметить, что удаление части печени разрешается не более, чем в 12% всех случаев.
Виды операций
В зависимости от степени поражения и индивидуальных особенностей организма пациента существуют несколько видов операций. Кроме того, стоит отметить, что современная хирургия постоянно прогрессирует и новые методы борьбы с онкологией уже не за горами.

- Радикальная операция. Данное хирургическое вмешательство характеризуется удалением части органа с большим скоплением раковых клеток или же трансплантацией. Последняя возможна в случае наличия единичного очага, чьи размеры не превышают 7 мм или присутствует несколько метастаз, однако их размеры не более 3 мм. При этом очаги поражения не должны распространяться на рядом расположенные здоровые ткани.
- Лапароскопическая операция. Эта процедура проводится путём прокола брюшной полости 3 небольшими разрезами и удаление повреждённой ткани. Назначается лапароскопия лишь при минимальных по размерам образований.
- Криохирургия. В случае неоперабельной формы метастаз и их небольших размеров – до 50 мм – лечащий врач может порекомендовать данную операцию.
Суть метода заключается в воздействии на злокачественные образования жидким азотом, что позволяет онкобольному прожить ещё несколько лет. Как остановить прогрессирование патологии и какой метод борьбы с опухолью использовать решает врач.
Прогноз срока жизни
Сколько осталось жить пациенту после диагностирования рака печени представляет собой довольно сложный вопрос и чёткого ответа на него не существует. Решающую роль в этой борьбе играют такие факторы, как своевременность диагностирования, локализация и степень злокачественности патологии. На данный момент, к сожалению, статистические данные не очень хорошие: многие онкобольные умирают в течение 12 месяцев после обнаружения метастаз в печени.
Также прогнозы срока жизни пациента зависят от применяемого вида лечения. Средние показатели продолжительности жизни после резекции равны 14-18 месяцем. После трансплантации печени более 70% людей перешагивают через 5-летний рубеж, при этом существенно снижается вероятность вторичного образования рака.
Криохирургия позволяет онкобольным оставаться со своими близкими ещё на протяжении 3-5 лет. Людям с неоперабельными патологиями остаётся жить не более 6 месяцев.
Риски и осложнения
К возможным послеоперационным осложнениям доктора относят печёночную недостаточность, образование гнойников и остаточных полостей, плеврит, секвестрацию печёночной ткани, появления кровотечения через жёлчные пути. При проведении химиотерапии и лучевого облучения существует риск повреждения здоровых клеток. Периодичность и значение данных последствий весьма неоднозначны.
Заключение
В заключение необходимо сказать, что единственный способ предупреждения формирования метастаз в печени представляет собой диагностирование первичного очага на начальной стадии. По этой причине следует обзавестись такой полезной привычкой, как профилактические осмотры и своевременное обращение к врачу.
Вне зависимости от диагноза, не стоит давать рукам опускаться: диета и правильное питание, подвижный образ жизни и регулярные тренировки, позитивное мышление и вера в себя – вот те факторы, позволяющие стать выше проблемы.
Видео
Метастазы в печени: методы лечения.
 Загрузка…
Загрузка…
Операция при метастазах в печени: виды, прогнозы
Проведение операции на печени при метастазах не всегда эффективно, потому назначают ее только после тщательного рассмотрения ситуации, оценки состояния организма и возможных рисков для больного. Поскольку этот орган пронизан большим количеством сосудов, в число которых входит крупная портальная вена, практически у всех людей с онкологическими заболеваниями возникает вторичное новообразование злокачественного характера.

Метастазирование при раке
Метастазы — вторичное раковое образование, сформированное из клеток первичной опухоли, которые не позволяют полноценно работать внутренним органам, провоцируют увеличение печени. При позднем проведении лечения и отсутствии требуемых мероприятий происходит постепенное разрушение печеночной ткани. Патологические процессы приводят к смерти больного.
Вернуться к оглавлению
Виды печеночных метастазов
 Через кровь раковые клетки распространяются на здоровые органы.
Через кровь раковые клетки распространяются на здоровые органы.
В зависимости от локализации и количественных показателей, выделяют следующие виды метастазов в печени:
- Унилобарные. В этом случае поражается одна доля печени.
- Билобарные. Негативным изменениям подвергаются обе доли органа.
- Одиночные. Образуется 2—3 опухолевых узелка.
- Множественные. Обнаруживается несколько десятков узлов.
Вернуться к оглавлению
Причины возникновения
Метастазы появляются в результате проникновения опухолевых клеток в печень через кровь. Отдаленное поражение свидетельствует о завершающей стадии онкологии, когда невозможно остановить патологический процесс. Вторичный рак является следствием таких болезней и состояний, как:
- меланома;
- рак желудка, пищевода, кишечника;
- новообразования в поджелудочной железе;
- раковое поражение легких, почек;
- распространение раковых клеток в молочной железе.
При первичном раке кожного покрова, органов ЖКТ, легочной ткани, почек и груди метастазы в печени выявляют у 50% больных.
Вернуться к оглавлению
Последняя стадия рака печени
 Последняя стадия разрушает весь орган.
Последняя стадия разрушает весь орган.
Возможность полного излечения при злокачественном онкологическом процессе 4 стадии и метастазах в печени отсутствует. У больных ярко выражены симптомы заболевания, размеры опухоли бесконтрольно увеличиваются, раковые клетки перемещаются по всем органам и системам. Прекращение работы печени приводит к летальному исходу.
Вернуться к оглавлению
Патологические клетки в поджелудочной железе
Когда в железе формируется новообразование, опухолевые клетки нарушают работу легких, повреждают печеночную ткань и не позволяют полноценно функционировать почкам, что существенно отражается на общем состоянии организма. Между этими органами присутствует определенная связь, они тесно взаимодействуют между собой, чем и объясняются протекающие процессы.
Вернуться к оглавлению
Раковые поражения прямой и слепой кишки
Колоректальный рак не сопровождается выраженными симптомами, на начальных стадиях развития его можно спутать с расстройством пищеварительной системы. Метастазы появляются преимущественно в печени. После успешного проведения назначенных мероприятий выживают около 35% пациентов. Точные прогнозы формируются в зависимости от объема поврежденной ткани.
Вернуться к оглавлению
Опасность метастазирования
 Вмешательство проводят в кратчайшие строки.
Вмешательство проводят в кратчайшие строки.
Вторичные опухоли нарушают структуру тканей органа, что отражается на его функциях. У больных выявляют сбои в работе организма, повышается уязвимость к негативному воздействию и риск развития тяжелых осложнений. Появляются выраженные болевые ощущения, которые существенно ухудшают качество жизни. В таких случаях пациенты нуждаются в экстренном хирургическом вмешательстве.
Вернуться к оглавлению
Эффективность оперативного лечения
При выявлении в одной из долей печени единичных новообразований есть смысл в выполнении операции. Хирургическое лечение позволяет удалить метастазы, преодолеть заболевание и продлить жизнь больного. Однако при множественных поражениях, развитии цирроза и сокращении здоровых тканей до 20% операцию можно не проводить, т. к. не удастся получить необходимые результаты.
Вернуться к оглавлению
Виды операций
При метастазах в печени порядок действий определяется степенью поражения тканей. Радикальная операция на печени при онкологии назначается в случаях, когда после формирования первичной опухоли в организме появились обширные печеночные метастазы. Во время ее проведения выполняют трансплантацию или частично удаляют орган. При отсутствии осложнений хирургическое лечение метастазов печени позволяет пациентам прожить 5—7 лет. Удаление опухоли проводят двумя способами, такими как лобэктомия и сегментэктомия. Эти операции показаны при минимальном количестве метастазов — не более 4. Рецидив наблюдается в 42—44% случаев, в основном при распространении опухоли на обе доли органа.
 Возможна пересадка как целой, так и части печени.
Возможна пересадка как целой, так и части печени.
Больным с единичными новообразованиями при отсутствии необратимых изменений проводят лапароскопию — удаление поврежденного участка печеночной ткани через несколько небольших проколов. В этом случае пациенты быстрее восстанавливаются, могут прожить после операции до 5 лет. В случаях же, когда опухоль имеет размеры не более 50 мм и форма вторичного новообразования неоперабельная, показана криохирургия. Используя жидкий азот, удается на несколько лет продлить жизнь пациента.
При обширном циррозе оперативное лечение не рассматривается.
Вернуться к оглавлению
Восстановительный период и прогнозы
После успешного прохождения лечения необходимо придерживаться специальной лечебной диеты. Рекомендуется отказаться от сладостей, жирной пищи, еды с острыми компонентами, консерв, животных жиров и белков. Кроме того, запрещается курить и употреблять алкоголь. Следует питаться часто, сократив объем порций вареной и приготовленной паровым методом пищи до 250 г.
При своевременном выявлении первичной опухоли в кишечнике, единичных метастазах, успешном прохождении лечения и соблюдении полученных рекомендаций пациентам удается прожить до 5—7 лет. Когда метастазирование в печень происходит на фоне рака почек, поджелудочной железы или желудка, прогноз менее благоприятный. В таких случаях пациенты живут не более 6 месяцев.
Метастазы в печени (вторичный рак печени): абляция и другие методы интервенционной радиологии
Интервенционные радиологи в Memorial Sloan Kettering используют сложные инструменты визуализации, чтобы увидеть, что происходит внутри тела, и лечить метастазы в печени без хирургического вмешательства. Используемые ими методы лечения на основе изображений могут уменьшить или разрушить опухоли:
Абляция для уничтожения метастазов в печени
Абляция — это метод удаления опухоли без хирургического вмешательства. Наши радиологи используют несколько видов энергии, чтобы выбрать опухоль для удаления.Эта процедура может выполняться с помощью малоинвазивных методов в амбулаторных условиях (пребывание в больнице не требуется).
Часто наши врачи могут доставлять энергию для устранения опухоли через игольчатый зонд, который они вводят через кожу и направляют в опухоль с помощью передовых технологий визуализации.
Наиболее распространенные методы абляции разрушают раковые ткани за счет применения тепла, доставляемого радиоволнами ( радиочастотная абляция ) или микроволнами ( микроволновая абляция ) или холодным газом для замораживания опухоли (криоабляция ).
Наши специалисты по метастазам в печень выбирают подходящую абляционную терапию в зависимости от размера, расположения и формы опухоли.
Наши хирурги и интервенционные радиологи все чаще и чаще проводят абляцию в сочетании с операцией на печени для удаления опухолей, которые другие больницы могут посчитать неоперабельными. Примером этого являются метастазы, которые развиваются в обе стороны печени.
Абляция также может снизить риск рецидива рака у людей с метастазами в печени, которые невозможно удалить полностью.Это может продлить жизнь людям с рецидивирующими метастазами, которым врачи ранее лечили хирургическим путем и химиотерапией.
Он также используется вместо хирургического вмешательства для пациентов, которые слишком больны, чтобы перенести операцию.
Сложные инструменты управления изображением, такие как компьютерная томография или ультразвук, позволяют нашим врачам четко видеть опухоль во время абляции. В MSK мы также используем специальный аппарат ПЭТ / КТ для нацеливания на опухоли печени, которые обнаруживаются на ПЭТ-сканировании, повышая точность и эффективность абляции.
Исследователи MSK ищут способы взять образцы ткани опухоли, чтобы определить, есть ли в ней биомаркеров (ранние маркеры заболевания), которые могут помочь нашим экспертам по метастазам в печени предсказать результаты абляции.
Радиоэмболизация / селективная внутренняя лучевая терапия (SIRT)
Наши интервенционные радиологи используют радиоэмболизацию , также известную как селективная внутренняя лучевая терапия (SIRT), для людей, у которых есть метастазы в печени, которые хирург не может удалить, или у которых метастазы в печени являются основной проблемой.Наши врачи также используют SIRT для людей с опухолями, которые увеличиваются или не реагируют на химиотерапию.
SIRT сочетает лучевую терапию с эмболизацией , которая включает инъекцию крошечных частиц для блокирования или уменьшения кровотока к раковым клеткам. В SIRT крошечные радиоактивные шарики доставляются к месту опухоли и там задерживаются.
В этой процедуре:
интервенционный радиолог вводит катетер в артерию в паху и перемещает его в печеночную артерию , которая снабжает кровью печень
врач вводит крошечные радиоактивные шарики прямо в печеночную артерию.Эти гранулы доставляют очень высокую дозу радиации непосредственно в кровоснабжение опухоли. Но они не влияют на нормальную ткань печени, которая получает кровь из другого источника.
Радиоэмболизация иногда может уменьшить опухоли настолько, что хирург или врач могут удалить или удалить , их.
Исследования показывают, что сочетание процедуры SIRT с химиотерапией может контролировать метастазы в печени в течение более длительных периодов времени. Он также кажется безопасным для людей, которые уже прошли несколько курсов лечения метастазов в печени.
.
хирургических вариантов лечения изначально неоперабельных метастазов колоректальной печени
Хотя границы резекции печени при колоректальных метастазах в печень за последние десятилетия расширились, примерно у 75% этих пациентов на момент постановки диагноза обнаруживаются неоперабельные метастазы. В прошлом эти пациенты проходили только паллиативное лечение, без шанса на излечение. В предыдущие два десятилетия было разработано несколько терапевтических стратегий, которые делают резектабельными те метастазы, которые изначально были неоперабельными, что дает шанс на долгосрочное выживание и даже излечение для этих пациентов.Доступные онкохирургические методы включают резекцию печени после лигирования / эмболизации воротной вены, «двухэтапную» резекцию печени, одноэтапную резекцию печени под ультразвуковым контролем, гепатэктомию после конверсионной химиотерапии и резекцию печени в сочетании с термической абляцией. Более того, в последние годы некоторые авторы рекомендовали пересмотреть концепцию трансплантации печени у тщательно отобранных пациентов с неоперабельными колоректальными метастазами в печени и благоприятными прогностическими факторами.При использовании таких методов лечения количество пациентов с метастазами в толстой и прямой кишке, которые проходят потенциально лечебное лечение, может возрасти до 40%. Профиль безопасности этих подходов приемлем (уровень заболеваемости до 45%, уровень смертности менее 5%). Кроме того, 5-летняя выживаемость (примерно 30%) значительно выше, чем при паллиативном лечении.
1. Введение
В настоящее время лечение пациентов с метастазами в печени от колоректального рака является мультимодальным, включая резекцию печени, химиотерапию, таргетную терапию (моноклональные антитела), интервенционную радиологию и лучевую терапию.Полная резекция метастазов в печень приводит к 5-летней общей выживаемости, которая колеблется от 21% до 58% [1–3], что значительно выше, чем показатели, достигаемые нехирургическими методами лечения (5-летняя выживаемость менее 5%). %) [4]. Таким образом, единственная потенциально лечебная терапия у пациентов с колоректальными метастазами в печень (CRLM) включает полную резекцию метастазов в печени.
В настоящее время CRLM считаются операбельными при соблюдении следующих критериев [5, 6]: (a) может быть достигнута полная резекция всех известных заболеваний, (b) можно сохранить как минимум два смежных сегмента печени с адекватным приток и отток сосудов с дренажом желчных путей; (c) объем остаточной печени достаточен, чтобы избежать послеоперационной печеночной недостаточности.
У пациентов со здоровой печенью объем будущего остатка печени (FLR) должен составлять более 25% от общего объема печени (TLV), чтобы избежать послеоперационной печеночной недостаточности [7–9]. Однако у пациентов с хроническим заболеванием печени или повреждением печени, вызванным химиотерапией, необходимо сохранить минимум 40% TLV [9–12].
Таким образом, хотя границы резекции печени расширились за последние два десятилетия [13], примерно три четверти пациентов с CRLM не подходят для первичной лечебной резекции печени (R0) после предоперационной оценки [14].
Наиболее частыми причинами начальной неоперабельности являются следующие. (1) Единичный, очень большой метастаз в печень, резекция которого не сэкономит достаточного объема паренхимы печени, чтобы избежать послеоперационной печеночной недостаточности. (2) Множественная двулопастная печень. метастазы, полная резекция которых не сохранит достаточный объем функциональной паренхимы печени. (3) CRLM вовлекает или располагается в непосредственной близости либо от бифуркации воротной вены, либо от места слияния трех печеночных вен с нижней полой веной ( IVC).В этом случае резекция метастаза в печень не позволит сохранить как минимум два соседних сегмента печени с адекватным притоком и оттоком сосудов.
Еще 20 лет назад единственным доступным лечением для этих пациентов была паллиативная химиотерапия, цель которой заключалась в увеличении выживаемости без прогрессирования заболевания и общей выживаемости; однако перспективы излечения не было. Хотя показатели выживаемости увеличились с появлением новых химиотерапевтических препаратов (таких как оксалиплатин и иринотекан) и таргетной терапии (например,g., бевацизумаб, цетуксимаб и панитумумаб), текущие показатели выживаемости для этих случаев все еще скромны по сравнению с теми, которые могут быть достигнуты резекцией печени. Поэтому для достижения полной резекции у этих пациентов было предложено несколько терапевтических стратегий [15].
2. Варианты лечения
На рисунке 1 мы схематически представляем те ситуации, в которых метастазы считаются неоперабельными, и терапевтические варианты, которые можно преобразовать в резектабельность.
2.1. Резекция печени после эмболизации / лигирования воротной вены
В некоторых случаях, хотя после полной резекции CRLM можно сохранить как минимум два соседних сегмента с соответствующим сосудистым притоком и оттоком, а также отток желчных путей, объем оставшейся паренхимы печени может быть уменьшен. недостаточно, чтобы избежать послеоперационной печеночной недостаточности. Такие ситуации обычно встречаются у пациентов, которым (1) требуется правосторонняя трисекционэктомия или (2) когда необходимо выполнить правую гемигепатэктомию, но объем левого полушария недопустимо мал (Рисунки 1 (а) и 1 (b)). .Чтобы избежать послеоперационной печеночной недостаточности у этих пациентов, рекомендуется попытаться увеличить объем FLR перед резекцией печени.
Этой цели можно достичь путем первоначального выполнения эмболизации воротной вены (ПВЭ) или лигирования (ПВЛ). Если объем FLR после PVE / PVL увеличивается в достаточной степени, чтобы предотвратить риск послеоперационной печеночной недостаточности, резекцию печени следует выполнить через 4–8 недель.
Эта терапевтическая стратегия основана на наблюдении, что увеличение объема FLR улучшает функцию остаточной паренхимы печени после гепатэктомии [16, 17].
В сообщениях Kinoshita и Makuuchi показано, что перевязка или эмболизация правой воротной вены вызывает процесс атрофии-гипертрофии печени (повышая безопасность резекции печени) у пациентов с гепатоцеллюлярной карциномой или внутригрудной холангиокарциномой [18, 19] . Поэтому другие авторы применяли ту же процедуру у пациентов с CRLM, у которых FLR был недостаточным, чтобы избежать послеоперационной печеночной недостаточности [10, 20–22]. Обоснование такого подхода заключается в том, что эмболизация или лигирование правой воротной ветви устраняет приток воротной вены в правую половину печени, что приводит к ее атрофии; альтернативно, портальный приток в левое полушарие увеличивается, вызывая гипертрофию FLR.
Этот подход позволяет выполнять плановую гепатэктомию (при одновременном снижении риска фатальной печеночной недостаточности) более чем у 50% пациентов, которые в противном случае не могли бытьоперабельны из-за небольшого FLR.
Некоторые авторы высказывали озабоченность относительно сравнительной эффективности ПВЭ и ПВЛ. В модели на животных Furrer et al. выявили, что гипертрофия левого полушария значительно увеличилась после ПВЛ по сравнению с ПВЭ. Эти авторы предположили, что захват большего количества макрофагов в эмболизированной печени (из-за реакции на инородное тело, вызываемой материалом, используемым для эмболизации) объясняет этот результат [23].Их вывод о том, что PVL превосходит PVE в индукции регенеративного ответа остаточной печени, отличается от вывода Wilms et al., Которые заявили, что, хотя PVL и PVE вызывают гипертрофию печени, PVE является наиболее эффективным методом увеличения FLR. [24]. Эти авторы заявили, что окклюзия сосудов, вызванная ПВЭ, более долговечна, чем окклюзия, вызванная ПВЛ. Кроме того, сообщалось, что причиной нижней регенерации в группе перевязки было образование коллатералей между закупоренными и неокклюзированными частями печени.Чтобы избежать этой нежелательной ситуации, некоторые авторы рекомендовали перерезку и введение этанола в перевязанную портальную ветвь [20]. Наконец, в дополнение к этим экспериментальным исследованиям, ретроспективное исследование 35 пациентов показало, что ПВЛ и ПВЭ схожи с точки зрения как увеличения FLR, так и степени конверсии в скорость резектабельности [25].
PVE- или PVE-индуцированная гипертрофия печени затрагивает как сегменты 2-3, так и сегмент 4. Большинству пациентов, подвергшихся PVL / PVE, требуется правосторонняя трисекция.У таких пациентов основная цель этого маневра — увеличить объем сегментов 2-3, а не объем сегмента 4 (который подвергается резекции). Некоторые авторы заявляют, что для увеличения объема левого латерального отдела в первую очередь оптимальным подходом является одновременная окклюзия правой воротной вены и портальных ветвей до сегмента 4 (эмболизация правой трисекционной воротной вены — R3PE) [26]. В 2000 году Нагино и др. представили результаты, которые подтверждают эту гипотезу, демонстрируя, что увеличение объема левого бокового отдела было выше у пациентов с R3PE по сравнению с пациентами, получившими эмболизацию правой воротной вены [26].На сегодняшний день мы выполнили R3PL у одного пациента, и результаты были выдающимися: процент увеличения FLR составил 16,22%, тогда как этот показатель составил 10,8% у пациентов, которым была перевязана правая портальная ветвь [27]. Однако другое исследование, опубликованное в 2005 году, не подтвердило эти результаты, показав, что средний объем сегментов 2–3 после эмболизации и скорость увеличения объема сегментов 2–3 были одинаковыми у пациентов, получавших R3PE, и у пациентов, получавших R3PE. получили стандартную эмболизацию правой воротной вены [7].Следовательно, нельзя сделать окончательных выводов относительно полезности эмболизации портальных ветвей в сегмент 4, и необходимы дальнейшие исследования для прояснения этого вопроса. В настоящее время большинство центров предпочитают рутинно выполнять эмболизацию / лигирование только правой воротной ветви у таких пациентов.
Для достижения более выраженной и быстрой гипертрофии FLR после перевязки воротной вены Schnitzbauer et al. [28] и де Сантибанес и др. [29] недавно рекомендовали связать перевязку правой воротной вены с «пересечением / расщеплением печени in situ».Используя этот подход, авторы достигли значительной и более быстрой гипертрофии FLR, что позволило провести лечебную резекцию печени во время той же госпитализации. Авторы пришли к выводу, что этот метод вызывает быстрый и более устойчивый рост FLR [28], чем сообщается при только окклюзии воротной вены. Более того, этот подход позволяет выполнять поэтапную резекцию печени в течение одного пребывания в стационаре [29].
Для расчета процента прироста FLR после PVE / PVL можно использовать две формулы: (a) (Объем FLR после PVE — Объем FLR до PVE) × 100 / Объем FLR до PVE [ 30], (b)% FLR после PVE -% FLR до PVE [12].
В серии из 30 пациентов процент прироста FLR (рассчитанный по первой формуле) составил 42% [10], тогда как прирост FLR варьировался от 9,7% до 13% в различных сериях с использованием второй формулы [21, 27, 30]. У большинства пациентов этих процентных значений обычно достаточно для безопасного удаления метастазов в печени.
Когда планируется ПВЭ, бевацизумаб следует применять с осторожностью, учитывая, что Aussilhou et al. выявили пагубное влияние этого лекарства на прирост FLR; этот эффект особенно силен у пациентов старше 60 лет, прошедших более шести курсов [31].Однако другие авторы продемонстрировали, что это моноклональное антитело не нарушает регенерацию печени после ПВЭ [32].
Наиболее тяжелыми осложнениями правого ПВЭ являются гематома печени, абсцесс печени, тромбоз левой воротной вены, портальная гипертензия и холангит. В метаанализе, проведенном Aboulkhir et al., Уровень заболеваемости после ПВЭ составил 2,2%, а смертность была нулевой [30].
Частота резектабельности после ПВЭ / ПВЛ в разных центрах колеблется от 60% до 88% [10, 21, 22].Основная причина отказа от лечебной гепатэктомии — не недостаточная гипертрофия FLR, а прогрессирование заболевания. В нашей серии у 5 из 13 пациентов (38%) наблюдалось прогрессирование заболевания после ПВЛ, что исключает радикальную резекцию печени. Остальным 8 пациентам была выполнена успешная полная резекция изначально неоперабельной CRLM. Таким образом, частота резектабельности составила 62% [27].
Показатели заболеваемости и смертности, которые наблюдались после лечебной гепатэктомии, в большинстве исследований были менее 35% и 4% соответственно [10, 22].
Пятилетняя выживаемость этих пациентов составила около 38% [10, 21].
Следует отметить, что у пациентов с метастазами в печени в FLR этот подход не рекомендуется из-за риска быстрого роста этих метастазов. Такой подход может поставить под угрозу шансы на последующую потенциально излечивающую резекцию печени. Таким пациентам следует пройти «двухэтапную» резекцию печени (см. Ниже), чтобы очистить остаточную печень перед PVE [33].
2.2. Двухэтапная резекция печени
Термин «двухэтапная» резекция печени использовался небольшим количеством авторов для определения стратегии, состоящей из одной резекции печени, выполняемой после ПВЛ и не включающей последовательную резекцию печени. [20].Здесь мы будем использовать номенклатуру «двухэтапной» резекции печени для тех процедур, которые состоят из двух последовательных гепатэктомий.
Эта терапевтическая стратегия используется у пациентов с множественными двулопастными CRLM, резекция которых не сохранит достаточное количество паренхимы печени, чтобы избежать послеоперационной печеночной недостаточности. Этим пациентам обычно требуется правосторонняя гепатэктомия или правосторонняя трисекционэктомия вместе с клиновидной резекцией метастазов, расположенных в левом полушарии или в левом боковом отделе (рис. 1 (c) и 1 (d)).
Чтобы избежать таких обширных резекций, которые сопровождаются высоким риском послеоперационной фатальной печеночной недостаточности, рекомендуется выполнить полную резекцию метастазов печени в два этапа хирургической процедуры. На первом этапе выполняется ограниченная резекция метастазов из левого полушария или левого латерального отдела (будущего остатка печени). На втором этапе (после регенерации FLR) основная часть метастатической нагрузки удаляется с помощью правой гепатэктомии или трисекционэктомии.Регенерация FLR необходима для минимизации рисков печеночной недостаточности после второй операции. Таким образом, PVE / PVL может быть подходящим для пациентов с небольшим FLR для повышения безопасности второй гепатэктомии. Чтобы облегчить вторую операцию и избежать прогрессирования заболевания между первым и вторым вмешательством, может быть полезно провести системную или местно-региональную химиотерапию для уменьшения объема метастазов. Чтобы свести к минимуму ингибирующее действие химиотерапевтических препаратов на регенерацию печени, химиотерапию следует начинать через три недели после первой гепатэктомии.Эта последовательность необходима, так как регенерация печени имеет важное значение для выполнения второй резекции [34].
Такой терапевтический подход особенно полезен у пациентов с синхронным двулопастным CRLM [35], учитывая, что (1) он позволяет избежать кумулятивных рисков одновременной резекции первичной опухоли и большой гепатэктомии и (2) позволяет оценить химиочувствительность метастазов в печень и руководство адъювантной терапией после второй операции. На первом этапе выполняется резекция первичной опухоли вместе с ограниченной резекцией метастазов из будущего остатка печени (как правило, из левого полушария или левого латерального отдела).Иногда во время первой операции также выполняется перевязка правой воротной вены. Краткосрочный курс химиотерапии (системный или местно-регионарный) следует начинать через три недели. Если остаточные поражения будут стабильными или поддаются химиотерапии, следует выполнить вторую резекцию печени.
Результаты такого подхода были впервые опубликованы группой Поля Брусса в 2000 году. Эта группа сообщила о степени резектабельности 81% [34]. В других сериях частота резектабельности варьировала от 66% до 75% [27, 33].
Среди опубликованных серий показатели заболеваемости после первой резекции были менее 31%, а уровень смертности был нулевым [33, 34].
Заболеваемость после второй резекции печени колеблется от 45% до 56% [27, 33, 34]. Несмотря на эти относительно высокие показатели заболеваемости, в большинстве исследований смертность была нулевой [27, 33]. Тем не менее, уровень смертности после второй операции составил 15%, по данным Adam et al. [34]. Авторы объяснили, что этот результат был следствием комбинации (1) сниженной толерантности таких пациентов к периоперационным осложнениям из-за прогрессирующего неопластического заболевания и (2) эффектов адъювантных процедур, которые использовались для облегчения резекции печени (химиотерапия). , ПВЭ).
3-летняя выживаемость этих пациентов колебалась от 35% до 54% [27, 33, 34], со средней выживаемостью 44 месяца с момента постановки диагноза метастазов в печень [34].
У отдельных пациентов с множественными метастазами в печени с двухлепестковым колоректальным отделом можно избежать «двухэтапной» резекции печени, выполнив гепатэктомию под контролем ультразвука.
2.3. Одноэтапная резекция печени под ультразвуковым контролем
Применение ультрасонографии в хирургии печени кардинально меняет подход к метастазам в печени, позволяя ставить более точный диагноз и бросая вызов традиционным парадигмам резекции печени.
Интраоперационное ультразвуковое исследование (IOUS) позволяет обнаруживать дополнительные CRLM, которые не были обнаружены методами предоперационной визуализации, и является наиболее точным методом обнаружения опухолей печени [36, 37]. Однако при стандартном ВМОЗИ могут не обнаруживаться очаги размером менее 1 см, особенно у пациентов, проходящих предоперационную химиотерапию, у которых CRLM демонстрирует эхо-картину, аналогичную паттерну окружающей паренхимы печени. Было продемонстрировано, что использование IOUS с контрастным усилением (CE-IOUS) улучшает обнаружение CRLM и является наиболее чувствительным и специфическим методом диагностики CRLM [38].
В середине 80-х годов прошлого века ИОУЗИ был впервые использован для проведения пункции и баллонной окклюзии воротной ветви, которая питает часть печени, подлежащую резекции, что позволило проводить ограниченные анатомические резекции печени вместо крупных гепатэктомий [39–41]. Этот метод снизил риск послеоперационной печеночной недостаточности и был рекомендован в основном пациентам с ГЦК на фоне цирроза печени.
Кроме того, ИОУЗИ предлагает лучшую оценку пространственных отношений между опухолями печени и внутрипеченочными сосудами, позволяя резекцию новообразований печени с сохранением внутрипеченочных сосудистых структур, даже если опухоли расположены в непосредственной близости от основных внутрипеченочных сосудов.Более того, даже когда необходимо резецировать большую печеночную вену (и), результаты цветного допплерографии ИОУЗИ предоставляют надежную информацию, которая может привести к сохранению части паренхимы печени, которая дренируется этими венами, что позволяет избежать серьезных гепатэктомий [42– 45]. Таким образом, в последние годы был разработан новый метод резекции печени, который получил название «гепатэктомия под ультразвуковым контролем». Эта техника открыла двери для новых процедур, которые позволяют проводить радикальные, но консервативные резекции печени, снижая потребность в крупных резекциях печени [46–48].
Поскольку у многих пациентов наблюдаются колоректальные метастазы в печень, которые считаются неоперабельными из-за недостаточного количества остаточной паренхимы печени после обширных гепатэктомий, использование этого хирургического метода (которое позволяет сэкономить значительное количество функциональной паренхимы печени) позволяет полностью удалить метастазы. снижение риска развития послеоперационной печеночной недостаточности. Таким образом, этот метод чаще использовался у пациентов с CRLM.
Кроме того, резекция печени под ультразвуковым контролем снижает потребность в серьезных гепатэктомиях, устраняя необходимость окклюзии воротной вены перед резекцией печени и / или необходимость «двухэтапной» резекции печени у отдельных пациентов.
У пациентов с CRLM, расположенных в непосредственной близости от основных печеночных вен или около воротных ветвей первой степени, большая гепатэктомия по-прежнему является основным хирургическим вариантом в большинстве центров. Если объем остаточной печени после обширной гепатэктомии критически мал, обычно рекомендуется резекция печени после окклюзии воротной вены с помощью ПВЭ или ПВЛ. В таких случаях пациент подвергается интервенционной радиологической процедуре или лапаротомии перед радикальной резекцией печени.Каждая из этих процедур представляет дополнительный риск заболеваемости [30]. Развитие гепатэктомии под ультразвуковым контролем в последние годы позволяет проводить более ограниченную резекцию печени плохо локализованных CRLM, избегая необходимости прегепатэктомии PVE / PVL. В серии из 22 пациентов с плохо расположенными опухолями печени, которым была назначена начальная резекция печени под ультразвуковым контролем, ограниченная резекция с сохранением печеночной вены или без нее была достигнута в 91% случаев, что обеспечивает более низкие показатели заболеваемости, чем большие резекции после ПВЭ, и отсутствие смертность [43].Частота местных рецидивов (на поверхности разреза) была равна нулю при среднем сроке наблюдения 23 месяца. Поскольку этот подход позволяет избежать окклюзии воротной вены (и связанных с ней заболеваний), комфорт пациента также улучшается. Более того, частота резектабельности после окклюзии воротной вены не превышает 60–88% из-за либо недостаточной гипертрофии остаточной печени, либо прогрессирования заболевания в промежутке между окклюзией воротной вены и регенерацией печени [21, 22, 49]. Когда выполняется первоначальная гепатэктомия под ультразвуковым контролем, риск прогрессирования заболевания устраняется, и необходимость в гипертрофии FLR отпадает.Таким образом, степень резектабельности, достигаемая с помощью доступа под ультразвуковым контролем, оказывается выше, чем при PVE / PVL, что расширяет показания для лечебной хирургии в случаях CRLM [43].
У пациентов с множественными двустворчатыми CRLM техника под ультразвуковым контролем может также представлять собой эффективную альтернативу «двухэтапной» гепатэктомии, позволяя провести лечебную и консервативную резекцию печени [44]. Преимуществами этого подхода перед «двухэтапной» резекцией печени являются комфорт пациента, меньшая заболеваемость [44] и повышенная вероятность повторных резекций, если у пациента развиваются рецидивирующие метастазы [50–52].Более того, частота рецидивов после одноэтапной резекции печени под ультразвуковым контролем была аналогична частоте рецидивов после «двухэтапной резекции печени».
В связи с вышеупомянутыми преимуществами одноэтапная резекция печени под ультразвуковым контролем должна быть частью арсенала хирурга печени, особенно у пациентов со сложными опухолевыми проявлениями.
2.4. Резекция печени после конверсионной химиотерапии
Эта терапевтическая стратегия была впервые представлена группой Пола Брусса в 1996 году [53] и рекомендуется пациентам с небольшим количеством крупных CRLM, резекция которых не сохранит достаточного количества функциональной печени для предотвратить послеоперационную печеночную недостаточность (рис. 1 (е)).Цель этого подхода — «уменьшить» метастазы в печени до такой степени, чтобы можно было полностью их удалить. Таким образом, шанс потенциально излечивающей резекции печени доступен для пациентов, которым в противном случае могло бы помочь только паллиативное лечение.
Еще 20 лет назад единственная эффективная химиотерапевтическая схема, которая применялась у пациентов с неоперабельным CRLM, состояла из 5-фторурацила (5-FU) и фолиновой кислоты. Хотя эта химиотерапия увеличивает общую выживаемость и выживаемость без прогрессирования у этих пациентов, частота ответа составила менее 23%, и сообщалось только о единичных случаях метастазов в печень, которые уменьшаются в достаточной степени, чтобы сделать возможным последующую лечебную гепатэктомию [54–5] 56].
Появление новых химиотерапевтических агентов, таких как оксалиплатин и иринотекан, привело к значительно лучшим результатам. Частота ответа, достигаемая при режимах FOLFOX и FOLFIRI, колеблется от 40% до 56% [57–59]. Наблюдалась сильная корреляция между частотой ответа и частотой резекции у пациентов с изначально неоперабельной CLRM [60]. Таким образом, больше пациентов стали операбельными после так называемой конверсионной химиотерапии. Folprecht et al. таким образом, пришел к выводу, что резектабельность следует рассматривать как новую конечную точку для предоперационной химиотерапии, уделяя особое внимание лечебному потенциалу этого онкохирургического лечения [60].
Группа Paul-Brousse опубликовала свои обновленные результаты в 2004 году, сообщая о 12,5% -ной степени конверсии в операбельность у 1104 пациентов с изначально неоперабельной CRLM (после 10 курсов химиотерапии в среднем) [14]. Помимо этой очень большой серии пациентов, другие центры впоследствии сообщили о подобных результатах у меньшего числа отобранных пациентов, которые поступили с изначально неоперабельной CRLM, которая была сделана резектабельной с помощью различных схем химиотерапии [61–63].
Во многих отчетах показатели заболеваемости после гепатэктомии у пациентов с изначально неоперабельной CRLM [14, 62, 64] колеблются от 23% до 28%, что аналогично тем показателям, которые наблюдаются у пациентов с изначально операбельной CRLM. Однако некоторые авторы сообщают о значительно более высокой частоте послеоперационных осложнений у пациентов, которым проводят резекции после «уменьшения» химиотерапии, что вызывает опасения по поводу пагубного воздействия предоперационной химиотерапии на паренхиму печени (см. Ниже) [65, 66].Сообщается, что послеоперационная смертность в большинстве центров составляет менее 2%, что аналогично показателям, достигнутым у пациентов, не получавших предоперационную химиотерапию [14, 53, 62, 66].
Пятилетняя выживаемость пациентов, которым была сделана резектабельная химиотерапия, составила 33% в группе Поля Брусса, что выше, чем у аналогичных пациентов с помощью новых паллиативных химиотерапевтических схем [14]. Хотя эта выживаемость значительно ниже, чем та, которая может быть достигнута у пациентов с изначально операбельной CRLM (значение = 0.01), 5-летняя безрецидивная выживаемость в 22%, о которой сообщалось у первоначально неоперабельных пациентов, по-видимому, полностью оправдывает усилия по доведению до резектабельности этих пациентов с неблагоприятным прогнозом [14].
Добавление таргетных методов лечения (например, бевацизумаба, цетуксимаба и панитумумаба) к схемам химиотерапии может быть полезным для дальнейшего повышения скорости превращения в резектабельность первоначально неоперабельных поражений. Эта гипотеза была подтверждена на ряде пациентов, у которых метастазы в печень были резистентны к предыдущим курсам традиционной химиотерапии.С появлением цетуксимаба в химиотерапии следующей линии 7% этих пациентов стали операбельными, с уровнем заболеваемости и смертности 50% и 3,7% соответственно, а средняя выживаемость составила 20 месяцев [67]. Это исследование, подобное исследованиям Zorzi et al., Продемонстрировало, что моноклональные антитела в сочетании с традиционной химиотерапией не оказывают вредного воздействия на безопасность резекции печени [32]. Кроме того, Gruenberger et al. выявили, что бевацизумаб мало влияет на регенерацию печени после гепатэктомии [68].Однако следует отметить, что использование ингибиторов фактора роста эндотелия сосудов (например, бевацизумаба) перед серьезным хирургическим вмешательством увеличивает риск кровотечений и осложнений заживления ран [69]. Эту терапию следует прекратить за 5–8 недель до хирургического вмешательства [68, 70].
При выборе этого терапевтического подхода следует иметь в виду несколько моментов.
(i) Нельзя предполагать, что ответ на химиотерапию сохранится. Иногда метастазы уменьшаются и становятся резектабельными после нескольких курсов химиотерапии.Однако, если химиотерапия будет продолжена, метастазы могут снова вырасти и снова стать неоперабельными, закрывая «окно возможностей» для потенциально излечивающей гепатэктомии [71]. Следовательно, если системное заболевание находится под контролем, резекцию печени следует назначить, как только метастазы станут операбельными.
(ii) Если химиотерапия продолжается после того, как метастазы становятся резектабельными, возможно, метастазы в печени станут меньше и больше не будут видны на изображениях (сканирование КТ / МРТ / ПЭТ).Такие метастазы называют «исчезающими метастазами». К сожалению, этот «полный радиологический ответ» или «полный клинический ответ» [72] не указывает на излечение, поскольку «полный патологический ответ» достигается менее чем в 20% случаев [73, 74]. У одной трети пациентов с полным радиологическим ответом лапаротомия может выявить небольшие метастазы, которые были пропущены методами визуализации, или остаточные рубцы, резекция которых выявила бы жизнеспособные опухолевые клетки. В качестве альтернативы, у пациентов без макроскопических остаточных тканей (при лапаротомии) и отрицательного (с контрастным усилением) интраоперационного ультразвука при патологическом исследовании резецированных образцов, включая сегменты печени, где изначально располагались метастазы, выявлялись жизнеспособные метастатические клетки в 75% случаев [74 , 75].Косвенное подтверждение наличия жизнеспособных опухолевых клеток на участках бывших метастазов (которые были невидимы при лапаротомии) дают некоторые отчеты. В серии пациентов с 31 CRLM, которые исчезли после химиотерапии и которые не наблюдались при лапаротомии, резекция исходного участка метастазов не выполнялась. Через год наблюдения рецидивировали in situ 23 (74%) метастаза [74].
Преимущество выживаемости, которое достигается при резекции печени у пациентов с клиническим полным ответом на химиотерапию, было выявлено в другом исследовании.Четырнадцать пациентов с полным радиологическим ответом после химиотерапии не подвергались резекции печени, достигнув 5-летней общей выживаемости 14% и средней выживаемости 30 месяцев. У 25 пациентов с изначально неоперабельными CRLM, которым была сделана резектабельность с помощью FOLFOXIRI
.
Хирургия метастазов в печень | Мемориальный онкологический центр им. Слоуна Кеттеринга
Многие из основных кровеносных сосудов проходят позади или через печень, по существу соединяя ее с сердцем. Во время операции следует проявлять особую осторожность, поскольку при травме печень может легко разорваться и сильно кровоточить.
Операция по удалению метастатических опухолей печени сопряжена с рядом проблем. У нас есть команда хирургов в Memorial Sloan Kettering, которые специализируются на проведении таких операций.
Наши хирурги являются одними из лидеров в этой области, которая в последнее время стала намного безопаснее благодаря усовершенствованным методам визуализации и достижениям в хирургической технике .
Каждый год хирурги MSK оперируют несколько сотен пациентов с метастазами в печень. Наши хирурги вместе с интервенционными радиологами разработали и усовершенствовали несколько методов, дающих лучшие результаты, в том числе методы, которые сводят к минимуму кровопотерю и необходимость переливания крови во время операции.
Мы первыми доказали, что хирургическое удаление ограниченного числа опухолей печени может продлить жизнь на несколько лет. В частности, операции на печени у людей с колоректальным раком , который распространился на печень, стала безопасной и эффективной даже при метастатическом поражении.Наши достижения в области хирургии привели к невиданным ранее показателям долгосрочной выживаемости.
Минимально инвазивная хирургия
Исследователи и хирурги MSK разработали и продолжают совершенствовать малоинвазивные методы (лапароскопические и роботизированные) и методы визуализации, используемые во время операций. Эти нововведения расширили возможности лечения людей с метастазами в печени.
По возможности, наши хирурги используют методы, которые не затрагивают большую часть здоровой печени. Это снижает риск осложнений и необходимость восстановления печени.
Лапароскопическая хирургия
Для некоторых людей минимально инвазивная лапароскопическая операция может значительно сократить время, необходимое для восстановления после операции. В этой процедуре хирурги вставляют тонкую освещенную трубку с камерой на конце (лапароскоп) через крошечный разрез (разрез) брюшной полости. Затем хирург направляет хирургические инструменты через лапароскоп для удаления опухолей или, в некоторых случаях, части печени. Наши хирурги также используют малоинвазивные роботизированные операции для удаления части печени.
Хирургия для людей с метастазами в толстую кишку или ректальную печень
У людей с метастазами в печень из опухолей толстой или прямой кишки наши хирурги часто могут удалить опухоли в обоих местах во время одной и той же операции. Это может быть хорошим подходом, когда в печени всего несколько небольших опухолей.
Ваша лечащая бригада часто сочетает этот подход с химиотерапией. Такой подход позволяет значительно сократить осложнения и время восстановления. Исследования показывают, что до половины всех людей с колоректальными метастазами в печени выживают не менее пяти лет после этого лечения.
.
При колоректальных метастазах в печень наличие внепеченочного заболевания коррелирует с патологией первичной опухоли
Предпосылки . ФДГ-ПЭТ-сканирование выявляет внепеченочные метастазы у 20% пациентов с колоректальными метастазами в печень, но, как сообщается, имеет приблизительно 16% ложноотрицательных результатов. Пациенты и методы . Ретроспективно были рассмотрены пациенты, которым в период с марта 2006 г. по март 2010 г. проводилось ПЭТ-сканирование в больнице Вестмид по поводу метастатического колоректального рака.Результаты ПЭТ коррелировали с характеристиками опухоли, которые, как предполагалось, влияли на общий прогноз. Результаты . Степень дифференцировки опухоли и сосудистой инвазии были значимыми предикторами наличия внепеченочного заболевания на ПЭТ-сканировании, также как и уровень CEA. Заключение . Обнаружение внепеченочного заболевания при колоректальных метастазах в печень коррелирует с биологическим поведением первичной опухоли. Плохо дифференцированные опухоли и опухоли с лимфоваскулярной инвазией ведут себя агрессивно и могут иметь широко распространенные метастазы.Это следует учитывать при планировании резекции печени по поводу колоректальных метастазов.
1. Введение
Резекция печени в настоящее время является наиболее эффективным методом лечения пациентов с метастазами колоректального рака в печень. Необходима строгая политика отбора, поскольку нет преимущества в выживаемости, если остаточная болезнь остается где-то еще после гепатэктомии [1].
ФДГ-ПЭТ-сканирование выявляет внепеченочные метастазы у 20% пациентов с колоректальными метастазами в печень, но, как сообщается, имеет приблизительно 16% ложноотрицательных результатов [2].Позитронно-эмиссионная томография с аналогом глюкозы [ 18 F] фтор-2-дезокси-D-глюкозой — это чувствительный диагностический тест, который выявляет опухоли на основе повышенного метаболического использования глюкозы опухолевыми клетками. Было продемонстрировано, что FDG-PET более чувствителен, чем CT при обнаружении метастатической колоректальной аденокарциномы, особенно во внепеченочных местах [3].
Позитронно-эмиссионная томография дает полезную информацию при отборе пациентов с метастазами в печень от колоректального рака, рассматриваемых для хирургического лечения; он изменяет решение о ведении у 15% таких пациентов, что помогает уменьшить количество ненужных хирургических исследований и косвенно приводит к увеличению выживаемости пациентов, перенесших резекцию печени [4].Позитронно-эмиссионная томография в настоящее время регулярно интегрируется в предоперационную оценку пациентов, которым предстоит резекция печени по поводу колоректальных метастазов.
Общая чувствительность 97% и общая специфичность 76% для FDG-PET при обнаружении рецидивирующего колоректального рака были задокументированы одним систематическим обзором и метаанализом исследований, проведенных для изучения роли ПЭТ в колоректальных метастазах в печени [5] .
Fernandez et al. проанализировал литературу, согласно которой пятилетняя выживаемость после резекции печени по поводу колоректальных метастазов до внедрения ПЭТ-сканирования составляла в среднем 30% (12–40%).При рутинном использовании ПЭТ-сканирования актуарная пятилетняя выживаемость улучшилась до 58% [3].
Предыдущие исследования обнаружили некоторую корреляцию между определенными клиническими показателями, такими как интервал рецидива в печени, размер метастазов в печень и уровни СЕА, и результатами ПЭТ-сканирования для обнаружения внепеченочных метастазов [2].
Обнаружено, что биология опухоли, отражаемая степенью дифференцировки, узловыми метастазами, стадией Т и, возможно, другими биологическими маркерами, влияет на общую выживаемость после резекции печени по поводу метастатического колоректального рака [6].
Мы разработали это исследование для оценки корреляции между клиническими факторами, связанными с заболеваниями и патологическими особенностями первичного колоректального рака, с результатами ПЭТ-сканирования пациентов с метастазами в печень, рассматриваемых для резекции печени.
2. Пациенты и методы
В базе данных для записей ПЭТ-сканирования был проведен поиск пациентов, у которых было ПЭТ-сканирование с историей колоректального рака, и их изображения показали метастазы в печени. Пациенты были идентифицированы, и их медицинские карты были изучены.Пациенты, у которых при ПЭТ-сканировании были обнаружены метастазы в печени, были включены в это исследование за период с марта 2006 г. по март 2010 г.
Собранные данные включают демографические данные и интервал между удалением колоректального рака и появлением метастазов в печени; результаты ПЭТ-сканирования были записаны и включали наличие внепеченочного заболевания, количество и размер метастазов в печени и двулопастное заболевание печени; Были записаны обычные данные изображения поперечного сечения. Мы также собрали данные из оперативных отчетов (включая результаты интраоперационного УЗИ) и периоперационных записей.
Был проанализирован отчет о патологии первичного колоректального рака, и извлеченные данные включали место первичного заболевания, степень дифференцировки, лимфоваскулярную инвазию, стадию Т, стадию N и вовлечение апикальных узлов. Факторы, которые, как считается, коррелируют с наличием внепеченочного заболевания, были проанализированы с использованием критерия хи-квадрат. Многовариантный анализ проводился с использованием теста логистической регрессии для независимых факторов, которые коррелируют с обнаружением внепеченочных заболеваний, обнаруженных на ПЭТ-сканировании.
3. Результаты
С 2006 г. по март 2010 г. было выполнено 230 сканирований ПЭТ; 174 пациентам с анамнезом или недавно диагностированным колоректальным раком сделали ПЭТ-сканирование для оценки подозреваемых метастазов в печень; у остальных пациентов либо наблюдалось повышение CEA, либо подозрение на внепеченочные метастазы. У этих пациентов были подозрительные поражения печени на компьютерной томографии и / или повышение уровня СЕА. У 106 пациентов (47 женщин и 59 мужчин) со средним возрастом 63 года (диапазон 26–88) были обнаружены метастазы в печень с внепеченочным рецидивом или без него.
Участок первичного поражения находился в правой ободочной кишке у 25 пациентов, прямой кишке у 20 пациентов, левой толстой кишке и сигмовидной кишке у 56 пациентов и поперечной ободочной кишке у 5 пациентов. Всем пациентам была проведена компьютерная томография грудной клетки, брюшной полости и таза.
Метастазы в печени были синхронными у 30 пациентов, у 37 пациентов был рецидив в течение 12 месяцев после резекции колоректального рака, и у 39 пациентов был рецидив через 12 месяцев (диапазон 14–72 месяцев). ПЭТ-сканирование дало ложноотрицательный результат у трех пациентов, у которых были КТ-доказательства заболевания печени и которым была проведена резекция печени, что подтвердило метастатический характер поражения, которое было замечено на поперечных изображениях.ПЭТ-сканирование обнаружило поражения, которые не были обнаружены на компьютерной томографии, у 12 пациентов, восемь из которых были внепеченочными поражениями и четыре были поражениями печени.
Патология первичного колоректального рака умеренно дифференцирована у 72 пациентов (68%), слабо дифференцирована у 30 пациентов (28%) и хорошо дифференцирована у 4 пациентов (4%). Лимфоваскулярная инвазия отсутствовала у 70 пациентов (66%) и наблюдалась у 36 пациентов (34%). Первичным поражением было Т2 у 14 пациентов, Т3 у 72 пациентов и Т4 у 20 пациентов.Заболевание было N0 у 23 пациентов и N2 у 83 пациентов. Апикальные лимфатические узлы были поражены у 11 пациентов.
Было одно поражение печени у 47 пациентов, у 19 пациентов было два поражения, у 9 пациентов было три поражения, у 8 пациентов было 4 поражения печени и у 23 пациентов было пять или более поражений. У 27 пациентов заболевание было двулопастным.
Уровень CEA был нормальным у 18 пациентов, а уровни сыворотки колебались от 0,5 мкг / л до 16223 мкг / л.
ПЭТ-сканирование показало, что заболевание ограничивалось печенью у 65 пациентов и у 41 пациента было внепеченочное заболевание.Наиболее частыми локализацией были легкие, заболевание брюшины, местный рецидив, узлы средостения, а иногда и кости и мозг.
3.1. Статистический анализ
Данные были проанализированы с помощью StatsDirect. Однофакторный анализ факторов, которые могут коррелировать с наличием внепеченочного заболевания, показал, что лимфоваскулярная инвазия, степень дифференцировки, Т-стадия, уровень СЕА, размер метастазов и билобарное заболевание были значимыми предикторами наличия внепеченочного заболевания (см. Таблицу 1).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Многовариантный анализ был проведен с использованием пошагового логистического регрессионного теста, показавшего, что сосудистая инвазия, степень дифференциации и уровень СЕА являются единственными независимыми факторами, предсказывающими наличие внепеченочного заболевания (см. Таблицу 2).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
4.Обсуждение
Рентгенологическая визуализация поперечного сечения с использованием компьютерной томографии брюшной полости и таза является наиболее часто используемой визуализацией для оценки анатомии печени и выявления внепеченочных заболеваний у пациентов с колоректальными метастазами в печень, которые являются потенциальными кандидатами на лечебную резекцию печени.
ПЭТ-сканирование показало, что в других исследованиях частота нетерапевтических лапаротомий снижается с 15% до менее 5% [7]. Те же исследователи из Центра Джона Хопкинса, количество опухолей более пяти, двустороннее заболевание печени и размер опухоли более 5 см были независимыми факторами, связанными с наличием внепеченочного заболевания.Huebner et al. провели метаанализ 11 статей об использовании ПЭТ-сканирования при колоректальных метастазах в печени; они определили, что общая чувствительность 97% (уровень достоверности 95%: 95–99%) и общая специфичность 76% (уровень достоверности 95%, 64–88%) для FDG PET, выявляющего рецидивирующий CRC по всему телу. Кроме того, путем объединения данных об изменениях в управлении общее изменение в управлении, направленное на FDG PET, было рассчитано на 29% (уровень достоверности 95%: 25–34%) [5].
Настоящее исследование представляет собой ретроспективный обзор пациентов, направленных в больницу Вестмид для оценки колоректальных метастазов в печени с целью подтверждения степени заболевания печени и оценки наличия или отсутствия внепеченочного заболевания; из-за схемы направления мы смогли просмотреть только пациентов, у которых была медицинская карта в больнице Вестмид.Объектами этого исследования были пациенты, у которых были обнаружены метастазы в печени при поперечной визуализации и ПЭТ-сканировании. Мы связали клинические факторы и патологию первичного колоректального рака с результатами ПЭТ-сканирования. При многофакторном анализе мы обнаружили, что наличие сосудистой инвазии, степень дифференцировки первичного поражения и уровень СЕА являются единственными факторами, связанными с наличием или отсутствием внепеченочного заболевания. В то время как стадия первичных и узловых метастазов опухоли, временной интервал между диагностикой первичных и рецидивов, а также размер и количество метастазов в печени были важными предикторами при однофакторном анализе; они не были значимыми факторами в многомерном анализе.Лимфоваскулярная инвазия кажется очень важным фактором в биологии опухолей; Пациенты с первичной опухолью, показывающей лимфоваскулярную инвазию, будут иметь значительно более высокий шанс метастазирования в лимфатические узлы. Положительный статус лимфатических узлов был предиктором более низкой выживаемости у пациентов с колоректальным раком T1 или T2. При раке с положительной лимфоваскулярной проницаемостью рекомендуется радикальное хирургическое вмешательство [8].
Lim et al. изучили 2417 пациентов; опухоль с положительной лимфоваскулярной инвазией была обнаружена у (25.2%). По сравнению с пациентами с опухолями с отрицательной лимфоваскулярной инвазией, пациенты с опухолями с лимфоваскулярной инвазией имели более высокие предоперационные уровни карциноэмбрионального антигена в сыворотке крови. Их опухоли также с большей вероятностью были плохо дифференцированы и более развиты по категориям T и N. Опухоли с положительной лимфоваскулярной инвазией также чаще имели системные метастазы. Опухоли с положительной лимфоваскулярной инвазией метастазируют в системные лимфатические узлы. Эти опухоли также чаще рецидивировали в системных лимфатических узлах после целенаправленной хирургической операции.Положительный статус лимфоваскулярной инвазии был независимым неблагоприятным прогностическим фактором для 5-летней общей и 5-летней безрецидивной выживаемости пациентов со спорадическим колоректальным раком [9].
Pawlik et al. описали факторы, связанные с нетерапевтической лапаротомией по поводу колоректальных метастазов в печень, включая размер метастазов, количество метастазов и двустороннее заболевание [7]; однако они не включали факторы, связанные с первичной патологией рака. Включение факторов, связанных с опухолью, в наше исследование показало, что факторы поражения печени сами по себе являются важными детерминантами, но не имели значения при многомерном анализе.В некоторых предыдущих исследованиях было показано, что безболезненный интервал является важным фактором, предсказывающим внепеченочные заболевания [2]. В нашем исследовании и исследовании Pawlik et al. [7], временной интервал не был значимым фактором в прогнозировании поведения распространения колоректального рака.
Было описано, что общая выживаемость пациентов, перенесших лечебную резекцию по поводу метастазов колоректального рака в печень, может быть предсказана по патологическим характеристикам первичного колоректального рака [6] в зависимости от степени дифференциации первичного рака и наличия или отсутствия лимфатических узлов метастазы.Выживаемость после резекции колоректальных метастазов в печени постоянно улучшается благодаря лучшему отбору пациентов, улучшенному послеоперационному уходу и более эффективным химиотерапевтическим агентам [10].
Das et al. исследовали значение патологических и биологических особенностей первичного рака прямой кишки и пришли к выводу, что патологические стадии T и N достоверно предсказывают общую выживаемость, отдаленные метастазы и локально-региональные рецидивы при многомерном анализе, и это косвенно является показанием для исследований более агрессивной адъювантной химиотерапии для местно-распространенный ректальный.Более поздняя агрессивная химиотерапия и молекулярная терапия показали значительное улучшение общей выживаемости при метастатическом колоректальном раке [11, 12]. В другом исследовании Harris et al. исследовали факторы, влияющие на выживаемость у пациентов с метастатическим колоректальным раком на поздних стадиях, а также при многофакторном анализе факторы, влияющие на выживаемость, включая стадию Т, стадию N и степень дифференциации основного заболевания [13]. У пациентов с местнораспространенным раком прямой кишки, перенесших полное мезоректальное иссечение, независимыми факторами плохой выживаемости были продвинутая стадия заболевания и наличие лимфоваскулярной и периневральной инвазии [14].У пациентов со стадией B по Герцогу наличие лимфоваскулярной инвазии связано с увеличением частоты рецидивов заболевания, и, следовательно, эта особенность используется в качестве показания для химиотерапии после лечебной резекции [15, 16].
Биология первичной опухоли все чаще признается в качестве основного определяющего фактора в поведении болезни и общем исходе; Одним из таких факторов является периневральная инвазия (ПНИ): в одном исследовании он был обнаружен у 57 из 341 пациента (16,7%) и был значительно связан с глубиной инвазии опухоли и положительной лимфоваскулярной инвазией.Многофакторный анализ показал, что PNI является значимым независимым прогностическим фактором безрецидивной выживаемости, а не общей выживаемости [17]. В одном исследовании первичного колоректального рака больший акцент на биологии первичной опухоли был сделан на генетических особенностях первичной опухоли; Мутации p53 были значимым отрицательным прогностическим показателем общей выживаемости. Это открытие имеет прогностическое и терапевтическое значение для лечения пациентов с колоректальной карциномой [18, 19].Дальнейшие исследования могут выявить больше молекулярных маркеров, которые не только могут предсказать прогноз, но также будут иметь значение для исследования и лечения метастатического заболевания, что может определять, какое подмножество пациентов с метастазами в печени должно проходить сканирование с помощью ПЭТ.
Биология метастазов в печень имеет тенденцию повторять особенности основного заболевания. Раджаганешан и др. изучили этот предмет и обнаружили, что первичный рак с высокой микроваскулярной плотностью (MVD) имеет тенденцию к формированию метастазов в печени с высоким MVD.Плотность микрососудов была важным показателем рецидива заболевания при первичных опухолевых опухолях. Эти результаты предполагают, что первичные CRC и их метастазы в печень имеют общие гистологические особенности [20]. А опухоли с высокой плотностью микрососудов имеют высокий риск рецидива [21].
В заключение, биологические факторы, связанные с первичными опухолями, такие как сосудистая инвазия, степень дифференцировки, мутация p53, плотность микрососудов и, возможно, новые молекулярные агенты, могут быть полезны в будущем для определения необходимости ПЭТ-сканирования колоректального рака. метастазы и могут диктовать тип терапии, которой должна подвергаться каждая группа пациентов.
.
