Здоровая микрофлора кишечника как защита от болезни Альцгеймера
Если спросить: какой самый важный орган в нашем организме, то многие назовут сердце или мозг. Любители застолий укажут на печень или желудок. Но готовы спорить на что угодно, никто не назовет кишечник. А ведь он защищает нас от болезней, греет, снабжает витаминами и энергией и даже, как выяснили ученые, здоровая микрофлора кишечника может отсрочить наступление рассеянного склероза, бороться с болезнью Альцгеймера и снимать симптомы аутизма… Итак, приведем несколько доказанных фактов о кишечнике.
ФАКТ ПЕРВЫЙ. В кишечнике живет больше микроорганизмов, чем клеток у человека.
В кишечнике проживает невероятное количество микроорганизмов — около 39 триллионов. Это примерно в 1,3 раза больше, чем количество клеток в организме. Большая часть флоры кишечника — это бактерии 300-500 видов. Большая доля нормальной микрофлоры — это полезные анаэробные бактерии: бифидобактерии, пропионовокислые бактерии, бактероиды и лактобактерии. В желудке их мало, в тонком кишечнике чуть больше, а основная часть облюбовала толстый кишечник.
ФАКТ ВТОРОЙ. Кишечник защищает нас от болезней.
Около 80% всех клеток, которые формируют иммунитет организма, находятся в слизистой оболочке кишечника. Они не дают бактериям проникать в нашу кровь, а при столкновении с опасностью активно вырабатывают иммуноглобулин А (IgA) — белок, который обеспечивает иммунитет.
Для повышения иммунитета полезно есть клетчатку — переваривая пищевые волокна, бактерии образуют короткоцепочечные жирные кислоты, такие как ацетат, пропионат и бутират, которые улучшают защитную функцию слизистой кишечника.
ФАКТ ТРЕТИЙ. Подавляет канцерогены, способные вызвать рак.
При тепловой обработке в красном мясе образуются азотсодержащие вещества, являющиеся канцерогенами, а в колбасу для красивого розового цвета добавляют нитрит натрия или нитрит калия, которые при переваривании образуют канцерогенные нитрозамины. Но кишечник обладает защитой от опасности — микрофлора и ферменты его слизистой оболочки способны инактивировать канцерогены. В этом им помогают клетчатка и витамины А, С и Е.
В этом им помогают клетчатка и витамины А, С и Е.
ФАКТ ЧЕТВЕРТЫЙ. Вырабатывает антибиотикоподобные вещества.
Бактерии кишечника производят антимикробные вещества, которые не дают размножаться микробам — возбудителям болезней. Бифидобактерии, лактобактерии и прочие «друзья» человека производят перекись водорода, молочную, уксусную и другие кислоты, способные разрушить, к примеру, бактерии дизентерии и многое другое. Вот почему при расстройстве кишечника у нас падает и общий иммунитет.
ФАКТ ПЯТЫЙ. Площадь поверхности тонкого кишечника – с теннисный корт.
Длина тонкой кишки составляет около 7 метров, а ширина — примерно 2,5 см в диаметре. Весь он покрыт складками и микроворсинками и за счет этого всасывает максимально возможное количество полезных веществ. Если расправить его стенки, они покроют площадь в 250 кв. метров — это размер теннисного корта.
ФАКТ ШЕСТОЙ. Кишечник нас греет.
Микрофлора питается непереваренными в тонком кишечнике остатками пищи — пищевыми волокнами. В результате вырабатывается огромное количество тепловой энергии, которая вместе с кровью разносится по организму. Вот почему человек всегда мерзнет, если голодает.
ФАКТ СЕДЬМОЙ. Синтезирует фолиевую кислоту и другие витамины.
Некоторые важные витамины вырабатываются в кишечнике, а не поступают готовые с пищей.
Это:
К2 — необходим для нормального свертывания крови.
В12 — отвечает за обмен веществ и помогает в работе нервной системы.
В3 — положительно влияет на работу сердечно-сосудистой системы, регулирует давление, очищает от токсинов.
В9, фолиевая кислота — участвует в кроветворении, укрепляет защитные функции, важна для беременных женщин, так как помогает формировать нервную систему ребенка.
Кроме того, в кишечнике синтезируются другие важные витамины группы В и аминокислоты.
ФАКТ ВОСЬМОЙ. Микрофлора кишечника производит «гормон счастья».
Микрофлора кишечника может влиять на наше настроение и память, и поэтому ей дали имя «второй мозг». Эта связь называется «ось кишечник-мозг» и сейчас активно изучается. Ученые уже сделали выводы, что здоровая микрофлора может отсрочить наступление рассеянного склероза, бороться с болезнью Альцгеймера и снимать симптомы аутизма. Скажем больше, исследователи утверждают, что микрофлора способна производить «гормон счастья» и если она чувствует себя хорошо, то и у нас вырастают крылья за спиной.
Эта связь называется «ось кишечник-мозг» и сейчас активно изучается. Ученые уже сделали выводы, что здоровая микрофлора может отсрочить наступление рассеянного склероза, бороться с болезнью Альцгеймера и снимать симптомы аутизма. Скажем больше, исследователи утверждают, что микрофлора способна производить «гормон счастья» и если она чувствует себя хорошо, то и у нас вырастают крылья за спиной.
Все это имеет, к сожалению, и обратный эффект: если кишечник не в порядке, качество жизни падает. Витамины всасываются хуже, кожа выглядит серой, цепляется простуда, настроение на нуле. Причины, нарушающие благоденствие микрофлоры, — это недостаток клетчатки, прием антибиотиков, отсутствие движения, стрессы, переутомление и другие частые спутники современного горожанина.
Если нарушения питания и стрессы случаются не раз-два, а являются нормой жизни, то возможны разные расстройства, среди которых такое явление, как раздраженный кишечник. От него страдает каждый пятый человек в мире. Боль или спазм в животе плюс вздутие, запор или диарея — обычные признаки раздраженного кишечника.
Так что относитесь к этому важному органу с заботой и уважением и ждите, когда он отплатит порцией «гормона счастья».
#нацпроектдемография89
Сдать анализ кала на дисбактериоз кишечника
Метод определения
Бактериологический, бактериоскопический
Исследуемый материал
Кал
Доступен выезд на дом
Синонимы: Дисбиоз кишечника; Анализ кала на дисбактериоз.
Intestinal dysbiosis; Intestinal disbios; Intestinal dysbacteriosis.
Краткое описание исследования «Дисбактериоз кишечника»
В медицинских офисах Москвы и Московской области приём биоматериала для выполнения теста № 456 производится 7 дней в неделю с ограничениями по времени взятия. Интересующую информацию уточняйте у администраторов медицинских офисов.
Интересующую информацию уточняйте у администраторов медицинских офисов.
Дисбактериоз (в англоязычной литературе используют термин Intestinal bacterial overgrowth, реже – disbios) острое или хроническое нарушение нормальной микрофлоры кишечника.
В содержимом тощей кишки здоровых людей может находиться до 105 бактерий в 1 мл кишечного содержимого. Основными являются молочнокислые палочки, стафилококки и стрептококки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 108, в первую очередь за счёт энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. В толстой кишке преобладают анаэробы (бактероиды, клостридии, лактобациллы). Этот симбиоз бактерий у здорового человека (и у млекопитающих!) выполняет многие полезные функции: противодействует чужеродным патогенным микробам и вирусам, помогает пищеварению, синтезирует витамины группы В.
Соотношение количества различных микроорганизмов достаточно постоянно. Но вследствии ослабления иммунитета, нерациональной терапии антибиотиками, лучевой и химиотерапии, врождённых дефектов ферментов баланс нарушается. Могут исчезнуть некоторые представители нормальной микрофлоры (бифидобактерии, молочнокислые и кишечные палочки) и появиться грибки рода кандида, стафилококки, протей, синегнойная палочка. Возникает клинический синдром, для которого характерны понос, стеаторея, снижение веса и анемия. При резком ослаблении защитных сил, иммунитета может развиться генерализованная форма эндогенной инфекции вплоть до сепсиса.
С какой целью проводят исследование на дисбактериоз кишечника
Исследование микрофлоры кишечника применяют для определения характера нарушения биоценоза кишечника.
Выявляемые микроорганизмы и возбудители в исследовании «Дисбактериоз кишечника»
Выделяемые микроорганизмы и возбудители:
- полезные бактерии кишечника – лактобактерии, бифидобактерии, кишечные палочки с типичными свойствами, а также со сниженными ферментативными и гемолитическими признаками;
- условно-патогенные бактерии – энтеробактерии, неферментирующие бактерии, стафилококки, энтерококки, анаэробные бактерии (клостридии, без идентификации до вида), грибы;
- патогенные – сальмонеллы, шигеллы.

Литература
Основная литература
- Парфенов А. И. Микробная флора кишечника и дисбактериоз РМЖ, 1998, т. 6, №18.
- Henry C. Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome JAMA. 2004, v.292, pp. 2213 — 2214.
Пройти обследование кишечника в специализированном центре / Клиника ЭКСПЕРТ
В Клинике ЭКСПЕРТ можно пройти комплексное обследование кишечника. Разбираем какие виды исследований необходимы.
Записаться
Длительность
15-90 минут
Если вы ищете обследование кишечника, то, скорее всего, уже столкнулись с неприятными симптомами, заметно снижающими комфорт и качество жизни. Причин этих симптомов может быть много — воспалительный, инфекционный процесс, нарушения питания, наследственные болезни.
Диагностику заболеваний кишечника проводят при симптомах:
- нарушение стула: диарея, запор или их чередование
- боли, вздутие живота, метеоризм
- неконтролируемая потеря веса
- кровь, слизь в кале
- кожные проявления
- общая слабость, повышение температуры.
Регулярно стоит проверяться на заболевания кишечника тем людям, чьи близкие родственники имеют диагноз рака кишечника, язвенного колита или болезни Крона.
Анализы для проверки кишечника
- Клинический (общий) анализ крови с лейкоцитарной формулой и СОЭ.
- Кровь на раковый эмбриональный антиген (РЭА) — толстая и прямая кишка. РЭА — маркер онкологических заболеваний, который в небольших количествах присутствует у всех взрослых людей, и значительно повышается при онкологических, а также аутоиммунных и воспалительных заболеваний.
- Копрограмма — общий анализ кала. Это базовое исследование функции пищеварения, дающее представление о физико-химический свойствах кала и компонентах и включениях разного происхождения.
- Анализ кала на скрытую кровь. Позволяет выявить внутреннее кровотечение в отделах желудочно-кишечного тракта.
 При минимальном кровотечении (которое может быть симптомом развития многих заболеваний, включая рак) в образце стула под микроскопом будут видны эритроциты (кровяные тельца), не видимые глазу.
При минимальном кровотечении (которое может быть симптомом развития многих заболеваний, включая рак) в образце стула под микроскопом будут видны эритроциты (кровяные тельца), не видимые глазу. - Анализ кала на дисбактериоз. Определяет состав микрофлоры кишечника, наличие вредных бактерий, а также их восприимчивость к действию антибиотиков.
- Анализы кала на яйца гельминтов, цисты и простейшие. Это два анализа, выявляющие паразитов и глистов, которые инфицируют нижние отделы кишечника и вызывают такие симптомы как диарея и боль.
Стоимость обследования кишечника
| Забор биологического материала | 250 ₽ |
| Клинический анализ крови с лейкоцитарной формулой и СОЭ | 620 ₽ |
| Копрограмма | 560 ₽ |
| Исследование кала на скрытую кровь | 300 ₽ |
| Анализ кала на яйца гельминтов | 380 ₽ |
| Анализ кала на цисты и вегетативные формы простейших | 240 ₽ |
| Раковый эмбриональный антиген (РЭА) — толстая и прямая кишка | 740 ₽ |
| Посев кала на дисбактериоз | 1 500 ₽ |
| Комплексное обследование кишечника | 4 590 ₽ |
Что делать с результатами анализов
С результатами анализов необходимо обратиться к врачу гастроэнтерологу. В большинстве случаев гастроэнтеролог рекомендует более углубленное обследование, необходимое для уточнения диагноза. Это может быть УЗИ органов брюшной полости и эндоскопическое исследование: видеоколоноскопия или ректороманоскопия.
Что является результатом обследования
В результате обследования кишечника и приема гастроэнтеролога вы получите:
- точный диагноз и назначение адекватного лечения
- облегчение симптомов и достижение ремиссии
- рекомендации доктора по образу жизни и питанию.
Почему у нас
- принимают врачи гастроэнтерологи, специализирующиеся именно на болезнях кишечника
- есть все необходимое для обследования — анализы, ультразвуковая диагностика, эндоскопические исследования
- сдавать анализы у нас выгоднее, чем в лабораториях.

Карта сайта
Адреса клиник г. Казань
Адрес: ул. Гаврилова, 1, ост. «Гаврилова» (пр. Ямашева)
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 10, 10а, 18, 33, 35, 35а, 36, 44, 45, 46, 49, 55, 60, 62, 76
Троллейбус: 2, 13
Трамвай: 5, 6
Адрес: ул. Т.Миннуллина, 8а, (Луковского) ост. «Театр кукол»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 1, 2, 31, 37, 47, 74
Троллейбус: 6, 8, 12
Метро: Суконная слобода
Адрес: ул. Сыртлановой, 16, ст. метро Проспект Победы, ост. ул. Сыртлановой (проспект Победы)
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 5, 34, 37, 62 77
Трамвай: 5
Метро: Проспект Победы
Адрес: ул. Назарбаева, 10, ст. метро «Суконная Слобода», ост. «Метро Суконная Слобода»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 1, 4, 25, 43, 71
Метро: Суконная слобода
Адрес: ул. Декабристов, 180, ст. метро «Северный вокзал», ост. «Гагарина»
Пн-Пт: 7. 00-20.00, Сб: 7.30-16.00, Вс: выходной
00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 6, 18, 29, 33, 37, 40, 43, 53, 62, 76, 78, 89
Троллейбус: 13
Трамвай: 1, 6
Метро: Северный вокзал
Адрес: пр. А.Камалеева, 28/9, (жилой комплекс «XXI век»), ост. «Новый ипподром»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Троллейбус: 3
Адрес: Дербышки, ул. Мира, 20, ост. «Магазин Комсомольский», «Гвоздика»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 1, 19, 25, 34, 44, 60, 84
Адрес: ул. Серова, 22/24, ост. «ул. Серова»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 10, 10а
Адрес: ул. Беломорская, 6, ст. метро «Авиастроительная», ост. «ул. Ленинградская»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 6, 18, 33, 37, 40, 42, 43, 53, 60, 78, 89, 93
Троллейбус: 13
Трамвай: 1
Метро: Авиастроительная
Адрес: ул. Закиева, 41а, ост. «Кабельное телевидение»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобус: 5, 18, 30, 31, 34, 45, 46, 62, 63, 77, 89
Троллейбус: 3, 5, 9, 12
Адрес: ул. Кул Гали, 27, ост. «ул. Кул Гали» (ул. Габишева)
Кул Гали, 27, ост. «ул. Кул Гали» (ул. Габишева)
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: выходной
Автобус: 46, 90
Адрес: ул. Рихарда Зорге, 95, м. «Дубравная», ост. «ул. Юлиуса Фучика»
Пн-Пт: 7.00-20.00, Сб: 7.30-16.00, Вс: 8.00-14.00
Автобусы: 5, 18, 30, 31, 33, 34, 45, 68, 74, 77
Троллейбусы: 5, 9, 12
Трамвай: 4
Метро: Дубравная
Функциональный анализ микробиоценоза желудочно– кишечного тракта | Лоранская И.Д., Лаврентьева О.А.
История изучения состава микрофлоры желудочно–кишечного тракта (ЖКТ) началась в 1681 г., когда голландский исследователь Антони Ван Левенгук впервые сообщил о своих наблюдениях относительно бактерий и других микроорганизмов, обнаруженных в человеческих фекалиях, и выдвинул гипотезу о совместном существовании различных видов бактерий в желудочно–кишечном тракте. В 1850 году Луи Пастер развил концепцию о функциональной роли бактерий в ферментационном процессе. Немецкий врач Роберт Кох продолжил исследования в данном направлении и создал методику выделения чистых культур, позволяющую идентифицировать специфичные бактериальные штаммы, что необходимо для разграничения болезнетворных и полезных микроорганизмов. В 1886 г. один из основоположников учения о кишечных инфекциях F. Esherich впервые описал кишечную палочку (Bacterium coli communae). Илья Ильич Мечников в 1888 году, работая в Институте Луи Пастера, утверждал, что в кишечнике человека обитает комплекс микроорганизмов, которые оказывают на организм «аутоинтоксикационный эффект», полагая, что введение в ЖКТ «здравословных» бактерий способно модифицировать действие кишечной микрофлоры и противодействовать интоксикации.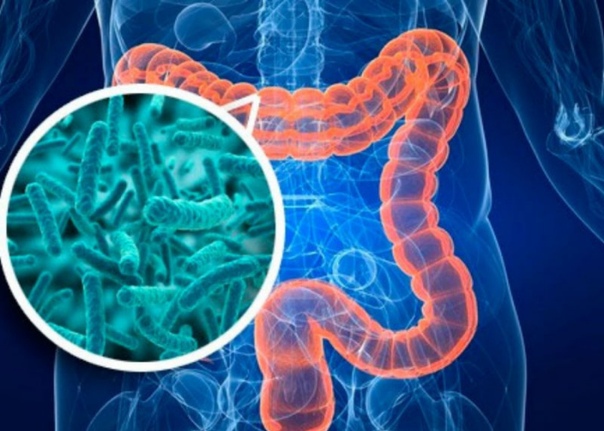 Практическим воплощением идей Мечникова стало применение ацидофильных лактобацилл с терапевтическими целями, начатое в США в 1920–1922 годах. Отечественные исследователи приступили к изучению этого вопроса только в 50–х годах XX века. В 1955 г. Перетц Л.Г. показал, что кишечная палочка здоровых людей является одним из основных представителей нормальной микрофлоры и играет положительную роль благодаря сильным антагонистическим свойствам по отношению к патогенным микробам. Начатые более 300 лет назад исследования состава кишечного микробиоценоза, его нормальной и патологической физиологии и разработка способов положительного влияния на кишечную микрофлору продолжаются и в настоящее время.
Практическим воплощением идей Мечникова стало применение ацидофильных лактобацилл с терапевтическими целями, начатое в США в 1920–1922 годах. Отечественные исследователи приступили к изучению этого вопроса только в 50–х годах XX века. В 1955 г. Перетц Л.Г. показал, что кишечная палочка здоровых людей является одним из основных представителей нормальной микрофлоры и играет положительную роль благодаря сильным антагонистическим свойствам по отношению к патогенным микробам. Начатые более 300 лет назад исследования состава кишечного микробиоценоза, его нормальной и патологической физиологии и разработка способов положительного влияния на кишечную микрофлору продолжаются и в настоящее время.
Основными биотопами являются: желудочно–кишечный тракт (ротовая полость, желудок, тонкая кишка, толстая кишка), кожа, дыхательные пути, урогенитальная система.
Микрофлора ЖКТ является наиболее представительной, ее масса у взрослого человека составляет более 2,5 кг, численность – 1014. Ранее считалось, что в состав микробиоценоза ЖКТ входят 17 семейств, 45 родов, более 500 видов микроорганизмов. С учетом новых данных, полученных при исследовании микрофлоры различных биотопов ЖКТ с помощью молекулярно–генетических методов и метода газожидкостной хромато–масс–спектрометрии общий геном бактерий ЖКТ насчитывает 400 тыс. генов, что в 12 раз превышает размер генома человека. Подвергнута анализу на гомологию секвенированных генов 16S pРНК пристеночная (мукозная) микрофлора 400 различных отделов ЖКТ, полученная при эндоскопическом исследовании различных отделов кишечника добровольцев. В результате исследования показано, что пристеночная и просветная микрофлора включает 395 филогенетически обособленных групп микроорганизмов, из которых 244 являются абсолютно новыми. При этом 80% новых таксонов, выявленных при молекулярно–генетическом исследовании, относятся к некультивируемым микроорганизмам. Большинство из предполагаемых новых филотипов микроорганизмов являются представителями родов Firmicutes и Bacteroides. Общее количество видов приближается к 1500 и требует дальнейшего уточнения.
Общее количество видов приближается к 1500 и требует дальнейшего уточнения.
ЖКТ через систему сфинктеров сообщается с внешней средой окружающего нас мира и одновременно через кишечную стенку – с внутренней средой организма. Благодаря этой особенности в полости ЖКТ создалась собственная среда, которую можно разделить на две отдельные ниши: химус и слизистая оболочка. Пищеварительная система человека взаимодействует с различными бактериями, которые можно обозначить, как «эндотрофную микрофлору кишечного биотопа человека». Эндотрофная микрофлора человека делится на три основные группы. К первой группе относят полезную для человека эубиотическую индигенную или эубиотическую транзиторную микрофлору; ко второй – нейтральные микроорганизмы, постоянно или периодически высевающиеся из кишечника, но не влияющие на жизнедеятельность человека; к третьей – патогенные или потенциально патогенные бактерии («агрессивные популяции»). В микроэкологическом плане желудочно–кишечный биотоп может быть разделен на ярусы (ротовая полость, желудок, отделы кишечника) и микробиотопы (полостной, пристеночный и эпителиальный). Способность к аппликации в пристеночном микробиотопе, т.е. гистадгезивность (свойство фиксироваться и колонизировать ткани) определяют суть транзиторности или индигенности бактерий. Эти признаки, а также принадлежность к эубиотической или агрессивной группе являются основными критериями, характеризующими взаимодействующий с ЖКТ микроорганизм. Эубиотические бактерии участвуют в создании колонизационной резистентности организма, что является уникальным механизмом системы противоинфекционных барьеров. Полостной микробиотоп на протяжении ЖКТ неоднороден, его свойства определяются составом и качеством содержимого того или иного яруса. Ярусы имеют свои анатомические и функциональные особенности, поэтому их содержимое различается по составу веществ, консистенции, рН, скорости перемещения и другим свойствам. Эти свойства определяют качественный и количественный состав адаптированных к ним полостных микробных популяций. Пристеночный микробиотоп является важнейшей структурой, ограничивающей внутреннюю среду организма от внешней. Он представлен слизистыми наложениями (слизистый гель, муциновый гель), гликокаликсом, расположенным над апикальной мембраной энтероцитов и поверхностью самой апикальной мембраны. Пристеночный микробиотоп представляет наибольший интерес с позиции бактериологии, так как именно в нем возникает полезное или вредное для человека взаимодействие с бактериями – то, что мы называем симбиозом. На сегодняшний день известно, что микрофлора слизистой оболочки кишечника существенно отличается от микрофлоры просвета кишечника и каловых масс. Хотя у каждого взрослого человека кишечник населяет определенная комбинация преобладающих видов бактерий, состав микрофлоры может меняться в зависимости от образа жизни, питания и возраста. Сравнительное исследование микрофлоры у взрослых лиц, состоящих в генетическом родстве той или иной степени, выявило, что на состав кишечной микрофлоры генетические факторы влияют больше, чем питание.
Пристеночный микробиотоп является важнейшей структурой, ограничивающей внутреннюю среду организма от внешней. Он представлен слизистыми наложениями (слизистый гель, муциновый гель), гликокаликсом, расположенным над апикальной мембраной энтероцитов и поверхностью самой апикальной мембраны. Пристеночный микробиотоп представляет наибольший интерес с позиции бактериологии, так как именно в нем возникает полезное или вредное для человека взаимодействие с бактериями – то, что мы называем симбиозом. На сегодняшний день известно, что микрофлора слизистой оболочки кишечника существенно отличается от микрофлоры просвета кишечника и каловых масс. Хотя у каждого взрослого человека кишечник населяет определенная комбинация преобладающих видов бактерий, состав микрофлоры может меняться в зависимости от образа жизни, питания и возраста. Сравнительное исследование микрофлоры у взрослых лиц, состоящих в генетическом родстве той или иной степени, выявило, что на состав кишечной микрофлоры генетические факторы влияют больше, чем питание.
Рассмотрим композиции нормальной микрофлоры разных отделов ЖКТ. Ротовая полость и глотка осуществляют предварительную механическую и химическую обработку пищи и дают оценку бактериологической опасности относительно проникающих внутрь человеческого организма бактерий. Слюна является первой пищеварительной жидкостью, обрабатывающей пищевые вещества и воздействующей на проникающую микрофлору. Общее содержание бактерий в слюне вариабельно и в среднем составляет 108 МК/мл. В состав нормальной микрофлоры ротовой полости входят стрептококки, стафилококки, лактобациллы, коринебактерии, большое количество анаэробов. Всего микрофлора рта насчитывает более 200 видов микроорганизмов. На поверхности слизистой в зависимости от применяемых индивидуумом гигиенических средств обнаруживается около 103–105 МК/мм2. Колонизационную резистентность рта осуществляют преимущественно стрептококки (S. salivarus, S. mitis, S. mutans, S. sangius, S. viridans), а также представители кожного и кишечного биотопов. При этом S. salivarus, S. sangius, S. viridans хорошо прилипают к слизистой оболочке и зубному налету. Эти альфа–гемолитические стрептококки, обладающие высокой степенью гистадгезии, сдерживают колонизацию рта грибами рода Сandida и стафилококками. Микрофлора, транзиторно проходящая через пищевод, нестабильна, гистадгезивности к его стенкам не проявляет и характеризуется обилием временно находящихся видов, попадающих из полости рта и глотки. В желудке создаются относительно неблагоприятные условия для бактерий, обусловленные повышенной кислотностью, воздействием протеолитических ферментов, быстрой моторно–эвакуаторной функцией желудка и другими факторами, лимитирующих их рост и размножение. Здесь микроорганизмы содержатся в количестве, не превышающем 102–104 в 1 мл содержимого. Эубиотики в желудке осваивают в основном полостной биотоп, пристеночный микробиотоп для них менее доступен. Основными микроорганизмами, активными в желудочной среде, являются кислотоустойчивые представители рода Lactobacillus, обладающие или не обладающие гистадгезивным отношением к муцину, некоторые виды почвенных бактерий и бифидобактерии. Лактобациллы, несмотря на короткое время пребывания в желудке, способны, кроме антибиотического действия в полости желудка, временно колонизировать пристеночный микробиотоп. В результате совместного действия защитных компонентов основная масса попавших в желудок микроорганизмов погибает. Однако при нарушении работы слизистого и иммунобиологического компонентов некоторые бактерии находят в желудке свой биотоп. Так, за счет факторов патогенности в желудочной полости закрепляется популяция Helicobacter pylori.
При этом S. salivarus, S. sangius, S. viridans хорошо прилипают к слизистой оболочке и зубному налету. Эти альфа–гемолитические стрептококки, обладающие высокой степенью гистадгезии, сдерживают колонизацию рта грибами рода Сandida и стафилококками. Микрофлора, транзиторно проходящая через пищевод, нестабильна, гистадгезивности к его стенкам не проявляет и характеризуется обилием временно находящихся видов, попадающих из полости рта и глотки. В желудке создаются относительно неблагоприятные условия для бактерий, обусловленные повышенной кислотностью, воздействием протеолитических ферментов, быстрой моторно–эвакуаторной функцией желудка и другими факторами, лимитирующих их рост и размножение. Здесь микроорганизмы содержатся в количестве, не превышающем 102–104 в 1 мл содержимого. Эубиотики в желудке осваивают в основном полостной биотоп, пристеночный микробиотоп для них менее доступен. Основными микроорганизмами, активными в желудочной среде, являются кислотоустойчивые представители рода Lactobacillus, обладающие или не обладающие гистадгезивным отношением к муцину, некоторые виды почвенных бактерий и бифидобактерии. Лактобациллы, несмотря на короткое время пребывания в желудке, способны, кроме антибиотического действия в полости желудка, временно колонизировать пристеночный микробиотоп. В результате совместного действия защитных компонентов основная масса попавших в желудок микроорганизмов погибает. Однако при нарушении работы слизистого и иммунобиологического компонентов некоторые бактерии находят в желудке свой биотоп. Так, за счет факторов патогенности в желудочной полости закрепляется популяция Helicobacter pylori.
К основным функциям тонкой кишки относят полостной и пристеночный гидролиз пищи, всасывание, секрецию, а также барьерно–защитную. В последней, кроме химических, ферментативных и механических факторов, значительную роль играет индигенная микрофлора тонкой кишки. Она принимает активное участие в полостном и пристеночном гидролизе, а также в процессах всасывания пищевых веществ. Тонкая кишка является одним из важнейших звеньев, обеспечивающих длительное сохранение эубиотической пристеночной микрофлоры. Существует разница в заселении эубиотической микрофлорой полостного и пристеночного микробиотопов, а также заселении ярусов по длине кишки. Полостной микробиотоп подвержен колебаниям по составу и концентрации микробных популяций, пристеночный микробиотоп имеет сравнительно стабильный гомеостаз. В толще слизистых наложений сохраняются популяции, обладающие гистадгезивными свойствами к муцину. Проксимальный отдел тонкой кишки в норме содержит относительно небольшое количество грамположительной флоры, состоящей главным образом из лактобацилл, стрептококков и грибов. Концентрация микроорганизмов составляет 102–104 на 1 мл кишечного содержимого. По мере приближения к дистальным отделам тонкой кишки общее количество бактерий возрастает до 108 на 1 мл содержимого, одновременно появляются дополнительные виды, включающие энтеробактерии, бактероиды, бифидобактерии.
Тонкая кишка является одним из важнейших звеньев, обеспечивающих длительное сохранение эубиотической пристеночной микрофлоры. Существует разница в заселении эубиотической микрофлорой полостного и пристеночного микробиотопов, а также заселении ярусов по длине кишки. Полостной микробиотоп подвержен колебаниям по составу и концентрации микробных популяций, пристеночный микробиотоп имеет сравнительно стабильный гомеостаз. В толще слизистых наложений сохраняются популяции, обладающие гистадгезивными свойствами к муцину. Проксимальный отдел тонкой кишки в норме содержит относительно небольшое количество грамположительной флоры, состоящей главным образом из лактобацилл, стрептококков и грибов. Концентрация микроорганизмов составляет 102–104 на 1 мл кишечного содержимого. По мере приближения к дистальным отделам тонкой кишки общее количество бактерий возрастает до 108 на 1 мл содержимого, одновременно появляются дополнительные виды, включающие энтеробактерии, бактероиды, бифидобактерии.
Основными функциями толстой кишки являются резервирование и эвакуация химуса, остаточное переваривание пищи, выделение и всасывание воды, всасывание некоторых метаболитов, остаточного питательного субстрата, электролитов и газов, формирование и детоксикация каловых масс, регуляция их выделения, поддержание барьерно–защитных механизмов. Все перечисленные функции выполняются с участием кишечных эубиотических микроорганизмов. Количество микроорганизмов толстой кишки составляет 1010–1012 КоЕ на 1 мл содержимого. На бактерии приходится до 60% каловых масс. На протяжении всей жизни у здорового человека преобладают анаэробные виды бактерий (90–95% всего состава): бифидобактерии, бактероиды, лактобациллы, фузобактерии, эубактерии, вейллонеллы, пептострептококки, клостридии. От 5 до 10% микрофлоры толстой кишки составляют аэробные микроорганизмы: эшерихии, энтерококки, стафилококки, различные виды условно–патогенных энтеробактерий (протей, энтеробактер, цитробактер, серрации и др.), неферментирующие бактерии (псевдомонады, ацинетобактер), дрожжеподобные грибы рода Сandida и др. Анализируя видовой состав микробиоты толстой кишки, необходимо подчеркнуть, что в ее состав, помимо указанных анаэробных и аэробных микроорганизмов, входят представители непатогенных простейших родов и около 10 кишечных вирусов. Два различающихся по анатомо–физиологическим и экологическим характеристикам биотопа – тонкую и толстую кишку отделяет эффективно функционирующий барьер: баугиневая заслонка, которая открывается и закрывается, пропуская содержимое кишечника только в одном направлении, и удерживает обсемененность кишечной трубки в количествах, необходимых здоровому организму. Таким образом, хотя содержание бактерий во рту может быть достаточно высоким – до 106 КоЕ/мл, оно снижается до 0–10 КоЕ/мл в желудке, поднявшись на 101–103 в тощей кишке и 105–106 в дистальных отделах подвздошной кишки, с последующим резким возрастанием количества микробиоты в толстой кишке, достигая уровня 1012 КоЕ/мл в дистальных ее отделах. По мере продвижения содержимого внутри кишечной трубки снижается парциальное давление кислорода и повышается значение рН среды, в связи с чем появляется «этажность» расселения различных видов бактерий по вертикали: выше всего располагаются аэробы, ниже факультативные анаэробы и еще ниже – строгие анаэробы.
Доказано, что микрофлора может влиять на сенсомоторную функцию кишечника в трех направлениях:
1) через конечные продукты бактериального брожения и метаболизма,
2) нейроэндокринные факторы
3) иммунные медиаторы.
Бактериальные пептиды стимулируют энтеральную нервную систему и афферентную иннервацию, а эндотоксины (липополисахариды) могут воздействовать на кишечную моторику. Продукты метаболизма сахаролитических бактерий – короткоцепочечные жирные кислоты (КЖК), такие как бутират, ацетат, пропионат, играют важную роль в поддержании нормальной функции кишечника и могут участвовать в патогенезе желудочно–кишечных заболеваний. КЖК являются важными источниками энергии, необходимыми для колоноцитов. Поддержание анаэробных условий в толстой кишке также осуществляется с помощью микробных метаболитов.
КЖК оказывают влияние на выработку серотонина, мотилина и соматостатина, содержащихся в энтероэндокринных клетках толстой кишки и подвздошной кишки; они являются ключевыми медиаторами кишечной моторики. Микрофлора имеет важное значение в нормальном развитии кишечной иммунной системы и лимфоидной ткани. Значение иммунной системы в регуляции сенсомоторной функции кишки также нельзя недооценивать.
Существуют гистохимические, морфологические, молекулярно–генетические методы исследования микроорганизмов, нагрузочные пробы.
Наиболее распространенным методом является бактериологическое исследование кала. Как правило, количество определяемых показателей колеблется от 14 до 25. Достоинством метода является точная верификация патогенных бактерий. К недостаткам метода относится возможность получения ложноположительных и ложноотрицательных результатов из–за неоднородности выделения микроорганизмов из разных отделов испражнений, трудности культивирования анаэробных микроорганизмов. Кроме того, определяется полостная и транзитная флора, которая доминирует в фекальной флоре, при этом пристеночная флора не оценивается.
Альтернативу бактериологическим исследованиям могут составить хроматографические методы дифференциации микроорганизмов – газожидкостная, ионнообменная и, в частности, газожидкостная хроматография (ГЖХ) в сочетании с масс–спектрометрией (МС) – ГЖХ–МС. Метод ГЖХ–МС основан на определении компонентов бактериальных клеток, появляющихся в результате их естественного отмирания, или атаки компонентов иммунной системы. В качестве маркеров используют минорные липидные компоненты мембран микробов. По их содержанию и количеству можно в течение нескольких часов определить до 170 видов аэробных и анаэробных бактерий и грибов в разных биологических средах.
Разработан и внедряется в практику метод ГЖХ–анализа, основанный на определении КЖК, являющихся метаболитами в основном анаэробных родов микроорганизмов. На основании полученных данных создан метаболический паспорт при эубиозе кишечника. Метод позволяет достаточно быстро и достаточно точно оценить состояние индигенной микрофлоры.
Синдром избыточного бактериального роста в тонкой кишке (СИБР) предполагает аномальный рост (более 105 КОЕ/мл) эндогенных бактерий в тонкой кишке, сходных с теми, что в норме находятся в толстой кишке. Для диагностики СИБР применяют прямые и косвенные методы. Прямой заключается в посеве дуоденального и еюнального содержимого, полученного с помощью стерильного зонда. К косвенному методу можно отнести исследование выделяемого водорода – дыхательный тест. Обоснованием для создания водородного дыхательного теста стал факт того, что в процессе метаболизма углеводов микрофлорой толстой кишки образуется большое количество газов, в том числе водорода. Водородный тест может применяться для ориентировочного представления о степени бактериального обсеменения тонкой кишки. Однако в последнее время появилось мнение, что дыхательный водородный тест позволяет определить лишь ороцекальный транзит бактерий.
В настоящее время широкое распространение получил способ определения видов микроорганизмов с помощью полимеразной цепной реакции (ПЦР). Метод ПЦР разработал еще в 1983 году Кэри Мюллис, за что в 1993 г. он был удостоен Нобелевской премии в области химии. В основу метода ПЦР положено многократное копирование (амплификация) искомого фрагмента ДНК с помощью фермента ДНК–полимеразы. По сравнению с традиционными методами диагностики ПЦР отличается высокой чувствительностью и специфичностью. Он позволяет использовать для диагностики образцы с менее жесткими требованиями к жизнеспособности исследуемых микроорганизмов, чем для исследования микробиологическими методами. Сегодня существует более совершенный, чем «классический», метод ПЦР – с детекцией результатов в режиме реального времени. Этот метод основан на автоматическом измерении уровня флуоресцентного сигнала, увеличивающегося с каждым циклом при положительной реакции ПЦР, что позволяет проводить количественную оценку ДНК исследуемого микроорганизма в биологическом образце.
Эволюция человека и животных проходила при постоянном контакте с миром микробов, в результате чего сформировались тесные взаимоотношения между макро– и микроорганизмами. Влияние микрофлоры ЖКТ на поддержание здоровья человека, его биохимического, метаболического и иммунного равновесия несомненно и доказано большим количеством экспериментальных работ и клинических наблюдений. Ее роль в генезе многих заболеваний продолжают активно изучать (атеросклероз, ожирение, синдром раздраженного кишечника, неспецифические воспалительные заболевания кишечника, целиакия, колоректальный рак и др.). Поэтому проблема коррекции нарушений микрофлоры, по сути, является проблемой сохранения здоровья человека, формирования здорового образа жизни.
Необходимо помнить, что дисбиотические нарушения всегда вторичны. Поэтому устранение причин, лечение основного заболевания, на фоне которого развиваются нарушения микробиоценоза кишечника, является одним из ведущих принципов его коррекции. Наряду с воздействием на основное заболевание и повышением резистентности организма при коррекции дисбиотических нарушений показано: нормализация моторной функции кишечника, применение энтеросорбентов, назначение антибактериальных препаратов, пре– и пробиотиков, синбиотиков.
Указанными свойствами обладает используемый в современной клинической практике Бактистатин® – комплексный препарат природного происхождения, инновационный энтеросорбент с пробиотическим действием.
Препарат Бактистатин® состоит из трех компонентов, взаимно усиливающих действие друг друга. Основой препарата является стерилизованная культуральная жидкость природного микроба Bacillus Subtilis с высокими медико–биологическими свойствами, содержащая пробиотические вещества (лизоцим, бактериоцины, каталазы), ферменты и аминокислоты. Бактерицидное и бактериостатическое влияние на патогенные и условно патогенные микробы обусловлено содержанием пробиотических веществ, синтезируемых в процессе вегетативного роста бактерий B. Subtilis штамма и концентрированием их в культуральной жидкости за время ферментации. Таким образом, пробиотические соединения в составе Бактистатина® обеспечивают восстановление нормальной микрофлоры кишечника, повышают неспецифическую резистентность организма.
Второй компонент – цеолит, природный сорбент, обладающий ионнообменными свойствами. Цеолит способен проявлять сорбционные свойства преимущественно по отношению к соединениям с низкой молекулярной массой (метан, сероводород, аммиак и другие токсические вещества), не вступая в прямое взаимодействие с витаминами, аминокислотами, белками, оставляя их в желудочно–кишечном тракте. Ионы, содержащиеся в организме, могут включаться в кристаллическую структуру минерала, и, наоборот, из минерала организм получает те неорганические элементы, в которых испытывает потребность. Происходит так называемый селективный ионообмен. Цеолиты способствуют нормализации жирового, белкового, углеводного обмена; повышению иммунитета; повышают устойчивость к стрессу; улучшают репродуктивную функцию, функции печеночных клеток; нормализует перистальтику кишечника, ускоряя продвижение содержимого кишечника по пищеварительному тракту.
Также в состав Бактистатина® входит гидролизат соевой муки, который является естественным источником полноценного белка аминокислот, олигосахаридов, обеспечивает максимально благоприятные условия для бесконкурентного роста нормальной флоры и восстановления микробного пейзажа организма.
Бактистатин® особо эффективен для нормализации микрофлоры кишечника при острых и хронических заболеваниях ЖКТ с явлениями дисбактериоза, при дисбактериозах, возникающих при синдроме раздраженной кишки, в результате антибиотикотерапии, после перенесенных кишечных инфекций.
Литература
1. Барановский А.Ю., Кондрашина Э.А. Дисбактериоз и дисбиоз кишечника. – Санкт–Петербург: Питер. – 2000. – С.17
2. Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико–лабораторный синдром: современное состояние проблемы. – М.: Издательская группа «ГЭОТАР–Медиа». – 2007. – С.8–35
3. Григорьев А.В. Желудочно–кишечный тракт как среда обитания бактерий// Раздел 1. – М.: Издательство: ЗАО «СИЛМА». – 2004.– С.5–7, С.16–32
4. Коровина Н.А., Захарова И.Н., Костадинова В.Н. и др. Пребиотики и пробиотики при нарушениях кишечного микробиоценоза у детей. – М.: ИД «Медпрактика–М». – 2004. – С.8–9
5. Ткаченко Е.И., Успенский Ю.П. Питание, микробиоценоз и интеллект человека. – Санкт–Петербург: СпецЛит. – 2006. – С.110–113
6. Урсова Н.И. Современные технологии в коррекции дисбактериозов у детей. – Учебное пособие. – Москва. – 2003. – С.4–6.
7. Eckburg P.B., Bik E.M., Bernstein C.N. et al. Diversity of the human intestinal microbial flora. // Science. 2005. – 308.– Р.1635–1638.
8. Ghoshal U.C., Park H., Gwee K.–A. Bugs and Irritable Bowel Syndrome: The Good, the Bad and Ugly. // J Gastroenterology, Hepatology. – 2010. – 25 (2). – P.244–251.
9. O’Hara А.М., Shanahan F. Обзор. Кишечная микрофлора: анализ терапевтического потенциала. // Клиническая гастроэнтерология и гепатология. Русское издание. – 2008.– Том1, №4: 236–247.
10. Spiller R.С. Review Article: Probiotics and Prebiotics in Irritable Bowel Syndrome // Alimentary Pharmacology & Therapeutics. 2008; 28(4):385–396.
.
Гастроэнтерология
Гастроэнтерология — это раздел медицины, который изучает причины и механизмы развития заболеваний желудочно-кишечного тракта, разрабатывает новые методы диагностики, лечения и профилактики гастроэнтерологических заболеваний.
Если вас беспокоят: боли или дискомфорт в животе различной локализации, вздутие, отрыжка, изжога, горечь во рту, тошнота или рвота, понос или запор — не откладывайте свой визит к врачу гастроэнтерологу.
В целом пищеварительная система очень сложна и весьма уязвима. Наша жизнь наполнена стрессами, неправильным питанием, плохой экологией, быстрым ритмом и спешкой. Все это существенно влияет на состояние желудочно-кишечного тракта, поэтому растет количество пациентов с гастроэнтерологическими заболеваниями. Как говорилось в одном из старинных индийских трактатов, который датирован 1515 годом — «Знай, что болезни бывают от приема плохой пищи или приема еды во время болезни». Часто неэффективное лечение или самолечение способствует переходу болезни в хроническую форму.
Врач гастроэнтеролог проводит диагностику и лечение таких заболеваний, как:
- Гастрит;
- Панкреатит;
- Дисбактериоз кишечника;
- Гастроэзофагеальная рефлюксная болезнь или рефлюкс-эзофагит
- Язвы двенадцатиперстной кишки и желудка;
- Колит;
- Энтерит, энтероколит,
- Холецистит, желчнокаменная болезнь,
- Гепатоз и гепатит,
- Дискинезии желчевыводящих путей,
- Синдром раздраженного кишечника, хронический запор.
- Наиболее часто встречающиеся заболевания желудочно-кишечного тракта:
Гастрит — характеризуется воспалением слизистой оболочки желудка. Ухудшается общее состояние человека, появляются боли, тяжесть в желудке, быстрая утомляемость, слабость. Самолечение в большинстве случаев приводит к хронизации процесса. Очень часто гастрит вызывается бактерией Helicobacter pylori. Только правильно подобранная терапия H.pylori, дает положительные результаты излечения от гастрита, язвенной болезни, достижение стойкой ремиссии этих заболевании на длительное время.
Гастроэзофагеальная рефлюксная болезнь — если вас беспокоит изжога, отрыжка или боли за грудиной обязательно нужно показаться гастроэнтерологу. Нельзя самостоятельно принимать соду, так как её прием ведет к нарушению кислотно-щелочного баланса в крови. Только врач может выявить причины, приводящие к рефлюксу (недостаточность сфинктера в области перехода пищевода в желудок (недостаточность кардии), грыжа пищеводного отверстия диафрагмы) и подобрать правильное лечение, чтобы не допустить таких серьезных осложнений как эрозия и язва пищевода, прободение пищевода.
Панкреатит — это заболевание поджелудочной железы, которое требует безотлагательного лечения и консультации врача-гастроэнтеролога. Осложнения болезни могут угрожать жизни или привести к серьезным последствиям, вплоть до некроза поджелудочной железы и летального исхода.
Дисбактериоз кишечника — это нарушения баланса микрофлоры кишечника. Когда «полезная» флора кишечника уменьшается или исчезает, как следствие — нарушается всасывание питательных веществ. Также, дисбактериоз характеризуется повышенным размножением «вредных» бактерий в кишечнике, которых в норме должно быть мало, вследствие чего возникает метеоризм (вздутие живота) и диарея (понос). Это заболевание встречается очень часто и у взрослых и у детей после приема антибиотиков. Заболевание может сопровождаться: вздутием кишечника, отрыжкой, болью в животе, поносом или запором, кожными и аллергическими проявлениями, ранним старением организма. Даже незначительно выраженный дисбактериоз требует лечения, так как может привести к метаболическим и иммунологическим изменениям в организме.
Язвенная болезнь двенадцатиперстной кишки и желудка — это хронические заболевания, склонные к рецидиву. Часто язва сопровождается появлением болей в подложечной области, слабостью, появлением «черного» стула. В такой период необходимо срочно обратиться к гастроэнтерологу и пройти диагностику, так как язвенная болезнь влечет за собой серьезные осложнения, которые могут угрожать жизни человека — желудочное кровотечение, прободение язвы.
Колит — воспаление и повреждение слизистой оболочки толстого кишечника, который появляется обычно при различных инфекциях, неправильном питании, отравлениях, нарушениях иммунной системы. Его симптомы: боли в животе, запор или понос, сопровождающиеся иногда появлением крови и слизи в кале.
Холецистит характеризуется воспалением желчного пузыря, которое чаще всего возникает вследствие попадания в него патогенных бактерий или развития желчнокаменной болезни. Камни в желчном пузыре долгое время могут не давать о себе знать, но при банальных инфекциях, травмах или погрешностях в диете возникает воспалительный процесс в желчном пузыре. При отсутствии лечения это приводит к гнойному воспалению брюшины, которое требует уже немедленного оперативного вмешательства. Если в течение нескольких часов не будет оказана медицинская помощь и проведена операция могут последовать серьезные осложнения вплоть до летального исхода от перитонита и сепсиса.
Энтерит — это воспалительное заболевание слизистой оболочки тонкого кишечника, которое в запущенной стадии грозит ее изъязвлением. В остром периоде болезни возникают боли в животе, сопровождающиеся тошнотой, рвотой, диареей, головокружением, потерей аппетита, слабостью, иногда повышением температуры. Часто при энтерите в воспалительный процесс вовлекаются желудок и толстая кишка.
Современная диагностика заболеваний желудочно-кишечного тракта позволяет выявить болезни органов пищеварения даже в начальной стадии и включает следующие обследования:
Анализы крови — общий анализ крови; биохимический анализ крови на печеночные ферменты и пробы; показатели пигментного обмена билирубина; ферменты поджелудочной железы; анализ крови на кишечные инфекции; хеликобактер; вирусы; простейших и глистные инвазии.
Анализы кала — копрограмма, анализ кала на скрытую кровь, желчные пигменты; анализ кала на дисбактериоз, на кишечные инфекции, простейших, глисты.
Анализ мочи на желчные пигменты.
Эзофагогастродуоденоскопия — эндоскопическое исследование пищевода, желудка, двенадцатиперстной кишки — дает полную информацию о состоянии слизистой и нарушениях функции пищеварения в верхних отделах желудочно-кишечного тракта. Кроме этого, во время гастроскопии можно получить 100% информацию о наличии у человека в желудке Хеликобактерной инфекции и на ранних стадиях определить онкологические заболевания. Поэтому гастроскопия рекомендована в плане диспансеризации ежегодно (!) всем пациентам старше 45 лет.
Колоноскопия — эндоскопическое исследование слизистой всех отделов толстого кишечника. Колоноскопия позволяет на ранних стадиях выявить дивертикулы, опухоли, воспаление кишечника, обнаружить полипы и провести их эндоскопическое удаление. Как гастроскопия, так и колоноскопия могут по желанию быть выполнены в состоянии «медикаментозного» сна, т. е. под наркозом. Это позволяет легко и безболезненно перенести процедуру.
Ультразвуковое исследование органов брюшной полости — помогает врачу получить точную информацию о нарушениях в структуре и функции печени, желчного пузыря, поджелудочной железы.
Дыхательный уреазный тест на Helicobacter Pylori — метод неинвазивной диагностики Хеликобактерной инфекции по выдыхаемому воздуху. Этот метод очень легко переносится пациентами, так как является быстрым, точным, безопасным и безболезненным методом, который разрешен даже детям и беременным. Он позволяет определить эффективность проведенной противомикробной терапии этой инфекции.
Только опытный врач-гастроэнтеролог, тщательно собрав все жалобы, осмотрев вас объективно, проанализировав ваши анализы и обследования, может создать истинную картину заболевания, назначить эффективную и современную терапию и избавить вас от страданий.
Для записи на прием позвоните по телефону 300-911 или оставьте заявку на нашем сайте. Мы перезвоним Вам в удобное время.
Как предотвратить заболевания желудочно-кишечного тракта — Российская газета
По статистике почти 90 процентов городского населения в той или иной степени страдают от заболеваний желудочно-кишечного тракта.
Длина этого пути, где из пищи извлекаются полезные вещества, у взрослого человека составляет примерно семь метров. И на всем его протяжении — в пищеводе, желудке, кишечнике — нас могут подстерегать неприятности.
Мелочь вредная и полезная
Одно из самых распространенных заболеваний желудка — хронический гастрит. Главную причину медики видят в негативных факторах, которые разрушают слизистую желудка. Это алкоголь, недоброкачественная пища, употребление слишком горячих напитков, аспирина, кислот и щелочей. Но не так давно выяснилось, что гастрит (как, впрочем, и язва) может вызываться нашим крохотным сожителем — микробом под названием «хеликобактер пилори», обитающим в желудке. А это значит, что (как и в случаях других инфекционных заболеваний) гастрит и язва заразны. И могут передаваться от человека к человеку.
Дисбактериоз — тоже нередкая сегодня болезнь. И, что важно, она тянет за собой и другие недуги. И опять дело в живой мелочи. Дело в том, что в нашем кишечнике обитают полезные бактерии, без которых процесс пищеварения просто не состоялся бы. Но прием антибиотиков (или иные причины) могут привести к изменениям нормального состава микрофлоры . А в результате нарушаются процессы пищеварения. Плохо усваиваются питательные вещества, витамины… Дефицит витамина РР вызывает раздражительность, неуравновешенность, подавленное настроение… Плохое усвоение витамина В2 характеризуется выпадением волос, изменением формы ногтей, заедами, стоматитом, дерматитом крыльев носа… Нехватка витаминов B1 и В6 приводит к приступам головной боли, слабости, атонии кишечника, дистрофическим изменениям в миокарде…
Всех последствий дисбактериоза и не перечислить. Ведь от него в первую очередь страдает иммунитет — главный страж здоровья нашего организма.
Когда следует насторожиться?
Первый тревожный сигнал, конечно, боль. Она может быть острой или тупой, схваткообразной или, напротив, ноющей.
Кроме боли для заболеваний ЖКТ характерны и другие признаки:
— неприятные ощущения в животе, например, чувство распирания и тяжести, на протяжении длительного времени;
— тошнота, изжога или горечь во рту;
— снижение аппетита, отвращение к каким-либо продуктам, особенно к мясу;
— неестественная жажда;
— появление налета на языке;
— повышенное газообразование;
— неприятный запах изо рта;
— повышенное слюноотделение;
— рвота «кофейной гущей» или с кровью;
— выделение крови из прямой кишки;
— расстройство стула длительностью свыше нескольких недель;
— чередование запоров и поносов;
— значительное снижение массы тела;
— явления анемии (малокровия) — слабость, повышенная утомляемость, головокружение;
— длительное повышение температуры тела.
Практически любой из этих симптомов, а тем более их сочетание означает, что нужно срочно обратиться к врачу. Самолечение недопустимо. Именно из-за таких самодеятельных попыток, как правило, болезнь переходит в хроническую форму. И тогда справиться с ней очень трудно. Только врач после тщательного обследования может определить, какая именно патология вызывает те или иные симптомы, которые, кстати, могут быть схожими при самых различных заболеваниях ЖКТ: гастрите, язвенной болезни желудка и двенадцатиперстной кишки, желчнокаменной болезни, синдроме раздраженного кишечника, дисбактериозе.
Все начинается с еды
Но какое бы лечение ни назначил врач, все может оказаться бесполезным, если не соблюдать определенную диету. Ведь наш главный «котел для пищи» часто помогает спасти сама еда.
Прежде всего надо отказаться от еды всухомятку, от острой, соленой, копченой и любой другой трудноперевариваемой пищи, а также не допускать переедания, однообразного неполноценного питания.
Вредны длительные перерывы в еде, есть лучше чаше — небольшими порциями.
Особое внимание следует обратить на температуру пищи. Расстройства органов пищеварения вызывают и очень холодные, и чрезмерно горячие еда и напитки.
Исключите продукты и блюда, усиливающие секрецию органов пищеварения, процессы брожения и гниения в кишечнике. Ну и само собой тем, кто страдает от заболеваний ЖКТ, непременно надо отказаться от алкоголя и табака.
Желудок в цифрах
— 0,5 литра — объем пустого желудка, который после принятия пищи может растянуться от одного до четырех литров;
— 2 — 4 часа тратит желудок на переваривание обеда, затем пища попадает в тонкую кишку, где пищеварение продолжается еще 4 — 6 часов. Затем остатки идут в толстую кишку и могут оставаться там еще 15 часов;
— 3 — 4 дня — срок, за который желудок полностью меняет свою оболочку. Без этого желудочный сок просто растворил бы наш главный пищеварительный орган;
— 5 стаканов желудочного сока вырабатывает в течение суток желудок взрослого человека;
— 50% россиян страдают гастритом;
— 100 желез, вырабатывающих пищеварительные ферменты, умещаются на одном квадратном сантиметре слизистой оболочки желудка;
— 22 000 килограммов пищи в среднем переваривает человеческий желудок в течение жизни;
— 5 000 000 тончайших ворсинок, через которые идет всасывание питательных веществ, расположено в тонкой кишке.
Временной анализ выявляет индивидуальные и общие основные симптомы и связь с кишечными симптомами
Аннотация
Фон
В то время как наши знания о кишечной микробиоте во время болезни накапливаются, основная информация о микробиоте здоровых людей все еще недостаточна. Целью этого исследования было охарактеризовать кишечную микробиоту здоровых взрослых и, в частности, рассмотреть ее временную стабильность, основную микробиоту и связь с кишечными симптомами.Мы провели продольное исследование, наблюдая за набором из 15 здоровых финских субъектов в течение семи недель и регулярно оценивая их кишечные бактерии и археи с помощью филогенетического микрочипа кишечника человека (HIT) в сочетании с анализами qPCR. Восприятие состояния здоровья и возникновение кишечных симптомов регистрировалось с помощью вопросника в каждой точке отбора проб.
Основные результаты
Наблюдалась высокая общая временная стабильность микробиоты. У пяти субъектов наблюдалась преходящая дестабилизация микробиоты, которая коррелировала не только с приемом антибиотиков, но также с поездками за границу и временным заболеванием, расширяя известные до сих пор факторы, влияющие на микробиоту кишечника.Мы выявили значительную корреляцию между микробиотой и общими кишечными симптомами, включая боль в животе и вздутие живота. Самым поразительным открытием была обратная корреляция между бифидобактериями и болью в животе: у субъектов, которые испытывали боль, было в пять раз меньше бифидобактерий по сравнению с теми, кто не болел. Наконец, новый вычислительный подход был использован для определения общей основной микробиоты, подчеркнув роль глубины анализа в обнаружении филогенетического ядра и оценке его размера.Углубленный анализ показал, что мы разделяем значительное количество наших кишечных филотипов, но, поскольку они представляют собой сильно изменяющиеся пропорции всего сообщества, многие из них часто остаются незамеченными.
Выводы / Значение
Был проведен глобальный анализ микробиоты с высоким разрешением для определения временной стабильности, связи с кишечными симптомами, а также индивидуальной и общей основной микробиоты у здоровых взрослых. Полученные данные предоставляют новые подходы к определению здоровья кишечника и дальнейшей характеристике микробных сообществ, населяющих кишечник человека.
Образец цитирования: Jalanka-Tuovinen J, Salonen A, Nikkilä J, Immonen O, Kekkonen R, Lahti L, et al. (2011) Кишечная микробиота у здоровых взрослых: временной анализ выявляет индивидуальный и общий стержень и связь с кишечными симптомами. PLoS ONE 6 (7):
e23035.
https://doi.org/10.1371/journal.pone.0023035
Редактор: Стефан Бересвилл, Медицинский университет Шарите, Берлин, Германия
Поступила: 12 апреля 2011 г .; Принята к печати: 4 июля 2011 г .; Опубликован: 28 июля 2011 г.
Авторские права: © 2011 Jalanka-Tuovinen et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа финансировалась Финским агентством финансирования технологий и инноваций (TEKES; номер гранта 40274/06). http://www.tekes.fi/en/community/Home/351/Home/473. Один из авторов (RAK) работает в коммерческой компании (Valio Ltd) и внес свой вклад в дизайн исследования и сбор образцов.Финансирующие организации не играли никакой роли в сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Один из авторов (RAK) работает в коммерческой компании (Valio Ltd). Это не меняет приверженности авторов всем политикам PLoS ONE по обмену данными и материалами, и этот факт не повлиял и не ограничил содержание данного документа.
Введение
После рождения наш желудочно-кишечный тракт (ЖКТ) заселен множеством микробов, в совокупности называемых (ЖКТ) микробиотой, которые развивают интимные взаимодействия с нашим телом и способствуют нашему здоровью и благополучию [1].Измененная микробиота желудочно-кишечного тракта была обнаружена не только при аберрациях кишечника, таких как воспалительные заболевания кишечника [2] и более умеренный синдром раздраженного кишечника (СРК) [3], [4], но также и при системных заболеваниях, включая диабет 2 типа и другие метаболические заболевания [ 5], [6]. Из-за значимости для здоровья микробиоты ЖКТ, характеристика ее разнообразия и функций активно продолжается с помощью недавно разработанных молекулярных высокопроизводительных технологий, таких как технология следующего поколения секвенирования ампликонов 16S рРНК и филогенетических микрочипов [7], [8].
В нескольких исследованиях была предпринята попытка описать нормальную микробиоту желудочно-кишечного тракта у здоровых людей, но из-за сильных индивидуальных различий, методологий измерения с низким разрешением и ограниченного количества образцов эта задача является сложной. Хозяин-специфичность и относительная временная стабильность микробиоты GI были хорошо установлены с использованием молекулярных методов [9] — [14]. Временная стабильность общей микробиоты предполагает существование отдельного ядра, состоящего из микробов, которые сохраняются в организме человека с течением времени [7].Временная стабильность также может отражать устойчивость экосистемы; даже сильные возмущения, такие как антибиотики, имеют в основном краткосрочное воздействие на доминирующую микробиоту [15] — [17]. Имеются данные об отрицательной корреляции между временным интервалом и сходством микробиоты внутри индивидуума уже в месячной шкале [13], [18], что, возможно, отражает кумулятивный эффект нарушений окружающей среды.
Возникновение кишечных симптомов и их возможное влияние на качество жизни у здоровых людей в значительной степени неизвестно.По данным американского исследования, почти половина населения в целом сообщила об одном или нескольких кишечных симптомах в течение одного месяца, наиболее частыми жалобами были диарея или жидкий стул, боль или дискомфорт в животе, вздутие живота или вздутие живота [19]. Высокая распространенность кишечных проблем у здоровых людей предполагает их существенное влияние на общее самочувствие. Соответственно, у пациентов с СРК, страдающих различными кишечными симптомами, качество жизни значительно ухудшается по сравнению с населением в целом [20], [21].Качество жизни, связанное со здоровьем (HRQoL), можно измерить с помощью проверенных вопросников, которые оценивают общее, психологическое и социальное благополучие субъекта [22]. Особенно актуально для появляющейся междисциплинарной области исследований здоровья кишечника [23] выяснить, в какой степени кишечные симптомы здоровых людей ухудшают качество их жизни и связано ли возникновение кишечных симптомов с составом микробиоты ЖКТ.
Фундаментальный вопрос, касающийся характеристики микробиоты GI, — это существование общей основной микробиоты, которую мы все можем разделить.Представленные до сих пор исследования этой общей основной микробиоты ЖКТ основаны на анализе инвентаризаций последовательностей гена 16S рРНК [12], [14], [24] — [27] или филогенетическом анализе микрочипов [13]. Большинство исследований указывают лишь на небольшое филогенетическое совпадение между людьми. Генофонд микробиоты желудочно-кишечного тракта, в свою очередь, кажется консервативным у людей, что указывает на функциональную избыточность экосистемы [8], [12]. Тем не менее, различная численность между видами до сих пор игнорировалась, несмотря на ее решающее влияние на возможность обнаружения конкретного вида на заданной глубине анализа и, следовательно, на распространение общих бактерий.Было показано, что увеличение глубины секвенирования заметно увеличивает размер ядра, поскольку это привело к охвату тех филотипов, которые имели низкую численность у некоторых особей [8]. Трудно сравнивать существующие общие базовые исследования, поскольку количество субъектов исследования варьируется, их состояние здоровья не определено, а требуемая распространенность для основных видов не определена [8], [12], [24] ] . Кроме того, на результаты влияют методологические аспекты, включая методы выделения ДНК [28], [29], выбор гипервариабельной области 16S рРНК [12], охват выбранных праймеров, глубина анализа [8] , [25], филогенетическое назначение и пороговые значения [30], а также выбранный конвейер биоинформатики [31].Вследствие разнообразия настроек исследования в настоящее время нет единого мнения о размере и составе общей основной микробиоты ЖКТ.
Настоящее исследование расширяет существующую концепцию временной динамики микробиоты в целом и ее отдельных членов, основываясь на частом отборе проб и всестороннем анализе микробиоты с филогенетическим микрочипом. Кроме того, мы впервые анализируем, насколько нам известно, взаимосвязь между кишечной микробиотой и кишечными симптомами у здоровых взрослых.Мы заметили, что обилие нескольких таксонов связано с кишечными симптомами, включая боль в животе и вздутие живота. Мы также добавляем новый взгляд на характеристику общей основной микробиоты. Мы использовали технологию, не зависящую от секвенирования, и новый вычислительный подход, который не ограничивается префиксными критериями численности или распространенности филотипов, а вместо этого изучает, как эти аналитические параметры влияют на итоговый размер ядра. Наши результаты подчеркивают влияние глубины анализа и предполагают, что при охвате также второстепенной микробиоты значительная часть кишечных филотипов, по-видимому, разделяется между людьми.
Результаты
Определение состояния здоровья
Для наблюдения за здоровьем субъектов мы попросили участников записывать их общее, кишечное и эмоциональное состояние здоровья в каждой точке отбора проб фекалий. Чтобы сосредоточиться на здоровых, бескомпромиссных субъектах и исключить потенциально смешанные образцы из дальнейшего анализа, мы рассчитали показатели качества жизни HR и использовали их параллельно с исходной информацией для классификации участников (таблица 1). Из 15 участников девять субъектов были признаны здоровыми на основании их высокого общего показателя здоровья, сопоставимого с финскими эталонными значениями [32], высокого (> 90) показателя здоровья ЖКТ и отсутствия каких-либо побочных эффектов в течение периода исследования.Остальные субъекты считались скомпрометированными: субъект 9 получал лечение антибиотиками, а субъекты 2 и 4 страдали значительными кишечными симптомами (вздутие живота, запор и боль в животе), которые значительно снижали их показатели здоровья желудочно-кишечного тракта по сравнению с таковыми у здоровых (t-тест p -значение <0,05) и отрицательно повлияло на их общее восприятие здоровья (Таблица 1). Остальные три субъекта были классифицированы как скомпрометированные на основании комбинации исследовательского анализа данных HITChip и справочной информации (см. Следующий раздел).
Сравнительный анализ микробиоты кишечника субъектов с течением времени
Чтобы получить обзор сходства общей микробиоты ЖКТ между всеми участниками исследования, мы неконтролируемо сгруппировали предварительно обработанные профили HITChip (см. Методы и рисунок S1), используя иерархическую кластеризацию с методом корреляционного расстояния (рисунок 1). Наибольшие различия в профилях микробиоты были межиндивидуальными различиями (средняя межиндивидуальная корреляция Пирсона; r = 0.78, стандартное отклонение; ± 0,04). Все образцы сгруппированы индивидуально (рис. 1), и наблюдалась высокая общая стабильность микробиоты индивидуумов (среднее внутри индивидуальное r = 0,96, ± 0,02 для всех временных точек).
Рис. 1. Иерархическая кластеризация профилей HITChip 15 субъектов и их шести временных точек.
Тематическая кластеризация выделена прямоугольниками, а временные изменения отображаются с переменной длиной ветвей. Красная вертикальная линия проведена при корреляции Пирсона, равной 0.925, ниже которого сходство внутри индивидуальной выборки было обнаружено только у пяти нестабильных субъектов (5,6,8,9 и 11), обсуждаемых в тексте.
https://doi.org/10.1371/journal.pone.0023035.g001
Несмотря на общую стабильность, мы обнаружили существенные вариации во временной динамике микробиоты субъектов, что визуализировалось по разной длине ветвей в дереве кластеризации. Субъект 9 находился на курсе антибиотиков во время сбора четвертой пробы, которая четко отделилась от других проб (рис. 1).Кроме того, предыдущий образец, взятый двумя неделями ранее, имел глубокие разветвления на дендрограмме, подразумевая отчетливый профиль микробиоты. В то время субъект не принимал лекарства, но был болен, и через несколько дней у него был диагностирован стрептококковый фарингит. Помимо лечения антибиотиками, мы не наблюдали корреляции между составом или стабильностью микробиоты и зарегистрированным лекарством (субъекты 1, 3, 7 и 11 регулярно получали гормоны щитовидной железы или эстрогена или лечение гипертонии). Уменьшение временной стабильности также наблюдалось у субъектов 5, 6, 8 и 11 (Рисунок 1).Для всех этих субъектов, за исключением субъекта 5, снижение стабильности можно объяснить в свете фоновой информации. Субъекты 6, 8 и 11 имели записи о путешествиях в течение первых недель испытания, проезжая через разные часовые пояса в диапазоне от 1 до 7 часов. Сходство между образцами, взятыми до и после путешествия, было статистически значимо ниже, чем между образцами, взятыми через две-четыре недели после путешествия (r = 0,90, ± 0,02 и 0,96, ± 0,02, соответственно; р-значение t-критерия <0.05) (Рисунок S2). Соответственно, путешественники показали значительно более низкую внутрииндивидуальную стабильность микробиоты желудочно-кишечного тракта, чем девять здоровых субъектов (r = 0,93 ± 0,01 и 0,96, ± 0,02, соответственно; t-критерий p-значение <0,05), что позволяет предположить, что микробиота желудочно-кишечного тракта была пострадали от путешествия. Поэтому, хотя путешественники были здоровы, мы классифицировали их в этом контексте как скомпрометированных вместе с тремя субъектами, пострадавшими от лечения антибиотиками или стойкими кишечными симптомами (Таблица 1). Причина такой классификации заключалась в том, чтобы сосредоточить анализ состава микробиоты на тех здоровых субъектах, для которых мы не наблюдали никаких прослеживаемых дестабилизаторов.
Композиционный анализ микробиоты
Микробиота желудочно-кишечного тракта девяти здоровых субъектов без компромиссов была подробно проанализирована с использованием интенсивности сигналов HITChip видоподобных таксонов, которые мы далее называем филотипами (филогения уровня 3 в Методиках и [13]). Мы обнаружили в среднем 470 филотипов на каждого субъекта, что составляет 68,4% от общего числа филотипов, прошедших порог сигнала (Рисунок S1). Наиболее многочисленный тип среди субъектов исследования состоял из Firmicutes с вкладом более 80% в общую микробиоту, за которыми следовали в среднем 10% Bacteroidetes и 1.5% актинобактерий (рис. 2). Были обнаружены веррукомикробия и протеобактерии с пропорциональной долей менее 1% (данные не показаны). Как и ожидалось, наиболее многочисленными Firmicutes были члены кластера Clostridium XIVa и кластера Clostridium IV, составляя в среднем 40% и 35% от общей микробиоты, соответственно.
Рисунок 2. Состав микробиоты испытуемых.
Относительная численность филотипов, составляющих более 0,5% от общего сигнала HITChip, была суммирована до уровня филума, за исключением Firmicutes, которые суммировались до уровня класса или кластера Clostridium (левая ось y).Количественное определение метаногенов на основе КПЦР показано на правой оси ординат.
https://doi.org/10.1371/journal.pone.0023035.g002
На основании Methanobrevibacter –специфической количественной ПЦР (кПЦР) кишечные метаногены присутствовали у 80% пациентов (12/15). У одного субъекта (субъект 2; рис. 2) метаногены были обнаружены только в один момент времени, в то время как у других 11 носителей они были обнаружены во все моменты времени. Содержание метаногенов варьировалось между носителями более двух порядков, начиная с log10 до 7.От 1 до 10,2 г-1 фекалий. Относительную долю метаногенных архей в общей микробиоте ЖКТ определяли по соотношению числа копий гена 16S рРНК метаногенов и всех бактерий. Доля метаногенов была ниже 1% в большинстве образцов, в то время как у субъекта 14 метаногены составляли 1–5% от всего сообщества в разные моменты времени.
Временная изменчивость здоровой микробиоты и отдельного ядра
Мы проанализировали влияние времени на изменение микробиоты у девяти здоровых субъектов, определив сходство профилей HITChip между образцами внутри индивидуума.Сходство определялось коэффициентом корреляции, рассчитанным для всех возможных временных интервалов от одной до семи недель. Средние внутрииндивидуальные корреляции Пирсона варьировались от 0,96 (± 0,02; интервал в одну неделю) до 0,95 (± 0,02; интервал в семь недель), показывая лишь небольшое, несущественное снижение сходства микробиоты со временем. Чтобы обратиться к индивидуальному ядру, состоящему из микробов, которые сохраняются с течением времени, мы определили временную изменчивость, характерную для таксона, путем расчета коэффициента вариации (CoV) внутри субъекта для каждого филотипа.CoV варьировались от 0,83% (некультивируемая Ruminococcus callidus -подобная бактерия) до 46,1% (филотип в некультивируемых Clostridiales) в среднем 6,3% (± 1,1%), что подтверждает высокую общую стабильность. Среди 50 наиболее стабильных таксонов на уровне рода на одного субъекта наиболее распространенными статистически обогащенными группами на уровне рода были Ruminococcus obeum и его родственники ( и отн. ), связанные с недавно переименованным родом Blautia [33] с средний CoV 3.7% и Clostridium symbiosum et rel. со средним значением CoV 4,4% (Таблица S1). Никакой другой стабильный таксон на уровне рода не был общим для> 50% здоровых субъектов, что указывает на предметную специфичность стабильных видов, то есть индивидуальной основной микробиоты. Точно так же мы определили 50 статистически значимых, наиболее нестабильных во времени филотипов для каждого здорового субъекта (таблица S2). Наиболее распространенными нестабильными родоподобными таксонами были некультивируемые Clostridiales и Bacteroides vulgatus et rel. (CoV 9,9%), но даже они были общими для нескольких человек. Не только общность, но и фактические CoV нестабильных групп имели большую межиндивидуальную вариабельность, чем стабильные, что указывает на то, что ни одна группа на уровне рода не была в целом нестабильной. Немногочисленные родоподобные группы, в том числе F. prausnitzii et rel. , были в верхнем списке как стабильных, так и нестабильных таксонов (таблицы S1 и S2), что подчеркивает большие индивидуальные вариации во временном поведении этих таксонов. Напротив, метаногенные археи оказались временно очень стабильными среди носителей, поскольку внутрииндивидуальные CoV, рассчитанные на основе данных qPCR, были ограничены диапазоном от 1% до 6%.
Корреляция между кишечными симптомами и микробиотой ЖКТ
Несмотря на хорошее общее состояние здоровья участников, только один из 15 субъектов не испытывал никаких кишечных жалоб в течение периода исследования (субъект 1; Таблица 1). Тем не менее, случайные и легкие кишечные проблемы преобладали в ответах, поскольку только у двух испытуемых показатель здоровья кишечника был ниже 90 из 100 (Таблица 1). Чтобы обнаружить бактерии, связанные со специфическими кишечными симптомами, мы коррелировали показатели HRQoL-опросника и микробиоту, используя данные HITChip от всех 15 субъектов.Мы смогли идентифицировать 170 филотипов, которые статистически значимо коррелировали (q <0,005) с 14 вопросами HRQoL, связанными с кишечными симптомами (рис. 3). Наиболее часто значимые корреляции обнаруживались с общим кишечным дискомфортом, острой потребностью в дефекации, переполнением после еды и болью в животе. Около половины (53%) из 170 филотипов отрицательно коррелировали с симптомами, показывая большее количество при отсутствии симптомов. Отрицательно коррелирующие родоподобные таксоны включали Bifidobacteria, R.obeum et rel. , Streptococcus bovis et rel. , Clostridium difficile et rel. (в основном из-за непатогенной Clostridium irregularis), и руминококков. Другая половина показала положительную корреляцию с наблюдаемыми симптомами, так что интенсивность зонда была выше, когда симптомы возникли. Положительно коррелирующие филотипы представлены в основном членами кластеров Clostridium IV и XIVa, среди которых некультивируемые представители F. prausnitzii et rel. и C. symbiosum et rel. были наиболее преобладающими группами.
Рис. 3. Тепловая карта корреляции профилей микробиоты и кишечных симптомов.
Тепловая карта визуализирует все значимые (q-значение <0,005) корреляции Спирмена между кишечными симптомами и численностью бактериальных филотипов, измеренной HITChip. Каждая строка представляет один филотип, присвоения которого на уровне рода перечислены под строками или посередине, если несколько строк относятся к одной и той же группе на уровне рода.Отрицательные корреляции между симптомами обозначены красным цветом, а положительные - желтым; несущественные корреляции показаны серым цветом.
https://doi.org/10.1371/journal.pone.0023035.g003
Далее мы стремились определить бактерии, связанные с симптомами, которые наиболее часто наблюдались в нашем исследовании, а именно вздутие живота (31 жалоба от 8 участников) и брюшная полость. боль (28 жалоб от 8 человек). Что касается вздутия живота, тяжесть зарегистрированных жалоб варьировалась от сильного дискомфорта (2 записи) до легких симптомов (23 записи).Несколько некультивируемых филотипов из кластеров Clostridium IV и XIVa имели статистически значимую положительную корреляцию с вздутием живота (Таблица S3). Обилие филотипов в пределах Anaerotruncus colihominis et rel., Ruminococcus callidus и Lachnospira pectinoschiza et rel. были более чем в десять раз выше, когда было зарегистрировано вздутие живота.
Субъекты испытывали боль в животе в различной степени, так что тяжесть зарегистрированных жалоб варьировалась от очень сильного нарушения (1 запись) до легких симптомов (20 записей).Самым поразительным открытием, связанным с болью в животе, была ее отрицательная корреляция с численностью бифидобактерий (r = -0,45, ± 0,03; таблица S4 и рисунок 3). Большинство филотипов Bifidobacterium , которые были выше предела обнаружения (14/21), имели статистически значимую (q≤0,02) отрицательную корреляцию с болью в животе. У субъектов, которые испытывали боль, было более чем в пять раз (в среднем 5,4, ± 1,3) меньше бифидобактерий по сравнению с субъектами, у которых не было зарегистрированной боли (Рисунок 4A).Более того, родоспецифическая кПЦР, охватывающая большинство культивируемых представителей этой группы, выявила статистически значимое различие и двукратное изменение (критерий Вилкоксона, p <0,05) в количестве бифидобактерий в соответствии со статусом симптомов (рис. 4B).
Рисунок 4. Количественное определение Bidifobacteria в отношении боли в животе.
Образцы были разделены на две группы: с сопутствующей болью в животе и без нее, и численность бифидобактерий в каждой группе определялась с использованием A. HITChip и B. КПЦР. Разница между группами была статистически значимой (q≤0,02 для A; p <0,05 для B). Прямоугольник простирается от 25-го до 75-го процентиля с линией на медиане; усы простираются до самого высокого и самого низкого значений.
https://doi.org/10.1371/journal.pone.0023035.g004
Помимо Bifidobacteria, один филотип в пределах R. lactaris et rel. , Clostridium cluster IV, было значительно снижено в образцах, связанных с болью (Таблица S4).Среди положительных корреляций, некультивируемые, потенциально патогенные филотипы в составе некультивируемых Clostridiales II, Anaerotruncus colihominis et rel. Значения и R. callidus, были увеличены более чем в десять раз при регистрации боли (Таблица S4). C. symbiosum и некультивируемые филотипы, относящиеся к F. prausnitzii et rel. были более многочисленны у субъектов, испытывающих сытость после еды (рис. 3). Положительная корреляция между сытостью после приема пищи и численностью F.prausnitzii был подтвержден с помощью количественной ПЦР (данные не показаны). Оценка симптомов вздутия живота и боли в животе сильно коррелировала (р = 0,72). Четыре группы клостридий на уровне рода были достоверно коррелированы с обоими симптомами, хотя и в неоднородном направлении (таблицы S3 и S4).
Общая микробиота ядра
Углубленный филогенетический анализ микроматрицы предоставил возможность изучить общую базовую микробиоту, потенциально разделяемую между здоровыми людьми.Большинство нынешних усилий по определению и определению микробного ядра сосредоточено на наличии и отсутствии филотипов у определенной части исследуемых субъектов. Вместо использования произвольных критериев численности и распространенности филотипов мы обратились к общей основной микробиоте, используя новый подход, который использует регулируемые значения этих двух параметров. Принимая во внимание относительную численность, мы использовали полный динамический диапазон микрочипа HITChip и включили филотипы, которые в самом низком значении составляли всего 0.02% от оцененного общего сигнала, в то время как наиболее доминирующие филотипы имели относительную численность более 5%. Что касается распространенности, мы учли все возможности в диапазоне 0–100% (n = 0–9). Использовались усредненные данные HITChip по шести временным точкам на человека. В результате размер общего ядра — это не одно число, а непрерывный диапазон от нуля до сотен, в зависимости от выбранных значений численности и распространенности, как показано на перспективном графике (рис. 5A). При распространенности 50% только 10 филотипов оставались в общем ядре, когда минимальная численность была установлена на уровне 0.5% от расчетного общего сигнала. С другой стороны, когда были приняты все филотипы выше предела обнаружения, изменение распространенности с 50% до 100% оказало гораздо меньшее влияние на количество основных филотипов. Другими словами, количество общих филотипов резко уменьшилось, когда филотип должен был присутствовать в большом количестве во всех образцах, что подчеркивает вклад бактерий с низким содержанием в ядре.
Рис. 5. Определение общей основной микробиоты.
A. Перспективный график используется для визуализации того, как количество филотипов в общем ядре является функцией выбранной численности и распространенности. Светло-серым цветом обозначена область, где ни один филотип не соответствовал заданным критериям. B. Общая основная микробиота здоровых людей. Ось ординат представляет собой диапазон общего количества филотипов, образующих общее ядро, у девяти здоровых субъектов. Линия визуализирует, как количество филотипов зависит от выбранного процентиля численности и как оно резко уменьшается, когда филотипы с наименьшей численностью исключены.Список показывает сводку филотипов на уровне филумов, которые внесли свой вклад с относительной численностью более 0,03%. C. Общие основные филотипы, обобщенные до таксонов на уровне родов. Коробчатые диаграммы визуализируют внутрииндивидуальные вариации численности основных таксонов. Bacteroides fragilis et rel. и бифидобактерии (два крайних левых прямоугольника) визуализируются для справочных целей. Эти таксоны не входили в общее ядро из-за их большой внутри- и межиндивидуальной изменчивости.Подробные сведения о коробчатой диаграмме см. В легенде к рис. 4.
https://doi.org/10.1371/journal.pone.0023035.g005
Включив все филотипы выше порогового значения сигнала у всех девяти здоровых субъектов, мы обнаружили 288 филотипов в общем ядре (рисунок 5B и таблица S5). . 288 филотипов представляют 41,9% всех обнаруженных филотипов, что указывает на высокую степень филогенетического совпадения между индивидуумами. К точным номерам таксонов следует относиться с осторожностью, поскольку они подвержены возникающему шуму. E.грамм. от непреднамеренной перекрестной гибридизации с последовательностями, не являющимися мишенями, и различий в аффинности связывания зонда. Чтобы оценить такой шум и исключить возможность того, что связанные эффекты на уровне зонда заметно повлияли бы на общий состав и размер керна, мы использовали алгоритм робастного вероятностного усреднения, разработанный для анализа характеристик зонда [34]. Для подавляющего большинства общих основных филотипов (234; 81%) корреляция между вероятностным и стандартным методами была> 0.9, что указывает на низкую долю потенциально ложноположительных результатов среди обнаруженных основных филотипов. Предварительная обработка не повлияла на филогенетический состав ядра, поскольку все 22 филотипа, обнаруженные с помощью наиболее ненадежных зондов (r <0,8), были отнесены к разнообразным и полифилогенным кластерам Clostridium XIVa и IV, которые значительно доминировали в ядре с 145 и 111 филотипами, соответственно. (Таблица S5). Большинство основных организмов были некультивируемыми филотипами, принадлежащими к 43 различным родоподобным таксонам из пяти типов (Рисунки 5B и 5C).Наиболее представлены группы R. obeum et rel. (37 филотипов), F. prausntizii et rel. (25 филотипов) и O. guillermondii et rel. (20 филотипов). Bacteroidetes, Actinobacteria, Proteobacteria и Verrucomicrobia также были представлены в ядре (рис. 5 и таблица S5) в соответствии с их установленной средой обитания в кишечнике человека. Численность большинства основных филотипов среди здоровых людей сильно варьировала (рис. 5C).
Временная стабильность обычных стержневых бактерий
В дополнение к изучению временной динамики общей микробиоты, мы определили временную изменчивость общих основных филотипов, определенных выше.Мы обнаружили, что внутрииндивидуальный CoV основных филотипов колеблется от 3,3% до 23%, что указывает на более высокую стабильность основных филотипов по сравнению со всеми обнаруженными филотипами, которые обсуждались выше. Подавляющее большинство (70%) основных филотипов колебалось менее 10% во время исследования (Рисунок S3). Стабильные основные филотипы были преимущественно членами кластера Clostridium XIVa, но также несколько таксонов принадлежали кластеру Clostridium IV. Наиболее преобладающая стабильная группа родового уровня включала R.obeum et rel. и C. symbiosum et rel. , стабильность которого была очевидна также при исследовании, основанном на анализе CoV всей микробиоты (Таблица S1).
Мы также изучили возможные корреляции между численностью и временной стабильностью (CoV) родоподобных таксонов. Единственной группой, показывающей сильную корреляцию между численностью и временной стабильностью, была группа F. prauznitzii et rel. (ρ = -0,66; рисунок S4). Отрицательная корреляция между численностью и стабильностью показала, что F.prauznitzii был временно стабильным только тогда, когда он был очень многочисленным членом микробиоты, в отличие от других обычных кишечных обитателей, таких как Bifidobacteria, которые колебались во времени независимо от численности (ρ = -0,12; Рисунок S4). Мы подтвердили обнаружение F. prauznitzii с помощью видоспецифического анализа кПЦР, который также показал сильную отрицательную корреляцию между его численностью и временной стабильностью (ρ = -0,56).
Обсуждение
Это исследование обеспечивает филогенетический анализ кишечной микробиоты субъектов с подтвержденным кишечным и общим состоянием здоровья.За испытуемыми регулярно наблюдали в течение двух месяцев. Мы использовали филогенетический микрочип, способный обнаруживать и относительную количественную оценку более тысячи филотипов кишечника [13]. В сочетании с анализом состояния здоровья это позволило нам: 1. Рассмотреть состав и временную динамику микробиоты желудочно-кишечного тракта, 2. Связать определенные микробные группы со статусом здоровья кишечника и 3. Обеспечить новое понимание существования и размеров микробиоты. общая основная микробиота, которую мы все разделяем.
Хорошо известно, что в микробиоте желудочно-кишечного тракта человека преобладают Firmicutes и Bacteroidetes, за которыми следуют Actinobacteria и Verrucomicrobia [8], [12], [35]. Один и тот же тип доминировал в сообществах GI у наших испытуемых (результаты и рисунок 2). Мы обнаружили почти 500 бактериальных филотипов на индивидуум и метаногенные археи у 80% субъектов, что указывает на то, что наш набор данных должен адекватно описывать отобранные фекальные сообщества на основе текущих оценок богатства [16], [24].Метаногенные археи были обнаружены с высокой распространенностью и различной внутрииндивидуальной, но постоянной внутрииндивидуальной численностью. В противоположность предыдущим находкам [36], наши результаты предполагают, что метаногенные археи являются временно стабильными членами микробиоты GI и, следовательно, могут составлять часть индивидуального ядра носителей. Одним из возможных объяснений упомянутых различий является использование в данном исследовании эффективного метода выделения ДНК, что привело к улучшенному обнаружению архей [29].
Наше обширное краткосрочное наблюдение подтверждает низкую временную изменчивость общей микробиоты желудочно-кишечного тракта у здоровых субъектов [10], [11]. Высокая временная стабильность предполагает строгий отбор здоровым хозяином для конкретной группы микробов, что дополнительно подтверждается тем фактом, что стабильные таксоны у разных индивидуумов различались, и, следовательно, между отдельными ядрами было мало филогенетической общности. Однако стабильные таксоны на уровне рода могут составлять функционально однородную группу, поскольку большинство из них принадлежало к отряду Clostridiales, многие из которых являются повсеместными гидролитическими или ферментативными утилизаторами углеводов.
Кластерный анализ показал предметную специфичность в бактериальных профилях, несмотря на изменения, которые временно снизили сходство внутрииндивидуальной микробиоты у нескольких субъектов исследования (рис. 1). Лечение антибиотиками — хорошо документированный модификатор экосистемы ЖКТ [15], [16]. Кроме того, микробный профиль, собранный во время немедикаментозного стрептококкового фарингита, четко отделен от исходных образцов пораженного субъекта. Это открытие предполагает, что инфекция как таковая может временно модулировать микробиоту желудочно-кишечного тракта, подтверждая предыдущее аналогичное наблюдение, связанное с лихорадкой [37].В качестве нового наблюдения мы обнаружили, что путешествия коррелируют с измененной микробиотой желудочно-кишечного тракта, поскольку сходство профилей микробиоты значительно уменьшилось после зарубежных поездок. Различные факторы могут вызвать нестабильность микробиоты, связанную с путешествиями, включая воздействие новых микробов окружающей среды, стресс или нарушения циркадных ритмов. Наши результаты в изучаемой небольшой когорте показывают, что нормальные жизненные изменения, такие как болезнь, лекарства и путешествия, влияют на гомеостаз микробиоты, по-видимому, временным образом, который не затрагивает индивидуальность микробиоты.
Наши результаты предполагают, что общая стабильность микробиоты и кишечные симптомы могут не быть связаны друг с другом. Профили микробиоты субъектов, которые сообщили о наиболее тяжелых кишечных симптомах (таблица 1), оставались очень стабильными во время исследования (рисунок 1). Кроме того, нестабильность микробиоты не проявлялась в виде кишечных симптомов согласно записям о состоянии здоровья (таблица 1), в соответствии с предыдущими исследованиями, предполагающими, что здоровые субъекты могут иметь нестабильную микробиоту при отсутствии каких-либо кишечных жалоб [16], [ 38].Поскольку это исследование не включало пищевые дневники, мы не могли оценить степень и характер диетического влияния на временную стабильность и возникновение кишечных симптомов. Следовательно, для проверки результатов необходимы будущие исследования с диетическими записями и более крупными когортами.
Хотя появление кишечных симптомов не отразилось на стабильности микробиоты желудочно-кишечного тракта, мы идентифицировали бактерии, численность которых статистически значимо ассоциировалась с симптомами. Самым поразительным открытием на уровне рода было уменьшение количества бифидобактерий, связанное с болью в животе (рис. 4).Хотя большинство оценок боли указывало только на незначительное нарушение, снижение численности бифидобактерий было очевидным. Это первое, насколько нам известно, исследование корреляций между составом микробиоты и кишечными симптомами у здоровых людей, в то время как два исследования проанализировали связи между симптомами желудочно-кишечного тракта у пациентов с СРК и кишечными бактериями с помощью кПЦР [39], [39]. 40]. Была описана слабая отрицательная связь между количеством бифидобактерий и симптомами [39], [40], в то время как другое исследование не обнаружило такой связи [40].В нескольких исследованиях сообщалось о снижении уровня бифидобактерий у пациентов с СРК (обзор приведен в [41]), а пробиотик B. infantis , как было зарегистрировано, снижает висцеральную боль как у пациентов с СРК [42], так и у животных [43]. Механистическая основа способности бифидобактерий устранять боль неизвестна, но ее можно предполагать в свете множества метаболических свойств бифидобактерий, которые благотворно влияют на хозяина (см. Обзор [44]). Наконец, аналогично нашим выводам, исследования СРК предположили роль Firmicutes в возникновении кишечных симптомов [39], [40].Однако коррелирующие таксоны у пациентов с СРК (Lactobacilli, Veillonella spp. И неохарактеризованный Ruminococcus) [39], [40] в основном отличались от наших, в которых преобладали некультивируемые и не охарактеризованные представители Clostridiaceae, Ruminococcaceae и Lachospiraceae.
Это исследование рассматривало как концептуально, так и конкретно общую базовую микробиоту, которая может состоять из таксонов, выбранных в ходе совместной эволюции человека и его микробиоты ЖКТ в качестве полезных партнеров.После внесения в каталог функциональную характеристику можно сфокусировать на этих выдающихся членах микробиоты, которые обладают потенциалом даже для терапевтического применения, если они подтверждены как полезные для здоровья и благополучия человека. Наш новый подход, ориентированный на концептуальное, а не конкретное определение общей основной микробиоты, показывает, что размер ядра очень условен и зависит как от глубины анализа, так и от выбранной распространенности желаемых филотипов. Детерминированное влияние охвата анализа на общее ядро подтверждается предыдущим выводом, согласно которому удвоение глубины секвенирования увеличивало количество общих видов на 25% [8].
Путем включения всех филотипов выше указанного предела обнаружения мы выяснили, что более 40% филотипов были общими для всех девяти здоровых субъектов. Предыдущие оценки доли общих бактерий на основе секвенирования варьировались от 0–2% [12], [24] до более 30% [8], [26]. Мы предполагаем, что наше большое ядро является результатом технических аспектов, которые поддерживали обнаружение общих бактерий, поскольку эффективное извлечение ДНК сообщества [29] было связано с его углубленным анализом состава, охватывающим филотипы с заметно низкой относительной численностью (ниже 0.05%). Такие редкие таксоны недоступны при обычной глубине секвенирования [8], [25] и поэтому часто остаются необнаруженными. Более того, наша основная оценка, возможно, менее случайна, чем предыдущие, поскольку она была ограничена ранее идентифицированными филотипами из-за технологии микрочипов и основывалась на нескольких образцах от каждого человека. Следовательно, в отличие от более раннего предположения об однозначном преобладании специфических филотипов в микробиоте желудочно-кишечного тракта [12], [45], это исследование поддерживает точку зрения о том, что большая часть кишечных бактерий присутствует у большинства людей, хотя и в очень неравных пропорциях.Если это так, индивидуальность микробиоты может быть связана как с дифференциальными соотношениями, так и с чистым присутствием или отсутствием определенных линий.
У финских субъектов, проанализированных в этом исследовании, основная основная микробиота состояла в основном из некультивируемых Firmicutes из кластеров Clostridium IV и XIVa, которые также широко представлены в более ранних основных исследованиях [13], [24], [27]. В качестве нового наблюдения мы обнаружили сигнал гибридизации, идентифицирующий Oxalibacterium formigenes , бета-протеобактерию в пределах отряда Burkholderiales, среди предполагаемых коровых бактерий (Фигуры 5B и 5C, Таблица S5).Неклассифицированный Burkholderiales недавно был обнаружен как часть здорового ядра [26]. O. formigenes — одна из немногих бактерий толстой кишки с четко определенной пользой для здоровья, поскольку она контролирует гомеостаз щавелевой кислоты и предотвращает образование камней в почках [46], [47]. Неохарактеризованные Firmicutes, относящиеся к одному и тому же или родственным родам, которые доминировали в нашем общем ядре ( Faecalibacterium, Oscillospira , Subdoligranulum), недавно были отмечены как «специфичные для здоровых», поскольку их численность и / или распространенность отличались между пациентами с болезнью Крона и здоровыми людьми из контрольной группы [ 48].Напротив, Bacteroidetes spp. не были многочисленной частью общей основной микробиоты. Предыдущие исследования либо поддерживают [12], [24], [27], либо противоречат [8], [14], [26] нашим выводам о низкой представленности Bacteroidetes в общем ядре. Хотя некоторые различия могут быть связаны с методологическими различиями между исследованиями, наш вывод о низкой доле Bacteroidetes (4,5%) в общем ядре согласуется с их высокой межиндивидуальной и внутрииндивидуальной вариабельностью [15], [24]. , [35].
Основные филотипы были во времени более стабильными, чем общий пул филотипов, как и в другом недавнем исследовании [27]. Тот факт, что стабильные филотипы варьировались среди субъектов, и только несколько таксонов на уровне рода были стабильными у большинства здоровых субъектов (Таблица S1), подтверждает парадигму функциональной избыточности микробиоты ЖКТ, согласно которой могут осуществляться ключевые процессы. несколькими таксонами. Подавляющее большинство наших наиболее стабильных таксонов на уровне рода принадлежало клостридиальным кластерам IV и XIVa, которые содержат большую часть продуцентов бутирата, что свидетельствует о гарантированном производстве этого важного метаболита, который способствует взаимному гомеостазу между хозяином и микробиотой желудочно-кишечного тракта (обзор в [49]).В нашей когорте бифидобактерии не были включены в общее ядро, вместо этого мы обнаружили существенные меж- и внутрииндивидуальные вариации, которые были связаны с возникновением боли в животе и других кишечных симптомов. Бифидобактерии были у некоторых субъектов среди обогащенных нестабильных таксонов на уровне рода (Таблица S2), что согласуется с некоторыми предыдущими результатами [50], но противоречит многим более ранним исследованиям, в которых сообщалось о высокой временной стабильности этого рода [11], [ 51], [52]. Таким образом, наши результаты подчеркивают роль бифидобактерий в экосистеме желудочно-кишечного тракта и требуют их дальнейшего анализа в отношении здоровья кишечника.Ожидается, что эти исследования выявят также возникшее несоответствие в отношении их внутрииндивидуальной стабильности.
В отличие от любого другого таксона на уровне рода, временная стабильность группы F. prausnitzii зависела от ее численности у данного хозяина. Хотя F. prausnitzii et rel. был в изобилии у всех особей (рис. 5C), он был временно менее стабильным у тех особей, у которых была наименьшая интенсивность сигнала. Наш вывод может просто отражать ситуацию, когда F. prausnitzii et rel.Популяции были временно несбалансированы, т.е. либо сокращались, либо восстанавливались по той или иной причине. F. prausnitzii появился как связанная со здоровьем и уменьшающая колит бактерия [2], [48], [53]. Среди здоровых людей мы не нашли доказательств ожидаемой отрицательной связи между F. prausnitzii et rel. и кишечные симптомы. Поскольку род Faecalibacterium оказывается функционально более разнообразным, чем считалось ранее [54], его дальнейшая характеристика необходима для определения филотипов и метаболических особенностей, которые важны для здоровья кишечника и общего состояния.
В заключение, эта работа расширяет и определяет наше текущее понимание нормальной микробиоты ЖКТ у здоровых субъектов, обращаясь к ее временной динамике, связи с кишечными симптомами и общим ядром. Эти знания приблизят нас к определению здоровья кишечника и вкладу микробиоты желудочно-кишечного тракта в него.
Методы
Предметы и дизайн исследования
Объектами исследования (таблица 1) была подгруппа здоровых взрослых финнов (n = 15) из более крупного рандомизированного двойного слепого плацебо-контролируемого девятинедельного интервенционного исследования (Kekkonen et al., неопубликованные результаты). Перед включением в исследование испытуемые дали письменное информированное согласие. Протокол исследования был одобрен этическим комитетом больничного округа Хельсинки и Уусимаа (этический протокол HUS 357 / E0 / 05). Критериями исключения были хронические заболевания, желудочно-кишечные заболевания и связанные с ними лекарства, прием антибиотиков или острые желудочно-кишечные расстройства в течение двух месяцев до исследования, беременность и период лактации. Испытание состояло из вводных, интервенционных и последующих периодов каждые три недели.Образцы кала были собраны в шести временных точках в течение семи недель (на 2, 3, 4, 6, 7, 9 недель), в результате было получено 88 образцов после двух случаев исключения. В течение периода вмешательства субъекты получали исследуемый напиток, содержащий штаммы бактерий, часто используемые при ферментации молочных продуктов, а именно Streptococcus thermophilus THS (n = 4), Lactococcus lactis ATH74 (n = 2), Leuconostoc mesenteroides PIA2 (n = 7) или плацебо (n = 2). Поскольку набор в это подисследование происходил после рандомизации в исследовании матери, мы не могли повлиять на количество субъектов в группе вмешательства.Субъектам не разрешалось употреблять какие-либо пробиотики или ферментированные молочные продукты во время испытания, и, следовательно, они имели ограниченный контакт с пищевыми микробами.
Перед анализом данных мы проверили возможное влияние вмешательства на микробиоту. Никаких статистически значимых различий между группами вмешательства не наблюдалось при дисперсионном анализе (ANOVA), который применялся к данным на уровне филотипа выше указанного порога (значение log10 1,8; см. Ниже).Однако, когда были включены филотипы ниже порога обнаружения, наблюдалась единственная статистически значимая (q <0,005) разница: количество Leuconostoc-подобных филотипов временно увеличивалось во время вмешательства в группе, потребляющей L. mesenteroides PIA2. Хотя результат свидетельствовал о высоком разрешении анализа HITChip, в настоящем анализе мы обращались только к сигналам, превышающим фон, и, таким образом, считалось, что субъекты составляют однородную группу с точки зрения состава микробиоты.
Во время каждого отбора фекалий испытуемые заполняли вопросник по качеству жизни, связанному со здоровьем (HRQoL), который был основан на вопроснике RAND-36 [55] и был дополнен вопросами, оценивающими симптомы со стороны ЖКТ, адаптированные из Раздражающего Опросник по синдрому кишечника [56]. Вопросы касались общего и эмоционального здоровья с акцентом на кишечные симптомы, возникновение которых и влияние на повседневную деятельность были оценены с помощью 14 вопросов (перечисленных на рисунке 3) с использованием 5-ступенчатой шкалы Лайкерта (e.грамм. 1 = нет симптомов, 5 = очень серьезное нарушение). Период отзыва составлял одну или две недели в зависимости от интервалов выборки. Баллы здоровья были получены путем оценки каждого вопроса от 0 до 100 и последующего усреднения связанных вопросов для формирования общего балла, балла кишечного и эмоционального здоровья. Кроме того, участники предоставили данные о возможных заболеваниях, приеме лекарств и поездках за границу во время исследования.
Образцы кала и выделение ДНК
Образцы фекалий, которые мы собрали дома, немедленно заморозили при -20 ° C и доставили в течение 12 часов в исследовательский центр, где они хранились при -70 ° C до анализа.ДНК сообщества была извлечена из образцов фекалий с помощью метода многократного взбивания шариков, который был недавно утвержден [29]. Экстрагированную ДНК количественно оценивали с помощью спектрофотометра Nanodrop (NanoDrop Technologies, Wilmington, DE, USA) и анализировали электрофорезом в 0,8% агарозном геле на целостность.
Микроматричный анализ
Анализ микрочипов HITChip проводили, как описано ранее [13]. Вкратце, HITChip состоит из более чем 4800 олигонуклеотидных зондов, нацеленных на гипервариабельные области V1 и V6 гена 16S рРНК, нанесенных в виде двойника на пользовательских массивах Agilent (Agilent Technologies, Пало-Альто, Калифорния, США).Чтобы подготовить фекальную ДНК для анализа на микрочипах, полноразмерный ген 16S рРНК амплифицировали с использованием праймеров T7prom-Bact-27-for и Uni-1492-rev [13]. Продукты ПЦР транскрибировали в РНК и метили Cy3 и Cy5 перед фрагментацией и гибридизацией на массиве. Матрицы сканировали с помощью сканера ДНК-микрочипов Agilent, и данные извлекали из созданных изображений с помощью программного обеспечения Agilent Extraction Software 9.1.
Предварительная вычислительная обработка микрочипов
Нормализация массива была проведена, как описано ранее [13], [29], включая пространственную нормализацию с полиномиальной регрессией каждого канала сканера с последующим обнаружением выбросов и квантильной нормализацией обоих красителей Cy3 и Cy5 для каждого образца.Дубликаты, которые показали корреляцию Пирсона более 0,98 между красителями, рассматривались для дальнейшего анализа, и красители усреднялись, в противном случае гибридизация воспроизводилась. Нормализация выборок между массивами проводилась с использованием предположения о нормально-экспоненциальном (фоновый сигнал) распределении и квантильной нормализации [57]. Массив зондов был организован на основе их последовательностей 16S рРНК на трех уровнях филогении, как описано ранее [13]. Вкратце, интенсивность сигнала HITChip была проанализирована с использованием следующих уровней филогенетического отнесения: 1) уровень филума, со спецификацией от Firmicutes до кластеров Clostridium, всего было создано 23 группы; 2) родоподобный уровень, включающий 131 группу последовательностей с ≥90% идентичности последовательностей, и 3) уровень филотипа (видоподобный) с 1033 отдельными филотипами с ≥98% сходством последовательностей с культивируемыми видами или клонами, соответствующими некультивируемым микроорганизмам. -организмы.«Таксоны на уровне рода с идентичностью последовательностей ≥90%, распределенные по нескольким родам, называются« et rel ». ». Чтобы уменьшить экспериментальный и потенциальный шум кросс-гибридизации и надежно оценить, присутствуют ли определенные филотипы в образце на основе распределений интенсивности гибридизации всех субъектов, мы оценили порог интенсивности сигнала на основе данных, используя подход, первоначально разработанный для генов. экспрессионные микрочипы [58]. Полученный таким образом порог интенсивности сигнала составлял log10 интенсивности, равный 1.8 (Рисунок S1), что соответствует оценкам 0,02% от общего сигнала в качестве предела обнаружения для каждого филотипа. Чтобы повысить надежность анализа, мы дополнительно определили специфичность зонда для каждого филотипа, вычислив количество целевых филотипов на зонд, чтобы указать таксоны, которые потенциально могут подвергаться перекрестной гибридизации (т. Е. Выявляются зондами, имеющими более одной мишени. филотип на основе гипервариабельных последовательностей V1 и V6 рДНК 16S). Множественные целевые филотипы были обнаружены только в пределах одного таксона на уровне рода.Кроме того, алгоритм робастного вероятностного усреднения использовался для оценки надежности отдельных датчиков HITChip в отношении шума, например к непреднамеренной перекрестной гибридизации с последовательностями, не являющимися мишенями [34], что может привести к ложноположительным результатам в общем анализе ядра. Ранее была зарегистрирована хорошая корреляция между микробными профилями, полученными с помощью HITChip и пиросеквенирования [30], [59].
Количественный анализ ПЦР
Трехкратная количественная ПЦР-амплификация гена 16S рРНК была выполнена для всех доступных образцов с использованием системы ПЦР в реальном времени MX3005P (Stratagene, La Jolla, CA, USA) и CYBR green chemistry.Общее количество бактерий определяли путем амплификации 0,5 нг фекальной ДНК с универсальными праймерами [60]. Количественное определение архей проводили с использованием праймеров, специфичных для рода Methanobrevibacter [61], и 25 нг матричной ДНК. Анализы на Faecalibacterium prausnitzii и Bifidobacterium spp. проводились, как описано ранее [62]. Условия реакции и построение стандартных кривых описаны ранее [29], [62]. Данные выражены в виде копий гена 16S рРНК мкг-1 матричной ДНК.
Анализ данных
Анализ данных проводился в R версии 2.10.1 [63] и Microsoft Excel. Методы статистического анализа, использованные в этом исследовании, включали линейные модели с ANOVA (для эффектов вмешательства) и t-тесты [64], [65] для нормально распределенных данных, критерий Вилкоксона [66] для ненормальных данных, определение частоты ложных открытий. p-значений как q-значений [67] и статистическое избыточное представление (обогащение) групп уровня рода в списках уровня филотипов с использованием точного критерия Фишера [68].Мы визуализировали данные с помощью иерархической кластеризации и анализа тепловой карты. Иерархическая кластеризация использовалась для группировки выборок в соответствии с корреляционным расстоянием и средним критерием кластеризации.
Все анализы данных проводились с логарифмически преобразованными данными, за исключением оценки процентного содержания от общего сигнала и расчета кратных изменений сигнала в отношении вздутия живота и боли в животе. Мы определили микробную стабильность, вычислив внутри- и межиндивидуальные корреляции Пирсона (r), а также временную изменчивость отдельных филотипов, вычислив коэффициент вариации (CoV) внутри субъекта по всем временным точкам.Среднее стандартное отклонение было рассчитано для корреляций и выражено в тексте как ±.
Для анализа значимых корреляций между микробными профилями и кишечными симптомами в опроснике HRQoL мы рассчитали их коэффициент ранговой корреляции Спирмена (ρ). Все пункты HRQoL оцениваются таким образом, что высокий балл указывает на хорошее состояние здоровья (22), что привело к неинтуитивному направлению корреляций, то есть к отрицательной корреляции при одновременном увеличении численности бактерий и тяжести симптомов из-за падения оценки HRQoL. .Следовательно, чтобы правдиво выразить связь между симптомами и данными микробиоты, направление результирующих корреляций (ρ) было изменено с отрицательного на положительное и наоборот. Используя оценку симптомов HRQoL GI, мы разделили образцы на две группы: с одновременной болью в животе и вздутием живота и без них, а затем использовали эти группы для анализа связи между составом микробиоты и двумя наиболее часто регистрируемыми кишечными симптомами. Мы проанализировали общую базовую микробиоту с данными на уровне филотипов, используя регулируемые параметры для численности (относительный вклад в общий сигнал) и распространенности (количество затронутых субъектов).Полученную поверхность визуализировали с помощью перспективного графика [69]. Для всех анализов значимыми считались значения p ниже 0,05 и q ниже 0,005.
Дополнительная информация
Рисунок S1.
Распределение интенсивности сигнала HITChip для всех филотипов во всем наборе данных (15 испытуемых, 88 выборок). Красная линия указывает пороговое значение log 10 интенсивности> 1,8, выше которого считается присутствующим любой филотип. Всего через порог прошли 687 филотипов, что составляет 66.5% филотипов, обнаруживаемых с помощью HITChip.
https://doi.org/10.1371/journal.pone.0023035.s001
(TIF)
Рисунок S3.
Временная изменчивость основных филотипов. Линия указывает коэффициент вариации (CoV) общих основных филотипов. Филотипы с вариацией менее 10% в течение семинедельного периода исследования суммируются до уровня филума.
https://doi.org/10.1371/journal.pone.0023035.s003
(TIF)
Рисунок S4.
Корреляция между временной стабильностью и численностью. Вертикальные линии указывают на отсутствие корреляции между временной стабильностью (CoV) и численностью (%) для таксонов на уровне рода, указанных в поле. В случае группы F. Prausnitzii линия соединяет высокие значения на обеих осях и визуализирует отрицательную корреляцию между двумя параметрами.
https://doi.org/10.1371/journal.pone.0023035.s004
(TIF)
Благодарности
Мы благодарим всех добровольцев, принявших участие в этом исследовании, и Valio Ltd.для сбора образцов кала и анкет о состоянии здоровья. Мы благодарны доктору Мирьяне Райилич-Стоянович, Хансу Хейлигу и команде HITChip (Университет Вагенингена, Нидерланды) за помощь в анализе HITChip, а также доктору Питеру Свинсу за помощь в интерпретации данных HRQoL. Работа была выполнена в Центре передового опыта по исследованиям микробной безопасности пищевых продуктов Академии Финляндии.
Вклад авторов
Задумал и спроектировал эксперименты: JJ-T AS JN WMdV. Проведены эксперименты: OI JJ-T.Проанализированы данные: JJ-T AS JN LL. Предоставленные реагенты / материалы / инструменты анализа: AP RAK JN LL WMdV. Написал статью: AS JJ-T JN WMdV.
Ссылки
- 1.
Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI (2005) Бактериальный мутуализм хозяина в кишечнике человека. Science (Нью-Йорк, Нью-Йорк) 307: 1915–1920. - 2.
Сокол Х., Сексик П., Фурет Дж. П., Фирмесс О, Нион-Лармурье I и др. (2009) Низкое количество Faecalibacterium prausnitzii в микробиоте колита.Воспалительные заболевания кишечника 15: 1183–1189. - 3.
Кассинен А., Крогиус-Курикка Л., Мякивуокко Х., Ринттиля Т., Паулин Л. и др. (2007) Фекальная микробиота пациентов с синдромом раздраженного кишечника значительно отличается от таковой у здоровых людей. Гастроэнтерология 133: 24–33. - 4.
Малинен Э., Ринттиля Т., Каяндер К., Мятто Дж., Кассинен А. и др. (2005) Анализ фекальной микробиоты пациентов с синдромом раздраженного кишечника и здоровых людей в контрольной группе с помощью ПЦР в реальном времени.Американский журнал гастроэнтерологии 100: 373–382. - 5.
Ларсен Н., Фогенсен Ф.К., Ван Ден Берг Ф.В., Нильсен Д.С., Андреасен А.С. и др. (2010) Микробиота кишечника взрослых людей с диабетом 2 типа отличается от взрослых людей, не страдающих диабетом. PLoS One 5: e9085. - 6.
Musso G, Gambino R, Cassader M (2010) Ожирение, диабет и кишечная микробиота. Уход за диабетом 33: 2277. - 7.
Зоетендал Э.Г., Райилич-Стоянович М., де Вос В.М. (2008) Высокопроизводительный анализ разнообразия и функциональности микробиоты желудочно-кишечного тракта.Gut 57: 1605–1615. - 8.
Цинь Дж., Ли Р., Раес Дж., Арумугам М., Бургдорф К.С. и др. (2010) Каталог кишечных микробных генов человека, созданный с помощью метагеномного секвенирования. Природа 464: 59–65. - 9.
Мацуки Т., Ватанабе К., Фудзимото Дж., Кадо И., Такада Т. и др. (2004) Количественная ПЦР с видоспецифичными праймерами, нацеленными на ген 16S рРНК, для анализа кишечных бифидобактерий человека. Прикладная и экологическая микробиология 70: 167–173. - 10.
Zoetendal EG, Akkermans AD, De Vos WM (1998) Анализ гель-электрофореза в градиенте температуры 16S рРНК из образцов фекалий человека выявляет стабильные и специфичные для хозяина сообщества активных бактерий.Прикладная и экологическая микробиология 64: 3854–3859. - 11.
Scanlan PD, Shanahan F, O’Mahony C, Marchesi JR (2006) Независимый от культуры анализ временных вариаций доминирующей фекальной микробиоты и целевых бактериальных подгрупп при болезни Крона. Журнал клинической микробиологии 44: 3980–3988. - 12.
Тернбо П.Дж., Хамади М., Яцуненко Т., Кантарел Б.Л., Дункан А. и др. (2009) Основной микробиом кишечника у тучных и худых близнецов. Природа 457: 480–484. - 13.
Rajilic-Stojanovic M, Heilig HG, Molenaar D, Kajander K, Surakka A, et al. (2009) Разработка и применение чипа кишечного тракта человека, филогенетического микрочипа: анализ универсально консервативных филотипов в многочисленной микробиоте молодых и пожилых людей. Environ Microbiol 11: 1736–1751. - 14.
Клаэссон MJ, Cusack S, O’Sullivan O, Greene-Diniz R, de Weerd H, et al. (2010) Микробы и коллоквиум Саклера по здоровью: Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей.Proc Natl Acad Sci U S A 15: Suppl 14586–4591. - 15.
Jernberg C, Lofmark S, Edlund C, Jansson JK (2007) Долгосрочное экологическое воздействие введения антибиотиков на микробиоту кишечника человека. ISME J 1: 56–66. - 16.
Dethlefsen L, Huse S, Sogin ML, Relman DA (2008) Распространенные эффекты антибиотика на микробиоту кишечника человека, как показали глубокое секвенирование 16S рРНК. PLoS биология 6: e280. - 17.
Cochetiere DL, Durand T., Lepage P, Bourreille A, Galmiche JP, et al.(2005) Устойчивость доминирующей микробиоты фекалий человека при кратковременном введении антибиотиков. Журнал клинической микробиологии 43: 5588–5592. - 18.
Мауконен Дж., Мэтто Дж., Сатокари Р., Седерлунд Х., Маттила-Сандхольм Т. и др. (2006) ПЦР DGGE и ОТ-ПЦР DGGE демонстрируют разнообразие и краткосрочную временную стабильность в группе Clostridium coccoides-Eubacterium rectale в кишечной микробиоте человека. FEMS микробиология экология 58: 517–528. - 19.
Сандлер Р.С., Стюарт В.Ф., Либерман Дж. Н., Риччи Дж. А., Зорич Н. Л. (2000) Боль в животе, вздутие живота и диарея в Соединенных Штатах: распространенность и влияние.Болезни пищеварения и науки 45: 1166–1171. - 20.
Gralnek IM, Hays RD, Kilbourne A, Naliboff B, Mayer EA (2000) Влияние синдрома раздраженного кишечника на качество жизни, связанное со здоровьем. Гастроэнтерология 119: 654–660. - 21.
Амуретти М., Ле Пен С., Годен А.Ф., Боммелаер Дж., Фрексинос Дж. И др. (2006) Влияние синдрома раздраженного кишечника (СРК) на качество жизни, связанное со здоровьем (HRQOL). Гастроэнтерол Clin Biol 30: 241–246. - 22.
Флетчер А., Гор С., Джонс Д., Фицпатрик Р., Шпигельхальтер Д. и др.(1992) Показатели качества жизни в здравоохранении. II: Дизайн, анализ и интерпретация. BMJ 305: 1145–1148. - 23.
Bischoff SC (2011) «Здоровье кишечника»: новая цель медицины? BMC Med 9: 24. - 24.
Tap J, Mondot S, Levenez F, Pelletier E, Caron C и др. (2009) К филогенетическому ядру кишечной микробиоты человека. Экологическая микробиология 11: 2574–2584. - 25.
Хамади М., Найт Р. (2009) Профилирование микробного сообщества для проектов по микробиому человека: инструменты, методы и проблемы.Исследование генома 19: 1141–1152. - 26.
Уиллинг Б., Диксвед Дж., Халфварсон Дж., Андерссон А., Лусио М. и др. (2010) Исследование пиросеквенирования у близнецов показывает, что микробные профили ЖКТ меняются в зависимости от фенотипов воспалительного заболевания кишечника. Гастроэнтерология 139: 1844–1854. - 27.
Секеля М., Бергет И., Наес Т., Руди К. (2010) Выявление обильной основной микробиоты в толстой кишке взрослого человека с помощью подхода поиска, не зависящего от филогрупп. ISME J 5: 519–531. - 28.Morgan JL, Darling AE, Eisen JA (2010) Метагеномное секвенирование микробного сообщества, смоделированного in vitro. PLoS ONE 5: e10209.
- 29.
Салонен А., Никкиля Дж., Яланка-Туовинен Дж., Иммонен О, Раджилич-Стоянович М. и др. (2010) Сравнительный анализ методов выделения фекальной ДНК с филогенетическим микрочипом: эффективное восстановление бактериальной и архейной ДНК с использованием механического лизиса клеток. J Microbiol Methods 81: 127–134. - 30.
Клаэссон М.Дж., О’Салливан О., Ван К., Никкила Дж., Марчези Дж. Р. и др.(2009) Сравнительный анализ пиросеквенирования и филогенетического микрочипа для изучения структур микробного сообщества в дистальном отделе кишечника человека. PloS one 4: e6669. - 31.
Wooley JC, Ye Y (2009) Метагеномика: факты и артефакты, а также вычислительные проблемы. J Comput Sci Technol 25: 71–81. - 32.
Аалто А.М., Аро А.Р., Тепери Дж. (1999) RAND-36 как показатель качества жизни, связанного со здоровьем. Надежность, конструктивная валидность и эталонные значения для финского населения в целом.Хельсинки: Stakes, Research Reports 101, 1999. [на финском языке]. - 33.
Лю С., Файнголд С.М., Сонг Й., Лоусон П.А. (2008) Международный журнал систематической и эволюционной микробиологии 58: 1896–1902. Реклассификация Clostridium coccoides, Ruminococcus hansenii, Ruminococcus Hydrogenotrophicus, Ruminococcus luti, Ruminococcus productus и Ruminococcus schinkii как Blautia coccoides gen. нов., греб. nov., Blautia hansenii comb. nov., Blautia Hydrogenotrophica comb. nov., Blautia luti comb.nov., Blautia producta гребешок. nov., Blautia schinkii comb. ноя и описание Blautia wexlerae sp. nov., выделенный из человеческих фекалий. - 34.
Lahti L, Elo LL, Aittokallio T, Kaski S (2011) Вероятностный анализ надежности зонда в исследованиях дифференциальной экспрессии генов с короткими массивами олигонуклеотидов. IEEE / ACM Trans Comput Biol Bioinform 8: 217–225. - 35.
Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, et al. (2005) Разнообразие кишечной микробной флоры человека.Science (Нью-Йорк, Нью-Йорк) 308: 1635–1638. - 36.
Abell GCJ, Conlon MA, McOrist AL (2006) Метаногенные археи в образцах фекалий взрослого человека обратно пропорциональны концентрации бутирата. Микробная экология в здоровье и болезнях 18: 154–160. - 37.
Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J и др. (2010) Микробы и Коллоквиум Саклера по здоровью: Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc Natl Acad Sci U S A 2011 15: Suppl 14578–4585. - 38.
Энгельбрексон А.Л., Корзеник Дж. Р., Сандерс М. Е., Клемент Б. Г., Лейер Г. и др. (2006) Анализ воздействия лечения на микробную экологию кишечника человека. FEMS Microbiol Ecol 57: 239–250. - 39.
Малинен Э., Крогиус-Курикка Л., Лира А., Никкиля Дж., Яэскеляйнен А. и др. (2010) Связь симптомов с микробиотой желудочно-кишечного тракта при синдроме раздраженного кишечника. Всемирный гастроэнтерологический журнал 16: 4532–4540. - 40.
Тана С., Умесаки Ю., Имаока А., Ханда Т., Канадзава М. и др.(2010) Измененные профили кишечной микробиоты и органических кислот могут быть причиной симптомов синдрома раздраженного кишечника. Нейрогастроэнтерология и моторика: официальный журнал Европейского общества моторики желудочно-кишечного тракта 22: 512–519, e114–515. - 41.
Salonen A, de Vos WM, Palva A (2010) Желудочно-кишечная микробиота при синдроме раздраженного кишечника: современное состояние и перспективы. Микробиология 156: 3205–3215. - 42.
О’Махони Л., Маккарти Дж., Келли П., Херли Дж., Луо Ф. и др.(2005) Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов. Гастроэнтерология 128: 541–551. - 43.
McKernan DP, Fitzgerald P, Dinan TG, Cryan JF (2010) Пробиотик Bifidobacterium infantis 35624 проявляет висцеральные антиноцицептивные эффекты у крыс. Нейрогастроэнтерология и моторика 22: 1029. - 44.
Роберфроид М., Гибсон Г.Р., Хойлс Л., Маккартни А.Л., Растолл Р. и др. (2010) Эффекты пребиотиков: метаболизм и польза для здоровья.Британский журнал питания 104: 1–63. - 45.
Rajilić-Stojanović M, Smidt H, de Vos WM (2007) Пересмотр разнообразия микробиоты желудочно-кишечного тракта человека. Экологическая микробиология 9: 2125–2136. - 46.
Стюарт С.С., Дункан С.Х., Кейв Д.Р. (2004) Oxalobacter formigenes и его роль в метаболизме оксалатов в кишечнике человека. Письма FEMS по микробиологии 230: 1–7. - 47.
Сидху Х., Хоппе Б., Гессен А., Тенброк К., Бромм С. и др. (1998) Отсутствие Oxalobacter formigenes у пациентов с муковисцидозом: фактор риска гипероксалурии.Ланцет 352: 1026–1029. - 48.
Mondot S, Kang S, Furet JP, Aguirre de Carcer D, McSweeney C, et al. (2011) Выявление новых филогенетических особенностей микробиоты болезни Крона. Воспаление кишечника. Dis 17: 185–192. - 49.
van Hylckama Vlieg JE, Veiga P, Zhang C, Derrien M, Zhao L (2011) Влияние микробной трансформации пищевых продуктов на здоровье — от ферментированных продуктов до ферментации в желудочно-кишечном тракте. Curr Opin Biotechnol. - 50.Мацуки Т., Ватанабе К., Фудзимото Дж., Такада Т., Танака Р. (2004) Использование ориентированных на ген 16S рРНК группоспецифичных праймеров для ПЦР-анализа в реальном времени преобладающих бактерий в человеческих фекалиях. Прикладная и экологическая микробиология 70: 7220–7228.
- 51.
Vanhoutte T, Huys G, Brandt E, Swings J (2004) Анализ временной стабильности микробиоты в человеческих фекалиях с помощью денатурирующего градиентного гель-электрофореза с использованием универсальных и группоспецифичных праймеров гена 16S рРНК. FEMS Microbiol Ecol 48: 437–446. - 52.
Энгельбрексон А., Корзеник Дж. Р., Питтлер А., Сандерс М. Е., Клаенхаммер Т. Р. и др. (2009) Пробиотики для сведения к минимуму нарушения фекальной микробиоты у здоровых людей, получающих антибактериальную терапию. Журнал медицинской микробиологии 58: 663–670. - 53.
Канг С., Денман С.Е., Моррисон М., Ю З., Доре Дж и др. (2010) Дисбиоз фекальной микробиоты у пациентов с болезнью Крона, выявленный с помощью пользовательского филогенетического микрочипа. Воспаление кишечника. Dis 16: 2034–2042. - 54.
Луи П., Янг П., Холтроп Г., Флинт Х. Дж. (2010) Разнообразие бактерий, продуцирующих бутират толстой кишки человека, выявленное с помощью анализа гена бутирил-КоА: ацетат-КоА-трансферазы. Экологическая микробиология 12: 304–314. - 55.
Hays RD, Sherbourne CD, Mazel RM (1993) Исследование здоровья RAND из 36 пунктов, 1.0. Экономика здоровья 2: 217–227. - 56.
Wong E, Guyatt GH, Cook DJ, Griffith LE, Irvine EJ (1998) Разработка анкеты для измерения качества жизни пациентов с синдромом раздраженного кишечника.Eur J Surg. С. 50–56. - 57.
Bolstad BM, Irizarry RA, Astrand M, Speed TP (2003) Сравнение методов нормализации для данных массива олигонуклеотидов высокой плотности на основе дисперсии и смещения. Биоинформатика (Оксфорд, Англия) 19: 185–193. - 58.
Zilliox MJ, Irizarry RA (2007) Штрих-код экспрессии гена для данных микрочипа. Нат Методы 4: 911–913. - 59.
van den Bogert B, de Vos WM, Zoetendal EG, Kleerebezem M (2011) Анализ микроматриц и пиросеквенирование со штрих-кодом обеспечивают согласованные микробные профили в зависимости от источника образцов кишечника человека.Appl Environ Microbiol 77: 2071–2080. - 60.
Надкарни М.А., Мартин Ф.Е., Жак Н.А., Хантер Н. (2002) Определение бактериальной нагрузки с помощью ПЦР в реальном времени с использованием широкого (универсального) зонда и набора праймеров. Microbiology (Reading, England) 148: 257–266. - 61.
Ufnar JA, Wang SY, Christiansen JM, Yampara-Iquise H, Carson CA, et al. (2006) Обнаружение гена nifH у Methanobrevibacter smithii: потенциальный инструмент для выявления загрязнения сточных вод в рекреационных водах.Журнал прикладной микробиологии 101: 44–52. - 62.
Rinttilä T, Kassinen A, Malinen E, Krogius L, Palva A (2004) Разработка обширного набора праймеров, нацеленных на 16S рДНК, для количественной оценки патогенных и местных бактерий в образцах фекалий с помощью ПЦР в реальном времени. Журнал прикладной микробиологии 97: 1166–1177. - 63.
R Разработка CT (2010) R: Язык и среда для статистических вычислений. Вена, Австрия: Фонд R для статистических вычислений. - 64.
Faraway JJ (2002) Практическая регрессия и дисперсионный анализ с использованием R. Опубликовано по URL-адресу: http: // wwwcranr-Progge / doc / contrib / Faraway-PRApdf. По состоянию на 3 июня 2010 г. - 65.
Пинейро Дж. К., Бейтс Д. М. (2000) Модели смешанных эффектов в S и S-Plus. Нью-Йорк: Спрингер. 598 с. - 66.
Майлз Х., Вулф Д. (1973) Непараметрические статистические методы. Нью-Йорк: Джон Уайли и сыновья. С. 68–75. - 67.
Стори Дж. Д. (2002) Прямой подход к количеству ложных открытий.Журнал Королевского статистического общества: серия B 64: 479–498. - 68.
Соперники I, Personnaz L, Taing L, Potier M (2007) Обогащение или истощение категории GO в классе генов: какой тест? Биоинформатика 23: 401–407. - 69.
Беккер RACJMWAR (1988) Новый язык S. Чепмен и Холл. 702 с.
Микрофлора кишечника человека | SpringerLink
Moore WEC, Holdeman LV: Обсуждение текущих бактериологических исследований взаимосвязи между кишечной флорой, диетой и раком толстой кишки.Cancer Res 35: 3418–3420, 1975
Google Scholar
Finegold S, Attebery HR, Sutter VL: Влияние диеты на фекальную флору человека: Сравнение японской и американской диет. Am J Clin Nutr 27: 1456–1469, 1974
CAS
PubMed
Google Scholar
Драсар Б.С., Шайнер М., Маклеод Г.М.: Исследования кишечной флоры. I. Бактериальная флора желудочно-кишечного тракта у здоровых и ахлоргидных лиц.Гастроэнтерология 56: 71–79, 1969
CAS
PubMed
Google Scholar
Горбач С.Л., Плаут А.Г., Нахас Л., Вайнштейн Л.: Исследования микрофлоры кишечника. II. Микроорганизмы тонкого кишечника и их связь с ротовой и фекальной флорой. Гастроэнтерология 53: 856–867, 1967
CAS
PubMed
Google Scholar
Драсар Б.С., Шайнер М: Исследования кишечной флоры.II. Бактериальная флора тонкого кишечника у больных с желудочно-кишечными расстройствами. Кишечник 10: 812–819, 1969
CAS
PubMed
Google Scholar
Саймон Г.Л., Горбач С.Л.: Кишечная флора в здоровье и болезнях. Гастроэнтерология 86: 174–193, 1984
CAS
PubMed
Google Scholar
Юстесен Т., Нильсен О.Н., Якобсон И.Е., Лаве Дж., Расмуссен С.Н.: Нормальная культивируемая микрофлора в верхних отделах тощей кишки у здоровых взрослых.Scand J Gastroenterol 19: 279–282, 1984
CAS
PubMed
Google Scholar
Хилл М.Дж., Драсар Б.С.: Нормальная бактериальная флора толстой кишки. Кишечник 16: 318–323, 1975
CAS
PubMed
Google Scholar
Фицджеральд Дж. Ф .: Колонизация желудочно-кишечного тракта. В Избранные аспекты перинатальной гастроэнтерологии, Симпозиум Мида Джонсона по перинатальной медицине и медицине развития 1977 г., стр.35–38
Ротими В.О., Дурден Б.И.: Бактериальная флора у здоровых новорожденных. J med Micro 14: 51–62, 1981
CAS
Google Scholar
Лонг С.С., Свенсон Р.М.: Развитие анаэробной фекальной флоры у здоровых новорожденных. J Pediatr 91: 298–301, 1977
CAS
PubMed
Google Scholar
Гиббонс Р.Дж., Капсималис Б. Оценка общей роли роста кишечной микрофлоры хомяков, морских свинок и мышей.J Bact 93: 510–512, 1967
CAS
PubMed
Google Scholar
Dack GM, Petran E: Бактериальная активность на разных уровнях кишечника и в отдельных сегментах тонкой и толстой кишки у обезьян и собак. J Infect Dis 54: 204–220, 1934
Google Scholar
Горбач С.Л. Популяционный контроль в тонкой кишке. Кишечник 8: 530–532, 1967
CAS
PubMed
Google Scholar
Рольф РД: Взаимодействие между микроорганизмами местной кишечной флоры и их влияние на хозяина. Ред. Инф. Диск 67: S73-S59, 1984
Google Scholar
Dixon JMS: Судьба бактерий в тонком кишечнике. J Path Bact 79: 131–140, 1960
CAS
PubMed
Google Scholar
Броидо П.В., Горбач С.Л., Найхус Л.М.: Микрофлора желудочно-кишечного тракта и синдромы хирургической мальабсорбции.Surg Gynecol Obstet 135: 449–460, 1972
CAS
PubMed
Google Scholar
Друде Р.Б. младший, Хайнс С. Младший: Патофизиология синдромов избыточного бактериального роста в кишечнике. Arch Intern Med 140: 1349–1352, 1980
PubMed
Google Scholar
Горбач С.Л., Табакчали С .: Бактерии, желчь и тонкий кишечник. Gut 10: 963–972, 1969
CAS
PubMed
Google Scholar
King CE, Toskes PP: Разрастание бактерий в тонком кишечнике. Гастроэнтерол 76: 1035–1055, 1979
CAS
Google Scholar
Маскрофт Т.Дж., Дин С.А., Янгс Д., Бердон Д.В., Кейли MRB: микрофлора послеоперационного желудка. Br J Surg 68: 560–564, 1981
CAS
PubMed
Google Scholar
Энанкер Л.К., Нильссон Ф., Райден А.С., Шван А: Аэробная и анаэробная микрофлора желудочного остатка более чем через 15 лет после резекции по Бильроту II.Scand J Gastroenterol 17: 715–720, 1982
Google Scholar
Кэш Р., Мьюзик С., Либонати Дж., Снадер М., Венцель Р., Хорник Р.: Ответ человека на инфекцию V. cholerae . I. Клинический, серологический и бактериологический ответ на известный посевной материал. J Infect Dis 129: 45–52, 1974
CAS
PubMed
Google Scholar
Мацковяк П.А. Нормальная микробная флора.N Engl J Med 307: 83–93, 1982
CAS
PubMed
Google Scholar
Savage DC: Микробная экология желудочно-кишечного тракта. Ann Rev Microbiol 31: 107–133, 1977
CAS
Google Scholar
Волин MJ: Метаболические взаимодействия между кишечными микроорганизмами. Am J Clin Nutr 27: 1320–1328, 1974
CAS
PubMed
Google Scholar
Freter R: Антагонизм in vivo и in vitro кишечных бактерий против Shigella flexneri II. Тормозной механизм. J Inf Dis 110: 38–46, 1962
CAS
Google Scholar
Бирн Б.М., Данкерт Дж .: Летучие жирные кислоты и аэробная флора в желудочно-кишечном тракте мышей в различных условиях. Infect Immun 23: 559–563, 1979
CAS
PubMed
Google Scholar
Hentges DJ, Maier BR: Ингибирование Shigella flexneri нормальной кишечной флорой. III. Взаимодействие со штаммами Bacteroides fragilis in vitro. Infect Immun 2: 364–370, 1970
CAS
PubMed
Google Scholar
Luckey TD: Двухсотлетний обзор кишечной микроэкологии. Am J Clin Nutr 30: 1753–1761, 1977
CAS
PubMed
Google Scholar
Келструп Дж., Гиббонс Р. Дж.: Инактивация бактериоцинов в кишечном канале и полости рта. J Bacteriol 99: 888–890, 1969
CAS
PubMed
Google Scholar
Горбач С.Л., Нахас Л., Лерер П.И., Вайнштейн Л.: Исследования кишечной микрофлоры. I. Влияние диеты, возраста и периодического отбора проб на количество фекальных микроорганизмов у человека. Гастроэнтерол 53: 845–855, 1967
CAS
Google Scholar
Горбач С.Л.: Влияние диеты на микрофлору кишечника и ее метаболические функции. В Определенная формула диет для медицинских целей, ME Shils (ed). Am Med Assoc, Чикаго, 1977
Google Scholar
Аттебери Х.Р., Саттер В.Л., Finegold SM: Влияние диеты с частично определенным химическим составом на нормальную фекальную флору человека. Am J Clin Nutr 1391–1398, 1972
Bornside GH, Cohn Jr, I: Стабильность нормальной фекальной флоры человека во время химически определенного жидкого рациона с низким содержанием остатков.Ann Surg 181: 58–60, 1974
Google Scholar
Драсар Б.С., Дженкинс Д.А., Каммингс Дж. Х .: Влияние диеты, богатой пшеничной клетчаткой, на фекальную флору человека. J Med Microb 9: 423–431, 1976
CAS
Google Scholar
Hentges DJ: Фекальная флора добровольцев на контролируемой диете. Am J Clin Nutr 31: S123-S124, 1978
CAS
PubMed
Google Scholar
Hill MJ, Drasar BS, Aries V, Crowther JS, Hawksworth G, Williams REO: Бактерии и этиология рака толстой кишки. Ланцет 1: 95–100, 1971
CAS
PubMed
Google Scholar
Finegold SM, Sutter VL: Фекальная флора в различных популяциях, с особым упором на диету. Am J Clin Nutr 31: S116-S122, 1978
CAS
PubMed
Google Scholar
Finegold SM, Sutter VL, Sugihara PT, Elder HA, Lehmann SM, Phillips RL: Фекальная микробная флора в популяциях адвентистов седьмого дня и контрольных субъектах. Am J Clin Nutr 30: 1781–1792, 1977
CAS
PubMed
Google Scholar
Bartlett JG, Condon RE, Gorbach SL, Clarke JS, Nichols RL, Ochi S: Совместное исследование администрации ветеранов по подготовке кишечника к плановым колоректальным операциям: влияние пероральной схемы приема антибиотиков на флору толстой кишки, посевы ирригации ран и бактериологию септических осложнений.Энн Сург 188: 249, 254 1978
CAS
PubMed
Google Scholar
Горбач С.Л., Спанкнебель Г., Вайнштейн Л., Плаут А.Г., Нахас Л., Левитан Р.: Исследования микрофлоры кишечника. VIII. Влияние линкомицина на микробную популяцию кишечника человека. J Infect Dis 120: 298–304, 1969
CAS
PubMed
Google Scholar
Nordenvall B, Hallberg D, Larsson L, Nord CE: Влияние клиндамицина на кишечную флору у пациентов с энтеической гипероксалурией.Scand J Gastroenterol 18: 177–181, 1983
CAS
PubMed
Google Scholar
Clarke JS, Condon RE, Bartlett JG, Gorbach SL, Nichols RL, Ochi S: Предоперационные пероральные антибиотики уменьшают септические осложнения операций на толстой кишке: результаты проспективного рандомизированного двойного слепого клинического исследования. Ann Surg 186: 251–259, 1977
CAS
PubMed
Google Scholar
Николс Р.Л., Броидо П., Кондон Р.Е., Горбач С.Л., Найхус Л.М.: Влияние предоперационного кишечного препарата неомицин-эритромицин на частоту инфекционных осложнений после рака толстой кишки. Энн Сург 178: 453–462, 1973
CAS
PubMed
Google Scholar
Дион Ю.М., Ричардс Г.К., Прентис Дж.Дж., Хинчи Э.Дж .: Влияние перорального или парентерального предоперационного метронидазола на сепсис после операции на толстой кишке. Энн Сург 192: 221–226, 1980
CAS
PubMed
Google Scholar
Schimpff SC, Young VM, Greene WH, Vermeulen GD, Mood MR, Wiernik PH: Происхождение инфекции при остром нелимфоцитарном лейкозе: Значение приобретения в больнице потенциальных патогенов. Ann Intern Med 77: 707–714, 1972
CAS
PubMed
Google Scholar
Guiot HFL, van den Broek PJ, van der Meer JWM, van Furth R: Избирательная антимикробная модуляция кишечной флоры у пациентов с острым нелимфоцитарным лейкозом: двойное слепое плацебо-контролируемое исследование.J Inf Dis 147: 615, 1983
CAS
Google Scholar
Gurwith MJ, Brunton JL, Lank BA, Harding GKM, Ronald AR: проспективное контролируемое исследование профилактического применения триметорфима / сульфаметоксазола у госпитализированных пациентов с гранулоцитопенией. Am J Med 66: 248–256, 1979
CAS
PubMed
Google Scholar
Schimpff SC, Greene WH, Young VM, Fortner CL, Jepsen L, Cusack N, Block JB, Wiernik PH: Профилактика инфекций при остром нелимфоцитарном лейкозе: обратная изоляция помещения с ламинарным воздушным потоком с пероральной неабсорбируемой антибиотикопрофилактикой.Ann Intern Med 82: 351–358, 1975
CAS
PubMed
Google Scholar
Sleijfer DT, Mulder NH, de Vries-Hospers HG, Fidler V, Nieweg HO, van der Waaij D, van Saene HKF: Профилактика инфекций у пациентов с гранулоцитопенией путем выборочной деконтаминации пищеварительного тракта. Europ J Cancer 16: 859–869, 1980
CAS
Google Scholar
Wade JC, Schimpff SC, Hargadon MS, Fortner CL, Young VM, Wiernik PH: Сравнение триметоприм-сульфаметоксазола плюс нистатин с гентамицином плюс нистатином в профилактике инфекций при остром лейкозе.N Engl J Med 304: 1057–1062, 1981
CAS
PubMed
Google Scholar
Schimpff SC: Профилактика инфекций при глубокой гранулоцитопении. Ann Inten Med 93: 358–361, 1981
Google Scholar
Guiot HFL, van der Meer JWM, van Furth R: Селективная антимикробная модуляция микробной флоры человека: Профилактика инфекций у пациентов со сниженными механизмами защиты хозяина путем избирательного устранения потенциально патогенных бактерий.J Inf Dis 143: 644–654, 1981
CAS
Google Scholar
Van der Waaij D, De Vries JM, Ledderkerk JEC: Устойчивость к колонизации пищеварительного тракта у обычных мышей и мышей, леченных антибиотиками. Дж. Гигиена 9: 405, 1971
Google Scholar
Курпад А.В., Шетти П.С.: Эффекты антимикробной терапии фекального наполнения. Gut 27: 55–58, 1986
CAS
PubMed
Google Scholar
Plaa GL: Энтерогепатическое кровообращение. В Справочнике по экспериментальной фармакологии . JR Gillete (ред.). Нью-Йорк, Спрингер-Верлаг, 1975
Google Scholar
Схема RR: Метаболизм чужеродных соединений желудочно-кишечными микроорганизмами. Pharm Rev 25: 451–523, 1973
CAS
PubMed
Google Scholar
Lindenbaum J, Rund DG, Butler Jr.В.П., Це-Энг Д., Саха Дж. Р.: Инактивация дигоксина кишечной флорой: отмена лечения антибиотиками. N Engl J Med 305: 789–794, 1982
Google Scholar
Добкин Дж. Ф., Саха Дж. Р., Батлер младший В. П., Ной Х. С., Линденбаум Дж.: Инактивация дигоксина Eubacterium lentum, анэробом кишечной флоры человека. Clin Res 30: 551A, 1982
Google Scholar
Abrams GD, Bauer H, Sprinz H: Влияние нормальной флоры на морфологию слизистой оболочки и обновление клеток в подвздошной кишке.Сравнение мышей без микробов и обычных мышей. Lab Invest 12: 355–364, 1963
CAS
PubMed
Google Scholar
Коутс М.Э., Фуллер Б: животное-гнотобиотик в изучении микробиологии кишечника. In Microbial Ecology of the Gut, RTJ Clarke, T. Bauchop (eds). Нью-Йорк, Academic Press, 1977, 311–346
Google Scholar
Томпсон Г.Р., Trexler PC: Структура и функции желудочно-кишечного тракта у стерильных или гнотобиотических животных.Кишечник 12: 230–235, 1971
CAS
PubMed
Google Scholar
Гордон HA, Bruchorer-Kardoss E: Влияние нормальной микробной флоры на поверхность кишечника. Am J Physiol 201: 175–182, 1961
CAS
PubMed
Google Scholar
Lesher S, Walburg HE, Sacher GA: Цикл генерации в клетках крипт двенадцатиперстной кишки свободных от микробов и обычных мышей. Nature 202: 884–886, 1964
CAS
PubMed
Google Scholar
Kenworthy R: Наблюдения за реакцией слизистой оболочки кишечника на бактериальную инфекцию. J Clin Pathol 24: 138–145, 1971
Google Scholar
Гордон HA: In Бесплодие животных в исследованиях, ME Coates (ed). Нью-Йорк, Academic Press, 1968, 127–150
Google Scholar
Abrams GD: Влияние микробов на структуру и функцию слизистой оболочки.Am J Clin Nutr 30: 1880–1886, 1977
CAS
PubMed
Google Scholar
Henegan JB: Влияние микробной флоры на абсорбцию ксилозы у крыс и мышей. Am J Physiol 205 (3): 417–420, 1963
Google Scholar
Bergstrand LO, Gustaffson BE, Holmstrum B, Norin KE: физиологическая активность фекальной флоры человека, оцененная путем определения характеристик стерильных животных.Acta Chir Scand 147: 703–705, 1981
CAS
PubMed
Google Scholar
Norin KE, Gustaffson BE, Lindblad BS, Midtvedt T: Установление некоторых биохимических характеристик, связанных с микрофлорой, в фекалиях у детей первого года жизни. acta Periatr Scand 74: 207–212, 1985
CAS
Google Scholar
Midtvedt T, Carlstedt-Duke B, Hoverstad T, Lingaas E, Norin KE, Saxerholt H, Steinbakk M: Влияние пероральных антибиотиков на биотрансформирующую активность кишечной микрофлоры у здоровых субъектов.(В печати.)
Коэн Р., Калсер М.Х., Артеага И., Зевн Е., Фрейзер Д., Лейте К.А., Ахерн Д.Г., Рот Ф .: Микробная кишечная флора при остром диарейном заболевании. JAMA 201: 835–840, 1967
CAS
PubMed
Google Scholar
Горбач С.Л., Банвелл Дж. Г., Чаттерджи Б.Д., Джейкобс Б., Сак Р. Б.: Острая недифференцированная диарея человека в тропиках. I. Изменения микрофлоры кишечника. J Clin Invest 50: 881–889, 1971
CAS
PubMed
Google Scholar
Gorbach SL, Banwell JG, Jacobs B, Chatterjee BD, Mitra R, Brigham KL, Neogy KN: Кишечная микрофлора при азиатской холере. I. Стул «рисово-водяной». J Infect Dis 121: 32–37, 1970
CAS
PubMed
Google Scholar
Gorbach SL, Banwell JG, Jacobs B., Chatterjee BD, Mitra R, Brigham KL, Neogy KN: Кишечная микрофлора при азиатской холере. II. Тонкая кишка. J Infect Dis 121: 38–45, 1970
CAS
PubMed
Google Scholar
Gorbach SL, Kean BH, Evans DG, Evans Jr., DJ, Bessudo D: диарея путешественников и токсигенные Escherichia coli . N Engl J Med 292: 933–936, 1975
CAS
PubMed
Google Scholar
Горбач С.Л., Хурана CM: Токсигенные Escherichia coli . Причина детской диареи в Чикаго. N Engl J Med 287: 791–795, 1972
CAS
PubMed
Google Scholar
Геррант Р.Л., Мур Р.А., Киршенфельд П.М., Санде М.А.: Роль токсигенных и инвазивных бактерий в острой диарее у детей. N Engl J Med 293: 567–573, 1975
CAS
PubMed
Google Scholar
Merson MH, Morris GK, Sack DA, Wells JG, Feeley JC, Sack RB, Creech WB, Kapikian AZ, Gangarosa EJ: Диарея путешественников в Мексике. Перспективное исследование врачей и членов семей, посещающих Конгресс. N Engl J Med 294: 1299–1304, 1976
CAS
PubMed
Google Scholar
Ryder RW, Wachsmuth K, Buxton AE, Evans DG, DuPont HL, Mason E, Barrett FF: детская диарея, вызванная термостабильными энтеротоксигенными Escherichia coli . N Engl J Med 295: 849–853, 1976
CAS
PubMed
Google Scholar
Горбач С.Л., Нил Г., Левитан Р., Хепнер Г.В.: Изменения кишечной микрофлоры человека во время экспериментальной диареи. Кишечник 11: 1–6, 1970
CAS
PubMed
Google Scholar
Hill ID, Mann MD, Moore L, Bowie MD: Дуоденальная микрофлора у младенцев с острой и стойкой диареей. Arch Dis Child 38: 330–334, 1985
Google Scholar
Кушинг А.Х., Смарт Дж .: Перенос токсигенных бактерий в желудочно-кишечном тракте: связь с диареей и иммунным ответом сыворотки крови. P Inf Dis 151: 114–123, 1985
CAS
Google Scholar
Echeverria P, Louria CJ, Smith AL, Smith D: Вариации энтеротоксигенности E.coli. J Inf Dis 135: 195–200, 1977
CAS
Google Scholar
Бартлетт Дж. Г., Чанг Т. В., Тейлор Н. С., Ондердонк А. Б.: Колит, вызванный Clostridium difficile . Rev Infect Dis 1: 370–378, 1976
Google Scholar
Бартлетт Дж., Чанг Т. В., Гурвит М., Горбач С.Л., Ондердонк А.Б.: Псевдомембранозный колит, связанный с антибиотиками, вызванный токсин-продуцирующими клостридиями.N Engl J Med 298: 531–534, 1978
CAS
PubMed
Google Scholar
Ruddell WSJ, Axon ATR, Findlay JM, Bartholomew BA, Hill MJ: Влияние циметидина на бактериальную флору желудка. Lancet i: 672–674, 1980
Google Scholar
Бьорнеклетт А., Фауса О., Мидтведт Т.: Избыточный бактериальный рост тонкой кишки при постгастрэктомическом синдроме. Сканд Дж Гастроэнтерол.18: 277–287, 1983
CAS
PubMed
Google Scholar
Browning GG, Buchan KA, Mackay C: Влияние ваготомии и дренажа на флору тонкой кишки. Gut 15: 139–142, 1974
CAS
PubMed
Google Scholar
Гринли HB, Гелбарт С.М., ДеОрио А.Дж., Франческатти Д.С., Паес Дж., Рейнхардт Г.Ф.: Влияние хирургии желудка на кишечную флору.Am J Clin Nutr 30: 1826–1833, 1977
CAS
PubMed
Google Scholar
Дин С., Янгс Д., Поксон В., Кейли MRB, Александр-Уильямс Дж., Бердон Д.В.: Циметидин и микрофлора желудка. Брит. J Surg 67: 371, 1980
Google Scholar
Маскрофт Т.Дж., Янгс Д., Бердон Д.В., Кейли MRB. Циметидин и потенциальный риск послеоперационного сепсиса. Br J Surg 68: 557–559, 1982
Google Scholar
Snepar R, Poporad GA, Romana JM, Kobasa WD, Kaye D: Влияние циметидина и антацида на микробную флору желудка. Infect Immun 36: 518–524, 1982
CAS
PubMed
Google Scholar
Ruddell WSJ, Losowsky MS: тяжелая диарея из-за колонизации тонкого кишечника во время лечения циметидином. Брит Мед. Ж. 3: 273, 1980
Google Scholar
Грейси М., Сухарджоно С., Стоун ДЭ: Микробное заражение кишечника.Еще одна особенность неправильного питания. Am J Clin Nutr 26: 1170–1174, 1973
CAS
PubMed
Google Scholar
Амент М.Е., Шимода С.С., Сондерс Д.Р., Рубин К.Е.: Патогенез стеатореи в трех случаях синдрома застоя тонкой кишки. Гастроэнтерол 63: 728–747, 1970
Google Scholar
Goldstein F, Wirts CW, Kowlessar OD: Диабетическая диарея и стеаторея.Микробиологические и клинические наблюдения. Ann Intern Med 72: 215–218, 1970
CAS
PubMed
Google Scholar
Горбач С.Л., Лал Д., Левитан Р.: Микрофлора кишечника при циррозе печени Лаеннека. J Clin Invest 49: 36a, 1970
Google Scholar
Мальдонадо Дж. Э., Грегг Дж. А., Грин PS, Браун А. Л.: Хроническая идиопатическая кишечная псевдообструкция. Am J Med 49: 203–212, 1970
CAS
PubMed
Google Scholar
Whalen GE, Soergel KH, Geenen JE: Диабетическая диарея. Гастроэнтерол 56: 1021–1032, 1969
CAS
Google Scholar
Goldstein F, Cozzolino HJ, Wirts CW: Диарея и стеаторея из-за большого одиночного дивертикула двенадцатиперстной кишки. Am J Dig Dis 8: 937, 1963
CAS
PubMed
Google Scholar
Макэвой А., Даттон Дж., Джеймс О.Ф.У. Бактериальное заражение тонкой кишки — важная причина скрытой мальабсорбции у пожилых людей.Brit Med J 287: 789–793, 1983
CAS
Google Scholar
Роберт Ш., Джеймс О., Джарвис Э. Х .: Синдром избыточного бактериального роста без «слепой петли»: причина недоедания у пожилых людей. Ланцет 2: 1193–1195, 1977
Google Scholar
Polter DE, Boyle JD, Miller LG, Finegold SM: Анаэробные бактерии как причина синдрома слепой петли. История болезни с наблюдениями за реакцией на антибактериальные препараты.Гастроэнтерол 54: 1148–1154, 1968
CAS
Google Scholar
Доусон AM, Иссельбахер KJ: Исследования липидного обмена в тонком кишечнике с наблюдением за ролью солей желчных кислот. J Clin Invest 39: 730–740, 1960
CAS
PubMed
Google Scholar
Дональдсон-младший, Р.М.: Исследования патогенеза стеатореи при синдроме слепой петли.J Clin Invest 44: 1815–1825, 1965
PubMed
Google Scholar
Грейси М: Синдром загрязненной тонкой кишки: патогенез, диагностика и лечение. Am J Clin Nutr 32: 234–243, 1979
CAS
PubMed
Google Scholar
Айзекс Э.Т., Ким С.: Синдром загрязненной тонкой кишки. Am J Med 67: 1049–1057, 1979
CAS
PubMed
Google Scholar
Ким Ю.С., Спритц Н., Блюм М., Терц Дж., Шерлок П.: Роль измененного метаболизма желчных кислот в стеаторее экспериментальной слепой петли. J Clin Invest 45: 956–962, 1966
CAS
PubMed
Google Scholar
Драсар Б.С., Хилл М.Дж., Шайнер М.: Деконъюгация солей желчных кислот кишечными бактериями человека. Lancet 1237–1238, 1966
Овен В., Кроутер Дж. С., Драсар Б. С., Хилл М. Дж .: Разложение желчных солей кишечных бактерий человека.Кишечник 10: 575–576, 1969
CAS
PubMed
Google Scholar
Льюис Р., Горбач С.: Модификация желчных кислот кишечными бактериями. Arch Intern Med 130: 545–548, 1972
CAS
PubMed
Google Scholar
Дональдсон-младший, RM: Мальабсорбция 60 Со-меченый цианокобаламин у крыс с кишечными дивертикулами. I. Эволюция возможных механизмов.Гастроэнтерол 43: 271–281, 1962
CAS
Google Scholar
Дональдсон-младший, Р.М., Корригон Х., Нациос Г.: Мальабсорбция 60 Со-меченного цианокобаламина у крыс с кишечными дивертикулами. II. Исследования содержимого дивертикулов. Гастроэнтерол 43: 282–290, 1962
CAS
Google Scholar
Джаннелла Р.А., Бройтмен С.А., Замчек N: Витамин B 12 Поглощение кишечными микроорганизмами: механизм и отношение к синдромам избыточного бактериального роста в кишечнике.J Clin Invest 50: 1100–1107, 1971
CAS
PubMed
Google Scholar
Schjonsby H, Peters TJ, Hoffbrond AV, Tabaqchali S: Механизм витамина B 12 , мальабсорбция при синдроме слепой петли. Гут 11:37, 1970 (абстракция)
Google Scholar
Welkos S, Toskes P, Baer H: Важность анаэробных бактерий в мальабсорбции кобаламина экспериментального синдрома слепой петли крыс.Гастроэнтерол 80: 313–320, 1981
CAS
Google Scholar
Aarbakke J, Schjonsby H: Значение определения простого фенола в моче и индиканов в диагностике синдрома застойной петли. Scand J Gastroenterol 11: 409–414, 1976
CAS
PubMed
Google Scholar
Goldstein F, Karacadag S, Wirts CW, Kowlessar OD: Внутрипросветное использование d-ксилозы бактериями в тонком кишечнике.Ограничение теста на абсорбцию d-ксилозы. Гастроэнтерол 59: 380–386, 1970
CAS
Google Scholar
Чернов А.Дж., Доу У.Ф., Гомпертц Д.: Летучие жирные кислоты в желудочно-кишечном тракте при синдроме застойной петли. Кишечник 13: 103–106, 1972
CAS
PubMed
Google Scholar
Prizont R, Whitehead JS, Kim YS: Короткоцепочечные жирные кислоты у крыс с слепыми петлями Jejeunal.I. Анализ SCFA в тонком кишечнике, слепой кишке, кале и плазме. Гастроэнтерол 69: 1254–1264, 1975
CAS
Google Scholar
Тоскес П.П., Джаннелла Р.А., Джервис Х.Р., Рут В.Р., Такеучи А: Повреждение слизистой оболочки тонкого кишечника при экспериментальном синдроме слепой петли. Гастроэнтерол 68: 1193–1203, 1975
CAS
Google Scholar
Джаннелла Р.А., Рут В.Р., Тоскес П.П.: Повреждение границы кисти Jejunal и нарушение поглощения сахара и аминокислот при синдроме слепой петли.Гастроэнтерол 67: 965–974, 1974
CAS
Google Scholar
Грейси М., Пападимитриу Дж., Бауэр G: ультраструктурные изменения в тонком кишечнике крыс с самозаполняющимися слепыми петлями. Гастроэнтерол 67: 646–651, 1974
CAS
Google Scholar
Грейси М., Томас Дж., Хоутон М.: Влияние застоя на активность кишечных ферментов. Aust NZ J Med 5: 141–144, 1975
CAS
Google Scholar
Йонас А., Фланаган П.Р., Форстнер Г.Г.: Патогенез повреждения слизистой оболочки при синдроме слепой петли. Активность ферментов щеточной каймы и деградация гликопротеинов. J Clin Invest 60: 1321–1330, 1977
CAS
PubMed
Google Scholar
Джонас А., Кришнан С., Форстнер Г.: Роль неконъюгированных солей желчных кислот и бактериальных белков как причин повреждения слизистой оболочки при синдроме загрязненного кишечника. Гастроэнтерол 72: 1076, 1977, (Abstr)
Google Scholar
Riepe SP, Goldstein J, Alpers DH: Эффект секретируемых протеаз Bacteroides на гидролазы щеточной каймы кишечника человека. J Clin Invest 66: 314–322, 1980
CAS
PubMed
Google Scholar
Klipstein GA: Тропический литник. Гастроэнтерол 1: 946–949, 1968
Google Scholar
Клипштейн Ф.А.: Последние достижения в области тропической мальабсорбции. Scand J Gastroenterol Suppl 6: 93–114, 1970
Google Scholar
Кук GC: Тропический стояк: значение концепции Мэнсона. Дж. Рой Колл. Phys 12: 329–349, 1978
CAS
Google Scholar
Матан В.И., Бейкер С.Дж.: Эпидемия тропического спру и другие эпидемии диареи в деревнях на юге Индии. Am J Clin Nutr 21: 1077–1087, 1968
CAS
PubMed
Google Scholar
Бхат П., Шантакумари С., Раджан Д., Матан В.Л., Кападиа С.Р., Сварнабай С., Бейкер С.Дж.: Бактериальная флора желудочно-кишечного тракта у контрольных субъектов Южной Индии и пациентов с тропическим спру.Гастроэнтерол 62: 11–21, 1972
CAS
Google Scholar
Горбач С.Л., Банвелл Дж. Г., Джейкобс Б., Чаттерджи Б.Д., Митра Р., Сен Н.Н., Гуха Мазумдер Д.Н.: Тропический спру и недоедание в Западной Бенгалии. I. Микрофлора кишечника и абсорбция. Am J Clin Nutr 23: 1545–1558, 1970
CAS
PubMed
Google Scholar
Горбач С.Л., Митра Р., Якобс Б., Банвелл Дж. Г., Чаттерджи Б.Д., Гуха Мазумдер Д. Н.: Бактериальное заражение верхней части тонкой кишки в тропических литочниках.Ланцет 1: 74–77, 1969
CAS
PubMed
Google Scholar
Tomkins AM, Drasar BS, James WPT: Бактериальная колонизация слизистой оболочки тощей кишки в остром тропическом спру. Ланцет I: 59–61, 1975
Google Scholar
Klipstein FA, Holdeman LV, Corcino JJ, Moore WEC: Энтеротоксигенные кишечные бактерии в тропических стояках. Ann Intern Med 79: 632–641, 1973
CAS
PubMed
Google Scholar
Klipstein FA, Goetsch CA, Engert RF, Short HB, Schenk EA: Эффект моноконтаминации стерильных крыс энтеротоксигенными колиформными бактериями. Гастроэнтерол 79: 341–348, 1979
Google Scholar
Банвелл Дж. Г., Горбач С. Л., Митра Р., Касселлс Дж. С., Гуха Мазумдер Д. Н., Томас Дж., Хардли Дж. Х .: Тропический спру и недоедание в Западной Бенгалии. II. Транспорт жидкости и электролитов в тонком кишечнике. Am J Clin Nutr 21: 1559–1568, 1970
Google Scholar
Банвелл Дж. Г., Горбач С. Л.: Тропический литник. Кишечник 10: 328–333, 1969
CAS
PubMed
Google Scholar
Gerson CD, Kent TH, Saha Jr, Siddiqi N, Lindenbaum J: Восстановление структуры и функции тонкой кишки после проживания в тропиках. II. Исследования на индейцах и пакистанцах, живущих в Нью-Йорке. Ann Intern Med 75: 41–48, 1971
CAS
PubMed
Google Scholar
Кук GC: Этиология и патогенез постинфекционной тропической мальабсорбции (тропический спру). Lancet i: 721–723, 1984
Google Scholar
Армстронг Б., Долл Р.: Факторы окружающей среды, заболеваемость и смертность от рака в разных странах, с особыми ссылками на методы питания. Int J Cancer 15: 617–631, 1975
CAS
PubMed
Google Scholar
Беркитт Д.П.: Эпидемиология рака толстой и прямой кишки. Рак 28: 3–13, 1971
CAS
PubMed
Google Scholar
Doll R: Географическое распространение рака. Br J Cancer 23: 1–8, 1969
CAS
PubMed
Google Scholar
Драсар Б.С., Ирвинг Д. Факторы окружающей среды и рак толстой кишки и груди. Br J Cancer 27: 167–172, 1973
CAS
PubMed
Google Scholar
Reddy BS, Mastromarino A, Wynder EL: Дальнейшие исследования метаболической эпидемиологии рака толстой кишки. Cancer Res 35: 3403–3406, 1975
CAS
PubMed
Google Scholar
Виндер Э.Л.: Эпидемиология рака толстой кишки. Cancer Res 35: 3388–3394, 1975
CAS
PubMed
Google Scholar
Виндер Э.Л., Каджитани Т., Исикава С., Додо Х., Такано А. Факторы окружающей среды рака толстой и прямой кишки.Рак 23: 1210–1220, 1969
CAS
PubMed
Google Scholar
Crowther JS, Drasar BS, Hill MJ, MacLennan R, Magnin D, Peach S, Teoh-Chan CH: Фекальные стероиды и бактерии и рак толстой кишки в Гонконге по социально-экономическим группам. J Cancer 34: 191–198, 1976
CAS
Google Scholar
Хензель Р., Берг Дж. У., Сеги М., Курихара М., Локк Ф. Б. Рак толстой кишки на гавайских японцах.J Natl Cancer Inst 51: 1765–1779, 1973
CAS
PubMed
Google Scholar
Драсар Б.С., Дженкинс Д. А. Бактерии, диета и рак толстой кишки. Am J Clin Nutr 29: 1410–1416, 1976
CAS
PubMed
Google Scholar
Хилл MJ: Диета и кишечная бактериальная флора человека. Canc Res 41: 3778–3780, 1981
CAS
Google Scholar
Варго Д., Московиц М., Флок М. Х .: Фекальная бактериальная флора при раке толстой кишки. Кишечник 21: 701–705, 1980
CAS
PubMed
Google Scholar
Hill MJ: Роль анаэробов толстой кишки в метаболизме желчных кислот и стероидов и ее связь с раком толстой кишки. Рак 36: 2387–2400
Weisburger JH: Канцерогены толстой кишки: их метаболизм и механизм действия. Рак 28: 60–70, 1971
CAS
PubMed
Google Scholar
Голдин Б.Р., Горбач С.Л.: Взаимосвязь между диетой и бактериальными ферментами фекалий крыс, участвующими в развитии рака толстой кишки. J Natl Cancer Inst 57: 371–375, 1976
CAS
PubMed
Google Scholar
Laqueur GL, Mickelson O, Whiting MG, Kurland LT: Канцерогенные свойства орехов Cyclos circonilis. J Natl Cancer Inst 31: 919–951, 1963
CAS
PubMed
Google Scholar
Laqueur GL, Spatz M: Токсикология циказина. Cancer Res 28: 2262–2267, 1968
CAS
PubMed
Google Scholar
Laqueur GL: Индукция кишечной неоплазии с помощью гликозида циказина и его агликона. Путь арки Вирхова Анат 340: 151–163, 1965
CAS
PubMed
Google Scholar
Laqueur GL, McDaniel EG, Matsumoto H: индукция опухоли у стерильных крыс с помощью метилазоксиметанола (MAM) и синтетического ацетата MAM.J Natl Cancer Inst 39: 355–371, 1967
CAS
PubMed
Google Scholar
Hill MJ: Бактерии и этиология рака толстой кишки. Рак 34: 815–818, 1974
PubMed
Google Scholar
Hill MJ, Drasar BS, Williams REO: Фекальные желчные кислоты и клостридии у пациентов с раком толстой кишки. Ланцет i: 535–538, 1975
Google Scholar
Кей Р.М.: Влияние диеты на фекальную экскрецию и бактериальную модификацию кислых и нейтральных стероидов, а также последствия для канцерогенеза толстой кишки. Cancer Res 42: 3774–3777, 1981
Google Scholar
Мастромарино А., Редди Б.С., Виндер Е.Л .: Метаболическая эпидемиология рака толстой кишки: ферментативная активность фекальной флоры. Am J Clin Nutr 29: 1455–1460, 1976
CAS
PubMed
Google Scholar
Mower HF, Ray RM, Shoff R, Stemmermann GN, Nomura A, Glober GA, Kamiyama S, Shimada A, Yamakawa H: фекальные желчные кислоты в двух японских популяциях с различным риском рака толстой кишки. Cancer Res 39: 328–331, 1979
CAS
PubMed
Google Scholar
Редди Б.С., Виндер Э.Л.: Канцерогенез толстой кишки: фекальные составляющие населения с различными показателями заболеваемости раком толстой кишки. J Natl Cancer Inst 50: 1437–1442, 1973
CAS
PubMed
Google Scholar
White BA, Lipsky RL, Fricke RJ, Hylemon PB: Специфичность индукции активности 7-альфа-дегидроксилазы желчной кислотой у кишечных видов Eubacterium . Стероиды 35: 103–109, 1980
CAS
PubMed
Google Scholar
Hill MJ: Желчь, бактерии и рак кишечника. Gut 24: 871–875, 1983
CAS
PubMed
Google Scholar
Вильпарт М., Маинге П., Маскенс А, Роберфроид М.: Мутагенность 1,2-диметилгидразина по отношению к Salmonella typhimurium , ко-мутагенный эффект вторичных желчных кислот.Канцерогенез 4: 45–48, 1983
CAS
PubMed
Google Scholar
Weisburger JH, Grantham PM, Horton RE, Weisburger EK: Метаболизм канцерогена N-гидрокси-N-2-флуоренилацетамида у свободных от микробов крыс. Biochem Pharmacol 19: 151–162, 1970
CAS
PubMed
Google Scholar
Фишер Л.Дж., Миллберн П., Смит Р.Л., Уильямс Р.Т.: Судьба (1 4 C) стильбэстриола у крысы.Biochem J 100: 698, 1966
Google Scholar
Granthame PH, Horton RE, Weisberger EK, Weisberger JH: Метаболизм канцерогена N-2-фторенилацетамида у свободных от микробов и обычных крыс. Biochem Pharmacol 19: 163–171, 1976
Google Scholar
Reddy BS, Weisburger JH, Wynder EL: Фекальная бактериальная бета-глюкуронидаза: контроль с помощью диеты. Наука 183: 416–417, 1974
CAS
PubMed
Google Scholar
Gillette JR, Kamm JJ, Sasame HA: Механизм восстановления p-нитробензоата у мышей: возможная роль цитохрома P-450 в микросомах печени. Mol Pharmacol 4: 541–548, 1968
CAS
PubMed
Google Scholar
Като Р., Осима Р., Таканара А: Исследования механизма восстановления нитро в печени крысы. Mol Pharmacol 5: 487–494, 1962
Google Scholar
Weisburger JH, Weisburger EK: Биохимические, образовательные и фармакологические, токсикологические и патологические свойства гидроксиламинов и гидроксамовой кислоты. Pharmacol Rev 25: 1, 1973
CAS
PubMed
Google Scholar
Голдин Б., Дуайер Дж, Горбач С.Л., Гордон В., Свенсон Л.: Влияние диеты и возраста на фекальные бактериальные ферменты. Am J Clin Nutr 31: S136-S140, 1978
CAS
PubMed
Google Scholar
Голдин Б.Р .: Роль диеты и кишечной флоры в этиологии рака толстой кишки. Международный симпозиум по колоректальному раку (Abstr), Нью-Йорк, 1979 г.
Голдин Б.Р., Горбач С.Л.: Диета и ее влияние на ферменты, связанные с раком толстой кишки. Пищеварение 16 (3): 240–241, 1977 (тезисы)
Google Scholar
Редди Б.С., Нарисава Т., Вайсбергер Дж. Х .: Влияние диеты с высоким уровнем белка и жира на канцерогенез толстой кишки у крыс F344, получавших 1,2-диметилгидразин.J Natl Cancer Inst 57: 567–569, 1976
CAS
PubMed
Google Scholar
Редди Б.С., Нарисава Т., Райт П., Юкусич Д., Вайсбургер Дж. Х., Виндер Е.Л .: Канцерогенез толстой кишки с азоксиметаном и диметилгидразином у стерильных крыс. Cancer Res 35: 287–290, 1975
CAS
PubMed
Google Scholar
Голдин Б.Р., Горбач С.Л.: Влияние пищевых добавок Lactobacillus acidophilus на индуцированный 1,2-диметилгидразина дигидрохлорид рак кишечника у крыс.J Natl Cancer Inst 64: 263–265, 1980
CAS
PubMed
Google Scholar
Reddy BS, Watanabe K: Влияние микрофлоры кишечника на 3,2′-диметил-4-аминобифенил-индуцированный канцерогенез у крыс F344. J Natl Cancer Inst 61: 1269–1271, 1978
CAS
PubMed
Google Scholar
Редди Б.С., Омори Т .: Влияние микрофлоры кишечника и пищевых жиров на 3,2′-диметил-4-аминобифенил-индуцированный канцерогенез толстой кишки у крыс F344.Cancer Res 41: 1363–1367, 1981
CAS
PubMed
Google Scholar
Голдин Б.Р., Свенсон Л., Дуайер Дж., Секстон М., Горбач С.Л.: Влияние диеты и добавок Lactobacillus на бактериальные ферменты фекалий человека. J Natl Cancer Inst 64: 255–262, 1980
CAS
PubMed
Google Scholar
Голдин Б.Р., Горбач С.Л.: Влияние антибиотиков на частоту возникновения опухолей кишечника у крыс, вызванных дигидрохлоридом 1,2-диметилгидразина.J Natl Cancer Inst 67: 877–880, 1981
CAS
PubMed
Google Scholar
Takada H, Hirook T, Hiramatsu Y, Yamamato M: Влияние ингибитора бета-глюкуронидазы на индуцированный азоксиметаном ингибитор канцерогенеза толстой кишки на индуцированный азоксиметаном канцерогенез толстой кишки у крыс. Cancer Res 42: 331–334, 1982
CAS
PubMed
Google Scholar
Отчет Международного агентства по исследованию рака Группа кишечной микроэкологии: пищевые волокна, время прохождения, фекальные бактерии, стероиды и рак толстой кишки в двух скандинавских популяциях.Lancet II: 207–211, 1977
Голдин Б.Р., Горбач С.Л.: Изменения ферментов фекальной микрофлоры, связанные с диетой, возрастом, добавками Lactobacillus и диметилгидразином. Рак 40: 2421–2426, 1977
CAS
PubMed
Google Scholar
Брюс В.Р., Дион П.В.: Исследования, касающиеся фекального мутагена. Am J Clin Nutrition 33: 2511–2512, 1980
CAS
Google Scholar
Брюс В.Р., Варгез А.Дж., Феррер А., Land PC: мутаген в фекалиях нормальных людей.
Kuhnlein U, Bergstrom D, Kuhnlein H: Мутагены в фекалиях вегетарианцев и невегетарианцев. Mutation Res 85: 1–12, 1981
CAS
PubMed
Google Scholar
Mower HF, Ichinotsubo D, Wang LW, Mandel M, Stemmermann G, Nomura A, Heilbrun L, Kamiyama S, Shimada A: Фекальные мутагены в двух японских популяциях с различным риском рака толстой кишки.Cancer Res 42: 1164–1169, 1982
CAS
PubMed
Google Scholar
Ван Тассел Р.Л., Макдональд Д.К., Уилкинс Т.Д .: Производство фекального мутагена с помощью Bacteroides spp . Infect Immun 37: 975–980, 1982
PubMed
Google Scholar
Хираи Н., Кингстон Г.И., Ван Тасселл Р.Л., Уилкинс Т.Д.: Выявление структуры сильнодействующего мутагена из человеческих фекалий.J Amer Chem Soc 104: 6150–6154, 1982
Google Scholar
Adlercreutz H, Martin F: Эстроген в фекалиях беременных человека. Acta Endocrinologica 83: 410–419, 1976
CAS
PubMed
Google Scholar
Ломбарди П., Голдин Б., Бутин Е., Горбач С.Л.: метаболизм андрогенов и эстрогенов фекальными микроорганизмами человека. J Steroid Biochem 9: 795–801, 1978
CAS
PubMed
Google Scholar
Sandberg AA, Slaunwhite Jr, WR: Исследования фенольных стероидов на людях. VII. Метаболическая судьба эстриола и его глюкуронида. J Clin Invest 44: 694–702, 1965
CAS
PubMed
Google Scholar
Inoue N, Sandberg AA, Graham JB, Slaunwhite Jr, WR: Исследования фенольных стероидов на людях. IX. Роль кишечника в конъюгации эстриола. J Clin Invest 48: 390–396, 1969
CAS
PubMed
Google Scholar
Goldin BR, Adlercreutz H, Gorbach SL, Warram JH, Dyer JT, Swenson L, Woods MN: Модели экскреции эстрогена и уровень в плазме у вегетарианцев и всеядных женщин. N Engl J Med 307: 1542–1547, 1982
CAS
PubMed
Google Scholar
Adlercreutz H, Martin F, Tikkanen MJ, Pulkkinen M: Влияние введения ампициллина на выведение двенадцати эстрогенов с мочой беременных. Acta Endocrinologica 80: 551–557, 1975
CAS
PubMed
Google Scholar
Pulkkinen MO, Willman K: Уровни материнского эстрогена во время лечения пенициллином. Br Med J 4:48, 1971
CAS
PubMed
Google Scholar
Пулккинен М.О., Уиллман К. Снижение экскреции материнского эстрогена с помощью неомицина. Am J Ob Gyn 115: 1153, 1973
CAS
Google Scholar
Adlercreutz H, Martin F, Lehtinen T, Tikkanen MJ, Pulkkinen MO: Влияние введения ампициллина на уровни конъюгированного и неконъюгированного эстрогена и прогестерона в плазме при беременности.Am J Obstet Gynecol 128: 266–271, 1977
CAS
PubMed
Google Scholar
Мартин Ф., Пелтонен Дж., Лаатикайнен Т., Пулккинен М., Адлеркрейц Х: Экскреция метаболитов прогестерона и эстриола с фекалиями беременных женщин во время введения ампициллина. J Steroid Biochem 6: 1339–1346, 1975
CAS
PubMed
Google Scholar
Мартин Ф., Бхаргава А.С., Адлеркрейц Н: Метаболизм андрогенов у гончей: эндогенные метаболиты C190 2 в желчи и фекалиях и эффект введения ампициллина.J Steroid Biochem 8: 753–760, 1977
CAS
PubMed
Google Scholar
Доссетар Дж .: Лекарственное взаимодействие с оральными контрацептивами. Br Med J 4: 467–468, 1975
Google Scholar
Микробиота ядра кишечника взрослого человека определяется глубиной анализа и состоянием здоровья.
Резюме
В настоящее время используются высокопроизводительные молекулярные методы для характеристики сложной и очень индивидуальной кишечной микробиоты в условиях здоровья и болезней.Определение основной микробиоты кишечника человека, то есть количества и идентичности бактерий, которые являются общими для разных людей, в настоящее время является одним из основных вопросов исследования. Здесь мы применяем филогенетический микрочип с высокой пропускной способностью для комплексного анализа микробиоты с высоким разрешением, а также новый вычислительный подход к количественному исследованию основной микробиоты у более чем 100 человек. В представленном подходе мы изучаем, как критерии численности или распространенности филотипов влияют на полученное ядро параллельно с биологическими переменными, такими как количество и состояние здоровья субъектов исследования.Мы заметили, что размер ядра весьма условен, в основном он зависит от глубины анализа и требуемой распространенности основных таксонов. Кроме того, на размер ядра также влияют биологические переменные, из которых состояние здоровья имело большее влияние, чем количество изучаемых субъектов. Мы также представляем вычислительный метод, который оценивает ожидаемый размер керна с учетом меняющихся критериев распространенности и численности. Подход напрямую применим к данным секвенирования, полученным из кишечных и других связанных с хозяином микробных сообществ, и может быть изменен для включения более информативных определений основной микробиоты.Следовательно, мы ожидаем, что его использование облегчит концептуальное определение основной микробиоты и ее последующую характеристику, так что будущие исследования дадут окончательные взгляды на микробиоту ядра кишечника, устраняя текущие противоречия.
Ключевые слова:
16S рРНК
основная микробиота
здоровье
кишечная микробиота
филогенетический микрочип
Рекомендуемые статьи Цитирующие статьи (0)
Просмотр аннотации
Copyright © 2012 European Society of Clinise Infectious.Опубликовано Elsevier Ltd.
Рекомендуемые статьи
Цитирующие статьи
Микробиота кишечника в первое десятилетие жизни
Основные моменты
Микробиота кишечника здоровых детей имеет функциональные и таксономические отличия от микробиоты взрослых, что позволяет предположить что микробиом кишечника может развиваться медленнее, чем считалось ранее.
Bifidobacterium spp. в кишечной микробиоте детей больше, чем у взрослых, и могут постепенно уменьшаться до достижения зрелого возраста.
У одних детей микробиота может развиваться медленнее, чем у других, что может иметь промежуточное состояние микробиоты.
Детство может предоставить дополнительные возможности для вмешательств, основанных на микробиоте, для укрепления здоровья или предотвращения отклонений микробиоты.
Микробиота кишечника детей может быть более податливой к факторам окружающей среды, чем микробиота взрослых.
Различия в образе жизни и, в частности, вестернизация сильно влияют на состав популяций кишечных микробов у детей, как уже сообщалось для взрослых.
Понимание важности микробиома кишечника растет, и становится все более актуальным определение профилактических или терапевтических решений, нацеленных на него. Состав и функция кишечной микробиоты относительно хорошо описаны для младенцев (до 3 лет) и взрослых, но в значительной степени упускаются из виду у детей дошкольного (3–6 лет) и младшего школьного возраста (6–12 лет). , а также подростки (12–18 лет). Ранние отчеты предполагали, что детская микробиота приобретет структуру, подобную взрослой в возрасте 3 лет, но недавние исследования показали, что развитие микробиоты может занять больше времени.Это время развития имеет ключевое значение, потому что есть данные, позволяющие предположить, что отклонения в этом развитии могут иметь последствия в дальнейшей жизни. В этом обзоре мы представляем обзор текущих знаний о кишечной микробиоте, ее эволюции, вариациях и реакции на диетические проблемы в течение первого десятилетия жизни с акцентом на здоровых детей дошкольного и младшего школьного возраста (до 12 лет). лет) из разных популяций по всему миру. Эти знания должны облегчить определение диетических подходов, ориентированных на людей этой возрастной группы, чтобы способствовать развитию здоровой микробиоты в более позднем возрасте.
Ключевые слова
кишечная микробиота
дети
эволюция
здоровье
пластичность
вмешательство
Рекомендуемые статьи Цитирующие статьи (0)
Просмотр аннотации
© 2019 Автор (ы). Опубликовано Elsevier Ltd.
Рекомендуемые статьи
Ссылки на статьи
Разнообразие, состав и функциональные различия между кишечной микробиотой детей и взрослых
Carroll, I.М., Чанг, Ю.-Х., Парк, Дж., Сартор, Р. Б. и Рингель, Ю. Микробиота кишечника, связанная с просветом и слизистыми оболочками, у пациентов с синдромом раздраженного кишечника с преобладанием диареи. Gut Pathog. 2 , 19 (2010).
PubMed
PubMed Central
Статья
Google Scholar
Кэрролл И. М. и др. . Молекулярный анализ микробиоты кишечника, связанной с просветом и слизистыми оболочками, при синдроме раздраженного кишечника с преобладанием диареи. Am. J. Physiol. Гастроинтест. Печень. Physiol. 301 , G799 – G807 (2011).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Франк, Д. Н. и др. . Фенотип и генотип заболевания связаны со сдвигами в кишечной микробиоте при воспалительных заболеваниях кишечника. Inflamm. Кишечник. 17 , 179–184 (2011).
PubMed
Статья
PubMed Central
Google Scholar
Франк, Д. Н. и др. . Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc. Natl. Акад. Sci. США 104 , 13780–13785 (2007).
ADS
CAS
PubMed
Статья
PubMed Central
Google Scholar
Кассинен А. и др. . Микробиота кала пациентов с синдромом раздраженного кишечника значительно отличается от таковой здоровых людей. Гастроэнтерология 133 , 24–33 (2007).
CAS
PubMed
Статья
Google Scholar
Mai, V. et al. . Микробиота кала у недоношенных детей до некротического энтероколита. PloS One 6 , e20647 – e20647 (2011).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Малинен, Э. и др. . Анализ фекальной микробиоты пациентов с синдромом раздраженного кишечника и здоровых людей в контрольной группе с помощью ПЦР в реальном времени. Am. J. Gastroenterol. 100 , 373 (2005).
ADS
CAS
PubMed
Статья
Google Scholar
Рингель Ю. и Кэрролл И. М. Изменения микробиоты кишечника и функциональные симптомы кишечника. Гастроинтест. Endosc. Clin. N. Am. 19 , 141–150 (2009).
PubMed
Статья
PubMed Central
Google Scholar
Свидсински, А., Ленинг-Бауке, В., Верстрален, Х., Осовска, С., Дёрффель, Ю. Биоструктура фекальной микробиоты у здоровых субъектов и пациентов с хронической идиопатической диареей. Гастроэнтерология 135 , 568–579 (2008).
PubMed
Статья
PubMed Central
Google Scholar
Каллиомяки М., Кармен Колладо М., Салминен С. и Исолаури Е. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am. J. Clin. Nutr. 87 , 534–538 (2008).
PubMed
Статья
Google Scholar
Ley, R.E., Turnbaugh, P.J., Klein, S. & Gordon, J.I. Микробы кишечника человека, связанные с ожирением. Nature 444 , 1022–1023 (2006).
ADS
CAS
PubMed
Статья
Google Scholar
Penders, J. et al. . Состав кишечной микробиоты и развитие атопических проявлений в младенчестве: когортное исследование KOALA Birth Cohort Study. Кишечник 56 , 661–667 (2007).
CAS
PubMed
Статья
Google Scholar
Тернбо, П. Дж. и др. .Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Nature 444 , 1027–1031 (2006).
ADS
PubMed
Статья
Google Scholar
Ваэль, К. и Десагер, К. Важность развития кишечной микробиоты в младенчестве. Curr. Opin. Педиатр. 21 , 794–800 (2009).
PubMed
Статья
Google Scholar
Ван, М. и др. . Уменьшение разнообразия в ранней фекальной микробиоте младенцев с атопической экземой. J. Allergy Clin. Иммунол. 121 , 129–134 (2008).
PubMed
Статья
Google Scholar
Флок, М. Х. Достижения в кишечной микроэкологии. Nutr. Clin. Практик. 27 , 193–194 (2012).
PubMed
Статья
Google Scholar
Рингель-Кулька, Т. Нацеленность на кишечную микробиоту в педиатрической популяции. Nutr. Clin. Практик. 27 , 226–234 (2012).
PubMed
Статья
PubMed Central
Google Scholar
Палмер, К., Бик, Э. М., ДиДжиулио, Д. Б., Релман, Д. А. и Браун, П. О. Развитие кишечной микробиоты младенца у человека. PLoS Biol. 5 , e177 – e177 (2007).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Тиихонен К., Оувеханд А. С. и Раутонен Н. Микробиота кишечника человека и здоровое старение. Aging Res. Ред. 9 , 107–116 (2010).
PubMed
Статья
PubMed Central
Google Scholar
Яцуненко Т. и др. . Микробиом кишечника человека в зависимости от возраста и географии. Природа 486 , 222–227 (2012).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Козырский А. Л., Эрнст П. и Беккер А. Б. Повышенный риск детской астмы в результате использования антибиотиков в раннем возрасте. Сундук 131 , 1753–1759 (2007).
PubMed
Статья
Google Scholar
Risnes, K. R., Belanger, K., Murk, W. & Bracken, M. B. Воздействие антибиотиков через 6 месяцев и астма и аллергия через 6 лет: данные в когорте из 1401 ребенка в США. Am. J. Epidemiol. 173 , 310–318 (2011).
PubMed
Статья
Google Scholar
Hviid, A., Svanström, H. & Frisch, M. Использование антибиотиков и воспалительные заболевания кишечника в детстве. Кишечник 60 , 49–54 (2011).
PubMed
Статья
Google Scholar
Коойман, М. Н. и др. . Исследование поколения R: дизайн и когортное обновление 2017. евро.J. Epidemiol. 31 , 1243–1264 (2016).
PubMed
Статья
Google Scholar
Икрам, М.А. и др. . Роттердамское исследование: обновленная информация о целях, дизайне и основных результатах за 2018 год. евро. J. Epidemiol. 32 , 807–850 (2017).
PubMed
PubMed Central
Статья
Google Scholar
Фадрош Д.W. и др. . Улучшенный подход двойной индексации для мультиплексного секвенирования гена 16S рРНК на платформе Illumina MiSeq. Микробиом 2 , 6 (2014).
PubMed
PubMed Central
Статья
Google Scholar
Caporaso, J. G. et al. . QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Нат. Методы 7 , 335–336 (2010).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Edgar, R.C. UPARSE: высокоточные последовательности OTU, полученные при считывании микробных ампликонов. Нат. Методы 10 , 996–998 (2013).
CAS
PubMed
Статья
Google Scholar
Schmieder, R., Lim, Y. W., Rohwer, F. & Edwards, R. TagCleaner: Идентификация и удаление последовательностей тегов из наборов геномных и метагеномных данных. Биоинформатика BMC 11 , 341–341 (2010).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Zhang, J., Kobert, K., Flouri, T. & Stamatakis, A. PEAR: быстрое и точное слияние Illumina Paired-End reAd mergeR. Биоинформатика 30 , 614–620 (2014).
CAS
PubMed
Статья
Google Scholar
Quast, C. et al. . Проект базы данных генов рибосомных РНК SILVA: улучшенная обработка данных и веб-инструменты. Nucleic Acids Res. 41 , D590 – D596 (2013).
CAS
PubMed
Статья
Google Scholar
Ван, К., Гаррити, Г. М., Тидже, Дж. М. и Коул, Дж. Р. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. Прил. Environ. Microbiol. 73 , 5261–5267 (2007).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Бенсон А.К. и др. . Индивидуальность в составе микробиоты кишечника — это сложный полигенный признак, сформированный множеством факторов окружающей среды и генетических факторов хозяина. Proc. Natl. Акад. Sci. США 107 , 18933–18938 (2010).
ADS
CAS
PubMed
Статья
PubMed Central
Google Scholar
Бокулич Н.А. и др. . Качественная фильтрация значительно улучшает оценки разнообразия при секвенировании ампликонов Illumina. Нат. Методы 10 , 57–59 (2013).
CAS
PubMed
Статья
PubMed Central
Google Scholar
R Фонд статистических вычислений, Вена, Австрия. Язык и среда для статистических вычислений, https://www.R-project.org (2010).
Оксанен, Дж. и др. . Веган: пакет «Экология сообщества», http://CRAN.R-project.org/package=vegan (2013).
Мак-Мерди, П. Дж. И Холмс, С. Филосек: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PloS One 8 , e61217 – e61217 (2013).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Morgan, X.C. et al. . Дисфункция кишечного микробиома при воспалительном заболевании кишечника и лечении. Genome Biol. 13 , R79 – R79 (2012).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Stokholm, J. et al. . Созревание микробиома кишечника и риск астмы в детстве. Нат. Commun. 9 , 141 (2018).
ADS
PubMed
PubMed Central
Статья
CAS
Google Scholar
Fu, J. и др. . Микробиом кишечника вносит значительный вклад в изменение липидов крови. Circ. Res. 117 , 817–824 (2015).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Жернакова А. и др. . Популяционный метагеномический анализ выявляет маркеры состава и разнообразия кишечного микробиома. Наука 352 , 565–569 (2016).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Falony, G. et al. . Популяционный анализ изменчивости микробиома кишечника. Наука 352 , 560–564 (2016).
ADS
CAS
PubMed
Статья
Google Scholar
Medina-Gomez, C. et al. . Костная масса и сила у детей школьного возраста демонстрируют половой диморфизм, связанный с различиями в мышечной массе: исследование поколения R. J. Bone Miner. Res. 31 , 1099–1106 (2016).
PubMed
Статья
PubMed Central
Google Scholar
Medina-Gómez, C. et al. . Локусы BMD вносят вклад в этнические различия и различия в развитии хрупкости скелета в разных популяциях: оценка давления эволюционного отбора. Мол. Биол. Evol. 32 , 2961–2972 (2015).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Langille, M.G.I. et al., . Прогнозирующее функциональное профилирование микробных сообществ с использованием последовательностей маркерного гена 16S рРНК. Нат. Biotechnol. 31 , 814–821 (2013).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Abubucker, S. et al. . Метаболическая реконструкция метагеномных данных и ее применение к микробиому человека. PLoS Comput.Биол. 8 , e1002358 – e1002358 (2012).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Сегата, Н. и др. . Открытие и объяснение метагеномных биомаркеров. Genome Biol. 12 , R60 (2011).
PubMed
PubMed Central
Статья
Google Scholar
Эверард, А. и др. .Взаимодействие между Akkermansia muciniphila и кишечным эпителием контролирует ожирение, вызванное диетой. Proc. Natl. Акад. Sci. США 110 , 9066–9071 (2013).
ADS
CAS
PubMed
Статья
PubMed Central
Google Scholar
Андерсон, К. Л. и Салиерс, А. А. Биохимические доказательства того, что расщепление крахмала Bacteroides thetaiotaomicron включает участки связывания крахмала на внешней мембране и ферменты, разрушающие периплазматический крахмал. J. Bacteriol. 171 , 3192–3198 (1989).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Chung, W. S. F. et al. . Модуляция микробиоты кишечника человека пищевыми волокнами происходит на уровне видов. BMC Biol. 14 , 3 (2016).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Коропаткин Н. М., Камерон Э. А. и Мартенс Э. С. Как метаболизм гликанов формирует микробиоту кишечника человека. Нат. Rev. Microbiol. 10 , 323–335 (2012).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Xu, J. et al. . Эволюция симбиотических бактерий в дистальном отделе кишечника человека. PLoS Biol. 5 , e156 – e156 (2007).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Мартинес, И. и др. . Состав микробиома кишечника связан с иммунологическими улучшениями, вызванными цельным зерном. ISME J. 7 , 269–280 (2013).
PubMed
Статья
CAS
Google Scholar
Чен, В., Лю, Ф., Линг, З., Тонг, X. и Сян, К. Микробиота, связанная с просветом кишечника человека и слизистой оболочкой, у пациентов с колоректальным раком. PloS One 7 , e39743 – e39743 (2012).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Murri, M. et al. . Микробиота кишечника у детей с диабетом 1 типа отличается от таковой у здоровых детей: исследование случай-контроль. BMC Med. 11 , 46 (2013).
ADS
PubMed
PubMed Central
Статья
Google Scholar
Хоу, А.Ю., Качмарек, Дж. Л., Хан, Н. А. и Хольшер, Х. Д. Пищевые волокна и микробиота желудочно-кишечного тракта человека как предикторы здоровья костей. FASEB J. 31 , фунт 322 (2017).
Артикул
Google Scholar
Bajaj, J. S. et al. . Микробиом слизистой оболочки толстой кишки отличается от микробиома кала при циррозе и печеночной энцефалопатии и связан с познанием и воспалением. Am. J. Physiol.Гастроинтест. Liver Physiol. 303 , G675 – G685 (2012).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Hong, P.-Y., Croix, J. A., Greenberg, E., Gaskins, H. R. & Mackie, R. I. Анализ микробиоты слизистой оболочки здоровых людей на основе пиросеквенирования выявляет повсеместные бактериальные группы и микрогетерогенность. PloS One 6 , e25042 – e25042 (2011).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Никайдо, Х. Наружный мембранный барьер как механизм противомикробной устойчивости. Антимикробный. Агенты Chemother. 33 , 1831–1836 (1989).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Шиварамайах, Х. С., Релхан, Н., Патенгей, А., Мохан, Н. и Флинн, Х. В. Эндофтальмит, вызванный грамположительными бактериями, устойчивыми к ванкомицину: клинические условия, возбудители, чувствительность к антимикробным препаратам и результаты лечения. Am. J. Ophthalmol. Case Rep. 10 , 211–214 (2018).
PubMed
PubMed Central
Статья
Google Scholar
Врона, И. Е., Агуридас, В. и Панек, Дж. С. Дизайн и синтез ансамициновых антибиотиков. C. R. Chim. 11 , 1483–1522 (2008).
CAS
Статья
Google Scholar
Huttenhower, C. et al. . Структура, функции и разнообразие микробиома здорового человека. Природа 486 , 207–214 (2012).
ADS
CAS
Статья
Google Scholar
Кэрролл И.М., Рингель-Кулька Т., Сиддл, Дж. П., Клаенхаммер, Т. Р. и Рингель, Ю. Характеристика фекальной микробиоты с помощью высокопроизводительного секвенирования показывает стабильное микробное сообщество во время хранения. PloS One 7 , e46953 – e46953 (2012).
ADS
CAS
PubMed
PubMed Central
Статья
Google Scholar
Доминианни, К., Ву, Дж., Хейс, Р. Б. и Ан, Дж. Сравнение методов сбора биологических образцов фекального микробиома. BMC Microbiol. 14 , 103 (2014).
PubMed
PubMed Central
Статья
Google Scholar
Gorzelak, M.A. et al. . Методы улучшения данных микробиома кишечника человека за счет уменьшения вариабельности за счет обработки образцов и хранения стула. PloS One 10 , e0134802 – e0134802 (2015).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Лаубер, К. Л., Чжоу, Н., Гордон, Дж. И., Найт, Р. и Фирер, Н. Влияние условий хранения на оценку структуры бактериального сообщества в почве и пробах, связанных с человеком. FEMS Microbiol. Lett. 307 , 80–86 (2010).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Sinha, R. et al. . Сбор образцов кала для анализа микробиома в эпидемиологических исследованиях. Cancer Epidemiol. Биомаркеры Пред. 25 , 407–416 (2016).
PubMed
Статья
Google Scholar
Теджо Д. И. и др. . Влияние отбора и хранения образцов на состав фекальной микробиоты у здоровых и больных людей. PloS One 10 , e0126685 – e0126685 (2015).
PubMed
PubMed Central
Статья
CAS
Google Scholar
Costea, P. I. et al. . К стандартам обработки образцов фекалий человека в метагеномных исследованиях. Нат. Biotechnol. 35 , 1069–1076 (2017).
CAS
PubMed
Статья
Google Scholar
Santiago, A. et al. . Обработка проб фекалий: шаг вперед к стандартам анализа микробного сообщества. BMC Microbiol. 14 , 112 (2014).
PubMed
PubMed Central
Статья
Google Scholar
Sinha, R. и др. . Оценка вариации в последовательности ампликонов микробного сообщества консорциумом проекта Microbiome Quality Control (MBQC). Нат. Biotechnol. 35 , 1077–1086 (2017).
CAS
PubMed
PubMed Central
Статья
Google Scholar
Микробные изменения кишечника, взаимодействия и их влияние на жизненный цикл человека: взгляд на старение
Микробиота кишечника формируется во время рождения и развивается с возрастом, в основном поддерживая комменсальные отношения с хозяином.Растущее количество клинических данных свидетельствует о сложной взаимосвязи между микробиотой кишечника и иммунной системой. По мере старения микробиота кишечника развивает значительный дисбаланс в основных типах, таких как анаэробные Firmicutes и Bacteroidetes, а также в разнообразных факультативных организмах, что приводит к нарушению иммунных ответов. Противомикробная терапия обычно используется для лечения инфекций; однако это также может привести к потере нормальной кишечной флоры. Пожилой возраст, употребление антибиотиков, основные заболевания, инфекции, гормональные различия, циркадный ритм и недоедание, как по отдельности, так и в сочетании, усугубляют проблему.Эту неблагоприятную модуляцию желудочно-кишечного тракта можно обратить вспять путем разумного и контролируемого использования антибиотиков и надлежащего использования пребиотиков и пробиотиков. В определенных постоянных, повторяющихся условиях можно изучить возможность трансплантации фекальной микробиоты. Цель настоящего обзора — сосредоточить внимание на формировании и изменении микробиоты кишечника с возрастом. В обзоре также обсуждается потенциальная роль микробиоты кишечника в регулировании иммунной системы, а также ее функции в здоровом и болезненном состоянии.
1. Введение
Человеческое тело содержит широкий спектр видов бактерий, в меньшей степени представленных вирусными и эукариотическими микробами, которые называются «микробным банком». Поскольку кишечник человека является местом обитания большинства микробов, его можно рассматривать как «микробный орган». Все микробы кишечника вместе известны как «микробиота кишечника», и связанные с ними геномы представляют «микробиом кишечника». Ранее количество бактерий у здорового взрослого человека оценивалось от 10 14 до 10 15 клеток.Однако в недавно пересмотренном [1] бактериальная нагрузка у здорового взрослого человека (с использованием объема и массы в качестве переменных) оценивалась примерно в 3 × 10 13 бактериальных клеток у взрослого человека весом 70 кг. Микробиота не является однородной популяцией микроорганизмов; скорее, он состоит из сложного ряда микробных сообществ, которые взаимодействуют друг с другом, а также с хозяином таким образом, что это влияет на его здоровье [2]. Bacteroidetes и Firmicutes — основные бактериальные филы с подгруппами, такими как Fusobacteria, Cyanobacteria, Proteobacteria, Verrucomicrobia, Actinobacteria и некоторые другие.
Здоровый кишечник относительно стабилен на протяжении всей взрослой жизни, но с процессом старения возникают нарушения из-за экзогенных факторов, таких как использование антибиотиков и диета, и эндогенных факторов, таких как клеточный стресс. Старение и связанные с ним осложнения являются основными проблемами общественного здравоохранения во всем мире [3]. Старение сопровождается серьезными физиологическими изменениями, такими как изменение микробного состава кишечника (дисбиоз), иммунные ответы и метаболизм, которые могут приводить к различным воспалительным состояниям желудочно-кишечного тракта (ЖКТ) и аутоиммунным нарушениям [4, 5].Обычный пороговый возраст для определения пожилых людей или пожилых людей превышает 63–76 лет, и примерно в этом возрасте микробиота кишечника теряет свою относительную стабильность [6, 7]. Любые различия в составе с возрастом оказывают прямое влияние на перистальтику кишечника и пищеварение [8]. Процессы брожения в толстой кишке ухудшаются из-за изменений микробиоты. Это влияет на гомеостаз кишечника, приводя к старению иммунной системы (снижению иммунных ответов) и старению воспаления, то есть к воспалительной реакции слабой степени [9–11].В настоящем обзоре мы сосредоточены на формировании и изменении микробиоты кишечника с возрастом. Кроме того, в обзоре также обсуждается потенциальная роль микробиоты в регулировании иммунной системы и ее функции в здоровом и болезненном состоянии.
2. Микробиота и старение
2.1. Младенчество
Стерильный период (в жизненном цикле человека) — это период беременности, когда плод растет в матке и остается толерантным к материнским антигенам. Однако несколько исследований подтвердили присутствие некоторых бактерий в околоплодных водах матки, но их количество и разнообразие оказались слишком низкими, чтобы показать какое-либо влияние на колонизацию кишечника младенца [2, 12].
Первоначальная колонизация на коже организмами окружающей среды происходит сразу после родов, после чего следует колонизация кишечника под влиянием материнских и диетических факторов. На характер и степень неонатальной колонизации также влияет способ родоразрешения, будь то вагинальный или инструментальный метод (рис. 1). Во время вагинальных родов исследования продемонстрировали присутствие видов Lactobacillus, , за которыми следовали видов Prevotella и Sneathia [2, 23, 24].После кесарева сечения (кесарево сечение) в кишечнике было обнаружено больше Staphylococcus , Propionibacterium и Corynebacterium и большое количество Clostridium difficile и Escherichia coli по сравнению с родившимися младенцами 25 , 26].
Возможная основа создания бактериальных сообществ в кишечнике была описана в исследовании [24], в котором они наблюдали за двумя здоровыми младенцами с рождения в течение 10 месяцев.Скрининг с использованием образцов фекалий, полимеразной цепной реакции и денатурирующего градиентного гель-электрофореза (ПЦР-DGGE) выявил термофилов Streptococcus, Ruminococcus gnavus, и Enterococcus raffinosus преимущественно на протяжении всего исследования. В образцах фекалий на 3-й и 4-й день наблюдалась быстрая колонизация бифидобактериальными видами, которые оставались сильными в течение 3 месяцев у обоих младенцев. По прошествии 3 месяцев доминантно колонизировалось видов Clostridium , что противоречило теории, основанной на культуре.Согласно данным, полученным на основе культур, Enterobacterium (грамположительный) был первым колонизатором, который создал и поддерживал стабильную среду для роста Bacteroidetes, Bifidobacterium, и Clostridium у младенцев. Однако исследование, зависящее от культуры или независимое, объясняет, что колонизация кишечника у младенцев демонстрирует низкое разнообразие, нестабильность и высокую динамику [27, 28]. Эти эксперименты проводились с использованием ДНК из образцов фекалий 13 младенцев в возрасте 1, 3 и 7 месяцев, что указывало на то, что микробиота кишечника стабильна в течение этого периода времени, хотя наблюдалась индивидуальная вариабельность [29].Введение антибиотиков влияет на колонизацию кишечника младенца. У младенцев, которым вводили антибиотики, меньше молочнокислых бактерий и энтерококков [1].
Известно, что помимо использования антибиотиков, диета также играет важную роль в колонизации кишечных микробов. Кишечник младенцев, которых кормили грудью, преимущественно состоял из стрептококков, бифидобактерий и кишечной палочки . Энтеробактерии и Bacteroides были обычными в кишечнике младенцев, получавших искусственное вскармливание [30].Изменения в колонизации кишечника происходят после введения твердой пищи. В исследовании сравнивали влияние диеты на микробиоту кишечника у детей (от 1 до 6 лет), которые придерживались западной диеты, и с африканской диетой (потребление богатой клетчаткой). После западной диеты у детей уменьшилось микробное разнообразие с более низким уровнем актинобактерий и Bacteroidetes по сравнению с африканской диетой.
2.2. Иммунитет и начальная колонизация
Иммунная система слизистых оболочек и микробиота кишечника эволюционируют вместе с возрастом.Несколько исследований показывают, что для развития врожденной и адаптивной иммунных систем необходимо взаимодействие с микробами в младенчестве [31, 32]. Исследование также показало роль способа доставки в развитии иммунологических функций и микробиоты кишечника [33]. Это исследование показало, что младенцы, рожденные посредством кесарева сечения, имеют относительно более высокие уровни иммуноглобулинов, продуцируемых компонентами периферической крови, по сравнению с младенцами, рожденными естественным путем. Иммуноглобулин A (IgA) в основном секретируется слоем слизистой оболочки кишечника, что способствует его барьерной функции.IgA вызывает слабые иммунные ответы, позволяя бактериям колонизировать кишечник [34]. Связь между иммуноглобулинами и развитием кишечной микробиоты у мышей-гнотобиотов исследовали Planer et al. [35]. Вкратце, для определения возрастных различий в ответе IgA мышам вводили донорскую микробиоту (младенцы) и собирали образцы фекалий мышей. Интересно, что ответы IgA были аналогичны ответам донорской популяции младенцев. Это исследование можно использовать в качестве индикатора для понимания иммунитета слизистой оболочки кишечника и микробиоты в условиях здоровья и болезней.IgA играет важную роль в иммунитете слизистых оболочек, поскольку он индуцируется в ответ на колонизацию специфическими комменсальными бактериями для защиты поверхностей слизистой оболочки и способствует взаимному взаимодействию микробиоты и хозяина.
2.3. Детство, ранний возраст и взрослая жизнь
В раннем детстве (от 1 до 5 лет) рост бактериального разнообразия замедляется, а микробное разнообразие кишечника остается ниже по сравнению со взрослыми. Микробиота кишечника в детстве более стабильна и в ней преобладают несколько представителей Bacteroidetes.В здоровом предподростковом возрасте (от 7 до 12 лет) микробиом кишечника богат видами, содержащими множество бактериальных таксонов и функциональных генов, подобных взрослой микробиоте, обогащенной Lachnospiraceae, Anaerovorax , Bifidobacterium и Faecalibacterium . Бактериальный состав взрослых особей преимущественно состоит из Bacteroidetes и Firmicutes (рис. 1). Было показано, что относительная численность как Bacteroidetes, так и Firmicutes может варьироваться от 0 до 99% [2, 36].Другие группы исследователей сообщили о присутствии бактерий из типов Proteobacteria, Actinobacteria, Fusobacteria Cyanobacteria и Verrucomicrobia, а также метаногенных архей, множественных фагов и Eucarya у здоровых людей [14, 37–39]. На уровне филы микробиота кишечника у взрослых стабильна по сравнению с младенцами; однако существуют значительные различия в конкретных видах микробов и их пропорциях. Нет подробных исследований, демонстрирующих микробный состав здоровых взрослых людей из-за огромных индивидуальных различий в составе.Эти вариации могут быть связаны с факторами окружающей среды, формирующими микробиоту сразу после рождения, и низкими временными вариациями, а также с генетическими вариациями. Целостный подход к выявлению консервативности и сходства среди здоровых взрослых, предполагающий наличие энтеротипов, таких как Bacteroides (энтеротип I), Prevotella (энтеротип II) и Ruminococcus (энтеротип III) [26]. Было показано, что они остаются относительно стабильными в течение примерно 6 месяцев, и доказательства колебаний между энтеротипами были выявлены в ходе 10-летнего последующего исследования [40].Несмотря на таксономическую изменчивость, функциональные свойства микробиоты кишечника взрослых относительно согласуются с путями, включающими метаболизм и ферментацию. У пожилых людей микробиота кишечника становится менее разнообразной и нестабильной из-за сосуществующих условий и возрастных факторов.
2.4. Пожилые люди
Имахори (1992) описал старение как «регресс физиологических функций с последующим увеличением возраста» [41]. Обычно люди в возрасте 65 лет и старше считаются пожилыми людьми в хронологическом порядке [7, 42, 43].Понимание кишечной микробиоты и ее модуляции является важным фактором улучшения здоровья и благополучия пожилых людей. Нарушения микробного состава кишечника связаны с хроническими состояниями, такими как ожирение и воспалительные заболевания. Индивидуальная изменчивость намного выше у пожилых людей, чем у взрослых или младенцев. С возрастом наблюдается значительный дисбактериоз кишечной микробиоты, наряду с применением антибиотиков и недостаточным питанием. Снижение жевательной способности с уменьшением функции слюны и потерей зубных рядов может ограничить потребление питательных веществ и, таким образом, повлиять на рост микробов.С возрастом моторика ротоглотки и пищевода снижается, что приводит к глотанию и снижению давления сфинктера пищевода, что приводит к увеличению распространенности гастроэзофагеального рефлюкса. С возрастом также увеличивается время прохождения через кишечник из-за снижения моторики, что может ухудшить пищеварение и всасывание, а при снижении аппетита это может привести к недоеданию [7, 44]. В частности, гипохлоргидрия связана со старением и преобладает у тех, кто уже переболел или ранее переболел инфекцией Helicobacter pylori .Гипохлоргидрия предрасполагает к мальабсорбции, изменению роста бактерий и дефициту витамина B12, что приводит к атрофическому гастриту (аутоиммунному) и потере париетальных клеток. Недоедание является одним из ключевых факторов, влияющих на рост кишечной микробиоты, и способствует ослаблению иммунной системы у пожилых людей.
2,5. Специфические изменения кишечных микробов у пожилых людей
В исследовании Mariat et al. Наблюдалось значительное снижение относительных долей Bacteroidetes и Firmicutes у пожилых людей по сравнению со взрослыми.[18] (Рисунок 1). Помимо этих двух основных типов, снижение кластера IV Clostridium также наблюдалось у пожилых людей, находящихся в лечебных учреждениях [45]. Взаимосвязь между показателями дряхлости и разнообразием микробиоты у пожилых людей была показана в исследовании, в котором участвовали 23 пожилых добровольца, и был проведен анализ их фекалий [46]. Сообщалось о значительном снижении Bacteroidetes, Prevotella, Lactobacillus, Candida albicans, Streptococcus, Staphylococcus, и Faecalibacterium prausnitzii и повышении уровней Ruminococcus, Enterobacterium, и Atobacterium, и Atobacterium, и Atobacterium.Относительная изменчивость кишечного микробиома среди пожилого населения была измерена и проанализирована Claesson et al. [45]. Были собраны образцы фекалий 165 пожилых людей и 9 молодых (контрольных) добровольцев, и был проведен анализ микробиоты с использованием технологии секвенирования гена 16S рибосомной РНК (рРНК). Доля Bacteroidetes и Firmicutes у людей варьировала от 3% до 92% и от 7% до 94%, соответственно. Исследование фекальных бактерий у здоровых пожилых добровольцев (возрастной диапазон от 63 до 90 лет;), проживающих в местном сообществе, старых госпитализированных пациентов (возраст от 66 до 103 лет;) и старых госпитализированных пациентов, получающих лечение антибиотиками (возрастной диапазон От 65 до 100 лет;) [47] продемонстрировало снижение в группе Bacteroides-Prevotella у старых госпитализированных пациентов.В другом исследовании изучались возрастные изменения микробиоты кишечника и иммунной системы хозяина среди молодых людей (в среднем 30 лет), пожилых людей (от 65 до 75 лет) и долгожителей (от 99 до 103 лет) с использованием чипа кишечного тракта человека и 16S. Методы секвенирования генов рРНК [6]. Молодые люди и взрослые люди старшего возраста показали очень сопоставимую микробиоту кишечника с Bacteroidetes и Firmicutes, сильно доминирующими и небольшими пропорциями Proteobacteria и Actinobacteria. Напротив, были значительно более высокие уровни Proteobacteria в столетнем поколении, относительные изменения в подгруппах Firmicutes с уменьшением Clostridium кластера IV и увеличением видов Bacillus .Различия в микробиоте между взрослыми и пожилыми людьми в четырех разных европейских странах (Италия, Франция, Швеция и Германия) были изучены [16] и оказались специфичными для страны. Другие исследования также обнаружили различия в микробиоте кишечника в зависимости от возраста, пола и географического положения [16, 48].
Недавние открытия показывают, что микробный состав кишечника различается у мужчин и женщин [36, 49]. В другом исследовании сравнивали микробиоту кишечника тучных и худых мужчин и женщин (средний возраст 60 лет) с одинаковым потреблением питательных веществ [50].Это исследование выявило более высокие уровни Firmicutes у женщин независимо от возраста и индекса массы тела (ИМТ), а у мужчин уровень Bacteroidetes был ниже, чем у женщин с ИМТ более 33 кг / м 2 . На различия в микробиоте кишечника мужчин и женщин может влиять степень ожирения, и это может помочь понять различную распространенность метаболических и желудочно-кишечных заболеваний у мужчин и женщин. Исследование ELDERMET, проведенное Claesson et al. [45] сравнили микробный состав пожилых и молодых людей и обнаружили характерные различия в уровнях Bacteroides и Clostridium .У пожилых людей была большая вариабельность микробного состава, что потенциально способствовало увеличению заболеваемости (таблица 1).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| , отсортированных по году публикации; FISH: флуоресцентная гибридизация in situ. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.6. Метагеномные и метаболические изменения, связанные с кишечной микробиотой при старении
Растущее количество доказательств указывает на то, что кишечная микробиота влияет на метаболизм [51–53] и может играть значительную роль в запуске метаболических заболеваний [54]. Взаимосвязь между микробиотой и метаболическими и функциональными путями у людей была исследована проектом Human Microbiome Project (HMP). Из HMP известно, что микробиом человека сильно варьируется как у одного субъекта, так и у разных людей.В процессе старения хозяину вызывают различные изменения, включая диету и сопутствующее воздействие нескольких лекарств, включая антибиотики, снижение физической активности и / или любое основное заболевание, которое заставляет перетасовку микробиома адаптироваться к изменениям [55].
В исследовании изучались функциональные различия между микробиомом кишечника в разных возрастных группах, включая молодых людей, пожилых людей и долгожителей [6]. Исследование охарактеризовало метаболическую траекторию метагенома кишечной микробиоты с использованием секвенирования с использованием дробовика Illumina на 9 образцах фекалий.Было обнаружено, что протеолитическая активность увеличивалась, и наблюдалась явная потеря генов, связанных с метаболизмом углеводов при старении. Способность продуцировать короткоцепочечные жирные кислоты (SCFA) также снизилась из-за возрастного сокращения генетических путей, вызванного общей перестройкой микробиома. Данные о дифференциальной численности в микробиоме указывают на структурные и функциональные изменения микробиоты в пожилом населении, переход от сахаролитического к гнилостному метаболизму.Исследование также показало, что многие изменения в микробиоме вынуждали перестраивать основной метаболический потенциал микробной экосистемы кишечника долгожителей. Этот специфический анализ микробиома позволяет нам оценить роль микробиоты в патофизиологических условиях в когорте пожилых людей.
Манипулирование кишечной микробиотой и микробиомом может быть полезным для поддержания здоровья и лечения определенных заболеваний, особенно распространенных среди пожилых людей. Тем не менее, необходимы более всесторонние клинические исследования в разных возрастных группах, чтобы полностью понять роль микробиома в метаболизме.
2.7. Циркадный ритм, микробиом и метаболизм при старении
Циркадный ритм, метаболизм и микробиота кишечника неразрывно связаны. В исследовании сравнивали цикл сна и бодрствования человека и секрецию инсулина и обнаружили устойчивые вариации в регуляции глюкозы в нормальных условиях и при отсутствии сна [56]. Большая часть толерантности к глюкозе происходит во время сна, что влияет на ночную утилизацию глюкозы в мозге и тканях. Следовательно, хронические нарушения сна и апноэ во сне у пожилых людей могут быть связаны с изменениями метаболизма.При снижении физиологической функции и режима сна у пожилых людей может наблюдаться измененный аппетит, что приводит к повышенной восприимчивости к желудочно-кишечным и другим нарушениям обмена веществ. Bass и Turek [57] продемонстрировали связь между циклом сна и бодрствованием и регуляцией метаболизма и предположили, что вмешательство в нарушения сна может улучшить некоторые метаболические нарушения, связанные с избыточным весом и ожирением [57, 58]. Другое исследование подвергло критическому анализу циркадный ритм, сон и метаболизм [59].Они предположили связь между вариациями генов часов, ожирением и метаболическими функциями в понимании влияния циркадного ритма. Аналогичным образом, исследование продемонстрировало двунаправленную взаимосвязь между циркадными часами и метаболизмом, протестированную на животной модели с высоким содержанием жиров [60]. Ученый-исследователь предположил, что микробиота и микробиом кишечника являются одними из ключевых элементов в поддержании циркадного ритма, влияющего на диетические и физиологические функции организма [61]. Чтобы проверить свою гипотезу, они использовали мышей, свободных от микробов, и мышей, свободных от специфических патогенов.В исследовании подчеркивается взаимосвязь между диетой, микробной функцией кишечника, метаболомом и метаболической функцией, влияющими на здоровье хозяина. Авторы предположили, что любое изменение в диете влияет на циркадный ритм, а манипуляции с микробной структурой кишечника могут восстановить метаболический баланс. Возрастные нарушения микробной структуры и микробиома кишечника, вызванные диетой и другими факторами, по-видимому, влияют на циркадные часы, способствуя метаболическим нарушениям и ожирению. Взаимосвязь между микробиотой кишечника и метаболизмом была впервые показана на стерильных мышах по сравнению с обычными мышами (обе группы на диете с высоким содержанием жиров) [62].Обычные мыши прибавили в весе (как и ожидалось), тогда как мыши без микробов сохранили свою массу тела, что указывает на снижение эффективности кормления у мышей, свободных от микробов. Исследования Turnbaugh et al. [62] подтверждают эту гипотезу, когда мыши, лишенные микробов, набирали вес, будучи колонизированными микробиотой от ожирения, а не от тощих мышей. Возможным механизмом может быть активация инсулиннезависимого пути киназы, активируемого АМФ, который контролирует расход энергии за счет увеличения окисления глюкозы в условиях метаболического стресса.Интересно, что дисбактериоз кишечника наблюдался у мышей ob / ob , лишенных лептина, и впоследствии было показано, что микробный дисбиоз наблюдается у людей с ожирением по сравнению с худой контрольной группой, что указывает на общий механизм у мышей и людей [51]. Следовательно, микробиоту кишечника можно считать зависимой от генома хозяина, как это наблюдается у мышей ob / ob . Важно отметить, что роль микробиоты кишечника в поддержании гомеостаза также может играть роль в микробном геноме [63].
3. Роль кишечной микробиоты в иммунной функции у пожилых людей
3.1. Провоспалительные и противовоспалительные реакции
Иммунная система, связанная с кишечником, является крупнейшим компонентом (примерно 70%) иммунной системы человека [64]. Наряду с многочисленными комменсальными бактериями в кишечнике имеется множество врожденных и адаптивных иммунных клеток (рис. 2). Микробиота кишечника и иммунная система активно взаимодействуют для поддержания гомеостатического равновесия [65]. Это равновесие зависит от кишечных эпителиальных клеток (IEC) в толстой кишке, которые разделяют микробы и иммунные клетки слизистой оболочки.Помимо IEC, энтероциты и лимфоидная ткань, ассоциированная с кишечником (GALT), образуют специализированный барьер против вторжения патогенов. Бокаловидные клетки IEC в толстой кишке способны секретировать гелеобразные слои слизи, такие как муцин и муцин 2 (MUC 2), которые образуют первую линию защиты от микробного нарушения [66, 67]. Фактор трилистника 3 (TFF3) и резистиноподобная молекула- β (RELM β ) — это другие продукты, полученные из бокаловидных клеток, которые способствуют формированию физического барьера в кишечнике.Во время воспаления RELM β помогает секретировать MUC 2 и регулировать макрофаги и адаптивные Т-клетки [68]. Антимикробные пептиды (AMP), секретируемые энтероцитами, присутствующими в IEC, дополнительно укрепляют защитный барьер. Например, в присутствии B. thetaiotaomicron и L. innocua или стимуляции липополисахаридом (ЛПС) уровни АМФ были высокими в НЭК [69]. Энтероциты также обладают специализированными рецепторами распознавания патогенных патогенов (PPR), которые содержат Toll-подобные рецепторы (TLR) и рецепторы, подобные домену олигомеризации нуклеотидов (NOD), которые распознают бактериальные поверхностные молекулярные структуры, называемые молекулярными структурами, связанными с микробами (MAMP).Распознавание MAMP приводит к активации воспалительной реакции, вызывающей высвобождение ядерного фактора каппа B (NF-kB) и повреждение тканей, а NOD распознает молекулярные паттерны, связанные с повреждениями (DAMP) в организме хозяина [70]. Все TLR присутствуют на уровне мРНК IEC с разными уровнями концентрации. TLR 2, 4, 5 и 9 обнаруживают присутствие бактериальных и грибковых патогенов, а TLR 3, 7 и 8 обнаруживают вирусные патогены в тонком и толстом кишечнике. Микрофолдинговые (M) клетки, присутствующие в субэпителиальной области, с лимфоцитами и дендритными клетками (DC) в основании, открываются в собственную пластинку (LP).М-клетки поглощают патогены посредством фагоцитоза или эндоцитоза и представляют антиген (APC) DC. ДК в присутствии большого количества интерлейкинов (IL-1 β , IL-6) и трансформирующего фактора роста (TGF- β ), которые объединяют иммунные ответы на T-хелпер (Th) 17, затем запускают широко распространенное воспаление за счет высвобождения IL-17A, IL-17F, IL-21, IL-22 и IL-23 [71]. Таким образом, ДК запускают как про-, так и противовоспалительный ответ у хозяина.
3.2. Роль энтероцитов
Микроорганизмы обычно располагаются на внешнем слое слизистой оболочки эпителия в виде отсеков в просвете. Чтобы уменьшить взаимодействие микробиоты и энтероцитов, есть плотный гелеподобный внутренний слой поверх эпителия, секретируемого бокаловидными клетками (MUC 2), который лишен микробов, тогда как внешний слой, напротив, тонкий и заселен бактериями. [72]. Энтероциты обнаруживают присутствие микробов в слоях слизи и контролируют их близость и плотность.Таким образом, энтероциты выступают в роли передовой линии взаимодействия микробиоты и иммунных клеток, которое происходит в организме хозяина. При здоровом старении энтероциты контролируют иммунный ответ GALT, посылают сигналы толерантности к комменсалам и поддерживают DC в стабильном режиме [73]. М-клетки (APC) представляют антиген наивным CD4 + клеткам, вызывая их дифференцировку в CD4 + Т-клетки (Т-регуляторные), которые вызывают противовоспалительный ответ (IL-10, TNF- α ). Одновременно антигены также презентируются В-клеткам в LP, стимулируя дифференцировку иммуноглобулина A (IgA).IgA помогает нейтрализовать токсины, вырабатываемые микробами, и предотвращает прилипание микробиоты к просвету кишечника. Индукция секреторного IgA (SIgA) оказывается более эффективной в присутствии Bacteroidetes [74].
Доклинические и клинические исследования у пожилых людей указывают на снижение иммунной функции [65, 75, 76]. У пожилых IEC (GALT и энтероциты) нарушение и изменения иммунных функций наблюдались на животных моделях [72]. При нарушении GALT наблюдается снижение муцина и дефенсинов ( α -дефенсинов и β -дефенсинов), что приводит к увеличению вероятности инфицирования из-за неконтролируемого роста комменсалов (от мутуалистических до условно-патогенных) и патогенов.Когда увеличивается количество патогенов, энтероциты могут активировать определенные цитокины и хемокины, заставляя ДК инициировать провоспалительный ответ путем дифференцировки Th-1, Th-2 и Th-17 (эффекторных) клеток [77]. Исследование [78] продемонстрировало, что Bacteroides fragilis высвобождает полисахарид A (PSA), распознаваемый TLR, и индуцирует продукцию IL-10 клетками Treg (в присутствии TGF- β ). Индукция Treg-клеток не ограничивается Bacteroides fragilis , поскольку присутствие местных видов Clostridium также способствует активации Treg-клеток.Исследование [79] показало роль клостридий в индукции Treg-клеток у стерильных мышей. Всего 17 штаммов из кластеров Clostridiales VI, XIVa и XVIII, выделенных из фекалий человека, проявляли активность, индуцирующую Treg, что позволяет предположить, что Clostridium -зависимая индукция Tregs может вносить вклад в поддержание иммунного гомеостаза кишечника [21]. Изменение группы Bacteroides-Firmicutes запускает высвобождение IL-6 DC в LP и активирует наивные Т-клетки. Наивные Т (Т0) -клетки дифференцируются в клетки Th-17 и Th-1, которые ответственны за воспаление при колите [80].
3.3. Короткоцепочечные жирные кислоты (SCFA)
Микробиота кишечника генерирует ряд метаболитов, особенно SCFA, такие как бутират, пропионат и ацетат. Эти SCFAs связаны с возникновением противовоспалительных и противоопухолевых реакций посредством ингибирования NF-kB, способствующего росту кишечного эпителия [81]. Бутират считается основным источником энергии для кишечного эпителия и помогает в производстве муцина (гелеобразный внутренний слой) в просвете, который создает физический барьер.Дефицит SFCA приводит к атрофии эпителия и воспалению при колите [82]. У пожилых людей снижение уровня бутирата коррелирует с уменьшением F. prausnitzii , Eubacterium hallii, и Eubacterium rectal [6]. Кроме того, из-за снижения бутирата и ослабления физического барьера иммунологическая толерантность снижается, что приводит к увеличению количества энтеробактерий у пожилых людей. Это было подтверждено в исследовании, проведенном [6], где уровни провоспалительных цитокинов увеличивались и были связаны с воспалением и старением.Кроме того, снижение провоспалительных реакций и снижение уровней SCFA были связаны с риском колоректального рака [83, 84].
3.4. Различия, связанные с полом
Как иммунная, так и эндокринная системы обнаруживают значительные различия в зависимости от пола. Исследование транскриптома мононуклеарных клеток периферической крови выявило более низкие Т-клеточные ответы и большее воспаление у пожилых женщин [85]. Другое исследование старения населения, проведенное в Японии, показало прогрессирование иммунного старения у пожилых мужчин со снижением пролиферации Т-клеток по сравнению с пожилыми женщинами [86].Возрастные изменения уровня половых стероидов усиливают изменения, связанные со старением иммунитета. Также показано, что различия кишечных микробов и половых гормонов с возрастом могут приводить к аутоиммунным заболеваниям на животных моделях [87]. Связь половых различий, старения и иммунного ответа с кишечной микробиотой была критически рассмотрена [86]. Авторы подчеркнули, что раннее воздействие окружающей среды влияет на микробиом и зависимые от пола иммунные реакции, и предложили рассматривать пол как биологическую переменную в иммунологических исследованиях.
3.5. Влияние на питание
Из-за снижения иммунной активности пожилые люди обычно относятся к категории людей с ослабленным иммунитетом, поскольку их устойчивость к инфекциям снижена. Связь между микробиотой и иммунной системой можно продемонстрировать, изучив влияние приема различных пищевых добавок, таких как пребиотики, пробиотики и синбиотики (таблица 2). Добавка к пище пробиотического напитка с Bacillus subtilis в количестве 2 × 10 9 колониеобразующих единиц (КОЕ) в течение 18 дней () увеличивала уровни SIgA на 65% в стуле и слюне при простудных инфекциях у пожилые люди [88].Употребление пробиотического напитка, содержащего L. casei Shirota (LcS) в количестве 1,3 × 10 10 КОЕ, в течение 4 недель увеличивало активность естественных киллеров (NK) и значительно снижало интенсивность CD25 в T-покоящихся клетках у здоровых пожилых людей без иммунодефицита. человек [89, 90]. Пребиотики, такие как бифидогенный стимулятор роста и галактоолигосахарид, при употреблении с ферментированным молоком в течение 4 недель улучшали и сохраняли титры антител в течение более длительных периодов времени за счет улучшения кишечной микробиоты у пожилых людей с вакцинацией против гриппа [91].Аналогичным образом, в рандомизированном двойном слепом исследовании, проведенном с участием 43 пожилых людей, добавление синбиотика (содержащего пробиотик Bifidobacterium longum и пребиотическую синергию на основе инулина 1) в течение 4 недель увеличивало количество бифидобактерий, а также увеличивало количество бактерий. Актинобактерии и фирмикуты. Протеобактерии были уменьшены на 1,0 log единицы. Наблюдалось снижение провоспалительного цитокина TNF- α и увеличение продукции бутирата [75]. Следовательно, диетические добавки с пре / про / синбиотиками у пожилых людей не только увеличивают разнообразие кишечных комменсалов, но и укрепляют иммунную систему против различных патологических состояний.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| , отсортированных по году публикации; РКИ: рандомизированное двойное слепое клиническое исследование. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Модуляция кишечной микробиоты для здоровья
Как обсуждалось в предыдущих разделах, диета играет важную роль во время установления и развития стабильной кишечной микробиоты и может способствовать ее модуляции. Из-за высокой распространенности недоедания среди пожилых людей важную роль могут играть диетические манипуляции. Производство SCFA в кишечнике пожилых людей снижается из-за значительного изменения бактериального состава и недоедания. Это, в свою очередь, способствует снижению противовоспалительного ответа, что приводит к увеличению числа инфекций.Взрослым и пожилым людям широко рекомендуется диета с высоким содержанием клетчатки, поскольку она увеличивает выработку SCFA и снижает pH в кишечнике, уменьшая колонизацию патогенных бактерий. Однако диета с высоким содержанием жиров и некоторыми кулинарными маслами, содержащими полиненасыщенные жирные кислоты (омега-3-ПНЖК), увеличивает уровни Firmicutes и Actinobacteria и снижает уровень Bacteroidetes [91].
Было предложено множество специфических методов лечения дисбактериоза, таких как использование пребиотиков, пробиотиков и синбиотиков.Ряд клинических исследований продемонстрировал способность пробиотиков (чаще всего используются Lactobacillus , Bifidobacterium, Lactococcus, и Streptococcus ) по модуляции кишечных бактерий у младенцев, взрослых и пожилых людей [21, 92, 93]. Эти исследования показали увеличение продукции SCFA и улучшение иммунной системы [30]. Было показано, что одни пребиотики улучшают микробиоту кишечника и помогают в производстве SCFA [94].
Терапия антибиотиками широкого спектра действия успешно лечит многие инфекции, однако за счет потери комменсальных бактерий.В любом возрасте предпочтительно осторожное использование антибиотиков, а при их использовании предпочтительнее потенциальное использование узкого спектра или таргетной терапии, так как это уменьшает изменение микробиоты.
Для борьбы с рецидивирующими инфекциями была внедрена концепция трансплантации фекальной микробиоты (FMT). FMT можно определить как природный пробиотик для борьбы с рецидивирующими инфекциями. Обычно отбирают образец фекалий здорового донора и вводят его больным пациентам с помощью колоноскопии, эндоскопии, ректороманоскопии или клизмы [95].FMT дал 90% преимущества в качестве варианта лечения диареи, вызванной рецидивирующей инфекцией, вызванной C. difficile . В 2013 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США классифицировало образцы фекалий как биологический исследовательский инструмент с целью терапевтического воздействия [93]. Многие исследователи показали эффективность FMT при ВЗК, болезни Крона и язвенном колите, но важные аспекты этого лечения, такие как скрининг и отбор здоровых доноров, еще предстоит определить.FMT также может быть использован против инфекции H. pylori (которая может вызывать язвы и рак желудка), чтобы минимизировать эффекты использования антибиотиков, особенно у пожилого взрослого населения [96].
5. Заключение
Микробное разнообразие кишечника уменьшается с возрастом, а его функция в метаболизме и регуляции иммунной системы снижается. Это дает возможность условно-патогенным микроорганизмам проникнуть в кишечник и вызвать воспаление, вызывая различные заболевания, начиная от хронических заболеваний низкой степени тяжести до тех, которые вызывают госпитализацию и даже смерть.Несмотря на значительные исследования микробиоты кишечника, оптимальная терапия для уменьшения / предотвращения дисбактериоза у пожилых людей еще не определена. Диета играет роль манипулятора микробиоты кишечника на протяжении всей жизни, и это может быть особенно важно для пожилых людей. Использование антибиотиков широкого спектра действия почти наверняка оказывает неблагоприятное воздействие на кишечные бактерии. Мы считаем, что добавки с пробиотиками обладают значительным потенциалом для восстановления разнообразия микробиоты кишечника и улучшения иммунной функции.Однако особенности приема, дозировки и других параметров все еще не ясны. Необходимы более тщательно проведенные рандомизированные исследования пробиотиков / пребиотиков / синбиотиков у пожилых людей.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этого обзора.
Микробиота кишечника регулирует созревание кишечной нервной системы взрослого человека через кишечные сети серотонина
Значение
Микробиота кишечника влияет на несколько физиологических процессов, включая моторику кишечника.Здесь мы наблюдали, что у мышей, свободных от микробов, есть незрелая кишечная нервная система (ENS), которая нормализуется после колонизации нормальной микробиотой. Мы определили механизм связи между микробиотой и кишечными нейронами как инициацию высвобождения серотонина и последующую активацию рецептора 5-HT 4 . Это демонстрирует сильное взаимодействие между микробиотой и ENS и указывает на потенциальные механизмы, связывающие микробный дисбиоз с желудочно-кишечными расстройствами.Возможность модулировать микробиоту, например, с помощью диеты, откроет новые перспективы исследований в нейрогастроэнтерологии.
Abstract
Кишечная нервная система (ENS) имеет решающее значение для основных физиологических функций желудочно-кишечного тракта, таких как моторика, секреция жидкости и кровоток. В кишечнике обитают триллионы бактерий, которые регулируют выработку хозяином нескольких сигнальных молекул, включая серотонин (5-HT) и другие гормоны и нейротрансмиттеры. Примерно 90% 5-HT происходит из кишечника, и активация рецептора 5-HT 4 в ENS была связана с нейрогенезом и нейропротекцией у взрослых.Здесь мы проверили гипотезу о том, что микробиота кишечника может индуцировать созревание ENS взрослых посредством высвобождения 5-HT и активации рецепторов 5-HT 4 . Колонизация стерильных мышей микробиотой от мышей, выращенных обычным способом, изменила нейроанатомию ENS и увеличила скорость кишечного транзита, что было связано с выработкой 5-HT нейронами и слизистыми оболочками и пролиферацией энтеросолюбильных нейронов-предшественников в кишечнике взрослых. Фармакологическая модуляция рецептора 5-HT 4 , а также истощение эндогенного 5-HT выявила механистическую связь между кишечной микробиотой и созреванием ENS взрослых через высвобождение 5-HT и активацию 5-HT. 4 рецептор.Взятые вместе, эти данные показывают, что микробиота модулирует анатомию ENS взрослых 5-HT-зависимым образом с сопутствующими изменениями кишечного транзита.
Желудочно-кишечный тракт уникален в организме, так как он имеет внутреннюю нервную систему, кишечную нервную систему (ENS), состоящую из внешнего мышечно-кишечного сплетения и внутреннего подслизистого сплетения. ENS выполняет несколько важных физиологических функций, таких как регулирование перистальтики желудочно-кишечного тракта, секреция и абсорбция жидкости, а также кровоток (1).У грызунов большинство кишечных нейронов формируется во время эмбриогенеза и в раннем постнатальном периоде жизни (2–5). Во время этого процесса небольшая субпопуляция Sox10-экспрессирующих клеток, происходящих из нервного гребня, колонизирует переднюю кишку, впоследствии подвергается пролиферации, а затем колонизирует весь кишечник, давая начало и нейронам, и глиальным клеткам (6-8). Более того, кишечные нейрональные стволовые клетки, которые экспрессируют такие маркеры, как нестин, были зарегистрированы в постнатальном кишечнике мышей (9–11). В то время как долгое время считалось, что кишечные нейроны не образуются после 21 дня постнатального развития у мышей, за исключением случаев воспаления или травмы (2–4), недавнее исследование продемонстрировало, что ENS подвергается непрерывному обновлению у взрослых мышей с уравновешиванием апоптоза. нейрогенез (12).Таким образом, этот отчет демонстрирует, что ENS взрослых способен к созреванию и пластичности, но механизмы, управляющие этими процессами, остаются неизвестными.
Микробиота колонизирует желудочно-кишечный тракт после рождения с непрерывным созреванием в течение первого года жизни (13). Одновременно с колонизацией желудочно-кишечного тракта и созреванием иммунной системы слизистых оболочек ENS претерпевает экстенсивное развитие в раннем постнатальном периоде жизни (14). Соответственно, мыши без микробов (GF), у которых отсутствует микробиота кишечника, имеют ранние постнатальные структурные и функциональные аномалии ENS (15).Эти особенности можно обратить вспять путем колонизации микробиотой от донора, выращенного традиционным способом (CONV-R) (16).
Около 90% серотонина в организме (5-гидрокситриптамин, 5-HT) вырабатывается энтерохромаффинными (ЕС) клетками, типом энтероэндокринных клеток, которые присутствуют в эпителии кишечника (17). Недавно в двух исследованиях сообщалось, что микробиота кишечника способна индуцировать секрецию 5-HT слизистой оболочки кишечника (18, 19). Идея о том, что 5-HT слизистой оболочки и нейроны представляют собой разные пулы, подтверждается тем фактом, что разные формы ограничивающего скорость синтетического фермента триптофангидроксилазы (TPH) используются нейрональными и ненейрональными клетками, при этом TPh3 используется нейронами, а TPh2 используется EC. ячейки (20).В то время как 5-HT слизистой оболочки оказывает сильное провоспалительное действие (21, 22), активация рецептора 5-HT 4 (5-HT 4 R) в ENS оказывает нейрогенеративное и нейропротекторное действие (4, 23).
В этом исследовании мы проверили гипотезу о том, что микробиота кишечника модулирует функцию и анатомию ENS посредством высвобождения 5-HT и активации рецептора 5-HT 4 (5-HT 4 R). Колонизация мышей GF сокращала время прохождения через кишечник и была связана с высвобождением 5-HT.Мы изучили GF и колонизировали Tph2 -дефицитных мышей и продемонстрировали, что 5-HT слизистой оболочки является нейропротекторным на ранних фазах колонизации. Затем мы изучили соответствующие роли 5-HT слизистой оболочки и нейронов в наблюдаемом фенотипе посредством ингибирования TPh2 и TPh3 парахлорфенилаланином (PCPA) или истощения 5-HT нейронов резерпином. Наконец, используя фармакологическую модуляцию рецептора 5-HT 4 , мы установили связь между микробиотой кишечника и активацией нейронов 5-HT 4 Rs.
Результаты
Кишечная микробиота регулирует кишечный транзит, сопровождаемый нейроанатомическими изменениями ENS.
Недавняя работа показала, что микробиота кишечника важна для нормального развития и функционирования мозга у мышей (24), но гораздо меньше известно о влиянии микробиоты кишечника на развитие ENS. Недавнее исследование установило, что микробиота необходима для постнатального развития кишечных глиальных клеток слизистой оболочки (25), но до сих пор проводятся механистические исследования роли кишечной микробиоты в созревании нейронов ENS, и особенно кишечных нейронов толстой кишки. не хватает.
Мы определили связь между кишечной микробиотой и функцией и анатомией ENS, колонизируя 12-недельных мышей GF микробиотой слепой кишки мышей-доноров соответствующего возраста, получая мышей CONV-D. В соответствии с предыдущими результатами (26), мы обнаружили, что у GF-мышей наблюдается значительно более медленный кишечный транзит, чем у контрольных CONV-R, и что кишечный транзит нормализовался через 15 дней, но не через 3 дня колонизации, т. Е. Когда микробное сообщество полностью сформировалось. установился после колонизации (рис.1 А ) (27, 28). В то время как мы не наблюдали никакой разницы в количестве нейронов кишечника или иннервации продольной мышцы / миэнтериального сплетения (LMMP) между мышами GF, CONV-D и CONV-R, как было выявлено с помощью иммуногистохимического количественного определения пан-нейронального маркера HuC. / D и нейритный маркер Tuj1 (рис. 1 B — D ) иннервация эпителия толстой кишки была снижена у GF животных. Эти фенотипы были восстановлены через 15 дней после колонизации (рис.1 E и F ), отражая более быстрый транзит (рис.1 А ). Примечательно, что в соответствии с предыдущим исследованием (25) колонизация увеличивала плотность глиальной сети (что было выявлено с помощью иммуноокрашивания на глиальный маркер S100β; см. Приложение SI , рис. S1 A и B ). Однако количество клеток Sox10 + (маркер нейрональных и глиальных предшественников) не зависело от микробного статуса мышей ( SI Приложение , рис. S1 C и D ), что позволяет предположить, что ( i ) глии больше после колонизации или ( ii ) больший процент глии, экспрессирующей S100β.Было показано, что клетки Sox10 + дают начало нейронам и глиальным клеткам in vitro и in vivo (2, 3, 25). Предыдущее исследование с использованием репортерных мышей показало, что после колонизации клетки Sox10 + претерпевают пролиферацию в мышечно-кишечном сплетении с последующей миграцией на слизистую оболочку, в результате чего возникают кишечные глиальные клетки (25). В соответствии с этим открытием, мы обнаружили, что около 1% клеток Sox10 + экспрессировали Ki67 в мышечно-кишечном сплетении через 15 дней после колонизации ( SI, приложение , рис.S2).
Рис. 1.
Микробиота кишечника регулирует анатомию и функцию ENS. ( A ) Кишечный транзит у мышей GF, мышей GF, колонизированных (CONV-D) микробиотой от донора CONV-R в течение 3 или 15 дней, и мышей CONV-R. * P <0,05; ** P <0,01 по сравнению с GF; Н.С., не имеет значения; односторонний дисперсионный анализ с последующим апостериорным тестом Даннета. ( B ) Типичные изображения LMMP толстой кишки, показывающие пан-нейрональный маркер HuC / D (зеленый) и нейрон-специфический бета-III тубулин (Tuj1, красный).( C и D ) Количественная оценка клеток HuC / D + ( C ) и области Tuj1 + ( D ). ( E и F ) Репрезентативные изображения ( E ) и количественная оценка ( F ) иннервации крипт толстой кишки мышей с использованием периферического нейронального маркера Tuj1. * P <0,05 по сравнению с GF; Н.С., не имеет значения; Тест Краскела – Уоллиса с последующим апостериорным тестом Данна. (Шкала: 50 мкм.)
Затем мы исследовали, снижает ли истощение кишечной микробиоты в результате 3-недельного лечения антибиотиками у мышей CONV-R иннервацию слизистой оболочки толстой кишки.Микробное истощение было подтверждено с помощью кПЦР и было связано с увеличением слепой кишки ( SI, приложение , рис. S3, A, и таблица S1). В отличие от мышей GF, истощение привело к снижению иннервации слизистой оболочки толстой кишки и LMMP, что было связано с уменьшением глиальной сети ( SI Приложение , рис. S3 B — H ). Это говорит о том, что наличие кишечной микробиоты не обязательно для развития нервной сети кишечника, но имеет решающее значение для ее поддержания.
Нестин представляет собой белок цитоскелета, который экспрессируется множеством нервных стволовых клеток (10, 12, 29, 30). Клетки Nestin + в миэнтериальном сплетении взрослых мышей дают нейроны in vivo (12), а исследования трансгенных мышей Nestin-GFP предполагают, что коэкспрессия Nestin и HuC / D является признаком нейрональной пластичности в ENS взрослых ( 10). Таким образом, мы определили долю нейронов Nestin + у мышей GF, CONV-D и CONV-R (рис. 2 A ). Колонизация мышей GF вызывала глобальное снижение доли нейронов Nestin + (χ 2 = 208.7; df = 3; P <10 -4 ) (рис.2 B ), что позволяет предположить, что мыши GF сохраняют более высокую пластичность в ENS, которая сохраняется в течение как минимум 3 дней после колонизации, но исчезает, когда микробиота достигает устойчивого состояния. состояние.
Рис. 2.
Колонизация мышей GF кишечной микробиотой вызывает созревание нейрональных предшественников в миэнтериальном сплетении толстой кишки. ( A ) Иммуноокрашивание с помощью HuC / D (красный) и маркера предшественника нейронов нестина (зеленый).( B ) Колонизация уменьшала долю нейронов Nestin + в ганглиях миентерального кишечника ( n > 1000 клеток на группу). (Масштаб: 20 мкм.)
Колонизация мышей GF индуцирует пролиферацию предсуществующего нестина
+ Субпопуляция нервных предшественников.
Чтобы проверить гипотезу о том, что колонизация мышей GF нормальной микробиотой вызывает пролиферацию нервных клеток-предшественников, мы исследовали коэкспрессию нестина с циклическим маркером Ki67 в миэнтериальных ганглиях толстой кишки.Мы обнаружили, что у мышей GF до 5% клеток Nestin + сохраняли способность подвергаться пролиферации и что это состояние сохранялось через 3 и 15 дней после колонизации (фиг. 3 A и B ). Напротив, менее 1% клеток Nestin + у мышей CONV-R экспрессировали Ki67 ( P = 0,03 по сравнению с GF; тест Краскела-Уоллиса с последующим апостериорным тестом Данна). Мы также наблюдали, что некоторые клетки Ki67 + имели небольшой ободок цитоплазмы Nestin + (рис.3).
Рис. 3.
Колонизация взрослых мышей GF кишечной микробиотой приводит к циклической смене нейрональных предшественников. ( A ) Репрезентативные изображения ганглия толстой кишки мышей, окрашенных маркером циклических клеток Ki67 (красные стрелки), маркером предшественников нейронов Nestin (зеленые) и с ядрами, контрастированными с помощью Hoechst (серый). ( B ) Количественная оценка дважды положительных клеток нестин / Ki67. * P <0,05 по сравнению с GF; Н.С., не имеет значения; Тест Краскела – Уоллиса с последующим апостериорным тестом Данна.(Масштаб: 20 мкм.)
Поскольку миэнтерические клетки Nestin + ответственны за нейрогенез взрослых в ENS (12), наши результаты предполагают, что мыши GF сохраняют потенциал для нейрогенеза и созревания ENS, который может активироваться колонизация. Однако, поскольку мы не наблюдали разницы в плотности нейронов у мышей GF, пролиферация, вероятно, компенсируется потерей клеток. Взятые вместе, наши результаты показывают, что дифференцировка нейронов от клеток Nestin + происходит после воздействия микробиоты кишечника.
Взаимодействие между микробиотой и слизистой оболочкой 5-HT является нейропротекторным.
5-HT участвует в нейрогенезе, а также способствует выживанию нейронов. Мы подтвердили предыдущие наблюдения, что колонизация мышей GF частично восстанавливала сывороточные уровни 5-HT ( SI Приложение , рис. S4 A ) (18, 19, 31), вероятно, за счет индукции синтеза 5-HT de novo за счет увеличения экспрессия ограничивающего скорость фермента синтеза 5-HT, Tph2 , в слизистой оболочке ( SI Приложение , рис.S4 B ). Кроме того, истощение микробиоты антибиотиками снижает уровни циркулирующего 5-HT ( SI Приложение , рис. S4, C ).
Чтобы исследовать, требуется ли продукция 5-HT слизистой оболочки для поддержания нейроанатомии ENS, мы количественно оценили плотность нейронов у мышей Tph2 -нокаут ( Tph2 — / — ) мышей. После подтверждения того, что Tph2 не экспрессируется в толстой кишке наших нокаутных мышей ( SI, приложение , рис.S4 D ), мы проанализировали анатомию ENS у мышей Tph2 — / — и однопометников дикого типа. CONV-R Tph2 — / — мыши не обнаруживают каких-либо явных изменений в нейроанатомии ENS (32), но до сих пор ни одно исследование не фокусировалось на этих мышах в условиях GF. В соответствии с предыдущими исследованиями подвздошной кишки мышей CONV-R (32) мы не наблюдали значительных изменений в нейроанатомии ENS мышей CONV-R и GF (рис. 4). Однако, когда мышей GF колонизировали в течение 3 дней микробиотой мышей C57BL / 6 CONV-R дикого типа (давая мышей CONV-D), мы обнаружили, что мыши Tph2 — / — (рис.4 A и B ) имели уменьшенное количество нейронов кишечника (влияние микробиоты: 35% от общей вариации; двухфакторный дисперсионный анализ, P = 0,02), что подчеркивает важность 5-HT слизистой оболочки в поддержании целостность ENS в ранний период колонизации. Более того, доля нейронов Nestin + была значительно снижена у мышей CONV-D Tph2 — / — (Рис.4 D и E и SI Приложение , Рис.S4 E ). Взятые вместе, наши данные показывают, что вызванное микробиотой высвобождение 5-HT слизистой оболочки является нейрозащитным для ENS на ранних этапах колонизации.
Рис. 4.
5-HT слизистой оболочки нейропротектором у мышей CONV-D. ( A ) Типичные изображения LMMP толстой кишки, показывающие пан-нейрональный маркер HuC / D (зеленый) и нейрон-специфический тубулин β-III (Tuj1, красный). ( B и C ) Количественная оценка клеток HuC / D + ( B ) и области Tuj1 + ( C ). P Значения сообщаются после двухфакторного дисперсионного анализа с последующим тестом множественных сравнений Даннета. * P <0,05. ( D ) Иммуноокрашивание с помощью HuC / D (красный) и маркера предшественника нейронов нестина (зеленый). ( E ) Количественная оценка результатов в D . Разделенные панели представлены в приложении SI , рис. S4 E . P Значения представлены нокаутом по сравнению с диким типом; Точный тест Фишера (было подсчитано n > 750 клеток на группу).(Шкала: 50 мкм.)
Кишечная микробиота индуцирует выработку 5-HT нейронов.
Было показано, что высвобождение 5-HT из кишечных нейронов влияет на развитие и выживание дофаминергических нейронов (32), показывая важность серотонинергических нейронов в организации более зрелых компонентов сети ENS. Мы выполнили иммуногистохимию 5-HT в LMMP и обнаружили, что серотонинергические нейрональные сети почти отсутствуют у мышей GF, но постепенно восстанавливаются путем колонизации кишечной микробиотой (рис.5 A и B ). Важно отметить, что наличие микробиоты кишечника было решающим для поддержания серотонинергических сетей, поскольку истощение антибиотиками отменяет иммунореактивность 5-HT ( SI Приложение , рис. S5, B и C ). Чтобы различить специфические роли серотонина в наблюдаемом фенотипе, мы хронически лечили мышей CONV-D в течение 3 дней PCPA, селективным и необратимым ингибитором TPh2 и TPh3, или резерпином, необратимым блокатором везикулярного транспортера моноаминов (таким образом истощая нервные клетки). 5-HT).Мы подтвердили, что PCPA и резерпин снижают иммунореактивность 5-HT в LMMP ( SI, приложение , рис. S5, E — H ).
Рис. 5.
Микробиота кишечника регулирует высвобождение 5-HT нейронов и активацию 5-HT4R в мышечно-кишечном сплетении. ( A ) Типичные изображения толстого кишечного сплетения, показывающие иммунореактивность к 5-HT (зеленый) и 5-HT 4 R (красный). Локализация 5-HT и 5-HT 4 R была изменена колонизацией. ( B и C ) Количественная оценка иммунореактивности к 5-HT ( B ) и 5-HT 4 R ( C ).* P <0,05; ** P <0,01; *** P <0,001; **** P <10 −4 по сравнению с GF; Тест Краскела – Уоллиса с последующим апостериорным тестом Данна. ( D ) Репрезентативные изображения LMMP толстой кишки мышей CONV-D, получавших раствор носителя, антагониста 5-HT 4 R GR-125487, ингибитора TPH PCPA или резерпина, блокатора везикулярного транспортера моноаминов, показывающие паннейрональный маркер HuC / D (зеленый) и нейрон-специфический тубулин β-III (Tuj1, красный).( E и F ) Количественная оценка клеток HuC / D + ( E ) и области Tuj1 + ( F ). * P <0,05 по сравнению с GF; Н.С., не имеет значения; Тест Краскела – Уоллиса с последующим апостериорным тестом Данна. ( G ) Иммуноокрашивание HuC / D (красный) и маркер предшественника нейронов нестин (зеленый). Разделенные панели показаны в приложении SI , рис. S6. ( H ) Количественная оценка доли нейронов Nestin + ( n > 500 клеток на группу).(Масштаб: 50 мкм.)
Обработка ингибитором TPH PCPA привела к снижению плотности нейронов кишечника (фиг. 5 D и E ). Удивительно, но лечение также привело к значительному увеличению доли нейронов Nestin + (фиг. 5 G и H и SI, приложение , фиг. S6). Эти данные предполагают, что блокирование продукции 5-HT приводит к потере ( i ) нейронов кишечника, аналогичной той, которая наблюдалась у мышей Tph2 — / — CONV-D, и ( ii ) ингибированию дифференцировки нейронов от Нестин + предков.
Хотя не было существенной разницы в количестве нейронов или плотности нейритов Tuj1 + в CONV-R, обработанном резерпином ( SI Приложение , рис. S5, J и K ) или CONV-D ( 5 D — F ), обработка значительно снизила долю нейронов Nestin + (фиг. 5 G и H и SI, приложение , фиг. S6). Примечательно, что резерпин является необратимым блокатором везикулярного переносчика моноаминов, который также переносит дофамин и норадреналин, поэтому мы не можем исключить возможность того, что эти нейротрансмиттеры способствуют фенотипу.Дальнейшие исследования с GF и CONV-D Tph3 -дефицитными мышами могут подтвердить специфичность действия нейронального 5-HT на созревание ENS после колонизации.
Активация 5-HT
4 R у мышей GF вызывает созревание взрослой ENS.
5-HT 4 R широко экспрессируется в кишечнике (33, 34), а нанесение на слизистые оболочки агонистов 5-HT 4 R активирует выделение слизи бокаловидными клетками и секрецию Cl — энтероцитами, тогда как Антагонисты 5-HT 4 R блокируют эти действия (33).Стимуляция 5-HT 4 R также индуцирует нейрогенез и нейрозащиту у взрослых в кишечнике (4, 23). Здесь мы подтвердили, что 5-HT 4 R экспрессируется в ENS и, в частности, в нейронах кишечника ( SI, приложение , рис. S5, A ), и обнаружили, что его экспрессия зависит от присутствия кишечника. микробиота (Рис.5 A и C и SI Приложение , Рис. S5 B и D ). Подобно 5-HT, мы наблюдали, что экспрессия 5-HT 4 R была локализована в соме клеток у мышей GF, но в серотонинергических нейритах после колонизации (рис.5 A и SI Приложение , рис. S5 A ).
Затем мы колонизировали мышей GF и одновременно лечили их в течение 3 дней хроническими инъекциями антагониста 5-HT 4 R GR-125487. Обработка антагонистом не повлияла на плотность нейрональной сети, но привела к уменьшению количества нейронов тонкой кишки (фиг. 5 D — F ). Доля Nestin + нейронов (рис.5 G и H и SI Приложение , рис.S6) значительно уменьшилось в результате лечения. Это предполагает, что высвобождение 5-HT нейронов регулирует стволовые клетки предшественников нейронов в ENS, тогда как специфическая активация 5-HT 4 R также регулирует пролиферацию.
Чтобы напрямую проверить, можно ли фенокопировать эффекты колонизации на анатомию ENS у мышей GF, мы лечили GF мышей 5-HT 4 R агонистом sc-53116 в течение 4 дней. Мы наблюдали, что активация 5-HT 4 R у мышей GF была связана с более быстрым кишечным транзитом (рис.6 A ), что сопровождается увеличением количества нейронов кишечника (рис. 6 B — D ) и повышенной иннервацией слизистой оболочки толстой кишки (рис. 6 E и F ).
Рис. 6.
5-HT 4 R регулирует анатомию и функцию ENS у мышей GF. ( A ) Кишечный транзит у мышей GF, которым вводили антагонист 5-HT 4 R sc-53116 или раствор носителя. P = 0,05; Непарный тест ученика t . ( B ) Репрезентативные изображения LMMP толстой кишки вышеупомянутых мышей, показывающие пан-нейрональный маркер HuC / D (зеленый) и нейрон-специфичный тубулин β-III (Tuj1, красный).( C и D ) Количественная оценка клеток HuC / D + ( C ) и области Tuj1 + ( D ). ( E ) Типичные изображения иннервации крипт толстой кишки мышей (белые стрелки) с использованием периферического нейронального маркера Tuj1. ( F ) Количественная оценка района Tuj1 + . P Значения определялись с помощью теста Манна – Уитни. Н.С., не имеет значения. (Масштаб: 50 мкм.)
Взятые вместе, наши данные предполагают, что после колонизации кишечная микробиота стимулирует высвобождение 5-HT нейронов и слизистых оболочек и что активация 5-HT 4 R у мышей GF приводит к дифференцировке и созреванию кишечных нейронов.
Обсуждение
ENS содержит клетки, дающие начало нейронам in vitro и in vivo (2, 3, 9). В этом исследовании мы показали, что колонизация взрослых мышей GF индуцировала созревание ENS, связанное с пролиферацией предшественников предшественников Nestin + , присутствующих у мышей GF. Хотя блокирование 5-HT 4 R или истощение эндогенного 5-HT предотвращало этот процесс, мыши GF восстанавливали иннервацию кишечника при лечении агонистами 5-HT 4 R. Здесь мы показываем, что созревание взрослой ENS требует 5-HT 4 R-специфической передачи сигналов и что колонизация кишечными микробами мышей GF Tph2 — / — приводит к меньшему количеству нейронов кишечника, что позволяет предположить, что оба пула кишечные 5-HT имеют решающее значение для поддержания ENS у взрослых.
Наши результаты подтверждают, что способность к созреванию ENS (то есть рост нейритов и нейрогенез) продолжается у взрослых мышей в кишечнике, не подвергающемся микробиоте. Интересно, что у грызунов GF наблюдается аномальное соотношение кальбиндина и нитрергических нейронов кишечника, что позволяет предположить, что микробиота влияет на созревание нейронных сетей кишечника (15, 16, 35). Кроме того, функциональная активность ENS может регулироваться микробиотой либо непосредственно через Toll-подобные рецепторы (36), либо путем индукции секреции BMP2 макрофагами (37).Недавнее исследование показало, что кишечный нейрогенез у взрослых — это активный процесс, уравновешенный апоптозом (12). Наши результаты дополняют эти открытия и предполагают, что клетки Nestin + могут подвергаться пролиферации и дифференцировке в функциональные нейроны. Однако механизмы, с помощью которых кишечные бактерии влияют на организацию ENS, остались неизученными. Например, при дисбактериозе продукция NO в ENS нарушается (38). Таким образом, вероятно, что нитрергические и серотонинергические пути взаимодействуют с микробиотой, чтобы установить функциональную ЭНС.
Желудочно-кишечный тракт — это место, где синтезируется большая часть 5-HT, и недавно два исследования показали, что микробиота кишечника играет ключевую роль в стимулировании секреции 5-HT (18, 19). Мы подтвердили эти находки, но наши результаты предполагают, что 5-HT нейронов и слизистых оболочек играют взаимодополняющие роли в созревании ENS ( SI Приложение , Fig. S7). Нейрональный 5-HT был идентифицирован как основной фактор роста нейронов во время развития (32), а также действующий как промотор роста и супрессор воспаления в слизистой оболочке кишечника (22, 39).Мы дополнили эти результаты повторным определением мышей Tph2 — / — как свободных от микробов. Подобно мышам, получавшим PCPA, колонизация этих мышей привела к уменьшению количества нейронов кишечника, показывая, что 5-HT слизистой оболочки имеет решающее значение для целостности ENS на ранних стадиях колонизации. Однако, в отличие от Tph2 — / — и мышей CONV-D, получавших резерпин, PCPA индуцировал увеличение соотношения клеток Nestin + в миэнтериальном сплетении, что требует дальнейшего исследования.
Измененная организация и свойства кишечных нейронов у мышей GF также влияют на функцию желудочно-кишечного тракта. Обработка прукалопридом, агонистом 5-HT 4 R, защищает кишечные нейроны от окислительного стресса (23), а активация 5-HT 4 R в эпителии снижает воспаление у мышей с колитом (40). Было высказано предположение, что изменения микробиоты кишечника, вызванные, например, инфекцией, стрессом или применением антибиотиков, вызывают синдром раздраженного кишечника (41).Таким образом, улучшенное понимание диалога между микробиотой и ENS открывает возможность для новых методов лечения воспалительных заболеваний кишечника.
Материалы и методы
Подробные процедуры см. В приложении SI , Методы SI .
Животные.
Взрослых самок мышей C57BL / 6J в возрасте 12 недель в начале экспериментов содержали в помещении с контролируемым климатом (22 ± 2 ° C), подвергнутом 12-часовому циклу свет / темнота (свет включен, 7: С 00:00 до 19:00), со свободным доступом к воде и пище. Tph2 — / — мышей были описаны ранее (42). Все процедуры на мышах были одобрены этическим комитетом по уходу за животными и их использованию в Гетеборге, Швеция. Лечение антибиотиками описано в SI Приложение , SI Методы .
Статистический анализ.
Данные представлены в виде прямоугольных диаграмм, показывающих максимум, минимум, медианное значение и межквартильный размах. Каждая точка представляет одну мышь. Статистический анализ проводился с использованием программного обеспечения GraphPad Prism 7.
Благодарности
Мы благодарим Анну Халлен, Карину Арвидссон, Луизу Хельден, Сару Нордин-Ларссон, Ульрику Энквист, Кэролайн Веннберг и Закариас Гулич за отличную помощь в исследованиях на животных; Анне Халлен за создание SI Приложение , рис.

 При минимальном кровотечении (которое может быть симптомом развития многих заболеваний, включая рак) в образце стула под микроскопом будут видны эритроциты (кровяные тельца), не видимые глазу.
При минимальном кровотечении (которое может быть симптомом развития многих заболеваний, включая рак) в образце стула под микроскопом будут видны эритроциты (кровяные тельца), не видимые глазу.