Метастатические опухоли легких
Легкие занимают 1-2 место по частоте поражения метастатическими (вторичными) опухолями. Это объясняется наличием в легких обширной и разветвленной сети капилляров (мелких сосудов) и тем, что легкое — первый орган, через который проходит венозная кровь после впадения в вены наиболее крупных лимфатических сосудов.
Частота и характер метастазирования зависят, как правило, от первичной локализации опухоли. Изолированное метастатическое поражение легких встречается в 6-30% случаев. Для некоторых локализаций злокачественных опухолей (саркомы мягких тканей, рак почки, хорионэпителиома матки) легкие являются как бы мишенью и в 60-70% случаев длительное время остаются единственным местом отдаленных метастазов.
Примерно у 1/3 больных с изолированным поражением легких наблюдаются единичные метастазы, которые в 70-90% случаев располагаются на периферии легких и потому могут подвергаться хирургическому или комбинированному лечению. Современные подходы к лечению позволяют добиться у части больных не только положительного эффекта, но и выздоровления. Таким образом, наличие метастазов в легкие не является основанием суждения об инкурабельности (неизлечимости) больного.
Гематогенные (путь распространения опухолевых клеток через кровь) метастазы наиболее характерны при оттоке крови из опухоли в малый круг кровообращения (саркомы, меланома, опухоли области головы и шеи, рак надпочечников, почек, матки, яичек, яичников). Злокачественные опухоли желудочно-кишечного тракта в первую очередь поражают печень, а затем уже легкие.
Лимфогенный (через лимфу) путь метастазирования характерен для опухолей легких, молочной железы, желудка, прямой кишки, поджелудочной железы.
Прогноз (исход) заболевания и тактика лечения зависят от многих факторов, важнейшими из которых являются:
- первичная локализация опухоли,
- стадия заболевания,
- срок до выявления метастазов в легкие по отношению ко времени радикального лечения,
- локализация метастазов,
- наличие или отсутствие легочной симптоматики,
- темп роста метастазов,
- поражение одного или обоих легких,
- число метастазов,
- наличие или отсутствие метастазов в области корня легкого и средостения,
- прорастание в грудную стенку,
- степень чувствительности метастазов к облучению и химиотерапии.

Клиническая картина
Клиническая симптоматика метастатических поражений легких зависит от наличия их связи с крупными бронхами, степени поражения легочной ткани и осложнений. Как и при первичном раке легкого, может наблюдаться кашель и кровохарканье.
Одышка возникает из-за вовлечения в процесс значительной части ткани легкого, при обтурации (закупорке) или сдавлении просвета крупного бронха, приводящего к ателектазу (спадению) доли или сегмента легкого.
Наличие одышки, общей слабости и сухого кашля у онкологического больного при отсутствии явных рентгенологических находок должно настораживать в отношении лимфогенного характера метастазирования.
При распространении опухолевого процесса на плевру, ребра или позвоночник у пациентов появляется боль. Симптомы заболевания могут возникать в результате воспаления вокруг опухоли, ее распада, самопроизвольного проникновения воздуха в плевральную полость, плеврального выпота (жидкости).
Диагностика
На первом этапе проводится рентгенологическое исследование грудной клетки, позволяющее во многих случаях выявить поражение легких. Для большинства гематогенных метастазов характерны четкие очертания, сохраняющиеся в течение длительного времени.
Метастатические узлы имеют различную плотность, которая соответствует плотности первичной опухоли. Так, метастазы хорионкарциномы имеют низкую плотность, метастазы остеогенной саркомы и аденокарциномы легкого способны образовывать костную ткань, а метастазы рака щитовидной железы и молочной железы, а также ободочной кишки — петрификаты (известковые отложения).
Компьютерная томография (КТ) (особенно спиральная) позволяет проводить более раннюю и точную диагностику легочных метастазов, размеры которых не превышают 0,5 см, особенно при их локализации под плеврой (субплеврально).
Магнитно-резонансная томография (МРТ) менее информативна для выявления очагов менее 3мм и показана в тех случаях, когда необходимо уменьшить лучевую нагрузку, например, у детей, и при длительном наблюдении за онкологическими больными.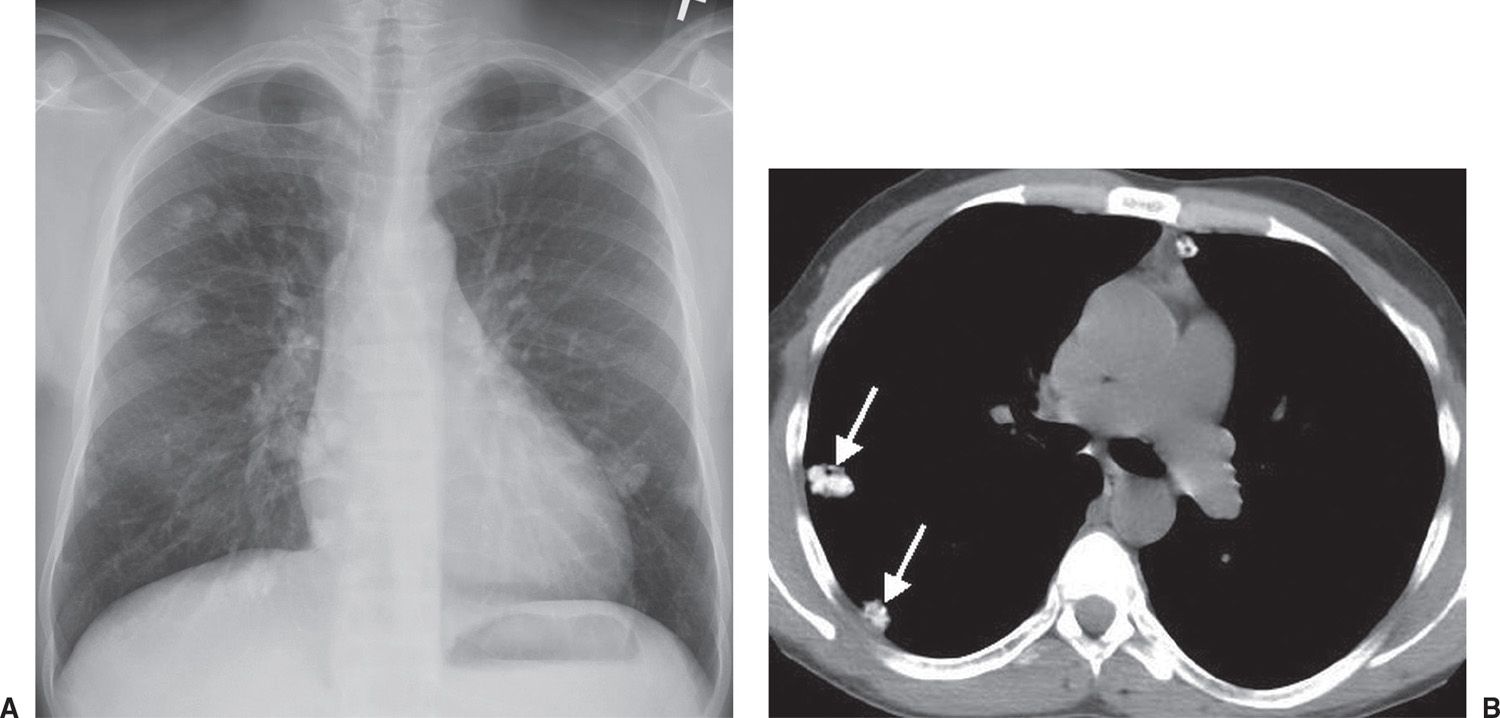
Всем пациентам, которым планируется операция по поводу метастазов, необходимо проводить КТ грудной клетки и брюшной полости.
Другие методы исследования (УЗИ, КТ головного мозга, радиоизотопное исследование костей, исследование опухолевых маркеров и пунктата костного мозга) направлены на установление истинного распространения опухолевого поражения.
Лечение
При лимфогенном карциноматозе (обсеменении) легких даже раннее выявление не оказывает положительного влияния на исход заболевания. Более половины больных умирает в течение 3 месяцев, и целью исследований является предотвращение ненужных операций по поводу первичной опухоли.
При гематогенных метастазах возможно применение хирургического и комбинированного лечения. До недавнего времени показания к удалению метастазов из легких были строго ограничены. Основными требованиями являлись:
- наличие единичных метастазов,
- отсутствие первичной опухоли и местного рецидива,
- длительный (не менее 1 года) безрецидивный период,
- невысокий темп роста метастазов.
В настоящее время расширены показания к активному хирургическому лечению метастазов и количество операций по поводу метастазов в легкие растет.
Операбельность таких больных составляет от 80 и почти до 100%. Осложнения у первично оперированных больных по поводу метастазов в легкие наблюдаются в 5-12% случаев.
В соответствии с анатомическим расположением опухолевых очагов больным с двухсторонними множественными метастазами можно выполнять двухсторонние торакотомии (одномоментные или последовательные).
Вместо торакотомии возможно выполнение срединной стернотомии (рассечение грудины), которая, по мнению ряда хирургов, является менее травматичной и менее болезненной операцией, позволяющей осуществить полноценный осмотр обоих легких.
При торакоскопическом удалении метастазов, наряду с быстрым выздоровлением, удается избежать некоторых осложнений открытой операции (торакотомии), прежде всего — болей.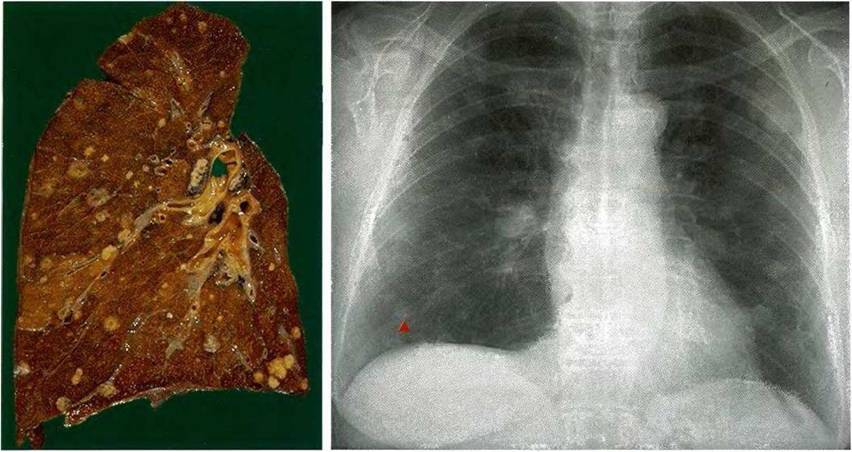 Недостатком метода является невозможность пальпации (ощупывания) легкого и поэтому неспособность в некоторых случаях выявить очаги поражения размерами до 5 мм, которые видны на КТ.
Недостатком метода является невозможность пальпации (ощупывания) легкого и поэтому неспособность в некоторых случаях выявить очаги поражения размерами до 5 мм, которые видны на КТ.
При появлении новых метастазов повторные оперативные вмешательства технически сложнее и травматичнее. При этом чаще, чем при первичных операциях, выполняется удаление доли или всего легкого, а осложнения составляют до 14%.
Однако у больных с рецидивными и вновь возникшими метастазами повторная операция (особенно в комбинации с химиотерапией) позволяет нередко значительно увеличить продолжительность жизни.
Прогноз
Существенное влияние на прогноз заболевания оказывают:
- интервал от радикального лечения первичной опухоли и выявлением метастазов в легкие: появление метастазов в сроки до 12 месяцев после радикального лечения является неблагоприятным признаком;
- увеличение внутригрудных лимфатических узлов значительно ухудшает прогноз и ставит под сомнение целесообразность операции;
- размеры метастазов, превышающие 5 см, являются неблагоприятным фактором;
- быстрый рост метастазов указывает на неблагоприятный прогноз болезни.
Такие факторы, как пол, проведение лучевой терапии, сторона поражения, методы диагностики, наличие высыпаний на плевре, расположение метастаза на периферии или центрально, мало влияют на исход заболевания.
Наиболее опасные виды рака: описание, эффективность лечения, прогнозы | | Infopro54
Рак: что это такое?
К онкологическим относятся заболевания, связанные с возникновением и разрастанием злокачественной опухоли. Раковые клетки активно делятся и с током крови распространяются по всему организму, провоцируя появление метастаз – вторичных, удаленных от первого очагов опухолей. Раковыми называют видоизмененные клетки с укрупненным ядром и высокой скоростью деления.
Онкология опасна тем, что на первых этапах какие-либо симптомы появления злокачественной опухоли отсутствуют, а успех лечения во многом определяется тем, на какой стадии удалось выявить и диагностировать заболевание. Кроме того, даже при своевременной и качественной терапии сохраняется опасность возникновения рецидива болезни. И самый важный фактор: не существует методик и лекарств, способных со стопроцентной гарантией победить рак.
Кроме того, даже при своевременной и качественной терапии сохраняется опасность возникновения рецидива болезни. И самый важный фактор: не существует методик и лекарств, способных со стопроцентной гарантией победить рак.
Меланома
Злокачественная опухоль кожи, меланома, относится к особо агрессивным видам рака. Причиной перерождения пигментных клеток, отвечающих за выработку меланина, нередко служит злоупотребление загаром. В список причин также входит вынашивание ребенка, прием ряда медикаментов и другие внешние и внутренние факторы.
Меланома носит звание «королевы рака». Выживаемость зависит от стадии, на которой было начато лечение. На первой стадии наблюдается 91% благополучных исходов, на четвертой – только 15%. Важно знать, что меланома опасна не только сама по себе – она нередко приводит к возникновению рака костей, легких, печени, головного мозга.
Рак легких
Основной причиной возникновения злокачественной опухоли в легком является курение. По статистике в 52% случаев опухоль развивается в правом легком, в 48% случаев – в левом. Данное заболевание на начальных стадиях протекает бессимптомно, при этом быстро распространяются метастазы.
Для диагностики рака легких эндоскопическое исследование бронхов, томография грудной клетки. Если удалось обнаружить заболевание на ранней стадии, вероятность выздоровления составляет около 54%. На поздних стадиях шанс выжить минимален – порядка 4%.
Рак мозга
Перерождение и бесконтрольное деление клеток может начаться в любой области и зоне головного мозга. Заболевание может быть наследственным, к причинам также относят генетические аномалии, гормональные нарушения, ряд вирусных заболеваний. Медицина еще не установила основной фактор возникновения рака мозга.
Данный вид онкологии крайне редко провоцирует появление метастаз, но относится к наиболее опасным, так как химиотерапия и иные методы лечения малоэффективны, а сама опухоль часто неоперабельна. Выживаемость при ранней диагностике — 65%, при обнаружении на поздних стадиях – не более 17%.
Выживаемость при ранней диагностике — 65%, при обнаружении на поздних стадиях – не более 17%.
Рак поджелудочной железы
Злокачественная опухоль, появившаяся в поджелудочной железе, быстро разрастается и захватывает соседние органы. Заболевание протекает бессимптомно и с трудом поддается лечению.
Рак поджелудочной по степени распространенности занимает 10 место среди онкологических заболеваний, при этом по смертности он находится на четвертой позиции. При диагностике на ранней стадии лишь 2-5% пациентов после прохождения лечения живут дольше 5 лет. Если опухоль неоперабельна, только 30-40% больных проживают около трех лет. В запущенных случаях лишь 50% пациентов может прожить около года. При диагностике на поздних стадиях только 10% больных живут более 10 недель.
Рак мочевого пузыря
Данный вид онкологии часто диагностируется на начальных стадиях и хорошо поддается лечению. Опасность рака мочевого пузыря заключается в большом риске послеоперационных осложнений и частых рецидивах. Заболеванию в большей степени подвержены мужчины — у них этот вид рака встречается в 4 раза чаще по сравнению с женщинами.
Более 5 лет живет 94% пациентов, у которых рак мочевого пузыря был диагностирован на начальных стадиях. При выявлении онкологии на 3 стадии выживаемость составляет 45%, на 4-й – от 7 до 26%.
Рак желудка
Один из наиболее распространенных видов рака, по частоте встречаемости занимает второе место после рака легких. Причиной возникновения рака желудка может служить частый прием алкоголя, курение, плохие экологические условия жизни, неправильное питание, бактерия Хеликобактер пилори, способная выжить в соляной кислоте.
Рак желудка часто диагностируется только на поздних стадиях, так как на начальных стадиях его можно принять за гастрит или язву. Кроме того, многие больные долгое время не обращают внимания на симптомы или занимаются самолечением.
При обнаружении рака желудка на 1 стадии излечивается 70-80% заболевших, на 2 стадии выживаемость составляет 56%, на 3-й – 38%, на 4-й – 5%.
Лейкемия
Лейкемия также известна под названиями белокровие, лимфосаркома, лейкоз. Это рак крови, его опасность заключается в отсутствии локации, где растет опухоль – аномальны клетки перемещаются по всему организму вместе с кровотоком. Перерождение лейкоцитов негативно сказывается на свойствах крови, что ведет к нарушению работы всех систем и органов.
Из-за отсутствия или слабо выраженной симптоматики лейкемия нередко диагностируется уже на поздних стадиях. Если традиционная терапия не помогает, для лечения необходима трансплантация клеток костного мозга от подходящего донора. Если рак крови диагностирован на ранних стадиях, у 30% больных выживаемость превышает 5 лет. Но для людей старше 60 лет эта статистика составляет около 10%. У 85% больных, прошедших лечение, наблюдается рецидив и ухудшение состояния спустя 3-5 лет после курса терапии.
Лимфома
Лимфмой называют рак лимфатических узлов. Злокачественная опухоль может возникнуть в любом лимфоузле, то есть, это заболевание способно затронуть любой внутренний орган. Лимфома опасна чрезвычайно быстрым распространением.
Существует несколько разновидностей лимфомы. Лучше всего подается лечению лимфома Ходжкина, обнаруженная на ранних стадиях – у 90% больных наблюдается выживаемость свыше 5 лет. В среднем при раке лимфоузлов любого типа выживаемость составляет около 60% — 70-80% при ранней диагностике и 20-30% при обнаружении на поздних этапах.
Заключение
Рассмотрев подробно основные виды рака, самым опасным стоит признать меланому. Ее часто обнаруживают слишком поздно, когда быстро прогрессирующая болезнь успевает поразить многие внутренние органы. При любых подозрительных симптомах следует обращаться к врачу, чтобы пройти обследование на предмет онкологических заболеваний.
Фото с сайта pixabay.com
В НМИЦ Блохина излечили без операции пациента с раком прямой кишки IV стадии
Такой диагноз Армену Тер-Авакяну поставили нижегородские онкологи в июне 2018 года.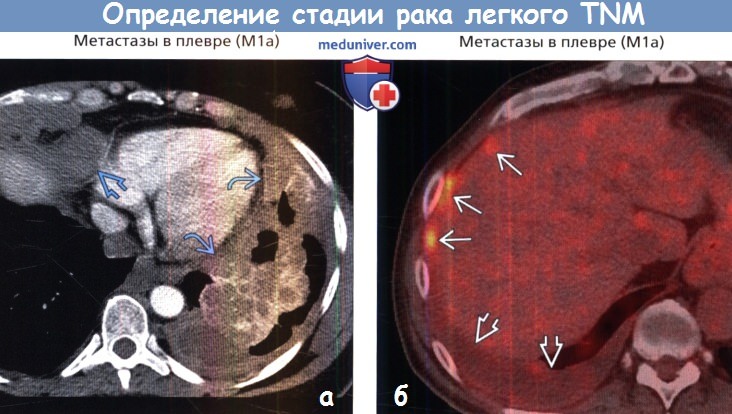 За лечением в федеральный онкоцентр он обратился самостоятельно, поскольку направление ему не давали. Здесь пациенту сделали генетическое обследование, чтобы определить мутационный статус опухоли, подтип, дифференцировку, локализацию, глубину инвазии.
За лечением в федеральный онкоцентр он обратился самостоятельно, поскольку направление ему не давали. Здесь пациенту сделали генетическое обследование, чтобы определить мутационный статус опухоли, подтип, дифференцировку, локализацию, глубину инвазии.
«В итоге выявили аденокарциному с определенным набором мутаций и подобрали таргетные препараты, которые присовокупили к химиотерапии. Они с большой эффективностью работали на его раковые клетки и метастазы», — цитирует пресс-служба НМИЦ заведующего колопроктологическим отделением Замана Мамедли.
Обычная схема предполагает химиотерапию с последующим (при достижении стабилизации) удалением прямой кишки. Но специалисты НМИЦ, определив с помощью КТ грудной клетки и МРТ малого таза, что опухоль и очаги в легких уменьшились, решили добавить лучевую терапию.
«Малый таз — зона, где располагается кишка с опухолью и ближайшие лимфоузлы, где потенциально тоже могут быть метастазы, были облучены по короткой программе, в течение пяти дней. Одновременно с этим облучили очаги в легких с помощью современной технологии — пучки с многих сторон соединились в точке, где у него метастазы. После мы продолжили лечение, уменьшив дозы и убрав два из трех препаратов. Все это — ступени персонализированного подхода, который пошагово определяется в ходе лечения, исходя из индивидуальных особенностей пациента и течения болезни», — пояснил доктор Мамедли.
В течение года пациент получил 15 курсов химиотерапии и лучевую терапию с заменой и комбинированием компонентов. При этом лечение больной перенес благополучно, без выраженной реакции на токсичность, добавил лечащий врач, онколог Хасан Джумабаев.
В итоге КТ, МРТ и гистологическое исследование показали, что признаков заболевания (раковых клеток в прямой кишке и метастазов в легких) у пациента нет, они исчезли и заместились рубцами. Операция ему не требуется. Армен Тер-Авакян пока продолжает получать курсы поддерживающей химиотерапии, но врачи намерены провести очередной консилиум и обсудить ее целесообразность. Скорее всего, ему назначат наблюдение раз в два месяца.
Скорее всего, ему назначат наблюдение раз в два месяца.
За счет чего онкологи способны расширить возможности терапии рака легкого
По данным The International Agency for Research on Cancer (IARC), в 2018 году в мире было выявлено почти 2,1 млн новых случаев рака легкого. Эта локализация занимает первые строчки не только в структуре глобальной онкозаболеваемости, но и превосходит многие другие ЗНО по смертности – 1,7 млн погибших пациентов во всем мире. Однако онкологи говорят о наметившемся позитивном тренде, позволяющем им находить новые терапевтические опции даже для пациентов с IV стадией заболевания. О том, как повышаются шансы на лечение рака легкого для курильщиков, каковы ожидания врачей от иммунотерапии в целом – в интервью заведующего онкологическим отделением лекарственных методов лечения НМИЦ онкологии им. Н.Н. Блохина, д.м.н. Константина Лактионова.
– Рак легкого остается наиболее распространенным онкологическим заболеванием в мире, лидируя, увы, и по показателю летальности. Российская эпидемиологическая картина подтверждает мировую статистику?
– Ежегодно в России раком легкого заболевают около 55 тысяч человек, для образного понимания – это примерно численность населения Кронштадта. Половина пациентов умирают где-то в первый год с момента установления диагноза. То есть в год погибают 25–30 тысяч человек, получается, что в России примерно каждые 10 минут от рака легкого умирает пациент.
Первая в мире монография по раку легкого была опубликована в 1912 году, и тогда еще долго думали, писать ли вообще работу о таком редком заболевании, как рак легкого. И за век – такой скачок, глобально в структуре заболеваемости рак легкого занимает второе или третье место.
– Такая стабильно драматичная летальность не сокращается?
– С внедрением новых методов лечения расчетные показатели выживаемости получили позитивную тенденцию. Просто сейчас мы только набираем эту группу больных, которые будут жить долго благодаря таким методам лечения. Таргетная терапия получила распространение в первое десятилетие 2000-х, а вообще иммунотерапия в мире появилась в последние 6-7 лет. Иными словами, позитивный тренд сейчас действительно наметился, имеет место, но критическая масса больных, которая получила эти современные варианты лечения, еще не набрана. И все же мы ожидаем сдвига в лучшую сторону.
Просто сейчас мы только набираем эту группу больных, которые будут жить долго благодаря таким методам лечения. Таргетная терапия получила распространение в первое десятилетие 2000-х, а вообще иммунотерапия в мире появилась в последние 6-7 лет. Иными словами, позитивный тренд сейчас действительно наметился, имеет место, но критическая масса больных, которая получила эти современные варианты лечения, еще не набрана. И все же мы ожидаем сдвига в лучшую сторону.
– Какая доля больных приходится на немелкоклеточный рак легкого?
– Соотношение больных с немелкоклеточным и мелкоклеточным раком легкого примерно 85% на 15%. Мелкоклеточный возникает практически только у курильщиков и отличается очень агрессивным течением. И вот при таком раке легкого хирургию практически не используют, а всегда идут по пути консервативных методов лечения, потому что именно на эту терапию мелкоклеточный рак неплохо реагирует.
– А в чем особенности течения и терапии немелкоклеточного рака легкого?
– Зависит от того, в какой стадии выявлен процесс. Если это I, II и частично III стадия, то очень важно рассмотреть возможность проведения хирургического лечения. Потому что этот наиболее радикальный метод дает реальную надежду на выздоровление. Кстати, в целом можно оперировать такими категориями: где-то у четверти больных рак легкого выявляется на I-II стадии, примерно у 30–35% – на III стадии, около 40% – на IV. Есть термин «опухоль не визуальной локализации», то есть это не рак кожи, не рак молочной железы, где опухоль можно увидеть либо прощупать. Рак легкого – это опухоль с глубоким расположением в организме, поэтому на ранних этапах симптомы не очень заметны.
Соответственно, иногда заболевание манифестирует лишь в тот момент, когда уже появились отдаленные метастазы. И здесь все надежды связаны с эффективной лекарственной терапией. А чем раньше мы выявляем, тем лучше результаты: на I стадии процент выздоровления составляет 75%, на II – около 50%, на III – можем надеяться где-то на 25%. На IV стадии до последнего времени наши надежды вообще были минимальны. Но сейчас, с появлением новых вариантов лечения, есть категория больных, которые могут надеяться либо на долгосрочный контроль болезни, либо даже на выздоровление.
На IV стадии до последнего времени наши надежды вообще были минимальны. Но сейчас, с появлением новых вариантов лечения, есть категория больных, которые могут надеяться либо на долгосрочный контроль болезни, либо даже на выздоровление.
– Позитивный тренд в лечении рака легкого наметился благодаря новым возможностям иммунотерапии?
– Стало понятно, с помощью чего опухоль уклоняется от надзора собственной иммунной системы организма – за разработку и понимание этого механизма ученые получили Нобелевскую премию. То есть они разгадали, как опухоль выживает, спасаясь от атаки иммунной системы. Иммунная система умеет эту опухоль распознавать, а опухоль, в свою очередь, пытается защититься. И задача современной иммунной терапии в онкологии – это не противоопухолевый эффект, не активация иммунной системы, а, в общем-то, поломка механизма защиты опухоли. То есть иммунотерапия блокирует то, с помощью чего опухоль уклоняется от надзора. А затем собственная иммунная система ее уничтожает. Сегодня мы можем говорить, что порядка 25–30% опухолей используют именно такой механизм защиты. И, соответственно, назначая иммунотерапию, примерно такой же доле пациентов мы можем помочь. Остальные 70% опухолей уклоняются за счет какого-то другого механизма, который нам пока не до конца ясен. На сегодняшний день зафиксирован только один маркер, который нам предсказывает эффективность иммунотерапии, это так называемая PDL-экспрессия. Именно с помощью этого рецептора опухоль и пытается спрятаться от активной иммунной системы. И понятно, что чем больше таких рецепторов на поверхности опухоли, тем больше шансов, что она уклонится от надзора. Задача иммунотерапии – сразу блокировать этот рецептор, препарат соединяется с этим рецептором, и он становится функционально неактивным.
– Для каких групп пациентов эти новые терапевтические опции актуальны? Получают ли такие возможности лечения пациенты с НМРЛ?
– Если смотреть глобально, то эти механизмы защиты вообще изначально были разработаны организмом для того, чтобы защищаться от аутоиммунной агрессии, заболеваний типа системной красной волчанки, ревматоидного артрита. И организм эволюционно разработал защиту с помощью этого рецептора, чтобы защищать нормальные ткани. А опухоль украла этот механизм, стала использовать его в своем арсенале и так защищаться. Поэтому наша идеология лежит над органной принадлежностью опухоли.
И организм эволюционно разработал защиту с помощью этого рецептора, чтобы защищать нормальные ткани. А опухоль украла этот механизм, стала использовать его в своем арсенале и так защищаться. Поэтому наша идеология лежит над органной принадлежностью опухоли.
Чтобы иммунитет распознал опухоль, у нее должна быть сильная мутационная нагрузка. Есть опухоли, в которых мало мутаций и иммунитет их плохо распознает, поэтому у таких опухолей нет задачи с помощью этого рецептора уклоняться. В таком случае иммунотерапия не будет работать. А есть, например, курильщики, у которых в течение 15–20 лет происходит ряд последовательных событий – одна мутация переходит в другую, вторая – в третью и так далее, пока не произойдет трансформации нормальной клетки в опухолевую. И вот такие опухоли курильщиков как раз сильно нагружены разными мутациями. И для них иммунотерапия кажется очень и очень перспективной. До иммунотерапии шансов у курильщиков на эффективное лечение IV стадии не было, шесть лет назад мы ничего обнадеживающего курильщикам предложить не могли. При этом курильщики – основная категория пациентов, страдающих раком легкого, их 90–95%.
– Играет ли роль, на какой стадии у курильщика выявлен рак легкого?
– Нет, сегодня стандарты использования иммунотерапии распространяются уже на III и IV стадии. То есть при I и II стадии это еще не стандартное лечение, но для III и IV в текущих мировых и российских стандартах в определенных случаях уже прописано использование иммунотерапии. При этом международные клинические исследования уже «зашли» в I и II стадии, и, надо сказать, первые результаты очень обнадеживающие. И мы ждем, что стандарты лечения даже I и II стадий в обозримом будущем будут пересмотрены и туда тоже будет интегрирована иммунотерапия.
– Насколько иммунотерапия продвинулась в лечении пациентов с НМРЛ?
– Сегодня у нас появились результаты применения иммунотерапии в реальной клинической практике. И никаких особенностей, генетических предрасположенностей, национальных расовых особенностей в эффективности препарата мы не видим. Те же результаты, которые были достигнуты в международных клинических исследованиях, повторяются и в лечении наших пациентов в рутинной практике. Фактически по частоте достижения ответа на иммунотерапию, по длительности этого ответа и по числу пациентов, находящихся в ремиссии больше 3-4 лет, показатели идентичны. Сегодня 25–30% пациентов, которые начинают лечение уже в IV стадии болезни, имеют шансы на длительный контроль над болезнью. И мы даже можем предположить, что у части этих пациентов есть потенциал на выздоровление, потому что даже по мировой статистике самые отдаленные результаты прослеживаемости составляют шесть лет. Но у нас перед глазами есть использование иммунотерапии при диссеминированной меланоме – результаты наблюдения более 10 лет. Кривые выживаемости очень похожи, а я уже говорил об универсальных механизмах контроля над болезнью, и в лечении диссеминированной меланомы мы уже считаем, что есть выздоровевшие, поэтому и при раке легкого мы тоже ожидаем потенциал выздоровления.
И никаких особенностей, генетических предрасположенностей, национальных расовых особенностей в эффективности препарата мы не видим. Те же результаты, которые были достигнуты в международных клинических исследованиях, повторяются и в лечении наших пациентов в рутинной практике. Фактически по частоте достижения ответа на иммунотерапию, по длительности этого ответа и по числу пациентов, находящихся в ремиссии больше 3-4 лет, показатели идентичны. Сегодня 25–30% пациентов, которые начинают лечение уже в IV стадии болезни, имеют шансы на длительный контроль над болезнью. И мы даже можем предположить, что у части этих пациентов есть потенциал на выздоровление, потому что даже по мировой статистике самые отдаленные результаты прослеживаемости составляют шесть лет. Но у нас перед глазами есть использование иммунотерапии при диссеминированной меланоме – результаты наблюдения более 10 лет. Кривые выживаемости очень похожи, а я уже говорил об универсальных механизмах контроля над болезнью, и в лечении диссеминированной меланомы мы уже считаем, что есть выздоровевшие, поэтому и при раке легкого мы тоже ожидаем потенциал выздоровления.
– Пациенты находятся на иммунотерапии весь названный вами период наблюдения?
– На сегодняшний день этот вопрос окончательно не решен – есть несколько направлений, которые продолжают изучаться в клинических исследованиях. В некоторых случаях лечение назначается до прогрессирования болезни либо до непереносимой токсичности, то есть фактически пожизненно. В других исследованиях препарат назначается на год или на два. Есть и другие промежуточные сроки, но основные тенденции такие. Все иммуноонкологические препараты, зарегистрированные в мире, есть и в России. Каждая клиническая ситуация трактует выбор определенного препарата, ведь вообще каждая опухоль индивидуальна и у нее существует свой генетический портрет. То есть иммуноонкологические препараты не являются полными аналогами друг друга и у них есть свои нюансы и показания к назначению в зависимости от клинической ситуации.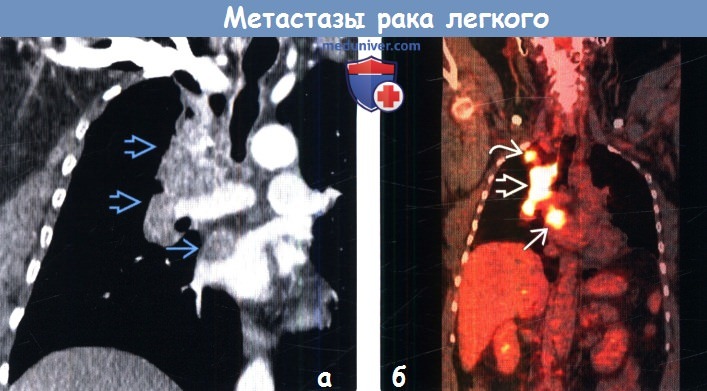 Поэтому назначение иммунотерапии сегодня – это работа для очень высококвалифицированного медицинского специалиста.
Поэтому назначение иммунотерапии сегодня – это работа для очень высококвалифицированного медицинского специалиста.
– Можно ли улучшить возможности современной иммунотерапии?
– Есть несколько возможностей. Во-первых, за счет изучения биомаркеров – лучше отбирать группу пациентов для назначения иммунотерапии, в которой она с максимальной вероятностью сработает. Например, пациенты с очень выраженной экспрессией PDL – им достаточно назначить даже только иммуноонкологический препарат, без других лекарственный опций, и результат будет весьма удовлетворительный. Хотелось бы, чтобы появились новые предикторы эффективности этой терапии, однако пока их нет.
Другая стратегия – комбинация иммунотерапии с другими вариантами противоопухолевой терапии. Иммунотерапия хорошо сочетается со стандартной химиотерапий, лучевой терапией, таргетной терапией. Эти сочетания увеличивают частоту непосредственных эффектов и обладают синергизмом – потенциируют друг друга, помогают друг другу реализовать собственный эффект. Если нет выраженной экспрессии PDL, то врачи используют такие комбинированные варианты.
Есть третья опция – двойная иммунотерапия. Здесь надежды именно на воздействие на разные этапы формирования собственного иммунитета. Мы говорили, что иммунотерапия работает на финальном этапе, когда лимфоцит распознал опухоль и готов ее уничтожить. Но прежде чем лимфоцит доберется до опухоли, должны пройти так называемые события запуска и реализации этого механизма – лимфоцит должен научиться распознавать опухоль, правильно увеличить численность той своей популяции, которая умеет распознавать опухоль. Потом эту «армию» лимфоцитов нужно доставить к опухоли и уже там проконтактировать с ней. И вот задача двойной иммунотерапии – действовать не только на этом финальном этапе, но и на предыдущих, когда происходит активация лимфоцита и его размножение. Тогда проявляется больше активных лимфоцитов, которые лучше распознают опухолевую клетку, в конечном итоге в сочетании с тем, что второй компонент иммунотерапии будет действовать как блокатор опухоли, – это дает более выраженные эффекты. И такие схемы иммунотерапии уже зарегистрированы для лечения больных НМРЛ – и в мире, и в России. В данном случае регистрация схем лечения была практически одновременной.
И такие схемы иммунотерапии уже зарегистрированы для лечения больных НМРЛ – и в мире, и в России. В данном случае регистрация схем лечения была практически одновременной.
Этот подход не только контроля, но и формирования собственного противоопухолевого иммунитета на всех этапах обеспечивает примерно такую же частоту ответа, как комбинированная терапия, но глубина ответа в плане длительности контроля над болезнью тут значимо возрастает. Если эффект достигнут, то длиться он будет долго – это отличительная черта двойной иммунотерапии. Ее работа – это помощь иммунной системе в активации своих «бойцов», эффективный процесс формирования собственного противоопухолевого иммунитета в принципе в организме, поэтому ширина применения такого подхода очень большая. В случае с той же меланомой уже давно зарегистрированы такие подходы, эта концепция уже реализована, то есть дальнейший потенциал и перспективы у такого подхода очень хорошие. Более того, на примере меланомы исследования показали, что один иммуноонкологический препарат лучше, чем просто химиотерапия, более новый иммуноонкологический препарат лучше, чем препарат первого поколения, а сочетание иммуноонкологических препаратов работает лучше, чем каждый из них по отдельности. Для рака легкого этот режим зарегистрирован в первой линии, и это серьезная опция в лечебном арсенале.
Рак легких — симптомы, лечение, диагностика, операция.
• Определение стадии опухоли.
Пожалуй, ключевым моментом в предоперационном обследовании пациентов со злокачественными опухолями является определение стадии заболевания, то есть оценка степени распространенности рака (прорастание в окружающие органы, метастазы в лимфатические узлы и отдаленные органы). Именно стадия опухоли определяет прогноз и диктует выбор оптимальной тактики лечения. При раке легкого вопросы стадирования особенно остры и актуальны, так как цена решения о выполнении/невыполнении операции очень высока, а значит, от того насколько правильно и точно проведено стадирование зависит адекватность и эффективность лечения. Для предоперационного стадирования пациентов с раком легкого в нашем Центре разработан алгоритм, который согласуется с европейскими рекомендациями. У некоторых пациентов сочетание данных компьютерной томографии и позитронной эмиссионной томографии достаточно для определения стадии рака, однако в большинстве случаев для точного знания стадии необходимо прибегать к небольшой диагностической операции – видеомедиастиноскопии (рис. 6). Эта процедура нужна для биопсии лимфатических узлов средостения. Нами накоплен и проанализирован крупнейший в городе опыт использования видеомедиастиноскопии при раке легкого. Результаты нашего исследования показали, что выполнение видеомедиастиноскопии перед большой операцией на легком позволяет улучшить отдаленные результаты лечения.
Для предоперационного стадирования пациентов с раком легкого в нашем Центре разработан алгоритм, который согласуется с европейскими рекомендациями. У некоторых пациентов сочетание данных компьютерной томографии и позитронной эмиссионной томографии достаточно для определения стадии рака, однако в большинстве случаев для точного знания стадии необходимо прибегать к небольшой диагностической операции – видеомедиастиноскопии (рис. 6). Эта процедура нужна для биопсии лимфатических узлов средостения. Нами накоплен и проанализирован крупнейший в городе опыт использования видеомедиастиноскопии при раке легкого. Результаты нашего исследования показали, что выполнение видеомедиастиноскопии перед большой операцией на легком позволяет улучшить отдаленные результаты лечения.
Рис. 6. Видеомедиастиноскопия – диагностическая операция, по результатам которой выбирается тактика лечения, определяется целесообразность хирургического лечения. А – введение медиастиноскопа в средостение через маленький разрез кожи на шее. Б – выполнение биопсии лимфоузлов под контролем видеоизображения. В – эндоскопическая картина во время операции: 1 – левый главный бронх, 2 – правый главный бронх, 3 – бифуркационные лимфоузлы, 4 – легочная артерия. Г – операция завершается наложением косметичного внутрикожного шва, практически незаметного на коже.
• Лечение.
В лечении рака легкого используются хирургическая операция, лучевая терапия, химиотерапия. Наиболее эффективным методом лечения при I-II стадии опухоли является хирургическое вмешательство, в ходе которого хирурги удаляют больную часть (долю) легкого или все легкое, а также лимфатические узлы средостения. При ранних стадиях рака легкого 5-летняя выживаемость после операции составляет 75-80 %. Для уменьшения травматичности необходимой больному операции в нашем Центре широко используются видеоторакоскопические вмешательства, которые позволяют существенно уменьшить операционную травму, послеоперационный болевой синдром, снизить частоту осложнений и существенно сократить восстановительный период.
При определении показаний к операции важно учитывать не только распространенность опухоли, но и возможность организма больного перенести необходимый объем операции, что в торакальной хирургии называется «функциональная операбельность». Мы уделяем большое внимание определению функциональной операбельности, для чего используются различные методы для оценки функциональных резервов организма.
В нашем Центре результаты обследования каждого пациента представляется на клиническом разборе и онкологической комиссии, где после подробного обсуждения выносится окончательное решение. Если оптимальным для больного является хирургическое лечение, операция незамедлительно выполняется торакальными хирургами нашего Центра (рис. 7). В тех случаях, когда вместо операции или после хирургического вмешательства пациенту необходима химиолучевая терапия, мы направляем больного в ведущие онкологические центры нашего города.
Рис. 7. Малоинвазивная радикальная операция при раке легкого – видеоторакоскопическая нижняя лобэктомия слева, выделение легочной артерии.
Чтобы записаться на консультацию к врачу по поводу диагностики и лечения рака легких в нашем центре —
позвоните по тел.: +7 952 3598179 – Санкт-Петербург (СПб).
Лечится ли рак 4 стадии?
Злокачественные образования проходят 4 этапа развития. Четвертая стадия является заключительной. На этом этапе образование захватывает весь организм, распространяясь не только на окружающие, но и на далекие органы.
Для последней стадии характерно:
- Метастазирование по крови.
 Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам.
Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам. - Образование отдаленных очагов в других органах. Изначально рак поражает только ткани, в которых образуется, постепенно захватывая окружающие участки. На последней стадии он дает дочерние опухоли в разных органах.
В зависимости от типа опухоли до развития четвертой стадии может пройти от нескольких недель (меланома), до нескольких лет (рак желудка, периферический НМРЛ).
Симптомы и изменения в организме на 4 стадии
Рак диагностируется на последней стадии в 45% случаев. Причина в том, что некоторые опухоли совсем не дают о себе знать (мезотелиома, меланома, рак щитовидки). Они не вызывают болезненности, а незначительные изменения не привлекают внимания пациента. Поэтому имеет место позднее обращение.
В этом случае о развитии онкологического процесса дают знать именно метастазы, которые чаще всего развиваются в печени, легких и костях. Они болезненны и вызывают яркую симптоматику. Метастазы в печени дают желтуху и увеличение размеров живота. Легочные – одышку, а костные – сильные боли и частые переломы.
Однако в большинстве случаев опухоли обнаруживаются раньше.
К четвертой стадии больной страдает от:
- сильной интоксикации;
- повышений температуры тела;
- чрезмерной слабости, потливости;
- тошноты и рвоты;
- сильного похудения.
Наблюдаются нарушения в анализах крови: чрезмерное повышение лейкоцитов, анемия, большой уровень кальция.
Разросшиеся образования могут препятствовать нормальному току крови, оттоку мочи, выходу кала. Могут развиться свищи в соседние полости, граничащие с пораженным органом. Как правило на этом этапе рак уже пророс во все окружающие структуры. Поэтому начинается гниение и разложение. Больного преследуют сильные боли, гнилостный запах, разнообразные нарушения в работе организма.
Конкретные симптомы очень отличаются в зависимости от размера и вида опухоли. При раке мозга наблюдаются головные боли, потери сознания, эпилептические приступы, а при раке прямой кишки – недержание кала и кровь в испражнениях.
Диагностика и классификация
При подозрении на рак всегда проводятся обследования на наличие метастазов, что и позволяет окончательно определить стадию процесса.
Для этого проводят:
- Проверку крови на наличие онкомаркеров. В зависимости от распространенности опухоли их количество бывает разным.
- ПЭТ. Позитронно-эмиссионная томография позволяет визуализировать опухоли в любом месте организма.
- Рентген. С его помощью можно обнаружить метастазы в костях.
- УЗИ. Покажет образования в органах и мягких тканях.
Для подтверждения метастатической природы опухолей могут брать биопсию для сравнения вида клеток с первичным образованием.
Обозначается стадия, исходя из общепринятой международной классификации, которая сокращается аббревиатурой TNM, где Т показывает размер опухоли, N – число пораженных лимфатических узлов и М – наличие отдаленных дочерних опухолей.
На четвертом этапе показатели Т и N не имеют значения.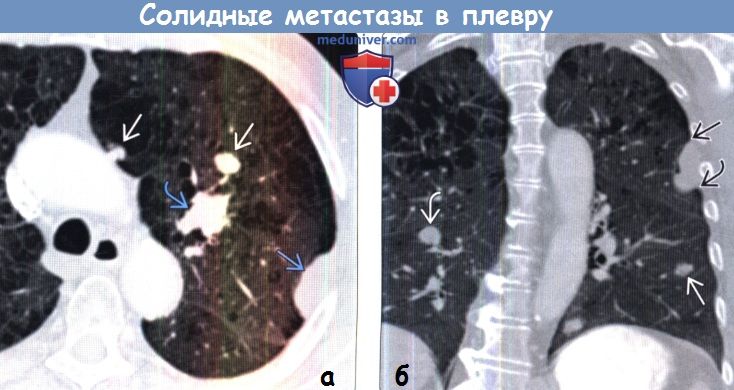 Исходная опухоль может быть меньше сантиметра и совсем не затронуть лимфоузлы. Образование отнесут к заключительной стадии, как только возле буквы М будет стоять цифра от 1 и более. Однако к 4 этапу все же большинство опухолей больше 6 сантиметров и затрагивает как близлежащие, так и отдаленные регионарные лимфоузлы.
Исходная опухоль может быть меньше сантиметра и совсем не затронуть лимфоузлы. Образование отнесут к заключительной стадии, как только возле буквы М будет стоять цифра от 1 и более. Однако к 4 этапу все же большинство опухолей больше 6 сантиметров и затрагивает как близлежащие, так и отдаленные регионарные лимфоузлы.
Каким путем была определена стадия образования, указывает буква С. К ней добавляют цифровое обозначение:
- Установлена путем стандартного обследования – визуального осмотра (например, при образованиях половых органов, кожи, полости рта), эндоскопии или рентгена.
- Были применены специальные методы исследования (КТ, МРТ, биопсия).
- Болезнь определена в ходе диагностической операции с взятием на исследование зараженных тканей.
- Диагноз поставлен после полноценной операции.
Диагноз, поставленный путем С1, не считается достаточно достоверным и может быть оспорен. Наиболее надежное определение стадии происходит во время операций.
Лечение
Прогноз на четвертой стадии неутешителен. Большинство больных неоперабельны и им предлагается только паллиативное лечение. Многие погибают в первый год после постановки диагноза.
Даже проведенная операция ненамного продлевает жизнь. Удаление образования возможно либо частично, либо вмешательство настолько масштабно, что дает серьезные осложнения.
Для лечения и облегчения состояния используются химиотерапия и облучение. Они помогают уменьшить размер образования, убрать метастазы и замедлить рост опухоли. Однако полностью уничтожить рак удается редко. Часто организм больного очень ослаблен, а борьба с распространенной опухолью требует высоких доз радиации и цитотоксических препаратов, что дает множество осложнений. Для части пациентов они являются губительными.
Предлагают сейчас и современные более эффективные и менее инвазивные методы.
- Таргетную терапию – нацеленное воздействие на клетки опухоли химиопрепаратами.
- Химиоэмболизацию – прекращение кровоснабжения опухоли.
- Протонную терапию – это высокоточное лучевое лечение. Метод является щадящим и может применяться для неоперабельных больных и людей, имеющих различные сопутствующие заболевания (сахарный диабет).
- Стереотаксическую радиочастотную электрохирургию – ее применение дает полный регресс дочерних образований у 26% пациентов благодаря использованию высоких доз, точному попаданию в область опухоли и метастазов.
Любые методы лечения в основном помогают убрать мучительные симптомы и продлить жизнь на 1-3 года. Выздоравливает небольшой процент больных. Дольше пяти лет живет 5-35% пациентов (в зависимости от пораженного органа).
Примечание!
Информация, размещенная в этом материале, предоставляется в ознакомительных целях. Установление показаний к лечению и назначение противоопухолевых препаратов может делать исключительно лечащий врач. Обязательно проконсультируйтесь с врачом!
Автор: Центр персонализированной фармации «Хемотека»
Уроженец Архангельска рассказывает в своем блоге, как выживать с 4-й стадией рака | 29.ru
В ноябре опять госпитализация с сепсисом. Компьютерная томография показала рост метастаз в лимфоузлах и на брюшине. К январю 2020-го из-за метастаз начались боли в животе — Алексей готовится к новой госпитализации. Обо всех этапах лечения Алексей рассказывает в своей группе.
Всего за это время Алексей Липницкий перенес более 30 курсов химиотерапии, несколько серьезных операций на печени и кишечнике. Он отмечает, что на лечение такого сложного заболевания уходит много средств: на лекарства, анализы, консультации, дополнительные обследования, но часть услуг всё-таки можно получить бесплатно: есть клиники, в которых именно онкологию также лечат по ОМС. Практически все курсы химио- и таргетной терапии также оплатили из фонда ОМС.
Практически все курсы химио- и таргетной терапии также оплатили из фонда ОМС.
Важная встреча и миссия поддерживать других
Алексей рассказывает, что это испытание настолько погрузило его в тему, что теперь медсестры порой интересуются, нет ли у него медицинского образования, а соседи по палатам удивляются, что с ним медики советуются, как, что и когда капать. С врачами же знание своей проблемы досконально помогает вместе подбирать тактику лечения — её приходится менять часто.
Не так давно у Алексея Липницкого возникла идея начать свой блог о борьбе с раком — он назвал его «Миссия Ремиссия» и запустил в декабре 2019-го. Он рассказывает о своих принципах в лечении, рассуждает на тему «Как выжить с четвертой стадией рака», а также пишет небольшими постами о том, как протекает его болезнь, о книгах, которые поменяли его отношение к онкологии. Так вел свой блог врач-кардиолог Евгений Парнес, у которого рак кишечника с метастазами в печени нашли в 2013 году — информация из этого блога на начальном этапе помогала Алексею разобраться в том, что происходит с его организмом.
Желание рассказывать обо всем публично вылилось из бесед с другими пациентами — для многих из них важно услышать поддержку из уст человека, который уже прошел через десятки сложных этапов и не сдается.
Алексей беседует с ними, старается приободрить, поделиться своими знаниями — иногда за советом ему звонят даже незнакомые люди. Общаясь, он и сам заряжается позитивной энергией. Говорит, что так он отдает Вселенной то, что в свое время ему дал один из его соседей по палате Сергей. Встречу с ним в самом начале лечения — на втором курсе химиотерапии — Алексей считает знаковой, очень важной. Это общение тогда дало надежду.
— Он болел к тому моменту уже 5 лет, была последняя стадия, метастазы в основном пошли в легкие. Он пережил 16 серьезных операций, десятки курсов химиотерапии. Это был умнейший человек, физик-ядерщик. За время болезни он очень глубоко погрузился в тематику, читал много иностранных статей по колоректальному раку.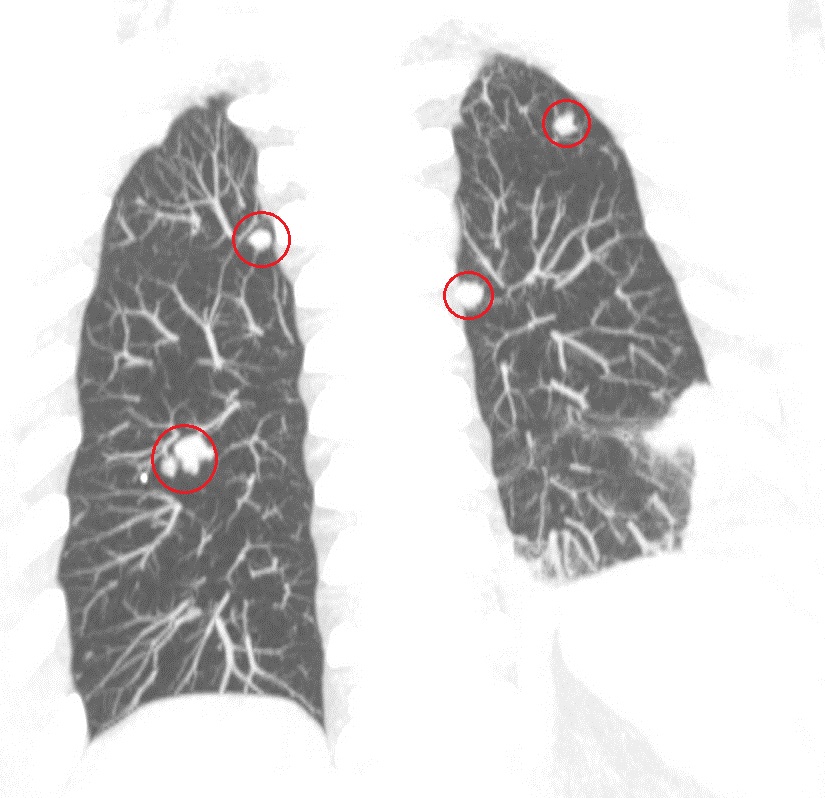 А еще Сергей был великолепным психотерапевтом.
А еще Сергей был великолепным психотерапевтом.
Рецидивирующая мелкоклеточная карцинома легкого с кожными метастазами в груди
Рак легкого остается ведущей причиной смертей, связанных с раком, и второй ведущей причиной новых случаев рака в Соединенных Штатах. Хотя чаще он поражает прикорневые узлы, печень, надпочечники, кости и мозг, рак легких может метастазировать практически в любой орган. Метастазы, хотя и редко встречаются в коже, могут быть первым признаком рака легких или кожные метастазы могут быть признаком рецидива заболевания.Заболеваемость кожными метастазами рака легких сообщается примерно в 1–12% случаев и связана с плохим прогнозом. Хотя кожные метастазы мелкоклеточного рака легкого встречаются редко, кожные метастазы в грудь встречаются еще реже. Здесь мы представляем случай рецидивирующего мелкоклеточного рака легкого с твердым пурпурным кожным метастатическим узлом в правой груди.
Общие сведения
Внутренние злокачественные новообразования, приводящие к метастазам в коже, встречаются редко, их частота составляет 2% в 5 крупных аутопсических исследованиях. 1 Кожные метастазы возникают, когда раковые клетки в организме распространяются на кожу через лимфатическую систему или кровоток, или раковые клетки могут распространяться непосредственно на кожу через хирургический рубец. Кожные метастазы могут возникать после того, как был диагностирован первичный рак, или в некоторых случаях эти поражения могут быть первым признаком рака. Рак легкого, вероятно, является причиной большинства кожных метастазов у мужчин и является второй по значимости причиной кожных метастазов у женщин после рака груди. 2 Наиболее часто регистрируемые метастатические поражения кожи возникают в результате первичного рака молочной железы, легких и толстой кишки. Другие виды рака, которые могут вызывать метастазы в кожу, включают меланому, а также рак почек, ротовой полости, шейки матки, яичников и поджелудочной железы. Кожные метастазы рака почек и полости рта чаще встречаются у мужчин и появляются в области головы и шеи. На коже появляются быстрорастущие, твердые, подвижные, безболезненные розовые или пурпурные поражения, которые могут изъязвляться.
На коже появляются быстрорастущие, твердые, подвижные, безболезненные розовые или пурпурные поражения, которые могут изъязвляться.
Рак груди является наиболее частой формой кожных метастазов у женщин из-за его высокой распространенности.Рак легкого является наиболее частым первичным злокачественным новообразованием, которое метастазирует в кожу у мужчин. Частота кожных метастазов при раке легких колеблется от 1% до 12% случаев. 3 Все гистологические типы рака легких могут вызывать метастазы в коже. Метастазы рака легких могут быть первым признаком рака легких, и клинически их нельзя отличить от кожных метастазов, происходящих из других органов. 4 Наиболее частыми местами кожных метастазов рака легких являются грудь, живот, голова и шея. 4,5 Клинически кожные метастазы проявляются в виде круглых или овальных узелков, подвижных или фиксированных, твердых и обычно цвета кожи (иногда красного, темно-красного, пурпурного или черного). Узелки обычно безболезненны и иногда могут изъязвляться. Изредка они могут проявляться в виде одиночных или сгруппированных папул, бляшек, зостериформ, рожистых воспалений или рубцовой алопеции на коже черепа. 6-8 При наличии поражений на груди они могут распространяться непосредственно из места биопсии легкого.Было обнаружено, что некоторые поражения кожных метастазов рака легких проходят параллельно кровеносным сосудам грудной клетки. Хотя все различные гистологические подтипы рака легких связаны с развитием кожных метастазов, чаще сообщается, что аденокарцинома или крупноклеточная карцинома легкого метастазируют таким образом. 9-11 Вторым по распространенности первичным источником метастатических кожных заболеваний у обоих полов является колоректальная карцинома. Наиболее частыми местами появления этих кожных метастазов являются брюшная полость и таз.Узел сестры Марии Джозеф на пупке является отличительным признаком рака желудочно-кишечного тракта. 12,13
Случай
У 57-летней белой женщины был обнаружен подкожный пурпурный узел размером 1,8 см в нижней части правой груди (рис. 1). Прошлый медицинский анамнез имел важное значение для двусторонних силиконовых грудных имплантатов 10 лет назад и диагноз мелкоклеточного рака легкого ограниченной стадии, лечившегося этопозидом / цисплатином плюс одновременное облучение грудной клетки, что привело к полной ремиссии 1 год назад.Для оценки этого кожного узелка была проведена компьютерная томография (КТ) грудной клетки и биопсия узла груди под контролем УЗИ. КТ грудной клетки подтвердила наличие двусторонних грудных имплантатов с грудным узлом 1,8 см в среднем нижнем квадранте правой груди и правым подмышечным лимфатическим узлом (рис. 2). Патология ткани, полученной при биопсии узелка груди, показана на Рисунке 3 и Рисунке 4.
1). Прошлый медицинский анамнез имел важное значение для двусторонних силиконовых грудных имплантатов 10 лет назад и диагноз мелкоклеточного рака легкого ограниченной стадии, лечившегося этопозидом / цисплатином плюс одновременное облучение грудной клетки, что привело к полной ремиссии 1 год назад.Для оценки этого кожного узелка была проведена компьютерная томография (КТ) грудной клетки и биопсия узла груди под контролем УЗИ. КТ грудной клетки подтвердила наличие двусторонних грудных имплантатов с грудным узлом 1,8 см в среднем нижнем квадранте правой груди и правым подмышечным лимфатическим узлом (рис. 2). Патология ткани, полученной при биопсии узелка груди, показана на Рисунке 3 и Рисунке 4.
Дальнейшее исследование с помощью компьютерной томографии брюшной полости и таза выявило аденопатию в брюшной полости, прилегающей к аорте и левому надпочечнику.Ей была начата химиотерапия второй линии паклитакселом 175 мг / м2 и карбоплатином (область под кривой зависимости концентрации от времени 6) внутривенно каждые 3 недели. После 4 курсов химиотерапии узелок груди больше не был виден или пальпирован при физикальном осмотре (рис. 5). Повторная компьютерная томография показала разрешение узелка груди и подмышечную и абдоминальную лимфаденопатию (рис. 6).
Обсуждение
Метастазирование рака — это избирательный процесс, определяемый анатомическими, биологическими и специфическими факторами микросреды. 14 Точный механизм метастазирования рака легких в кожу до конца не изучен. Несколько недавних исследований показали, что могут быть задействованы уникальные гены и генные сигнатуры. 15,16 Карциномы легких и груди являются наиболее распространенными первичными опухолями, которые приводят к кожным метастазам в коже у мужчин и женщин, соответственно. Некоторые виды рака демонстрируют предпочтение колонизации регионам их происхождения — рак легких наддиафрагмальной коже и колоректальный рак над поддиафрагмальными областями кожи.Хотя любой гистологический тип рака легкого может вызывать метастазы в кожу, 17 аденокарциномы и крупноклеточные карциномы являются наиболее часто встречающимися гистологическими исследованиями в литературе.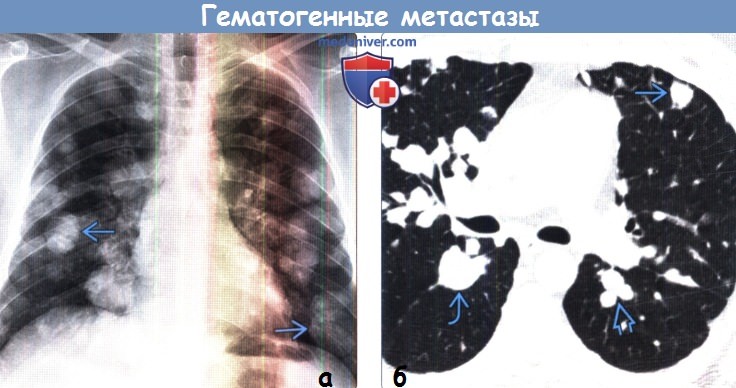 2,3
2,3
Мелкоклеточный рак легкого редко метастазирует на кожу. 18,19 В обзоре 4020 случаев кожных метастазов системного рака, 19 имели легочное происхождение и только 2 возникли в результате мелкоклеточной карциномы. 20 Злокачественные клетки мелкоклеточной карциномы часто поражают региональные области через лимфатические каналы, но они также могут широко распространяться по всему телу через гематогенное распространение.Метастазы в коже возникают при прогрессировании болезни и указывают на плохой прогноз. 4,21 Время выживания после появления кожных метастазов может составлять от 5 до 6 месяцев. 22 Пациенты, у которых кожные метастазы появляются раньше во время течения болезни, имеют худший прогноз по сравнению с теми, у которых кожные метастазы появляются позже в течении болезни. 23
Метастатические поражения часто обнаруживаются на передней части груди, голове, волосистой части головы, спине и животе, и реже на плечах, боках, а также верхних и нижних конечностях. 17,20 Метастазы в грудь из экстрамаммарных участков очень необычны и составляют от 0,4% до 2,0% злокачественных новообразований молочной железы. 22 Они могут проявляться как одиночные или множественные поражения с язвенными или экссудативными признаками. Кожные проявления мелкоклеточной карциномы разнообразны и не имеют классических патогномоничных черт. Были описаны несколько общих характеристик, включая узловатую, подвижную, быстрорастущую и безболезненную. При биопсии образцы могут оставаться поверхностными или могут проникать в дерму и подкожную клетчатку. 11 При дифференциальной диагностике кожных метастазов мелкоклеточного рака легкого в грудь следует исключить первичный мелкоклеточный рак груди. Первичная мелкоклеточная карцинома груди — очень редкое заболевание, в англоязычной литературе зарегистрировано менее 30 случаев. 24 Гистологические данные первичной мелкоклеточной карциномы молочной железы и других органов аналогичны, хотя их иммуногистохимические характеристики окрашивания различаются. Гистологическое обнаружение внутрипротоковых компонентов in situ важно для диагностики первичной мелкоклеточной карциномы груди наряду с иммуногистохимическим окрашиванием рецептора эстрогена, рецептора прогестерона, рецептора 2 эпидермального фактора роста человека, фактора транскрипции щитовидной железы 1 (TTF-1). , цитокератин (CK) 7, CK20, хромогранин и синаптофизин.25 Хотя первичный мелкоклеточный рак легкого обычно является TTF-1-положительным, это открытие неспецифично. 26 Он может быть положительным при мелкоклеточной карциноме многих первичных локализаций, и определение первичного органа требует клинической и рентгенологической корреляции.Гистологические и иммунофенотипические данные в нашем случае были типичными для мелкоклеточной карциномы, показывая клетки с тонким хроматином, минимальной цитоплазмой и ядерной формовкой. Связанного внутрипротокового компонента не было (рис. 3). Иммуногистохимические окрашивания были положительными на синаптофизин и хромогранин (рис. 4). CK20 был отрицательным, за исключением карциномы из клеток Меркеля.
Гистологическое обнаружение внутрипротоковых компонентов in situ важно для диагностики первичной мелкоклеточной карциномы груди наряду с иммуногистохимическим окрашиванием рецептора эстрогена, рецептора прогестерона, рецептора 2 эпидермального фактора роста человека, фактора транскрипции щитовидной железы 1 (TTF-1). , цитокератин (CK) 7, CK20, хромогранин и синаптофизин.25 Хотя первичный мелкоклеточный рак легкого обычно является TTF-1-положительным, это открытие неспецифично. 26 Он может быть положительным при мелкоклеточной карциноме многих первичных локализаций, и определение первичного органа требует клинической и рентгенологической корреляции.Гистологические и иммунофенотипические данные в нашем случае были типичными для мелкоклеточной карциномы, показывая клетки с тонким хроматином, минимальной цитоплазмой и ядерной формовкой. Связанного внутрипротокового компонента не было (рис. 3). Иммуногистохимические окрашивания были положительными на синаптофизин и хромогранин (рис. 4). CK20 был отрицательным, за исключением карциномы из клеток Меркеля.
Выводы
На поздней стадии мелкоклеточный рак легкого чаще всего метастазирует в печень, но может также попасть и в другие органы.Кожные метастазы могут быть первым признаком или развиваться как рецидив ранее пролеченного заболевания (как это было в нашем случае). Из-за их неспецифического внешнего вида эти кожные поражения могут быть не замечены или ошибочно диагностированы как доброкачественные поражения или как вторые первичные опухоли. В нашем случае необычное расположение этого одиночного изолированного метастаза молочной железы предполагало несколько возможностей дифференциальной диагностики, включая гранулему, связанную с силиконовым имплантатом, ангиосаркому груди, первичную мелкоклеточную карциному груди или карциному из клеток Меркеля.Наличие метастазов в кожу указывает на запущенную стадию заболевания и плохой прогноз. Клиницисты должны помнить об этом необычном, но важном представлении и соответствующим образом оценивать подозрительные поражения кожи.
Исход случая
Пациент имел полный клинический ответ на химиотерапию второй линии. Ее болезнь находится под пристальным наблюдением, и при первых признаках рецидива ей будет назначена комбинированная иммунотерапия ипилимумаб плюс ниволумаб. 27
Раскрытие финансовой информации: Авторы не имеют значительной финансовой заинтересованности или каких-либо иных отношений с производителем любого продукта или поставщика каких-либо услуг, упомянутых в этой статье.
Каталожные номера:
- Coslett LM, Katlic MR. Рак легких с кожными метастазами. Сундук . 1990; 97 (3): № 757-759. DOI: 10.1378 / сундук.97.3.757.
- Brownstein MH, Helwig EB.Метастатические опухоли кожи. Рак . 1972; 29 (5): 1298-1307. DOI: 10.1002 / 1097-0142 (197205) 29: 5 <1298 :: help-cncr28202
> 3.0.co; 2-6.
- Хидака Т., Исии Ю., Китамура С. Клинические особенности кожных метастазов при раке легкого. Медицинский работник . 1996; 35 (6): 459-462. DOI: 10.2169 / internalmedicine.35.459.
- Драйзен С., Дхингра Х.М., Чиутен Д.Ф., Умсавасди Т., Вальдивьесо М. Кожные и подкожные метастазы рака легких. Клинические характеристики. Постградская медицина . 1986; 80 (8): 111-116. DOI: 10.1080 / 00325481.1986.11699635.
- Нил В., Собер А. Метастатические опухоли в кожу. В: Kufe D, Bast R, Frei E, Holland J, Gansler T, Pollock R, Weichselbaum R, eds. Онкологическая медицина . Данбери, Коннектикут: B. C. Decker Incorporated; 2003.
- Ахмед И. Кожные метастазы. В: Bolognia J, Jorizzo J, Horn T, Mancini A, Mascaro J, Rapini R, Salasche S, Saurat J, Stingl G, ред. Дерматология .Испания: Мосби; 2003: 1953–1956.
- Homler HJ, Goetz CS, Weisenburger DD. Лимфангитные кожные метастазы рака легких, имитирующие целлюлит. Карцинома рожистая. Вест Дж. Мед. . 1986; 144 (5): 610-612.

- Кикучи Ю., Мацуяма А., Номура К. Зостериформный метастатический рак кожи: отчет о трех случаях и обзор литературы. Дерматология . 2001; 202 (4): 336-338. DOI: 10,1159 / 000051670.
- Шварц RA.Кожное метастатическое заболевание. J Am Acad Dermatol. 1995; 33 (2 Пт 1): 161-182. DOI: 10.1016 / 0190-9622 (95)
-7.
- Триллер Ваднал К., Триллер Н., Поцек И., Кечель П., Коаник М. Кожные метастазы рака легких. Acta Dermatovenerol Alp Pannonica Adriat . 2008; 17 (3): 125-128.
- Kamble R, Kumar L, Kochupillai V, Sharma A, Sandhoo MS, Mohanti BK. Кожные метастазы рака легкого. Постградская медицина J . 1995; 71 (842): 741-743.DOI: 10.1136 / pgmj.71.842.741.
- Габриэле Р., Конте М., Эгиди Ф., Боргезе М. Метастазы в пуповину: современная точка зрения. Мир J Surg Oncol . 2005; 3 (1): 13. DOI: 10.1186 / 1477-7819-3-13.
- Салемис NS. Пупочный метастаз или узелок сестры Марии Джозеф как очень ранний признак скрытой аденокарциномы слепой кишки. J Рак желудочно-кишечного тракта . 2007; 38 (2-4): 131-134. DOI: 10.1007 / s12029-008-9024-0.
- Ковач К.А., Хегедус Б., Кенесси И., Тимар Дж.Метастазирование рака человека по типу опухоли и избирательному участку кожи: еще один пример гипотезы «семя и почва». Метастазы рака Ред. . 2013; 32 (3-4): 493-499. DOI: 10.1007 / s10555-013-9418-8.
- Калл С.Л., Коблински Ю.Е. Гены, опосредующие органотропизм метастазов. В: База данных мадам Кюри Bioscience [Интернет]. Остин (Техас): Landes Bioscience; 2000-2013. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK154549/.
- Ван Л., Пантел К., Кан Ю.Метастазирование опухоли: внедрение новых биологических представлений в клинику. Нат Мед . 2013; 19 (11): 1450-1464. DOI: 10,1038 / нм. 3391.
- Амброги V, Нофрони I, Тонини G, Mineo TC.
 Кожные метастазы при раке легкого: анализ 10-летнего опыта. Компания Oncol Rep . 2001; 8 (1): 57-61.
Кожные метастазы при раке легкого: анализ 10-летнего опыта. Компания Oncol Rep . 2001; 8 (1): 57-61.
- Терашима Т., Канадзава М. Рак легкого с кожными метастазами. Сундук . 1994; 106 (5): 1448-1450. DOI: 10.1378 / сундук.106.5.1448.
- De Argila D, Bureo JC, Márquez FL, Pimentel JJ.Мелкоклеточная карцинома легкого, представляющая собой кожный метастаз губы, имитирующий карциному из клеток Меркеля. Клин Эксп Дерматол . 1999; 24 (3): 170-172. DOI: 10.1046 / j.1365-2230.1999.00445.x.
- Lookingbill DP, Spangler N, Helm KF: Кожные метастазы у пациентов с метастатической карциномой: ретроспективное исследование 4020 пациентов. Дж. Академик Дерматол . 1993; 29 (2 Pt 1): 228-236. DOI: 10.1016 / 0190-9622 (93) 70173-q.
- Estarriol MH, Годай MR.Образы в клинической медицине. Кожные метастазы мелкоклеточного рака легкого. N Engl J Med . 2006; 354 (24): 2583. DOI: 10.1056 / NEJMicm031071.
- Mollet TW, Garcia CA, Koester G. Кожные метастазы при раке легких. Dermatol Online J . 2009; 15 (5): 1.
- Лю В., Пальма-Диас, Ф. Аласио, TM. Первичная мелкоклеточная карцинома легкого, первоначально проявляющаяся в виде образования груди: диагноз тонкоигольной аспирации. Диагностика Цитопатол . 2009; 37 (3): 208-212.DOI: 10.1002 / dc.20995.
- Уссаварунгси К., Ким М., Тиджани Л. Метастазы в кожу у пациента с мелкоклеточным раком легкого. Юго-западные респираторные и реанимационные хроники. 2013; 1: 35-38.
- Китаката Х., Ясумото К., Судо Й., Минато Х., Такахаши Ю. Случай первичной мелкоклеточной карциномы груди. Рак молочной железы . 2007; 14 (4): 414-419. DOI: 10.2325 / jbcs.14.414.
- Алтинтопрак Ф., Байтекин Х. Ф., Тасдемир С. Первичная мелкоклеточная карцинома легкого, проявляющаяся метастазами в груди и коже. Корейский Дж. Стажер Мед.
 . 2011; 26 (2): 207-209. DOI: 10.3904 / kjim.2011.26.2.207.
. 2011; 26 (2): 207-209. DOI: 10.3904 / kjim.2011.26.2.207.
- Антония С.Дж., Лёпес-Мартин Дж. А., Бенделл Дж. И др. Ниволумаб отдельно и ниволумаб плюс ипилимумаб при рецидивирующем мелкоклеточном раке легкого (CheckMate 032): многоцентровое открытое исследование фазы 1/2. Ланцет Онкол . 2016; 17 (7): 883-895. DOI: 10.1016 / S1470-2045 (16) 30098-5.
Немелкоклеточный рак легкого, стадия 4: симптомы, причины и лечение
| Стадия | Обозначения T, N, M | Описание |
|---|---|---|
| 4A | T1, T2, T3 или T4 N1, N2 или N3 M1a или M1b | Размер: Любая Распространение: Рак распространился на лимфатические узлы и / или другие части тела Критерии метастазов M1a: Критерии метастазов M1b: |
| 4B | T1, T2, T3 или T4 N1, N2 или N3 M1c | Размер: Любая Распространение: Рак распространился на лимфатические узлы и / или другие части тела Критерии метастазов M1c: |
Следует отметить, что мелкоклеточный рак легкого (который отличается от НМРЛ и встречается реже) включает только две стадии: ограниченную и обширную.
Симптомы НМРЛ 4 стадии
Симптомы немелкоклеточного рака легкого на стадии 4 могут варьироваться в зависимости от расположения опухоли и степени распространения рака.
Проблемы из-за наличия опухоли в легких включают:
Поскольку рак метастазирует, симптомы связаны с областью, где рак распространился. Например:
- Боль в животе и желтуха (пожелтение кожи) из-за опухоли, распространившейся на печень
- Головные боли, потеря памяти, проблемы со зрением и слабость при распространении опухоли на мозг
- Боль в спине, бедрах, плечах и груди при распространении рака на кости
- Затруднение при глотании из-за опухоли около пищевода
Эти симптомы могут сопровождаться утомляемостью, непреднамеренной потерей веса и потерей аппетита.
Процедуры
Поскольку немелкоклеточный рак легкого 4 стадии распространился за пределы легких, он считается неоперабельным. Но рак легких 4 стадии поддается лечению. Новые лекарства помогли людям жить дольше и полнее, борясь с этим заболеванием.
Целенаправленная терапия
Используя углубленное генетическое тестирование (молекулярное профилирование) ваших опухолей, врачи могут идентифицировать генетические мутации в раковых клетках. Основываясь на этих данных, они могут спланировать индивидуальный подход к вашему уходу и включить в него целевую терапию — лекарства, которые воздействуют на эти гены, чтобы остановить прогрессирование болезни.
Ваш врач, вероятно, порекомендует вам пройти генетическое тестирование, прежде чем начинать какое-либо другое лечение. Если эти тесты на биомаркеры покажут, что опухоли обнаруживают изменения ДНК, возможно, вы можете принимать лекарства, которые нацелены на эти мутации.
Например, если есть мутация EGFR, это означает, что раковые клетки осуществляют деление клеток с чрезмерной скоростью. Затем вам могут быть назначены ингибиторы тирозинкиназы, лекарственные препараты для таргетной терапии, которые посылают сигнал клеткам, чтобы остановить этот рост.Лекарства одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для лечения ряда других отклонений, включая ALK, ROS-1, NTRK, MET, RET и BRAF V600E.
Химиотерапия
Исторически сложилось так, что химиотерапия была основным вариантом, доступным для пациентов с запущенным раком легких. Эти лекарства убивают раковые клетки, но они также имеют трудноуправляемые побочные эффекты, которые не все люди могут переносить. С новыми химиотерапевтическими препаратами побочные эффекты менее серьезны, и есть преимущество длительного выживания с лечением.
Если генетическое тестирование не выявляет поддающихся лечению изменений генома, скорее всего, будет рекомендована химиотерапия, часто вместе с иммунотерапией. Химиотерапия также может использоваться отдельно в качестве паллиативной помощи для тех, кто с очень запущенным раком хочет облегчить свои симптомы.
Иммунотерапия
Иммунотерапия — это еще один новый вид лечения рака легких, который стимулирует вашу собственную иммунную систему распознавать раковые клетки и бороться с ними. Люди с опухолями, которые являются PD-L1-положительными и / или имеют большое количество мутаций (так называемые опухоли с высоким уровнем мутаций нагрузка) может лучше всего подействовать на эти препараты.Те, у кого есть геномные изменения, такие как мутации EGFR, также обычно не реагируют.
Хотя они работают не для всех, некоторые люди с далеко зашедшим немелкоклеточным раком легкого испытали длительный контроль над своим заболеванием с помощью этих препаратов.
Лучевая терапия
Лучевая терапия, такая как стереотаксическая лучевая терапия тела (SBRT), направляет высокие дозы излучения непосредственно на опухоль, чтобы убить ее. Это не остановит агрессивный немелкоклеточный рак легкого 4 стадии, который распространился, но может быть рекомендован в качестве паллиативной терапии.
Некоторым людям это может быть полезно для контроля симптомов метастазов в мозг, боли в костях, кровотечения из легких или затрудненного дыхания, вызванного опухолями, препятствующими прохождению дыхательных путей.
Хотя хирургическое вмешательство может использоваться для удаления рака с целью облегчения симптомов, оно не дает шанса на излечение.
Клинические испытания
Методы лечения рака легких постоянно исследуются и совершенствуются. Национальный институт рака (NCI) проводит клинические испытания новых методов лечения распространенного немелкоклеточного рака легкого.Взаимодействие с другими людьми
Вы можете использовать их онлайн-базу данных для поиска участников испытаний.
Прогноз
Общая 5-летняя выживаемость при немелкоклеточном раке легкого 4 стадии составляет приблизительно всего 4%, но может быть намного выше в некоторых популяциях. Среднее время выживания (время, при котором 50% пациентов живы и 50% умерли) составляет около восьми месяцев.
Колпачок
Врачи часто говорят, что изучение того, что вы можете о своем раке легких, может улучшить качество вашей жизни и, возможно, даже ваш исход.Задавать вопросы. Узнайте о клинических испытаниях. Подумайте о том, чтобы присоединиться к группе поддержки.
Многие люди не решаются говорить о проблемах, связанных с окончанием жизни, но обсуждение этих вопросов с врачом и семьей ассоциируется с меньшим чувством одиночества и повышением качества жизни. Никогда не теряй надежды. Даже если вы решили не продолжать лечение, вы можете надеяться на качественное времяпрепровождение с близкими и хороший контроль над своими симптомами.
Диагностическая визуализация рака легких
Реферат
Карцинома бронхов — наиболее распространенное злокачественное новообразование в западном мире.Это также основная причина смерти от рака, на которую приходится 32% всех случаев смерти от рака у мужчин и 25% у женщин 1. В США он вызывает больше смертей, чем рак толстой кишки, груди и простаты вместе взятых 2. К сожалению, в в недавнем британском исследовании улучшения выживаемости при раке 3 карцинома бронха показала наименьшее процентное сокращение числа предотвращенных смертей в период 1981–1990 гг. (0,2%). Это плохо сравнивается с грудью (уменьшение на 11%) и меланомой (32%). Общая 5-летняя выживаемость при раке легких, диагностированном в период 1986–1990 гг., Составила всего 5 лет.3% (против 66% для груди и 76% для меланомы). Именно на этом фоне радиолог продолжает активно заниматься обнаружением, диагностикой, постановкой и анализом этого распространенного злокачественного новообразования.
Общая 5-летняя выживаемость при раке легких, диагностированном в период 1986–1990 гг., Составила всего 5 лет.3% (против 66% для груди и 76% для меланомы). Именно на этом фоне радиолог продолжает активно заниматься обнаружением, диагностикой, постановкой и анализом этого распространенного злокачественного новообразования.
Теоретически рак легкого должен поддаваться скринингу. Заболевание очень распространено, и на самых ранних стадиях ≤70% случаев можно вылечить хирургическим путем 4. Несмотря на это, общий прогноз рака легких настолько мрачен, что заболеваемость превышает распространенность 5. Основной фактор риска, курение, легко идентифицируется и неинвазивные скрининговые тесты, такие как рентгенография грудной клетки и цитология мокроты, широко доступны.
Почему не проводится скрининг? Три крупные американские программы скрининга в 1970-х годах, спонсируемые Национальным институтом здравоохранения 6–9, и еще одна в Чехословакии в 1980-х годах 10 обследовали группы высокого риска с использованием рентгенографии грудной клетки и анализа мокроты. Все они показали повышенное выявление рака легких на ранней стадии, более резектабельные виды рака и улучшенные показатели 5-летней выживаемости в проверенных группах по сравнению с контрольными группами. Важно отметить, что ни один из них не показал статистически значимого снижения общей смертности.
За последние 5 лет в трех нерандомизированных испытаниях, включающих низкодозовую компьютерную томографию (КТ), были представлены данные скрининга распространенности 11–13. Их выводы кратко изложены в (таблица 1⇓). В таблицу также включены предварительные данные двух продолжающихся испытаний в США и Германии. Эти испытания показывают, что КТ выявляет гораздо больше узелков в легких, чем рентгенография грудной клетки. Однако лишь небольшой процент этих узелков оказывается раком легких. Например, в исследовании Mayo Clinic 7 более половины всех пациентов имели хотя бы один узелок. Таким образом, логистика дифференциации доброкачественных узелков от злокачественных становится очень реальной проблемой, и были опасения по поводу количества биопсий, которые могут потребоваться. Однако при оценке характера кальцификации при КТ с низкой дозой и высоким разрешением (КТВР) и повторном сканировании после определенного интервала, в группе Проекта действий по борьбе с раком легких (ELCAP) был проведен только один случай биопсии доброкачественного некальцинированного узелок 11. В этом исследовании уровень выявления рака составлял 2.7%, но в двух других опубликованных исследованиях он был <0,5% (таблица 1). Хотя это кажется низким, следует помнить, что уровень выявления рака груди составляет всего 0,6–0,7% 14.
Таким образом, логистика дифференциации доброкачественных узелков от злокачественных становится очень реальной проблемой, и были опасения по поводу количества биопсий, которые могут потребоваться. Однако при оценке характера кальцификации при КТ с низкой дозой и высоким разрешением (КТВР) и повторном сканировании после определенного интервала, в группе Проекта действий по борьбе с раком легких (ELCAP) был проведен только один случай биопсии доброкачественного некальцинированного узелок 11. В этом исследовании уровень выявления рака составлял 2.7%, но в двух других опубликованных исследованиях он был <0,5% (таблица 1). Хотя это кажется низким, следует помнить, что уровень выявления рака груди составляет всего 0,6–0,7% 14.
Невозможно переоценить важность строгого дизайна исследования при оценке валидности этих крупных и дорогостоящих исследований. Хотя обычно сообщается о выживаемости с момента постановки диагноза заболевания, это не является подходящей мерой диагностического скринингового теста и может вводить в заблуждение, поскольку подвержено систематической ошибке заблаговременности, систематической ошибке продолжительности и систематической ошибке гипердиагностики.Для валидации таких методов скрининга необходимо изменение смертности, а не выживаемости 2. Хотя КТ в низких дозах может выявлять заболевание на ранних стадиях в 6–10 раз чаще, чем рентгенография грудной клетки 11, 15, подобного снижения распространенности пока не наблюдалось. запущенного заболевания 2. Отсутствие так называемого «сдвига стадии» снова ставит под сомнение способность низкодозного КТ-скрининга снизить общую смертность. Перекрестное заражение между отобранной и контрольной группами исследования также является проблемой в этих крупных испытаниях, особенно по мере того, как широкая общественность становится более осведомленной о проблемах здоровья.Лица, участвующие в исследованиях с контрольной группой, могут беспокоиться о том, что они упускают оптимальное лечение, и пробираются в обследованную популяцию.
Пытаясь преодолеть эти различные трудности, группы, спонсируемые Советом медицинских исследований в Великобритании и Национальным институтом рака в США, в настоящее время проводят пилотные проспективные рандомизированные контролируемые испытания с участием 40 000 и 88 000 пациентов, соответственно, с использованием КТ в низких дозах. Последний должен обладать способностью определять снижение смертности на 20% 2.
Рентгенологические характеристики по типам ячеек
Аденокарцинома
Аденокарцинома составляет 31% всех случаев рака легких, включая бронхоальвеолярную карциному 16. Аденокарциномы обычно располагаются периферически и имеют диаметр <4 см 17; только 4% показывают кавитацию 18. Хила или хила и поражение средостения наблюдается в 51% случаев при рентгенографии грудной клетки 19, а недавнее исследование описывает два характерных проявления на КТ: либо локализованное помутнение матового стекла, которое медленно растет (время удвоения> 1 года) ) или твердая масса, которая растет быстрее (время удвоения <1 года) 20.
Бронхоальвеолярный рак
Это считается подтипом аденокарциномы и составляет 2–10% всех первичных раковых заболеваний легких. Выделяют три характерных проявления: наиболее частым является единичный легочный узелок или образование в 41% случаев; у 36% может быть многоцентровое или диффузное заболевание; наконец, в 22% имеется локализованная область уплотнения паренхимы 21. Пузырьковые области с низким затуханием внутри массы (рис. 1⇓) являются характерной находкой на CT 22.Придненочная и средостенная лимфаденопатия встречается редко 23. Стойкая периферическая консолидация с ассоциированными узелками в той же или других долях должна повышать вероятность бронхоальвеолярной карциномы 24.
Аденосквамозная карцинома
Аденосквамозная карцинома составляет 2% всех случаев рака легких 16. Этот тип клеток обычно идентифицируется как одиночный периферический узелок. Более половины имеют размер 1–3 см, кавитация наблюдается в 13%. Признаки паренхиматозных рубцов или фиброза в опухоли или рядом с ней наблюдаются у 50% 25.
Более половины имеют размер 1–3 см, кавитация наблюдается в 13%. Признаки паренхиматозных рубцов или фиброза в опухоли или рядом с ней наблюдаются у 50% 25.
Плоскоклеточный рак
Плоскоклеточная карцинома составляет 30% всех случаев рака легких 16. Эти опухоли чаще располагаются в центре легкого и могут вырастать намного больше, чем 4 см в диаметре 17. Кавитация (рис. 2⇓) наблюдается до 82% 18 . Они обычно вызывают сегментарный или долевой коллапс легких из-за их центрального расположения и относительной частоты 26.
Мелкоклеточный рак легкого
Мелкоклеточный рак легкого (SCLC) составляет 18% всех случаев рака легкого 16.SCLC часто проявляется объемными новообразованиями в воротах и средостенных лимфатических узлах (рис. 3⇓) 27, 28. Несмежные паренхиматозные образования могут быть идентифицированы в 41% случаев на CT 28, которые очень редко образуют кавитацию 18. Они образуют злокачественный конец спектра. нейроэндокринных карцином легких с типичными карциноидными опухолями, находящимися на более доброкачественном конце 27. Образование в воротах ворот или рядом с ними является характерным для SCLC, и опухоль вполне может проявлять средостенную инвазию 17.
Карциноидная опухоль
Карциноидная опухоль составляет 1% всех случаев рака легких 16.Атипичные карциноидные опухоли, как правило, больше (обычно> 2,5 см на КТ), при этом типичные карциноидные опухоли чаще связаны с эндобронхиальным ростом (рис. 4⇓) и обструктивной пневмонией 27. Карциноиды, как правило, располагаются в центре, а не на периферии, и наблюдается кальцификация в 26–33% 29. 5-летняя выживаемость для типичных карциноидов составляет 95% против 57–66% для атипичных карциноидов 29.
Крупноклеточный рак
Крупноклеточная карцинома составляет 9% всех случаев рака легких 16.Крупноклеточная карцинома или гигантоклеточная карцинома — это плохо дифференцированная немелкоклеточная карцинома (НМРЛ), которая диагностируется гистологически после исключения аденокарциноматозной или плоскоклеточной дифференцировки 16.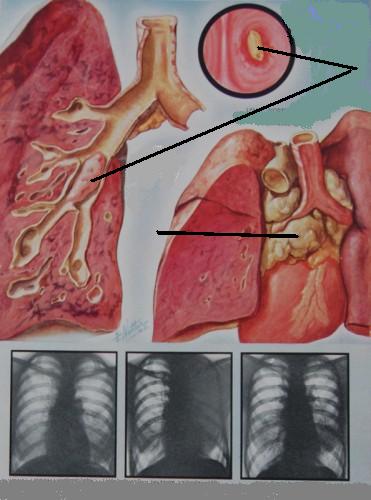 Она может очень быстро расти 30 до большого размера, но рано метастазировать в средостение и мозг 31.
Она может очень быстро расти 30 до большого размера, но рано метастазировать в средостение и мозг 31.
Следует отметить, что, по-видимому, происходит изменение распространенности описанных гистологических подтипов. Два недавних крупных исследования показали распространенность аденокарциномы 78% и 58%, в то время как плоскоклеточный рак составлял только 4% и 11% соответственно 11, 13.
Методы визуализации
Рентгенография грудной клетки
Из-за своей широкой доступности, в том числе для врачей первичного звена, рентгенограмма грудной клетки часто является первым методом визуализации, позволяющим предположить диагноз бронхогенной карциномы. Рак легкого может представлять собой прямую спикулированную массу, но о его наличии также можно судить по другим признакам, таким как неизлечимая пневмония или долевой коллапс (рис. 5⇓). В некоторых ситуациях дальнейшая визуализация не требуется при наличии объемной аденопатии контралатерального средостения или при выявлении очевидного костного поражения.Однако КТ грудной клетки часто требуется из-за недостаточной чувствительности рентгенограмм грудной клетки при обнаружении метастазов в средостенных лимфатических узлах, грудной стенки и инвазии средостения 32.
Компьютерная томография
КТ может идентифицировать специфические особенности узелков в легких, которые являются диагностическими, например, артериовенозных свищей, округлых ателектазов, грибковых клубочков, слизистой закупорки и инфарктов. Сканирование с высоким разрешением дополнительно уточняет этот диагностический процесс 33.Возможность компьютерной томографии оценить всю грудную клетку во время оценки узелков является дополнительным преимуществом.
Спиральная или спиральная КТ является преимуществом, так как небольшие узелки не пропускаются между срезами, как это может происходить на старых, неспиральных машинах. Это также увеличивает скорость обнаружения узелков диаметром <5 мм, особенно при просмотре в киноформате на рабочей станции 34, 35. Получение наборов данных непрерывного объема позволяет реконструировать трехмерное и мультипланарное изображения ( i.е. неаксиальное) переформатирование (рис. 6⇓). Было показано, что эти методы улучшают обнаружение плевральной инвазии опухолью и проясняют происхождение перидиафрагмальных опухолей соответственно 36, 37. Дальнейшие манипуляции с наборами исходных данных позволяют использовать технику виртуальной бронхоскопии. Интерактивная имитация бронхоскопии может быть выполнена с дополнительным преимуществом одновременной информации о соседних структурах средостения. Этот метод имеет большой потенциал как в качестве учебного пособия, так и в качестве средства оценки анатомии грудной клетки и бронхов перед интервенционными процедурами и установкой стента 38.
Это также увеличивает скорость обнаружения узелков диаметром <5 мм, особенно при просмотре в киноформате на рабочей станции 34, 35. Получение наборов данных непрерывного объема позволяет реконструировать трехмерное и мультипланарное изображения ( i.е. неаксиальное) переформатирование (рис. 6⇓). Было показано, что эти методы улучшают обнаружение плевральной инвазии опухолью и проясняют происхождение перидиафрагмальных опухолей соответственно 36, 37. Дальнейшие манипуляции с наборами исходных данных позволяют использовать технику виртуальной бронхоскопии. Интерактивная имитация бронхоскопии может быть выполнена с дополнительным преимуществом одновременной информации о соседних структурах средостения. Этот метод имеет большой потенциал как в качестве учебного пособия, так и в качестве средства оценки анатомии грудной клетки и бронхов перед интервенционными процедурами и установкой стента 38.
Недавнее появление мультисрезовых сканеров привело к прогрессу в разрешении изображений со значительным сокращением как загрузки пробирки, так и времени сканирования, так как одновременно можно получить до четырех срезов 39, 40. И спиральные, и мультисрезовые аппараты меньше страдают от артефактов дыхательного движения из-за их более короткое время сканирования.
Спиральная компьютерная томография с болюсным введением йодсодержащего контрастного вещества внутривенно обеспечивает «динамическое сканирование». Недавнее исследование 84 пациентов с НМРЛ не обнаружило разницы в рентгенологической стадии, когда сканирование с неконтрастным усилением сравнивалось со сканированием с контрастным усилением у 80 пациентов (95%), и было рекомендовано, что КТ без усиления через грудную клетку и надпочечники было достаточно для определения стадии пациентов с недавно диагностированным НМРЛ 41.Однако другое исследование с участием 50 пациентов, сравнивающее оба метода, показало, что частота выявления увеличенных узлов средостения после усиления контраста на 11% выше, и рекомендовало его обычное введение (рис. 7 и 8⇓⇓) 42. Многие центры проводят сканирование печени и надпочечников после внутривенного контраст.
7 и 8⇓⇓) 42. Многие центры проводят сканирование печени и надпочечников после внутривенного контраст.
Толщина и интервал срезов должны быть ≤10 мм и проходить от верхушек легких до надпочечников 16. В настоящее время обычной практикой является выполнение 5-миллиметровых срезов через хилы и аортопульмональные области, чтобы улучшить очертание локальных лимфатических узлов и истоки долевые бронхи.Поле зрения должно включать прилегающую грудную стенку 16.
Магнитно-резонансная томография
Магнитно-резонансная томография (МРТ) становится все более доступной, но время сканирования МРТ настолько велико, что ее обычно используют для решения проблем и там, где введение контрастных веществ противопоказано. МРТ может быть более точным, чем КТ, в отделении опухолей стадии IIIa (операбельной) от опухоли IIIb (обычно неоперабельной) у отдельных пациентов благодаря ее способности обнаруживать инвазию в основные структуры средостения, i.е. Болезнь Т4 43.
Преимущества МРТ перед КТ включают: лучший контраст мягких тканей, возможность многоплоскостной визуализации и, следовательно, полезность для опухолей верхней борозды и оценки аортопульмонального окна (рис. 9⇓), а также сердечную синхронизацию, которая позволяет отличное очертание сердца и отличное качество изображения. сосудов и удаляет артефакт пульсации сердца 44, 45.
МРТ также полезен для оценки инвазии средостения и грудной стенки благодаря ее способности определять инвазию жировых полос (рис.10⇓) и поражение диафрагмы и позвоночного канала. Кроме того, было показано, что он помогает дифференцировать лимфатические узлы от сосудов хилы из-за феномена «пустоты потока» 46, 47.
У
МРТ есть недостатки по сравнению с КТ: он медленнее и дороже, с худшим пространственным разрешением и предоставляет ограниченную информацию о паренхиме легких. МРТ может переоценивать размер лимфатических узлов из-за дыхательного движения, вызывая слияние отдельных узлов в более крупную конгломератную массу 44. МРТ также плохо переносится пациентами с клаустрофобией и противопоказана пациентам с постоянными электромагнитными устройствами и некоторыми протезами сердечных клапанов.
МРТ также плохо переносится пациентами с клаустрофобией и противопоказана пациентам с постоянными электромагнитными устройствами и некоторыми протезами сердечных клапанов.
T1-взвешенных последовательностей используются для визуализации плоскостей жира и улучшения пространственного разрешения. Т2-взвешенные последовательности полезны для обнаружения высокосигнальной инфильтрации опухоли. Повышение содержания гадолиния может еще больше повысить диагностическую ценность 48.
Позитронно-эмиссионная томография
Позитронно-эмиссионная томография (ПЭТ) — это новый метод визуализации, роль которого в оценке рака легких все еще определяется.Его преимущество перед другими методами заключается в его чувствительности при обнаружении злокачественных новообразований и в способности визуализировать все тело за одно обследование.
ПЭТ — это метод физиологической визуализации, в котором используются радиофармацевтические препараты, полученные путем мечения метаболических маркеров, таких как аминокислоты или глюкоза, с помощью излучающих позитрон радионуклидов, таких как фтор-18. Затем создается изображение радиомаркера путем совпадения двух фотонов с энергией 511 кэВ, которые образуются в результате аннигиляции испускаемых позитронов.Радиофармацевтический препарат 18 F-2-дезокси-d-глюкоза (ФДГ) идеально подходит для визуализации опухолей. ПЭТ, выполняемая с этим агентом, использует различия в метаболизме глюкозы между нормальными и неопластическими клетками, что позволяет точно и неинвазивно дифференцировать доброкачественные и злокачественные аномалии 49. Известно, что поглощение ФДГ пропорционально агрессивности и скорости роста опухоли 50. Поглощение ФДГ может оцениваться визуально на ПЭТ-изображениях (рис. 11⇓) путем сравнения активности поражения с фоном или с помощью полуколичественного анализа с использованием рассчитанных стандартизованных коэффициентов поглощения.Коэффициент поглощения <2,5 считается показателем доброкачественного поражения 51, 52.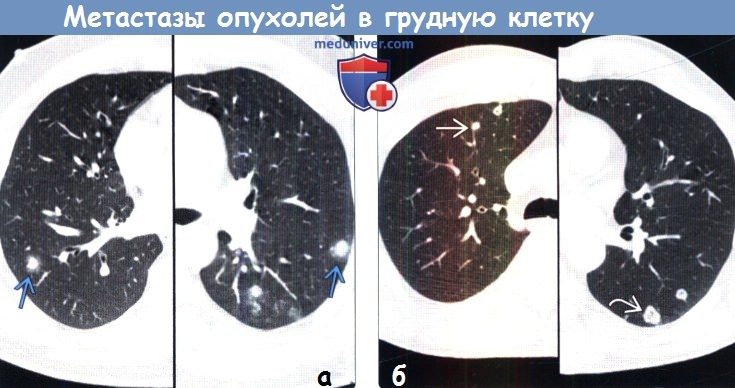
ПЭТ-сканирование обнаруживает злокачественные новообразования в очаговых помутнениях легких с чувствительностью 96%, специфичностью 88% и точностью 94% в очагах поражения ≥10 мм 53–58. Однако по сравнению с КТ, ПЭТ имеет более низкое пространственное разрешение, что не позволяет провести точную анатомическую оценку статуса первичной опухоли 59. Ложноположительные результаты ПЭТ в легких наблюдаются при туберкулезной инфекции, гистоплазмозе и ревматоидном заболевании легких.Ложноотрицательные результаты наблюдаются при карциноидных опухолях, бронхоальвеолярной карциноме и поражениях размером менее 10 мм 58–61.
ПЭТ более точен, чем КТ в обнаружении или исключении метастазов в средостенные лимфоузлы: чувствительность составляет 67–100% и 50–63% соответственно, а специфичность составляет 81–100% и 59–94% 62–65. Было показано, что ПЭТ правильно увеличивает или уменьшает стадию узлов, как было первоначально определено с помощью КТ, у 21% дооперационных пациентов 66. В исследовании с участием 50 пациентов, в котором результаты ПЭТ и КТ сообщались совместно, чувствительность повысилась до 93%, специфичность — 97% и точность 96% при обнаружении поражения средостения 63.Было показано, что ПЭТ выявляет скрытые внегрудные метастазы у 11–14% пациентов, отобранных для лечебной резекции, и изменяет тактику почти в 40% случаев 66–68.
В недавнем исследовании 100 пациентов, сравнивающих ПЭТ всего тела с традиционной визуализацией (КТ грудной клетки, сцинтиграфия костей и КТ или МРТ головного мозга) при постановке бронхогенной карциномы ПЭТ точно определила НМРЛ в 83% случаев по сравнению с патологической стадией 69. Рисунок для обычной визуализации — 65%. ПЭТ выявила девять пациентов с метастазами, которые не были пропущены при обычной визуализации, в то время как 10% пациентов с подозрением на наличие метастазов традиционно не имели метастазов при ПЭТ.ПЭТ была более чувствительной и специфичной, чем сцинтиграфия костей, для обнаружения метастазов в кости и имела 100% положительную прогностическую ценность для наличия отложений надпочечников по сравнению с 43% для обычных изображений.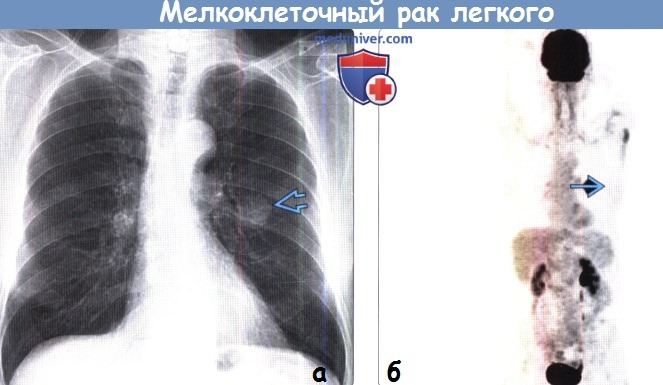 Техника плохо справлялась с обнаружением метастазов в головной мозг (чувствительность 60%), что побудило авторов рекомендовать дальнейшее использование обычных изображений для стандартного определения стадии мозга. Тем не менее, отрицательная прогностическая ценность ПЭТ для болезни N3 была идентична таковой у медиастиноскопии (96%), что побудило заявить, что пациенты с отрицательными результатами ПЭТ средостения могут сразу перейти к хирургической резекции первичного поражения 69.Этот подход был поддержан другими авторами 59, 68. Положительные результаты ПЭТ, однако, требуют проведения узловой биопсии, исходя из областей повышенного поглощения ФДГ, чтобы исключить ложноположительные результаты. Причины включают инфекцию, воспаление, гиперплазию и саркоидоз 59.
Техника плохо справлялась с обнаружением метастазов в головной мозг (чувствительность 60%), что побудило авторов рекомендовать дальнейшее использование обычных изображений для стандартного определения стадии мозга. Тем не менее, отрицательная прогностическая ценность ПЭТ для болезни N3 была идентична таковой у медиастиноскопии (96%), что побудило заявить, что пациенты с отрицательными результатами ПЭТ средостения могут сразу перейти к хирургической резекции первичного поражения 69.Этот подход был поддержан другими авторами 59, 68. Положительные результаты ПЭТ, однако, требуют проведения узловой биопсии, исходя из областей повышенного поглощения ФДГ, чтобы исключить ложноположительные результаты. Причины включают инфекцию, воспаление, гиперплазию и саркоидоз 59.
Главный недостаток ПЭТ — отсутствие доступности и относительно высокая стоимость каждого исследования. Тем не менее, модели анализа решений показывают, что совместное использование КТ и ПЭТ-визуализации для оценки очаговых поражений легких является наиболее рентабельной и полезной стратегией при определении ведения пациента с предварительной вероятностью наличия злокачественного узла, равной 0.12–0,69 70.
ПЭТ более точен, чем обычные исследования в выявлении рецидивирующего рака легких, и, по-видимому, превосходит его в отличии персистирующей или рецидивирующей опухоли от фиброзных рубцов 59, 71. Однако ложноположительные исследования происходят вторично по отношению к пострадиационным воспалительным изменениям и откладывают обследование до 4 или через 5 недель после облучения 72.
Недавнее исследование 114 пациентов с одиночными легочными узелками диаметром ≤6 см показало полезность однофотонной эмиссионной компьютерной томографии с использованием меченного технецием аналога соматостатина 99m , Депреотида 73.Чувствительность и специфичность этого метода при определении доброкачественных узлов от злокачественных составили 97% и 73% соответственно. Эти результаты сопоставимы с визуализацией FDG-PET и могут быть выполнены с помощью стандартной гамма-камеры.
Эти результаты сопоставимы с визуализацией FDG-PET и могут быть выполнены с помощью стандартной гамма-камеры.
Одиночный легочный узел
Только 20% карцином подлежат резекции при диагнозе 74 и 50% «очагов поражения» на рентгенограмме грудной клетки являются злокачественными: 40% представляют собой первичный рак легких, а остальные 10% представляют собой одиночные метастазы 75.Однако 20–30% всех раковых образований представляют собой одиночные легочные узелки (SPN), из которых 88% являются операбельными с 5-летней выживаемостью около 50% 74. Таким образом, раннее выявление и правильная оценка таких узелков имеют первостепенное значение. важность.
Доброкачественные узелки
Рентгенография грудной клетки
Ряд находок позволяет классифицировать узелок как доброкачественный на основании рентгенологического исследования грудной клетки. 1) Возраст <35 лет, отсутствие курения в анамнезе и внегрудных злокачественных новообразований 76.2) Сравнение со старыми пленками и установление отсутствия роста в течение как минимум 2-летнего периода 32. 3) Если узелок содержит плотность жира или доброкачественную структуру кальцификации, такую как центральный очаг, попкорн, слоистый или диффузный (рис. 12⇓) 33. Следует отметить, что эксцентрическая или пунктирная кальцификация наблюдается примерно в 10% случаев рака легких 76. Соответствующий анамнез, такой как лихорадка или боль в груди, может повысить вероятность доброкачественного процесса, такого как очаговая пневмония или инфаркт. как SPN. Повторная рентгенограмма должна быть выполнена через 2–6 недель для оценки разрешения 76.
Компьютерная томография, денситометрия и улучшение
КТ-сканирование может улучшить обнаружение кальциноза и жира в узелках. В общей сложности 22–38% некальцинированных узелков на рентгенограммах грудной клетки выглядят кальцинированными на КТ 76. Используя КТ-денситометрию, можно создать «пиксельную карту» узелка со значениями единиц Хаунсфилда (HU), где> 200 указывает на кальцификацию 77, 78 Только характерные образцы кальцификации, такие как центральная, диффузная, ламинарная или попкорн, указывают на доброкачественность 33.Было показано, что наличие жира (-40–120 HU) или кальциноза или их комбинации правильно идентифицирует 30 из 47 пациентов (64%) с гамартомами на 2-мм сечении КТ в одной серии 79. Однако при По крайней мере, одна треть гамартом в этой серии не содержала ни жира, ни кальция, что привело к неопределенной оценке.
Используя КТ-денситометрию, можно создать «пиксельную карту» узелка со значениями единиц Хаунсфилда (HU), где> 200 указывает на кальцификацию 77, 78 Только характерные образцы кальцификации, такие как центральная, диффузная, ламинарная или попкорн, указывают на доброкачественность 33.Было показано, что наличие жира (-40–120 HU) или кальциноза или их комбинации правильно идентифицирует 30 из 47 пациентов (64%) с гамартомами на 2-мм сечении КТ в одной серии 79. Однако при По крайней мере, одна треть гамартом в этой серии не содержала ни жира, ни кальция, что привело к неопределенной оценке.
Изменения в ослаблении после внутривенного введения контрастного вещества при КТ также можно использовать для отличия доброкачественных паренхиматозных узелков от злокачественных. В недавнем исследовании 356 узелков (5–40 мм), не содержащих ни жира, ни кальциноза, усиление постконтрастного введения <15 HU было сильным предиктором доброкачественности 80.Ретроспективно уменьшив порог отсечения до 10 HU, можно было повысить чувствительность метода в исключении злокачественных новообразований с 98 до 100%.
Злокачественные узелки
Узелок размером> 3 см связан со злокачественными новообразованиями в 93–99% случаев 81. Если узелок спикулирован (рис. 13⇓), 88–94% будут злокачественными 82–84, хотя 11% злокачественных узелков действительно имеют отчетливые края 74. Наличие кальциноза в более крупных (> 3 см) и спикулированных узелках не следует рассматривать как показатель доброкачественности.
Неопределенные узелки
Маленький размер не должен использоваться в качестве дискриминатора для исключения злокачественности. Было показано, что каждый седьмой узелок размером <1 см является злокачественным 81, а в недавнем исследовании узелков, удаленных при видеоассистированной торакоскопической хирургии, 31% узелков размером менее 1 см у пациентов без известных злокачественных новообразований были злокачественными 85. Кавитация и долька не являются полезными признаками злокачественности, поскольку гранулемы и гамартомы могут иметь эти проявления 74.
Центральные опухоли
В отличие от SPN, центральный рак легкого рентгенологически часто проявляется в виде образования хилы или в виде коллапса и консолидации легкого за пределами опухоли с сопутствующей потерей объема. Воздушные бронхограммы можно увидеть на КТ 17.
Дифференцировать центральные опухоли от дистального коллапса может быть сложно, но этому способствует болюсное введение контрастного вещества с последующим быстрым компьютерным сканированием на уровне аномалии (рис. 14⇓). Легкие заметно улучшаются, в то время как увеличение опухоли минимально и замедляется.Наиболее заметная разница между ними наблюдается от 40 секунд до 2 минут после введения контрастного вещества 86.
Дифференциация центральных опухолей легких от новообразований средостения также может быть проблематичной. В исследовании 90 центральных образований легкого и средостения единственной наиболее полезной находкой КТ для различения этих двух явлений была «граница раздела масса-легкое». Маргинальная спикуляция, узловатость или неравномерность образования и окружающего легкого почти всегда указывали на образование образования в легком.Гладкий интерфейс предполагал, что образование было расположено в средостении. Заметным исключением была лимфома Ходжкина, которая иногда может проникать через плевру, вторгаться в легкие и приводить к образованию плохо очерченной массы, имитирующей массу легкого 87.
Следующие признаки могут рассматриваться как подозрительные для закупоривающего новообразования, если они связаны с пневмонией. 1) Золотой знак «S», указывающий на отклонение трещины вокруг центральной опухолевой массы (рис. 15⇓). 2) Пневмония, ограниченная одной долей (или более, если она вызвана общим закупоренным бронхом), особенно если возраст> 35 лет и сопровождается потерей объема или бронхами, заполненными слизью, при отсутствии воздушных бронхограмм 17.При анализе 50 пациентов с сегментарным или долевым ателектазом 27 (54%) были вызваны обструктивной опухолью, все из которых были обнаружены на КТ 88. 3) Локализованная пневмония, которая сохраняется более 2 недель или рецидивирует в той же доле.
Увеличение хилы является частым признаком у пациентов с раком легкого 17. В серии исследований Mayo Clinic у 38% пациентов с раком легких была опухоль хилы или перихилы 89. Совсем недавно 14 из 25 пациентов (56%) с При компьютерной томографии патологического воротника обнаружена бронхогенная карцинома 90.Наличие опухолевой массы или увеличенных лимфатических узлов даст плотный ворот. Вообще говоря, чем более дольчатая форма, тем больше вероятность наличия аденопатии 17.
Стадия немелкоклеточного рака легкого
Пересмотренная международная система определения стадии рака легкого 4 включает систему подмножества опухоли, узла, метастазов (TNM) (таблицы 2 и 3⇓⇓) и демонстрирует улучшенные показатели выживаемости с более точным определением стадии и соответствующим отбором пациентов для окончательного хирургического лечения путем различения IIIa из группы IIIb (таблица 4⇓).Процент выживаемости в 5 лет по клинической стадии для более поздних стадий остается низким, что подчеркивает важность раннего выявления.
Общая 5-летняя выживаемость в Великобритании, составляющая лишь 5,3%, подчеркивает преобладание запущенной стадии заболевания при 3-м осмотре. Точная стадия опухоли (Т) и узловая (N) является обязательной, поскольку она определяет последующее лечение, особенно при рассмотрении нео-заболевания. адъювантная терапия при заболеваниях IIIa и IIIb. Только примерно половина стадий TNM, полученных на основе КТ, согласуется с оперативной стадией, при этом пациенты находятся как ниже, так и выше стадии 91,92.Однако известно, что быстрый доступ к исследованию, высокие показатели гистологического подтверждения (при бронхоскопической / трансторакальной биопсии или торакотомии), рутинное КТ-сканирование и осмотр каждого пациента торакальным хирургом существенно повышают успешность хирургической резекции 93.
Статус опухоли
Различие между опухолями T3 и T4 имеет решающее значение, поскольку оно разделяет традиционное хирургическое и нехирургическое лечение 17. Опухоли T4 могут быть легко идентифицированы в силу их инвазии в тело позвонка (рис.16⇓), очевидная инвазия в средостение или сердце (рис. 17⇓) или наличие паренхиматозных метастазов в легких. Однако опухоли Т3 может быть труднее классифицировать в основном из-за трудностей отличить простое распространение опухоли в медиастинальную плевру или перикард (Т3) от фактической инвазии (Т4).
Инвазия средостения
Многие хирурги считают минимальную инвазию медиастинальной жировой ткани операбельной 94. Контакта со средостением недостаточно для диагностики медиастинальной инвазии 17.В серии из 80 КТ Глейзера, считавшихся неопределенными для прямой медиастинальной инвазии, 60% были резектабельными при торакотомии без признаков медиастинальной инвазии, 22% действительно прорезали средостение, но все еще оставались технически резектабельными и только 18% были неоперабельными 95. Фактически только один из них. 37 новообразований не были операбельны при условии, что предоперационная компьютерная томография продемонстрировала по крайней мере одно из следующего: 1) ≤3 см контакт новообразования со средостением; 2) контакт с аортой <90 °; 3) жир, видимый между массой и структурами средостения.Однако важно отметить, что эта информация не идентифицирует неоперабельные опухоли (что позволяет избежать ненужной торакотомии), потому что около 50% технически резектабельных опухолей имели контакт средостения> 3 см или потерю прозрачного слоя жира. Искусственные пневмотораксы использовались для улучшения выявления инвазии как средостения, так и грудной стенки путем изучения того, отслаивается ли плевра от соответствующей структуры. Хотя одно исследование продемонстрировало 100% точность инвазии грудной стенки, его точность в отношении поражения средостения составила только 76% 96.Другое исследование было 100% чувствительным к инвазии средостения и грудной стенки, но только 80% специфичным 97. Это снова указывает на то, что метод не может быть категоричным в отношении наличия неоперабельности.
Группа 98 радиологической диагностической онкологии сравнила КТ и МРТ у 170 пациентов с НМРЛ, 90% из которых перенесли торакотомию. Не было существенной разницы между чувствительностью двух методов (63% и 56% соответственно) или специфичностью (84% и 80%) для различения опухолей T3–4 и T1–2, за исключением случаев, когда выполнялся анализ рабочих характеристик приемника. по статистике.Они показали, что МРТ лучше, чем КТ при диагностике инвазии средостения. МРТ особенно полезна для определения инвазии миокарда или распространения опухоли в левое предсердие через легочные вены 76.
Вторжение в грудную стенку
КТ оценка инвазии опухолевой стенки грудной клетки варьируется с указанной чувствительностью от 38 до 87% и специфичностью от 40 до 90% 94. Инвазия грудной стенки массой приводит к оценке T3.Это не означает, что новообразование не поддается лечению. per se , но en bloc резекция новообразования и прилегающей грудной стенки требует увеличения смертности и заболеваемости 99. А также техники искусственного пневмоторакса, описанной ранее. , динамическая многосекционная КТ выдоха (рассматриваемая как кинопетля) также была оценена. В исследовании с участием 15 пациентов было установлено, что это было 100% точным для фиксации грудной стенки и средостения при патологическом обследовании 100.При обычной компьютерной томографии единственным надежным критерием для установления определенной инвазии является разрушение костной ткани с образованием опухолевой массы, распространяющейся между ребрами и в грудную стенку, или без нее (рис. 18.) 94.
Ультразвук упоминается как дополнительный метод оценки грудной стенки (рис. 19⇓). В серии из 120 пациентов с примыканием опухоли к грудной стенке на КТ у 19 пациентов была установлена инвазивная опухоль при УЗИ с чувствительностью и специфичностью 100% и 98% соответственно по сравнению с оперативными данными 101.
МРТ — полезный метод определения инвазии грудной клетки. Он основан на демонстрации инфильтрации или нарушения нормальной внеплевральной жировой плоскости на T1-взвешенных изображениях или гиперинтенсивности париетального плеврального сигнала на T2-взвешивании. Эффективность диагностики дополнительно повышается за счет внутривенного введения гадолиниевого контрастного вещества 48. Сагиттальная и корональная МРТ лучше отображают анатомические взаимоотношения на верхушке легкого по сравнению с аксиальной КТ (рис. 20⇓). При опухолях верхней борозды или опухоли Панкоста обнаружение инвазии опухоли за пределы верхушки легкого в плечевое сплетение, подключичную артерию или тело позвонка с помощью МРТ оказалось с точностью 94% по сравнению с 63% для CT 102, 103, хотя мультиспиральная КТ с неаксиальной реконструкция может улучшить этот показатель.Для МРТ таких опухолей рекомендуются поверхностные спирали и тонкие срезы (5 мм).
Плевральная инвазия
Выпоты у пациентов с раком легких могут быть доброкачественными, особенно с постобструктивной пневмонией, или злокачественными из-за метастазов в плевре, часто характеризующимися узловатостью плевры 94. Такой выпот делает опухоль Т4 неоперабельной, хотя это должно быть подтверждено торакоцентезом или биопсией плевры.
Статус узла
Наиболее важным предиктором исхода у большинства пациентов с раком легких, ограниченным грудной клеткой, является наличие или отсутствие пораженных лимфатических узлов средостения 17.Заболевание лимфатических узлов N3 хирургически невозможно, в то время как лечение болезни N2 является спорным. Медиастиноскопия и КТ признаны наиболее ценными методами для оценки метастазов средостенных лимфатических узлов 104, но появление ПЭТ начало влиять на ведение пациентов в ограниченном количестве центров, где они доступны.
Энтузиазм по поводу полезности КТ для оценки узлового статуса рос на протяжении 1980-х годов. В 1984 году Либшиц и Маккенна 105 продемонстрировали чувствительность и специфичность КТ 67% и 66% соответственно, используя размер узлов в 1 см, чтобы различать доброкачественные узлы и узлы с метастазами.В 1988 г. Staples et al. 106 продемонстрировал 79% чувствительность и 65% специфичность для КТ с использованием измерения отсечки узлов по длинной оси 1 см. Проведенный в 1990 г. метаанализ 42 исследований компьютерной томографии, оценивающих метастазы в средостенные лимфатические узлы при НМРЛ, показал общую чувствительность 0,79, специфичность 0,78 и точность 0,79 107. Однако в 1992 г. McLoud et al. 108, используя измерение по короткой оси узла в 1 см у 143 пациентов, вернулось к менее впечатляющим показателям чувствительности 64% и специфичности 62% соответственно.В этих исследованиях 105, 106, 108 были обследованы все пациенты с предполагаемым операбельным раком легкого, у которых полный отбор пробы узлов выполнялся либо при медиастиноскопии, либо при торакотомии. И Либшиц, и МакКенна 105, и Маклауд и др. 108 наблюдали увеличение ложноположительных узлов у пациентов с обструктивной пневмонией. McLoud et al. 103 также обнаружил, что 37% узлов диаметром 2–3 см не содержали метастазов при торакотомии. Совсем недавно в исследовании лимфатических узлов и узлов средостения при КТ по сравнению с патологическим обследованием чувствительность и специфичность метастатического поражения составляли только 48% и 53% с общей точностью 51% 92.Несмотря на эту статистику, КТ по-прежнему рекомендуется в качестве стандартной стратегии для исследования рака легких Канадской группой онкологии легких 109 после изучения 685 пациентов, КТ и медиастиноскопии у всех пациентов оказались слишком дорогими. Они рекомендовали зарезервировать медиастиноскопию и биопсию для узлов с диаметром короткой оси> 1 см (рис. 21⇓). Рекомендовано дальнейшее уточнение показаний к медиастиноскопии с ее опущением у пациентов с поражениями Т1 и отрицательными узлами на КТ, если тип клеток не является адено- или крупноклеточным раком 104.Однако, используя короткую ось КТ диаметром 1 см, Seely et al. 110, при обследовании 104 пациентов с поражениями T1 обнаружены узловые метастазы во время операции в 21% случаев, одна треть из которых была плоскоклеточной карциномой.
Другие предполагают, что отрицательная узловая компьютерная томография не требует медиастиноскопии, потому что даже при наличии микрометастазов эти пациенты могут рассчитывать на лучшую выживаемость при хирургическом лечении, чем те, кому было отказано в таком лечении 76. Также было показано заболевание N2, не очевидное на КТ быть операбельным с 5-летней выживаемостью до 30% 16, 94.
Хиловых узлов (N1) обычно можно удалить из сосудов ворот. Таким образом, хотя предоперационное обнаружение лимфоузлов полезно, обычно оно не имеет решающего значения для хирургического лечения. Более того, наличие или отсутствие метастазов в лимфоузлы является ненадежным индикатором метастазов в средостенные лимфоузлы (болезнь N2) 111, 112.
КТ может служить путеводной картой для проведения фиброоптической бронхоскопии и биопсии, а также помочь идентифицировать увеличенные узлы, которые недоступны для медиастиноскопа 16.Он также предупреждает хирурга о наличии анатомических аномалий. Не было обнаружено значительных различий между способностью КТ и МРТ обнаруживать метастазы средостения N2 или N3 98. Комбинация артефакта дыхательного движения и более низкого пространственного разрешения 47, присущего МРТ, может означать, что небольшие дискретные узлы, видимые на КТ, могут появляться как более крупная, нечеткая, единичная узловая масса на МРТ, приводящая к ошибочному диагнозу увеличения узлов. МРТ также плохо обнаруживает кальцификацию узлов и, таким образом, может ошибочно классифицировать увеличенные доброкачественные узлы как злокачественные 94.
Метастатический статус
Метаанализ 25 исследований, оценивающих результаты клинического обследования и визуализации (КТ головы, брюшной полости или сцинтиграфия костей), показал, что риск метастазов, обнаруженных с помощью визуализации, составляет <3%, если клиническое обследование нормальное 113. Если клиническое обследование положительно на метастатическое заболевание, то метастазы будут обнаружены при визуализации примерно у 50% пациентов. Sider и Horejs 114 обнаружили внегрудные метастазы у 25% пациентов с I стадией заболевания при КТ грудной клетки, головного мозга - 11%, костей - 8%, печени - 6% и надпочечников - 6% (у некоторых пациентов имеется более одного места распространения метастазов).Клинически скрытые метастазы присутствовали только у 4% пациентов. Grant et al. 115, обнаружили отдаленные метастазы у пациентов без КТ-свидетельств распространения заболевания средостения у трех из 114 пациентов (2,5%). Другой метаанализ 16 исследований показал, что 113 из 2426 потенциально оперируемых пациентов (4,7%) стали неоперабельными вследствие результатов компьютерной томографии головы и живота, УЗИ брюшной полости или сцинтиграфии костей и печени 116.
Визуализация печени
Quint et al. 117, обнаружены отдаленные метастазы у 21% всех пациентов с НМРЛ. Относительные частоты: мозг 10%, кости 7%, печень 5% и надпочечники 3%. Изолированные метастазы в печень были редкостью, в то время как метастазы, изолированные в головном мозге, встречались чаще, что привело к рекомендации, что КТ брюшной полости не является эффективным методом скрининга при выполнении КТ грудной клетки.
Получение изображений печени с помощью КТ или УЗИ при отсутствии клинических признаков, симптомов или лабораторных отклонений является спорным и, как правило, не рекомендуется 76.Однако, если надпочечники обычно включаются в КТ грудной клетки, что является обычной практикой, то печень включается по умолчанию.
Визуализация мозга
Два исследования определили, что 21–64% метастазов в головной мозг были клинически скрытыми до компьютерной томографии 118, 119. Kormas et al. 120, после отрицательного клинико-лабораторного обследования метастазы обнаружены у 3% из 158 дооперационных больных. Эти и другие исследования 115 рекомендуют проводить КТ головного мозга у предоперационных пациентов в плановом порядке (рис.22⇓). Однако совсем недавно, используя стандартизированное клиническое неврологическое обследование в отличие от Karnofsky et al. 121 шкала показателей, использованная в предыдущих исследованиях, Colice et al. 122 обнаружил, что обычная КТ головного мозга не показывалась при обычном клиническом обследовании. Знание типа первичных опухолевых клеток может помочь в принятии решения. Недавний метаанализ 113 показал, что аденокарцинома и SCLC статистически более склонны к метастазированию в мозг, чем плоскоклеточный рак.Наконец, в исследовании с использованием МРТ с контрастным усилением у пациентов с подозрением на хирургически резектабельный НМРЛ, локализованных в легком или легком и регионарных узлах, скрытые метастазы в головной мозг были выявлены у 17% пациентов с первичными опухолями> 3 см 123.
Визуализация надпочечников
В одном метааналитическом исследовании до 7% пациентов с карциномой бронхов имели метастазы в надпочечники 113. Однако до 10% населения в целом имеют доброкачественные аденомы надпочечников 32.Было рекомендовано, чтобы КТ надпочечников выполнялась как часть стадийной КТ грудной клетки 16. Она требует минимального дополнительного времени, срезов и дозы для пациента и является наиболее рентабельной стратегией для оценки надпочечников. масса у пациента с впервые диагностированным НМРЛ 124. Gillams et al. 125 обнаружил, что 4% из 546 пациентов с раком легких имели солидные опухоли надпочечников. Было доказано, что из них 23% вызваны злокачественной инфильтрацией. Доброкачественные аденомы, как правило, имеют размер <2 см, имеют низкую аттенюацию, хорошо очерчены или затрагивают только часть железы.Злокачественные железы, как правило, имеют размер> 5 см и имеют неправильную или смешанную форму (рис. 23⇓). Было рекомендовано, чтобы все недетерминантные железы , то есть 2–3 см, подверглись тонкоигольной аспирации (FNA) пациентам, рассматриваемым для операции. Этот подход поддерживается в других статьях 16, 32, но следует отметить, что МРТ может предоставить дополнительную информацию через химическое изображение или визуализацию с фазовым сдвигом относительно возможности доброкачественности таких образований надпочечников 126, 127. ПЭТ также может играть роль и было показано, что чувствительность 100% и специфичность 80% при обнаружении метастатической инфильтрации надпочечников в исследовании пациентов с бронхогенной карциномой и опухолью надпочечников 128.
Визуализация костей
Большинство метастазов в кости являются симптоматическими, и сцинтиграфия костей предлагает быстрое и недорогое обследование всех чувствительных, если не очень специфических, костей 129. В качестве альтернативы, наличие патологического перелома, повышение уровня щелочной фосфатазы и кальция в сыворотке крови или другие неспецифические признаки метастатического заболевания. должен аналогичным образом вызвать сканирование костей 16. Метастазы также могут быть обнаружены при постановке КТ грудной клетки (рис. 24⇓).
Карциноматозный лимфангит
Злокачественная инфильтрация лимфатических сосудов и перилимфатической соединительной ткани обычно бывает асимметричной и узловатой, и ее следует дифференцировать от левожелудочковой недостаточности.Лучше всего это демонстрируется при сканировании КТВР (рис. 25⇓).
Стадия мелкоклеточного рака легкого
SCLC отличается от NSCLC своим быстрым временем удвоения опухоли, развитием ранних широко распространенных метастазов и почти исключительным возникновением у курильщиков 130. Он разделен на две стадии: ограниченное заболевание, которое ограничивается ипсилатеральным гемитораксом в пределах одного переносимого порта для лучевой терапии. и обширное заболевание, которое охватывает все другие заболевания, включая отдаленные метастазы.Системная терапия требуется всем пациентам с МКРЛ, даже если заболевание ограничено. Лучевая терапия средостения не всегда показана пациентам с обширным заболеванием, поэтому важно различать эти две стадии. Чтобы избежать исчерпывающего поиска обширного заболевания ( например КТ грудной клетки, печени, надпочечников и черепа, сканирование костей, аспират костного мозга и т.д. ), альтернативный подход состоит в том, чтобы позволить клинические симптомы направлять визуализацию, прекращая обнаружение обширного заболевания. 130.Учитывая тот факт, что краниальная КТ при МРЛ дает положительный результат примерно у 15% пациентов на момент постановки диагноза, у одной трети из которых симптомы отсутствуют, а раннее лечение метастазов в головной мозг снижает частоту хронической неврологической заболеваемости, кажется разумным начать любое внелегочное стадирование. с визуализацией головного мозга 32, 130.
Игольная биопсия под визуальным контролем
Трансторакальная пункционная биопсия первичной опухоли легкого вызывает споры при рассмотрении одиночного узелка или образования. Отрицательный результат биопсии необходимо повторить, и пациент обязательно перейдет к операции, если не будет получен положительный доброкачественный результат.Биопсия полезна для определения типа клеток при неоперабельном заболевании, чтобы направлять дальнейшую терапию, и необходима для подтверждения наличия отдаленного метастатического заболевания.
Игольная биопсия обычно выполняется под контролем УЗИ или КТ. Биопсия под ультразвуковым контролем выполняется быстро и позволяет оператору направлять иглу под прямым контролем, но может использоваться только с периферическими опухолями, которые примыкают к плевре или вторгаются в стенку грудной клетки. В этом случае обычно можно получить сердцевину ткани с помощью режущей иглы № 18, хотя можно использовать FNA.Биопсия под контролем КТ занимает больше времени, и для поддержания режима пациента может потребоваться системная анальгезия и седация.
КТ обеспечивает хорошую визуализацию всех структур грудной клетки, а биопсия под контролем КТ имеет точность диагностики злокачественных новообразований 80–95% 131, 132. Это процедура выбора для отбора образцов периферических узелков (<2 см в диаметре) в качестве результата трансбронхиального исследования. Игольная биопсия при отсутствии эндобронхиального поражения снижается с 92–95% до 50–80% 132. FNA является предпочтительным методом отбора проб паренхиматозных узелков для снижения частоты осложнений и, как известно, имеет аналогичную чувствительность в Обнаружение злокачественных новообразований при основной биопсии 131.Однако небольшие фрагменты ткани для гистологической оценки обычно можно получить с помощью игл 19–22 размера у 40–75% пациентов 132. Такая оценка ценна, поскольку она придает уверенность цитологической диагностике рака, определению типа клеток и надежность отрицательного результата 131, 132. При обнаружении кавитационного или некротического поражения рекомендуется забор стенки для получения жизнеспособного опухолевого материала. Единичный отрицательный результат биопсии не исключает злокачественности и требует повторной биопсии.
При выполнении биопсии поражений средостения обычно можно использовать режущую иглу 18-го размера после выбора безопасного маршрута. Это особенно важно при диагностике лимфом. Режущие иглы также используются при биопсии предполагаемых метастазов в печень и надпочечники, хотя FNA последних может потребоваться при небольших поражениях (рис. 26 и 27⇓⇓).
Заключение
Рак легких — распространенное заболевание с неблагоприятным прогнозом.Выживаемость обратно пропорциональна стадии, а раннее выявление и диагностика являются ключом к достижению хирургического излечения. Визуализация поперечного сечения в настоящее время является основным радиологическим методом оценки. Рентгенография грудной клетки по-прежнему важна и часто позволяет установить первый диагноз, но ее относительная нечувствительность привела к тому, что компьютерная томография в настоящее время оценивается в скрининговых исследованиях.
В настоящее время практически нет выбора между КТ и МРТ для определения стадии заболевания, хотя КТ более широко доступна и менее дорога.ПЭТ-визуализация обеспечивает повышенную чувствительность как для выявления первичного злокачественного новообразования, так и для выявления распространения заболевания, хотя она не является 100% точной и доступна только в нескольких центрах. КТ-сканеры становятся все более сложными по конструкции и универсальности и, вероятно, останутся основным методом визуализации при этом заболевании в ближайшем будущем.
Рисунок 1.-
a) Диффузное затенение альвеол в правой нижней доле у мужчины 58 лет с неизлечимой пневмонией.б) Воздушные бронхограммы (черные стрелки) и низкая прозрачность (открытая стрелка) в апикальной «консолидации», позже подтвержденной как бронхоальвеолярная карцинома.
Рис. 2.—
Женщина 50 лет с нерегулярной кавитирующей плоскоклеточной карциномой в правой верхней доле (стрелки).
Рис. 3.—
a) Женщина 55 лет с одышкой. Рентгенограмма грудной клетки демонстрирует расширенное средостение, особенно справа, с уменьшенной васкуляризацией правого легкого.б) Компьютерная томография с контрастным усилением, показывающая центральное новообразование средостения, прорастающее в правую легочную артерию. Мелкоклеточная карцинома была подтверждена при чрескожной биопсии.
Рис. 4.—
а) Пленка на вдохе с асимметричной васкуляризацией. б) Снимок выдоха, подтверждающий задержку воздуха из-за карциноидной опухоли в левом главном бронхе.
Рис. 5.—
Повышенная ретрокардиальная плотность из-за коллапса левой нижней доли с инферомедиальным смещением ворот.
Рис. 6.—
a) Переформатирование коронки из мультиспиральной компьютерной томографии (КТ), демонстрирующее средостенные лимфатические узлы (стрелка) и некротическую опухолевую массу в легком. б) Трехмерная реконструкция опухоли легкого с плевральной меткой (стрелка) (изображения любезно предоставлены Т. МакАртуром, отдел радиологии, больницы университетского колледжа, Лондон). c) Реконструкция тонкого среза в аксиальной плоскости по данным спиральной компьютерной томографии позволяет правильно идентифицировать вдыханную рыбную кость (стрелка) у другого пациента, предположительно опухолью при бронхоскопии.
Рис. 7.—
Некротические лимфатические узлы средостения с нерегулярными увеличивающимися краями (стрелки).
Рис. 8.—
а) Образование средостения, сужающее левый нижнедолевой бронх и вторгающееся в левое предсердие. б) Дистальные бронхи, заполненные жидкостью (стрелки), видны в спавшейся нижней доле из-за проксимальной опухоли.
Рис. 9.—
Коронарная магнитно-резонансная томография, показывающая аденокарциному у молодого мужчины, инфильтрирующую аортопульмональное окно. Имеется потеря жировой плоскости относительно аорты (стрелки) и инвазия в главную легочную артерию (наконечник стрелки).
Рис. 10.—
T1-взвешенных изображений, демонстрирующих превосходные возможности магнитно-резонансной томографии в демонстрации потери жировой ткани (стрелка) в а) аксиальной и б) сагиттальной плоскостях.
Рис. 11.—
Активное поглощение 18 F-2-дезокси-d-глюкозы в левой апикальной опухоли (стрелка).
Рис. 12.—
Диффузно кальцинированный четко очерченный узелок, типичный для гамартомы.
Рис. 13.—
Колосовидная масса, типичная для карциномы.
Рис. 14.—
а) Коллапс левого легкого со смещением средостения и узелком правой средней зоны (стрелка).б) Перихилярная аденокарцинома низкой аттенуации (стрелки) с дистальным усилением коллапса легкого у того же пациента.
Рис. 15.—
Центральное образование с золотым знаком «S» проксимального отдела опухоли (стрелки) и дистального коллапса.
Рис. 16.—
a) Эрозия ребра (большая стрелка) из-за периферической опухоли (маленькие стрелки), предполагающая, по крайней мере, болезнь Т3. б) Соответствующая компьютерная томография, показывающая массовую эрозию ребра и тела позвонка (стрелки), подтверждающая статус Т4 и неоперабельность.
Рис. 17.—
Большое центральное образование (стрелки), сужающее левый главный бронх и охватывающее левую легочную артерию, что указывает на статус Т4.Отмечается плевральный выпот.
Рис. 18.—
Фрэнк Инвазия грудной клетки крупной периферической опухолью.
Рис. 19.—
a) Компьютерная томография, показывающая инфильтрацию плеврального жира (стрелки). б) Отсутствие движения относительно грудной стенки (стрелки) подтверждает вторжение.
Рис. 20.—
Корональная Т1-взвешенная магнитно-резонансная томография, показывающая небольшую опухоль Панкоста (открытая стрелка) с распространением в верхнюю борозду и эрозией тела соседнего позвонка (стрелка).
Рис. 21.—
Женщина среднего возраста с а) образованием в правом корне (стрелка) и б) сомнительным прекаринальным лимфатическим узлом (стрелка).c) Позитронно-эмиссионная томография (ПЭТ) показывает повышенное поглощение в узлах средостения (стрелки) и небольших периферических узелках (открытая стрелка). Биопсия прикорневой массы подтвердила немелкоклеточный рак легкого. (Изображения ПЭТ любезно предоставлены Дж. Боманджи, Институт ядерной медицины, Университетский колледж Лондона).
Рис. 22.—
Компьютерная томография увеличения церебральных метастазов с выраженным отеком и масс-эффектом.
Рис. 23.—
Массивные метастазы в левый надпочечник (открытая стрелка) и печеночные метастазы (стрелки). Болезнь М1, IV стадия.
Рис. 24.—
Метастаз в теле позвонка.
Рис. 25.—
Характерное узловое утолщение перегородки на снимках с высоким разрешением, типичное для карциноматозного лимфангита.
Рис. 26.—
Универсальность трансторакальной игольной биопсии с кончиком иглы в а) новообразовании средостения (обратите внимание на безопасный доступ) и б) периферическом одиночном узелке.
Рис. 27.—
a) Надпочечник с низким затуханием (стрелки) с нормальным правым надпочечником (открытая стрелка), который при биопсии подтвердил метастатические отложения.
Таблица 1
Данные скрининговых исследований низкой дозы компьютерной томографии
Таблица 2
Классификация опухоли, узла, метастаза (TNM)
Таблица 3
Классификация стадий
Таблица 4
Совокупная выживаемость в процентах через 5 лет после лечения по клинической стадии
Сноски
↵ Предыдущие статьи из этой серии: No.1: Baldacci S, Omenaas E, Oryszcyn MP. Маркеры аллергии в респираторной эпидемиологии. Eur Respir J 2001; 17: 773–790. No. 2: Antó JM, Vermeire P, Vestbo J, Sunyer J. Эпидемиология хронической обструктивной болезни легких. Eur Respir J 2001; 17: 982–994. № 3: Кувелье А., Мюир Дж-Ф. Неинвазивная вентиляция и обструктивные заболевания легких. Eur Respir J 2001; 17: 1271–1281. № 4: Высоцкий М., Антонелли М. Неинвазивная механическая вентиляция легких при острой гипоксемической дыхательной недостаточности. Eur Respir J 2001; 18: 209–220. № 5: Østerlind K. Химиотерапия при мелкоклеточном раке легкого. Eur Respir J 2001; 18: 1026–1043. № 6: Jaakkola MS. Экологический табачный дым и здоровье пожилых людей. Eur Respir J 2002; 19: 172–181.
- Получено 11 сентября 2001 г.
- Принято 11 сентября 2001 г.
Список литературы
- ↵
Landis SH, Murray T, Bolden S, Wingo PA.Статистика рака. Ca: Онкологический журнал для клиницистов 1998; 48: 6–29.
- ↵
Patz EF Jr, Goodman PC, Bepler G. Скрининг рака легких. N Engl J Med 2000; 343: 1627–1633.
- ↵
Richards MA, Stockton D, Babb P, Coleman MP. Сколько смертей удалось избежать благодаря повышению выживаемости при раке? BMJ 2000; 320: 895–898.
- ↵
Mountain CF.Изменения в Международной системе определения стадии рака легких. Сундук 1997; 111: 1710–1717.
- ↵
Смит И.Е. Скрининг на рак легких: время думать о позитиве. Ланцет 1999; 354: 86–87.
- ↵
Токман М. Выживаемость и смертность от рака легких в скрининговой популяции: исследование Джона Хопкинса. Сундук 1986; 89: 324S – 326S.
- ↵
Фонтана Р.С., Сандерсон Д.Р., Вулнер Л.Б., Тейлор В.Ф., Миллер В.Е., Мухм-младший.Скрининг рака легких: программа Майо. J Occup Med 1986; 28: 746–750.
Frost JK, Ball WC Jr, Levin ML, et al. Раннее выявление рака легких: результаты первоначального (распространенного) радиологического и цитологического скрининга в исследовании Джона Хопкинса. Амер Рев Респир Дис 1984; 130: 549–554.
- ↵
Меламед М.Р., Флехингер Б.Дж., Заман М.Б., Хилан Р.Т., Перчик В.А., Мартини Н. Скрининг на ранний рак легких.Результаты исследования Мемориала Слоуна-Кеттеринга в Нью-Йорке. Сундук 1984; 86: 44–53.
- ↵
Кубик А., Паркин Д.М., Хлат М., Эрбан Дж., Полак Дж., Адамек М. Отсутствие пользы от полугодового скрининга на рак легкого: последующий отчет рандомизированного контролируемого исследования на популяции высокого риска мужчины в Чехословакии. Int J Cancer 1990; 45: 26–33.
- ↵
Henschke CI, McCauley DI, Yankelevitz DF, et al. Проект действий по борьбе с раком легких: общий план и результаты базового скрининга. Ланцет 1999; 354: 99–105.
- ↵
Канеко М., Эгути К., Омацу Х., и др. Периферический рак легкого: скрининг и обнаружение с помощью спиральной КТ с низкой дозой по сравнению с рентгенографией . Радиология 1996; 201: 798–802.
- ↵
Sone S, Takashima S, Li F, et al. Массовый скрининг рака легких с помощью передвижного спирального компьютерного томографа.Ланцет 1998; 351: 1242–1245.
- ↵
Ван Х, Каресен Р., Хервик А, Торесен СО. Маммографический скрининг в Норвегии: результаты первого раунда скрининга в четырех округах и рентабельность смоделированного общенационального скрининга. Контроль причин рака 2001; 12: 39–45.
- ↵
Sone S, Li F, Yang ZG, et al. Результаты трехлетней программы массового обследования на рак легких с использованием передвижного низкодозного спирального компьютерного томографа.Br J Cancer 2001; 84: 25–32.
- ↵
Предварительная оценка немелкоклеточного рака легкого. Американское торакальное общество и Европейское респираторное общество. Amer J Respir Crit Care Med 1997; 156: 320–332.
- ↵
Армстронг П. Новообразования легких, дыхательных путей и плевры. В : Армстронг П., Уилсон А.Г., Ди П., Ханселл Д.М., редакторы. Визуализация болезней грудной клетки. 3-е издание.Лондон, Мосби (Харкорт), 2000; С. 305–401.
- ↵
Чаудхури MR. Первичные кавитирующие карциномы легких. Thorax 1973; 28: 354–366.
- ↵
Woodring JH, Стеллинг CB. Аденокарцинома легкого: опухоль с изменяющимся плеоморфным характером. Am J Roentgenol 1983; 140: 657–664.
- ↵
Аоки Т., Наката Х., Ватанабе Х., и др. Развитие аденокарциномы периферических легких: результаты КТ коррелировали с гистологией и временем удвоения опухоли. Am J Roentgenol 2000; 174: 763–768.
- ↵
Bonomo L, Storto ML, Ciccotosto C, и др. Бронхиолоальвеолярный рак легкого. Eur Radiol 1998; 8: 996–1001.
- ↵
Zwirewich CV, Vedal S, Miller RR, Muller NL. Одиночный легочный узел: КТ высокого разрешения и рентгенопатологическая корреляция.Радиология 1991; 179: 469–476.
- ↵
Кларк Л. Р., Стулл Массачусетс, Твигг Х.Л. Комод дня. Бронхоальвеолярный рак легкого. Am J Roentgenol 1990; 154: 1318–1319.
- ↵
Aquino SL, Chiles C, Halford P. Отличие консолидированной бронхиолоальвеолярной карциномы от пневмонии: работают ли критерии КТ? Am J Roentgenol 1998; 171: 359–363.
- ↵
Kazerooni EA, Bhalla M, Shepard JA, McLoud TC.Аденосквамозная карцинома легкого: рентгенологические данные. Am J Roentgenol 1994; 163: 301–306.
- ↵
Берд Р.Б., Миллер В.Е., Карр Д.Т., Пейн В.С., Вулнер LB. Рентгенографический вид плоскоклеточного рака бронха. Слушания клиники Мэйо, 1968; 43: 327–332.
- ↵
Форстер Б. Б., Мюллер Н. Л., Миллер Р. Р., Нелемс Б., Эванс К. Г.. Нейроэндокринные карциномы легкого: клиническая, рентгенологическая и патологическая корреляция.Радиология 1989; 170: 441–445.
- ↵
Перлберг Дж. Л., Сандлер М. А., Льюис Дж. В. Младший, Бойте Г. Х., Альперн МБ. Мелкоклеточная бронхогенная карцинома: оценка КТ. Am J Roentgenol 1988; 150: 265–268.
- ↵
Dahnert W. Заболевания грудной клетки. В : Dahnert W, ed. Руководство по обзору радиологии. 3-е издание. Балтимор, Уильямс и Уилкинс, 1996; С. 346–346.
- ↵
Fraser RG, Parre JAP.Диагностика заболеваний грудной клетки. 4-е издание. Филадельфия, W.B. Сондерс, 1999; С. 1142–1143.
- ↵
Шин М.С., Джексон Л.К., Шелтон Р.В. Младший, Грин Р. Гигантоклеточный рак легкого. Клинические и рентгенографические проявления. Сундук 1986; 89: 366–369.
- ↵
Hyer JD, Silvestri G. Диагностика и определение стадии рака легких. Clin Chest Med 2000; 21: 95–106.
- ↵
Уэбб WR.Рентгенологическая оценка одиночного легочного узелка. Am J Roentgenol 1990; 154: 701–708.
- ↵
Реми-Жардин М., Реми Дж., Жиро Ф., Маркетт Ш. Легочные узелки: обнаружение толстым спиральным CT по сравнению с обычным CT . Радиология 1993; 187: 513–520.
- ↵
Tillich M, Kammerhuber F, Reittner P, Riepl T., Stoeffler G, Szolar DH. Обнаружение легочных узелков с помощью спиральной компьютерной томографии: сравнение фильмов и фильмов.Am J Roentgenol 1997; 169: 1611–1614.
- ↵
Бринк Дж. А., Хайкен Дж. П., Семенкович Дж., Тифей С. А., МакКленнан Б. Л., Сагель СС. Патологии диафрагмы и прилегающих структур: результаты многоплоскостной спиральной компьютерной томографии. Am J Roentgenol 1994; 163: 307–310.
- ↵
Курияма К., Татейши Р., Куматани Т., и др. Плевральная инвазия периферической бронхогенной карциномой: оценка с помощью трехмерной спиральной компьютерной томографии.Радиология 1994; 191: 365–369.
- ↵
Aquino SL, Vining DJ. Виртуальная бронхоскопия. Clin Chest Med 1999; 20: 725–730.
- ↵
Ohnesorge B, Flohr T, Schaller S, et al. Технические основы и использование многосрезового КТ. Радиолог 1999; 39: 923–931.
- ↵
McCollough CH, Zink FE. Оценка производительности многосрезовой компьютерной томографии.Med Phys 1999; 26: 2223–2230.
- ↵
Patz EF Jr, Erasmus JJ, McAdams HP, et al. Стадия и лечение рака легкого: сравнение спиральной компьютерной томографии грудной клетки с контрастным усилением и без усиления. Радиология 1999; 212: 56–60.
- ↵
Cascade PN, Gross BH, Kazerooni EA, et al. Вариабельность в обнаружении увеличенных лимфатических узлов средостения при стадировании рака легкого: сравнение КТ с контрастированием и без усиления.Am J Roentgenol 1998; 170: 927–931.
- ↵
Gefter WB. Магнитно-резонансная томография в оценке рака легких. Семин Рентген 1990; 25: 73–84.
- ↵
Hatabu H, Stock KW, Sher S, et al. Магнитно-резонансная томография грудной клетки. Прошлое, настоящее и будущее. Clin Chest Med 1999; 20: 775–803.
- ↵
Batra P, Brown K, Steckel RJ, Collins JD, Ovenfors CO, Aberle D.МРТ грудной клетки: сравнение аксиальной, корональной и сагиттальной плоскостей визуализации. J Comp Assist Tomogr 1988; 12: 75–81.
- ↵
Эйткен К., Армстронг П. Клиническая визуализация для определения стадии рака легкого. Imaging 1992; 4: 15–22.
- ↵
Webb WR, Jensen BG, Sollitto R, et al. Бронхогенная карцинома: стадия МРТ по сравнению с стадией КТ и хирургическим вмешательством. Радиология 1985; 156: 117–124.
- ↵
Padovani B, Mouroux J, Seksik L, et al. Инвазия грудной стенки бронхогенной карциномой: оценка с помощью МРТ. Радиология 1993; 187: 33–38.
- ↵
Erasmus JJ, Patz EF Jr. Позитронно-эмиссионная томография грудной клетки. Clin Chest Med 1999; 20: 715–724.
- ↵
Duhaylongsod FG, Lowe VJ, Patz EF Jr, Vaughn AL, Coleman RE, Wolfe WG.Рост опухоли легкого коррелирует с метаболизмом глюкозы, измеренным с помощью позитронно-эмиссионной томографии фторид-18 фтордезоксиглюкозы. Анналы торакальной хирургии 1995; 60: 1348–1352.
- ↵
Lowe VJ, Fletcher JW, Gobar L, et al. Проспективное исследование позитронно-эмиссионной томографии узелков в легких. Дж. Клин Онкол 1998; 16: 1075–1084.
- ↵
Lowe VJ, Duhaylongsod FG, Patz EF, et al. Легочные аномалии и анализ данных ПЭТ: ретроспективное исследование. Радиология 1997; 202: 435–439.
- ↵
Conti PS, Lilien DL, Hawley K, Keppler J, Grafton ST, Bading JR. ПЭТ и [18F] ‐FDG в онкологии: обновленная клиническая информация. Nucl Med Biol 1996; 23: 717-735.
Gupta NC, Frank AR, Dewan NA, et al. Одиночные легочные узелки: выявление злокачественных новообразований с помощью ПЭТ с 2- [F-18] -фтор-2-дезокси-D-глюкозой.Радиология 1992; 184: 441–444.
Gupta NC, Maloof J, Gunel E. Вероятность злокачественного образования одиночных легочных узелков с использованием фтор-18-ФДГ и ПЭТ. J Nucl Med 1996; 37: 943–948.
Hubner KF, Buonocore E, Gould HR, et al. Отличие доброкачественных образований от злокачественных поражений легких с использованием «количественных» параметров изображений ПЭТ с ФДГ. Clin Nucl Med 1996; 21: 941–949.
Patz EF Jr, Lowe VJ, Hoffman JM, et al. Очаговые легочные аномалии: оценка с помощью ПЭТ-сканирования с фтордезоксиглюкозой F-18. Радиология 1993; 188: 487–490.
- ↵
Скотт В. Дж., Швабе Дж. Л., Гупта, Северная Каролина, Деван Н. А., Риб С. Д., Сугимото Дж. Т.. Позитронно-эмиссионная томография опухолей легких и лимфатических узлов средостения с использованием [18F] фтордезоксиглюкозы. Члены исследовательской группы по изучению опухолей легких. Анналы торакальной хирургии 1994; 58: 698–703.
- ↵
Erasmus JJ, McAdams HP, Patz EF Jr.Немелкоклеточный рак легкого: визуализация FDG-PET. J Thorac Imaging 1999; 14: 247–256.
Erasmus JJ, McAdams HP, Patz EF Jr, Coleman RE, Ahuja V, Goodman PC. Оценка первичных карциноидных опухолей легких с использованием FDG PET. Am J Roentgenol 1998; 170: 1369–1373.
- ↵
Jang HJ, Lee KS, Kwon OJ, Rhee CH, Shim YM, Han J. Бронхиолоальвеолярная карцинома: очаговая область ослабления матового стекла при КТ тонких срезов как ранний признак.Радиология 1996; 199: 485–488.
- ↵
Steinert HC, Hauser M, Allemann F, et al. Немелкоклеточный рак легкого: узловая стадия с FDG PET по сравнению с CT с корреляционным картированием лимфатических узлов и взятием образцов. Радиология 1997; 202: 441–446.
- ↵
Vansteenkiste JF, Stroobants SG, De Leyn PR, et al. Определение стадии средостения лимфатических узлов с помощью ФДГ-ПЭТ у пациентов с потенциально операбельным немелкоклеточным раком легкого: проспективный анализ 50 случаев.Leuven Lung Cancer Group. Сундук 1997; 112: 1480–1486.
Guhlmann A, Storck M, Kotzerke J, Moog F, Sunder-Plassmann L, Reske SN. Стадия лимфатических узлов при немелкоклеточном раке легкого: оценка с помощью позитронно-эмиссионной томографии (ПЭТ) [18F] FDG. Thorax 1997; 52: 438–441.
- ↵
Двамена BA, Sonnad SS, Angobaldo JO, Wahl RL. Метастазы немелкоклеточного рака легкого: стадирование средостения в 1990-е годы — метааналитическое сравнение ПЭТ и КТ.Радиология 1999; 213: 530–536.
- ↵
Valk PE, Pounds TR, Hopkins DM, et al. Определение стадии немелкоклеточного рака легкого с помощью позитронно-эмиссионной томографии всего тела. Ann Thorac Surg 1995; 60: 1573–1581.
Льюис П., Гриффин С., Марсден П., и др. Позитронно-эмиссионная томография всего тела с 18F-фтордезоксиглюкозой в предоперационной оценке рака легких. Ланцет 1994; 344: 1265–1266.
- ↵
Weder W, Schmid RA, Bruchhaus H, Hillinger S, von Schulthess GK, Steinert HC. Обнаружение внегрудных метастазов с помощью позитронно-эмиссионной томографии при раке легкого. Ann Thorac Surg 1998; 66: 886–892.
- ↵
Маром Э.М., Макадамс Х.П., Эразмус Дж. Дж., и др. Определение стадии немелкоклеточного рака легкого с помощью ПЭТ всего тела. Радиология 1999; 212: 803–809.
- ↵
Gambhir SS, Shepherd JE, Shah BD, et al. Аналитическая модель решения для рентабельного лечения одиночных легочных узелков. Дж. Клин Онкол 1998; 16: 2113–2125.
- ↵
Бери Т., Корхей Дж. Л., Дуйсинкс В, и др. Значение ФДГ-ПЭТ в обнаружении остаточного или рецидивирующего немелкоклеточного рака легкого. Eur Respir J 1999; 14: 1376–1380.
- ↵
Франк А., Лефковиц Д., Джегер С., и др. Схема принятия решения о повторном лечении бессимптомного рецидива рака легкого на основе результатов позитронно-эмиссионной томографии.Int J Radiat Oncol Bio Phys 1995; 32: 1495–1512.
- ↵
Blum J, Handmaker H, Lister-James J, Rinne N. Многоцентровое испытание аналога соматостатина 99mTc Depreotide при оценке одиночных легочных узелков. Chest 2000; 117: 1232–1238.
- ↵
Viggiano RW, Swensen SJ, Rosenow EC III. Оценка и лечение одиночных и множественных легочных узелков. Clin Chest Med 1992; 13: 83–95.
- ↵
Уэбб WR. Одиночный легочный узел. В : Фрейндлих И.М., Брэгг Д.Г., редакторы. Радиологический подход к заболеваниям грудной клетки. Балтимор, Уильямс и Уильямс, 1997; С. 101–108.
- ↵
McLoud TC, Swenson SJ. Карцинома легкого. Clin Chest Med 1999; 20: 697–713.
- ↵
Im JG, Gamsu G, Gordon D, et al. КТ-денситометрия легочных узелков в замороженной грудной клетке человека. Am J Roentgenol 1988; 150: 61–66.
- ↵
Siegelman SS, Khouri NF, Scott WW Jr, et al. Легочная гамартома: результаты компьютерной томографии. Радиология 1986; 160: 313–317.
- ↵
Сигельман СС, Хоури Н.Ф., Лео Ф.П., Фишман Е.К., Браверман Р.М., Зерхуни Е.А. Одиночные легочные узелки: КТ. Радиология 1986; 160: 307–312.
- ↵
Swensen SJ, Viggiano RW, Midthun DE, et al. Увеличение узелков в легких на КТ: многоцентровое исследование. Радиология 2000; 214: 73–80.
- ↵
Зерхуни Э.А., Ститик Ф.П., Сигельман С.С., и др. КТ легочного узелка: совместное исследование. Радиология 1986; 160: 319–327.
- ↵
Весткотт JL. Чрескожная трансторакальная пункционная биопсия. Радиология 1988; 169: 593–601.
Huston J III, Muhm JR.Солитарные помутнения легких: обзорная томография. Радиология 1987; 163: 481–485.
- ↵
Zerhouni EA, Boukadoum M, Siddiky MA, et al. Стандартный фантом для количественного КТ-анализа легочных узелков. Радиология 1983; 149: 767–773.
- ↵
Ginsberg MS, Griff SK, Go BD, Yoo HH, Schwartz LH, Panicek DM. Легочные узелки, удаленные при видеоассистированной торакоскопической хирургии: этиология у 426 пациентов.Радиология 1999; 213: 277–282.
- ↵
Onitsuka H, Tsukuda M, Araki A, Murakami J, Torii Y, Masuda K. Дифференциация центральной опухоли легкого от постобструктивного долевого коллапса с помощью быстрой компьютерной томографии. J Thorac Imaging 1991; 6: 28–31.
- ↵
Woodring JH, Johnson PJ. Компьютерная томография различения центральных грудных масс. J Thorac Imaging 1991; 6: 32–39.
- ↵
Вудринг JH.Определение причины ателектаза легких: сравнение рентгенографии и компьютерной томографии. Am J Roentgenol 1988; 150: 757–763.
- ↵
Берд РБ, Карр Д.Т., Миллер В.Е., Пейн В.С., Вулнер LB. Рентгенологические аномалии карциномы легкого в зависимости от гистологического типа клеток. Thorax 1969; 24: 573–575.
- ↵
Webb WR, Gamsu G, Glazer G. Компьютерная томография аномальных ворот легкого.J Comput Assist Tomogr 1981; 5: 485–490.
- ↵
Льюис Дж. В. Младший, Перлберг Дж. Л., Бойте Г. Х., и др. Может ли компьютерная томография рака легкого стадии грудной клетки? И да и нет. Энн Торак Сург 1990; 49: 591–595.
- ↵
Гдидо А., Ван Шил П., Кортаутс Б., Ван Мигем Ф., Ван Меербек Дж., Ван Марк Э. Сравнение визуализации TNM [(i) TNM] и патологического TNM [pTNM] в стадировании бронхогенной карциномы.Eur J Cardiothoracic Surg 1997; 12: 224–227.
- ↵
Laroche C, Wells F, Coulden R, et al. Повышение скорости хирургической резекции при раке легкого. Thorax 1998; 53: 445–449.
- ↵
Quint LE, Francis IR. Радиологическая стадия рака легкого. J Thorac Imaging 1999; 14: 235–246.
- ↵
Glazer HS, Kaiser LR, Anderson DJ, et al. Неопределенная инвазия средостения при бронхогенной карциноме: оценка КТ. Радиология 1989; 173: 37–42.
- ↵
Йокои К., Мори К., Миядзава Н., Сайто Ю., Окуяма А., Сасагава М. Инвазия опухоли в грудную стенку и средостение при раке легких: оценка с помощью КТ пневмоторакса. Радиология 1991; 181: 147–152.
- ↵
Ватанабе А., Симоката К., Сака Х., Номура Ф., Сакаи С. КТ грудной клетки в сочетании с искусственным пневмотораксом: значение в определении происхождения и степени опухоли.Am J Roentgenol 1991; 156: 707–710.
- ↵
Webb WR, Gatsonis C, Zerhouni EA, et al. КТ и МРТ в постановке немелкоклеточной бронхогенной карциномы: отчет группы радиологической диагностической онкологии. Радиология 1991; 178: 705–713.
- ↵
Piehler JM, Pairolero PC, Weiland LH, Offord KP, Payne WS, Bernatz PE. Бронхогенная карцинома с инвазией грудной стенки: факторы, влияющие на выживаемость после резекции единым блоком.Энн Торак Сург 1982; 34: 684–691.
- ↵
Мурата К., Такахаши М., Мори М., и др. Инвазия грудной стенки и средостения при раке легких: оценка с помощью многосекционной экспираторной динамической КТ. Радиология 1994; 191: 251–255.
- ↵
Сузуки Н., Сайто Т., Китамура С. Инвазия опухоли в грудную стенку при раке легких: диагностика с помощью УЗИ. Радиология 1993; 187: 39–42.
- ↵
Heelan RT, Demas BE, Caravelli JF, et al. Опухоли верхней борозды: КТ и МРТ. Радиология 1989; 170: 637–641.
- ↵
McLoud TC, Filion RB, Edelman RR, Shepard JA. МРТ карциномы верхней борозды. J Comput Assist Tomogr 1989; 13: 233–239.
- ↵
Пирсон Ф.Г. Стадирование средостения. Роль медиастиноскопии и компьютерной томографии. Сундук 1993; 103: 346S – 348S.
- ↵
Libshitz HI, McKenna RJ Jr.Размер средостенных лимфатических узлов при раке легких. Am J Roentgenol 1984; 143: 715–718.
- ↵
Staples CA, Muller NL, Miller RR, Evans KG, Nelems B. Узлы средостения при бронхогенной карциноме: сравнение КТ и медиастиноскопии. Радиология 1988; 167: 367–372.
- ↵
Дейлс Р.Э., Старк Р.М., Раман С. Компьютерная томография для определения стадии рака легкого. Подходя к противоречию с помощью метаанализа. Амер Рев Респир Дис 1990; 141: 1096–1101.
- ↵
McLoud TC, Bourgouin PM, Greenberg RW, et al. Бронхогенная карцинома: анализ стадирования средостения с помощью КТ путем корреляционного картирования лимфатических узлов и отбора проб. Радиология 1992; 182: 319–323.
- ↵
Исследование заболевания средостения у пациентов с явно операбельным раком легкого. Канадская группа онкологии легких. Анналы торакальной хирургии 1995; 60: 1382–1389.
- ↵
Сили Дж. М., Мэйо Дж. Р., Миллер Р. Р., Мюллер Н. Л.. Рак легкого T1: распространенность метастазов в средостенные лимфоузлы и диагностическая точность КТ. Радиология 1993; 186: 129–132.
- ↵
Кирш М.М., Кан Д.Р., Гаго О, и др. Лечение бронхогенной карциномы с метастазами средостения. Анналы торакальной хирургии 1971; 12: 11–21.
- ↵
Martini N, Flehinger BJ, Zaman MB, Beattie EJ Jr.Результаты резекции не овсяноклеточного рака легкого с метастазами в средостенные лимфатические узлы. Анналы хирургии 1983; 198: 386–397.
- ↵
Silvestri GA, Littenberg B, Colice GL. Клиническая оценка для выявления метастатического рака легких. Метаанализ. Amer J Respir Crit Care Med 1995; 152: 225–230.
- ↵
Sider L, Horejs D. Частота внегрудных метастазов бронхогенной карциномы у пациентов с лимфатическими узлами нормального размера и средостения на КТ.Am J Roentgenol 1988; 151: 893–895.
- ↵
Грант Д., Эдвардс Д., Голдстроу П. Компьютерная томография мозга, грудной клетки и брюшной полости в предоперационной оценке немелкоклеточного рака легкого. Thorax 1988; 43: 883–886.
- ↵
Hillers TK, Sauve MD, Guyatt GH. Анализ опубликованных исследований по обнаружению внегрудных метастазов у пациентов с предположительно операбельным немелкоклеточным раком легкого.Thorax 1994; 49: 14–19.
- ↵
Quint LE, Tummala S, Brisson LJ, et al. Распространение отдаленных метастазов от недавно диагностированного немелкоклеточного рака легкого. Энн Торак Сург 1996; 62: 246–250.
- ↵
Ferrigno D, Buccheri G. Компьютерная томография черепа как часть процедур начальной стадии для пациентов с немелкоклеточным раком легкого. Сундук 1994; 106: 1025–1029.
- ↵
Salvatierra A, Baamonde C, Llamas JM, Cruz F, Lopez-Pujol J.Внегрудная стадия бронхогенной карциномы. Сундук 1990; 97: 1052–1058.
- ↵
Kormas P, Bradshaw JR, Jeyasingham K. Предоперационная компьютерная томография мозга при немелкоклеточной бронхогенной карциноме. Thorax 1992; 47: 106–108.
- ↵
Карновский Д.А., Бурченал JH. Клиническая оценка химиотерапевтических средств при раке. В : Macleod CM, ed. Оценка химиотерапевтических агентов.Нью-Йорк, издательство Колумбийского университета, 1949; С. 199–205.
- ↵
Colice GL, Birkmeyer JD, Black WC, Littenberg B, Silvestri G. Экономическая эффективность КТ головы у пациентов с раком легких без клинических доказательств метастазов. Сундук 1995; 108: 1264–1271.
- ↵
Earnest F, Ryu JH, Miller GM, et al. Подозрение на немелкоклеточный рак легкого: частота скрытых метастазов в головной мозг и скелет и эффективность визуализации для пилотного исследования.Радиология 1999; 211: 37–145.
- ↵
Ремер Е.М., Обуховски Н., Эллис Д.Д., Райс Т.В., Адельштейн Д.Д., Бейкер МЭ. Оценка массы надпочечников у пациентов с карциномой легких: анализ экономической эффективности. Am J Roentgenol 2000; 174: 1033–1039.
- ↵
Гилламс А., Робертс С.М., Шоу П., Спиро С.Г., Голдстроу П. Значение компьютерной томографии и чрескожной тонкоигольной аспирации образований надпочечников при подтвержденном биопсией раке легких.Clin Radiol 1992; 46: 18–22.
- ↵
Коробкин М., Ломбарди Т.Дж., Айсен А.М., и др. Характеристика образований надпочечников с помощью химического сдвига и МРТ с усилением гадолиния. Радиология 1995; 197: 411–418.
- ↵
Schwartz LH, Panicek DM, Koutcher JA, et al. Образования надпочечников у пациентов со злокачественными новообразованиями: проспективное сравнение эхопланарной, быстрой спин-эхо и МРТ с химическим сдвигом.Радиология 1995; 197: 421–425.
- ↵
Erasmus JJ, Patz EF Jr, McAdams HP, et al. Оценка массы надпочечников у пациентов с бронхогенной карциномой с помощью позитронно-эмиссионной томографии 18F-фтордезоксиглюкоза. Am J Roentgenol 1997; 168: 1357–1360.
- ↵
Шаффер К. Радиологическая оценка рака легкого: диагностика и стадирование. Сундук 1997; 112: 235S – 238S.
- ↵
Элиас AD.Мелкоклеточный рак легкого: современная терапия в 1996 г. Chest 1997; 112: 251S – 258S.
- ↵
Klein JS, Salomon G, Stewart EA. Трансторакальная пункционная биопсия с коаксиально размещенной автоматической режущей иглой 20 калибра: результаты у 122 пациентов. Радиология 1996; 198: 715–720.
- ↵
Салазар AM, Весткотт JL. Роль трансторакальной игольной биопсии для диагностики и определения стадии рака легкого.Clin Chest Med 1993; 14: 99–110.
Рак легкого — немелкоклеточный: Диагностика
НА ЭТОЙ СТРАНИЦЕ: Вы найдете список общих тестов, процедур и сканирований, которые врачи используют для поиска причины медицинской проблемы. Используйте меню для просмотра других страниц.
Врачи используют множество тестов для обнаружения или диагностики рака. Они также проводят тесты, чтобы узнать, распространился ли рак на другую часть тела, откуда он начался. Если это происходит, это называется метастазированием.Например, визуализирующие тесты могут показать, распространился ли рак, но их нельзя использовать отдельно для диагностики НМРЛ. Визуализирующие тесты показывают изображения внутренней части тела. Врачи также могут провести тесты, чтобы узнать, какое лечение лучше всего.
Для большинства видов рака биопсия — единственный надежный способ для врача узнать, есть ли рак в той или иной области тела. При биопсии врач берет небольшой образец ткани для исследования в лаборатории. Если биопсия невозможна, врач может предложить другие тесты, которые помогут поставить диагноз.Рак легких нельзя обнаружить с помощью обычного анализа крови.
В этом разделе описаны варианты диагностики НМРЛ. Не все тесты, перечисленные ниже, будут использоваться для каждого человека. Ваш врач может учитывать следующие факторы при выборе диагностического теста:
Тип подозреваемого рака
Ваши признаки и симптомы
Ваш возраст и общее состояние здоровья
Результаты ранее проведенных медицинских обследований
В дополнение к физическому обследованию для диагностики и определения стадии рака легких могут использоваться следующие тесты:
Визуальные тесты
Визуализирующие исследования очень важны при лечении людей с НМРЛ.Однако ни один тест не является идеальным, и никакое сканирование не может диагностировать НМРЛ. Это можно сделать только с помощью биопсии (см. Ниже). Рентген грудной клетки и результаты сканирования должны быть объединены с историей болезни человека, физическим осмотром, анализами крови и информацией из биопсии, чтобы сформировать полную историю о том, где начался рак и распространился ли он и где он распространился.
Компьютерная томография. Компьютерная томография создает изображения, которые позволяют врачам увидеть размер и расположение опухоли легких и / или метастазов рака легких.Компьютерная томография делает снимки внутренней части тела с использованием рентгеновских лучей, сделанных под разными углами. Компьютер объединяет эти изображения в подробное трехмерное изображение, на котором видны любые аномалии или опухоли. Для измерения размера опухоли можно использовать компьютерную томографию. Иногда перед сканированием наносят специальный краситель, называемый контрастным веществом, чтобы улучшить детализацию изображения. Этот краситель можно вводить пациенту в вену или давать в виде таблетки или жидкости для проглатывания.
Позитронно-эмиссионная томография (ПЭТ). ПЭТ-сканирование обычно сочетается с компьютерной томографией (см. Выше), называемой ПЭТ-КТ-сканированием. Однако вы можете услышать, что ваш врач называет эту процедуру просто ПЭТ-сканированием. ПЭТ-сканирование — это способ создания изображений органов и тканей внутри тела. В организм пациента вводится небольшое количество радиоактивного сахарного вещества. Это сахарное вещество поглощается клетками, которые потребляют больше всего энергии. Поскольку рак имеет тенденцию активно использовать энергию, он поглощает больше радиоактивного вещества.Затем сканер обнаруживает это вещество и создает изображения внутренней части тела.
Магнитно-резонансная томография (МРТ). МРТ также производит изображения, которые позволяют врачам увидеть местоположение опухоли легкого и / или метастазов рака легких и измерить размер опухоли. МРТ использует магнитные поля, а не рентгеновские лучи, для получения подробных изображений тела. Перед сканированием наносится специальный краситель, называемый контрастным веществом, для создания более четкого изображения. Этот краситель можно вводить пациенту в вену или давать в виде таблетки или жидкости для проглатывания.Однако сканирование МРТ не позволяет делать снимки движущихся частей тела, таких как легкие, которые двигаются с каждым вдохом. По этой причине МРТ редко используется для исследования легких. Может быть полезно обнаружить рак легких, распространившийся на мозг или кости.
Сканирование костей. При сканировании костей используется радиоактивный индикатор, чтобы исследовать внутреннюю часть костей. Индикатор вводится пациенту в вену. Он собирается в областях костей и обнаруживается специальной камерой.Здоровые кости выглядят светлее для камеры, а участки травм, например, вызванные раком, выделяются на изображении. ПЭТ-сканирование (см. Выше) заменило сканирование костей, чтобы найти НМРЛ, распространившееся на кости.
Процедуры, которые врачи используют для сбора ткани для диагностики рака легких и планирования лечения, перечислены ниже:
Биопсия. Биопсия — это удаление небольшого количества ткани для исследования под микроскопом. Полезно иметь образец опухоли большего размера, чтобы определить подтип НМРЛ и провести дополнительное молекулярное тестирование (см. Ниже).Если для проведения этих тестов удалено недостаточно опухоли, может потребоваться повторная биопсия. После биопсии патолог анализирует образец (ы). Патолог — это врач, который специализируется на интерпретации лабораторных тестов и оценке клеток, тканей и органов для диагностики заболеваний.
Бронхоскопия. При бронхоскопии врач вводит тонкую гибкую трубку со светом на конце в рот или нос, вниз через магистраль трахеи и в дыхательные пути легких.Эту процедуру может выполнить хирург или пульмонолог. Пульмонолог — это врач, специализирующийся на диагностике и лечении заболеваний легких. Трубка позволяет врачу заглянуть внутрь легких. Крошечные инструменты внутри трубки могут брать образцы жидкости или ткани, чтобы патолог мог их исследовать. Пациентам проводят легкую анестезию во время бронхоскопии. Анестезия — это лекарство, блокирующее осознание боли.
Игольная аспирационная / стержневая биопсия. После обезболивания кожи рентгенолог особого типа, называемый интервенционным радиологом, берет образец опухоли легкого для исследования.Это можно сделать с помощью иглы меньшего размера или иглы большего размера, в зависимости от необходимого размера образца. Врач использует иглу, чтобы взять образец ткани для исследования. Часто радиолог использует компьютерную томографию грудной клетки или специальный рентгеновский аппарат, называемый флюороскопом, для направления иглы. Как правило, стержневая биопсия дает больший объем ткани, чем пункционная аспирация. Как объяснялось выше, врачи узнали, что при НМРЛ требуется больше тканей для диагностики и молекулярного тестирования.
Торакоцентез. После обезболивания кожи грудной клетки игла вводится через стенку грудной клетки в пространство между легким и стенкой грудной клетки, где может скапливаться жидкость. Жидкость удаляется и проверяется патологом на наличие раковых клеток.
Торакоскопия. Эта процедура проводится в операционной под общим наркозом. Через небольшой разрез на коже грудной стенки хирург может ввести специальный инструмент и небольшую видеокамеру, чтобы помочь в обследовании внутренней части грудной клетки.Пациентам требуется общая анестезия для этой процедуры, но время восстановления может быть короче при торакоскопии из-за меньшего размера разрезов. Эта процедура может называться торакоскопической хирургией с применением видео или VATS.
Медиастиноскопия. Это хирургическая процедура, выполняемая в операционной, под общим наркозом. Хирург исследует и берет образец лимфатических узлов в центре груди под грудиной, делая небольшой разрез в верхней части грудины.Эта процедура также требует общей анестезии и проводится в операционной.
Торакотомия. Эта процедура проводится в операционной, и пациент получает общую анестезию. Затем хирург делает разрез в груди, непосредственно исследует легкое и берет образцы ткани для анализа. Торакотомия — это процедура, которую хирурги чаще всего используют для полного удаления опухоли легкого.
Выяснение причины возникновения рака
НМРЛ начинается в легких.Многие другие виды рака возникают в других частях тела и при метастазах распространяются на легкие. Например, рак груди, распространившийся на легкие, по-прежнему называется раком груди. Поэтому врачам важно знать, начался ли рак в легких или где-то еще.
Чтобы определить, где начался рак, ваш врач примет во внимание ваши симптомы и историю болезни, результаты физического осмотра, то, как опухоль выглядит на рентгеновских снимках и сканировании, а также ваши факторы риска рака. Патолог может провести анализы биоптата, чтобы выяснить, где начался рак.Ваш врач может порекомендовать другие тесты, чтобы исключить определенные типы рака. Если после этих соображений врач все еще не уверен, откуда начался рак, он может поставить диагноз метастатического рака «неизвестной первичной». Большинство методов лечения метастатического рака неизвестной первичной формы, который впервые обнаруживается в грудной клетке, такие же, как и методы лечения метастатического рака легких.
Молекулярное исследование опухоли
Ваш врач может порекомендовать провести тесты на образце опухоли для выявления конкретных генов, белков и других факторов, уникальных для опухоли.
Есть несколько генов, которые могут иметь изменения, называемые мутациями, в опухоли легких, которые могут способствовать росту и распространению рака. Эти мутации обнаруживаются в опухоли, а не в здоровых клетках организма. Это означает, что они не передаются по наследству вашим детям.
Генетические мутации, которые, как известно, способствуют развитию рака легких, часто возникают в одном или нескольких из нескольких генов, включая EGFR , ALK , KRAS , BRAF , HER2, ROS1, RET, MET , и ТРК. Тестирование опухоли на некоторые из этих генов в настоящее время является обычным для поздних стадий НМРЛ. Тестирование на эти гены также может проводиться на более ранних стадиях заболевания.
Результаты этих тестов могут помочь определить, можете ли вы получить таргетную терапию, которая может быть направлена на определенные мутации (см. Типы лечения). Мутации, в отношении которых существует таргетная терапия, гораздо чаще возникают у людей с аденокарциномой типа НМРЛ, которые никогда не курили. Стадия НМРЛ также важна для определения возможности получения таргетной терапии.
Ваш врач может также порекомендовать тестирование PD-L1. PD-L1 — это белок, обнаруженный на поверхности некоторых раковых клеток и некоторых иммунных клеток организма. Этот белок не дает иммунным клеткам организма уничтожить рак. Информация о том, есть ли в опухоли PD-L1, поможет вашему врачу решить, могут ли помочь определенные виды иммунотерапии (см. Типы лечения). Эти типы иммунотерапии блокируют PD-L1 и позволяют иммунной системе нацеливаться на рак.
После того, как диагностические тесты будут выполнены, ваш врач изучит вместе с вами все результаты.Если диагноз — рак, эти результаты также помогают врачу описать рак. Это называется постановкой.
Как справиться с диагнозом НМРЛ
Для большинства пациентов диагноз НМРЛ является чрезвычайно напряженным. У некоторых пациентов развивается тревога и, реже, депрессия. Пациенты и их семьи не должны бояться говорить с медицинскими работниками о своих чувствах. Медицинская бригада имеет специальную подготовку и опыт, которые могут облегчить жизнь пациентам и их семьям и всегда готовы помочь.
Помимо предоставления информации и эмоциональной поддержки, ваш врач может включить в ваше лечение вспомогательные услуги и специалистов по паллиативной помощи. В эту команду может входить консультант, психолог, социальный работник или психиатр.
Вы и ваша семья можете также найти ресурсы, доступные в сообществе, чтобы помочь людям, живущим с раком легких, например, группы поддержки. Некоторые пациенты чувствуют себя комфортно, обсуждая свое заболевание и переживания на протяжении всего лечения со своими медицинскими работниками, семьей, друзьями или другими пациентами через группу поддержки.Эти пациенты могут также присоединиться к группе поддержки или группе поддержки, чтобы повысить осведомленность о раке легких и помочь другим пациентам, живущим с этим заболеванием.
Диагноз НМРЛ серьезен. Однако ваш врач может предложить эффективное лечение рака. Кроме того, прогресс в диагностике и лечении НМРЛ дает все большему количеству пациентов шанс на излечение.
Узнайте больше о консультировании, поиске группы поддержки и о том, как быть защитником рака.
Отказ от курения
Даже после того, как диагностирован НМРЛ, бросить курить по-прежнему полезно. Людям, которые бросают курить, легче пройти любое лечение, они чувствуют себя лучше, живут дольше и имеют меньший риск развития второго рака легких или других проблем со здоровьем. Бросить курить никогда не бывает легко, а еще труднее, когда сталкивается с диагнозом НМРЛ. Если вы курите, обратитесь за помощью к семье, друзьям, программам по отказу от курения и к специалистам в области здравоохранения. Ни один из доступных продуктов для отказа от курения не мешает лечению рака.Узнайте больше о прекращении употребления табака после постановки диагноза рака в отдельном разделе этого веб-сайта.
Следующий раздел в этом руководстве — этапы . Он объясняет систему, которую используют врачи для описания степени заболевания. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Кифопластика грудины при метастатическом раке легких: паллиативная помощь под визуальным контролем с использованием рентгеноскопии и сонографии | Медицина боли
Аннотация
Скелетные метастазы могут вызывать сильную боль и функциональные нарушения, вторичные по отношению к прямой инвазии или остеолизу.Прямое смягчение этих метастазов может уменьшить бремя боли. Для нацеливания на эти опухоли использовалось хирургическое удаление или лучевая терапия. В опасных местах, таких как грудина, операция может привести к серьезным осложнениям. Лучевая терапия требует многократных посещений, что может быть затруднительно для людей с тяжелыми формами инвалидности. Минимально инвазивные процедуры с визуальным контролем получают все большее распространение при лечении этих поражений. Кифопластика используется при метастазах в позвоночник. Остеопластика метастазов в плоскую ненесущую кость встречается редко.Автор сообщает об успешном паллиативном лечении метастазов в грудины с помощью кифопластики. Ультразвуковое изображение использовалось с рентгеноскопией. Воспроизводимость, полученная другими поставщиками, является обязательной для любой новой техники; это будет способствовать более широкому доступу пациентов и инновациям в устройствах. Надеемся, что будущие многоцентровые испытания подтвердят эффективность и безопасность этого метода.
Паллиативная помощь, немелкоклеточный рак легкого, метастаз, полиметилметакрилат, боль, паллиативная помощь, грудина, стернал, кифопластика, остеопластика, минимально инвазивная, вертебропластика, ультразвук
Введение
Метастатический немелкоклеточный рак легкого — основная причина смерти от рака среди мужчин и женщин в Соединенных Штатах и во всем мире [1,2].Ожидаемая продолжительность жизни после постановки диагноза составляет менее 1 года. Одно недавнее исследование, оценивающее пациентов с метастатическим немелкоклеточным раком легкого, показало, что средняя выживаемость составляет 8,9 месяцев; эта средняя выживаемость увеличилась до 11,6 месяцев при раннем оказании паллиативной помощи [2]. Ранняя паллиативная помощь в течение 8 недель после постановки диагноза привела к улучшению качества жизни и настроения [2].
Метастатическое поражение костей на ранней стадии может остаться невыявленным. Расширенные метастазы могут вызывать разрушительные события, связанные со скелетом, такие как компрессия спинного мозга или переломы позвонков [3].Сами по себе метастазы могут быть болезненными и приводить к инвалидности из-за прямой инвазии и остеолиза. Лучевая терапия, анальгетики, невролиз, имплантируемые нейромодулирующие процедуры и физиотерапия используются для лечения болезненных метастазов.
Чрескожные абляционные процедуры используются для лечения болезненных опухолей мягких тканей. Эти методы все чаще используются при первичных и метастатических опухолях костей [4]. В совокупности эти процедуры представляют собой альтернативу широкому хирургическому удалению и сопутствующим осложнениям.Эти методы используют визуализацию и специализированные устройства доступа. Разрушение опухоли осуществляется с помощью химических агентов (этиловый спирт или уксусная кислота) или тепловой энергии (лазер, микроволновая печь, ультразвук, криотерапия и радиочастота) [4]. Радиочастотная абляция вызывает дискретное термическое поражение и была эффективна при болезненных метастазах в скелет [5]. Дискретные метастазы позвоночника успешно лечились с помощью чрескожной стабилизации позвоночника [6]. Обезболивание после вертебропластики и кифопластики при патологических и непатологических переломах позвонков связывают со стабилизацией позвоночника [6,7].
Эффективность процедур цементопластики ненесущих костей предполагает механизм обезболивания, не связанный со стабилизацией кости [8]. Цемент из полиметилметакрилата (PPMA) вызывает экзотермическую реакцию с отверждением и затвердеванием. Сообщалось о температурах от 50 до 57 ° C на границе раздела кость-цемент во время полимеризации [8]. Сообщалось о средних пиковых температурах от 45 до 100 ° C, в зависимости от цемента [9]. Невролиз происходит при 45 ° C [10]; Эти температуры приводят к разрушению опухолевых клеток и сосудов [8].Итак, обезболивание может происходить за счет нескольких механизмов: 1) стабилизация костей; 2) прямая тканевая токсичность; 3) невролиз; 4) термическое повреждение [8,9].
Остеопластика плоских костей, не несущих нагрузки, встречается редко [8]. Три недавних клинических случая описывают остеопластику с или без радиочастотной абляции лопатки и грудины [8,11,12]. Создание полости и нацеливание с помощью дополнительных методов визуализации (рентгеноскопия и ультразвук) могут повысить безопасность при метастазах, не относящихся к позвоночнику.Автор сообщает об успешном паллиативном лечении метастазов в грудины, вызванных немелкоклеточным раком легкого, с использованием этих методов визуализации.
Презентация дела
Мужчина 58 лет перенес правую нижнюю лобэктомию по поводу умеренно дифференцированного плоскоклеточного рака. Края и средостенные узлы были отрицательными, но региональные узлы (перибронхиальные) были положительными: стадия 2B. Он получил, но не завершил адъювантную химиотерапию (карбоплатин, таксотер и абраксан).Таксотер вызвал аллергическую реакцию, и у него развилась периферическая невропатия. Серийная компьютерная томография (КТ) не показала рецидив заболевания.
Примерно через 22 месяца после операции он был направлен к пульмонологу по поводу отказа от курения и обструктивного заболевания дыхательных путей — пациент продолжал курить в послеоперационном периоде. Рентгенограмма грудной клетки не показала рецидива опухоли, а легочная функция улучшилась при применении бронходилататоров. К сожалению, бронхоскопия показала рецидив опухоли на культи бронха и в правой верхней доле.Позитронно-эмиссионная томография выявила двустороннее, многоцентровое и гиперметаболическое заболевание. Он не был кандидатом на полную пневмонэктомию.
В течение 23 и 24 месяцев после операции его часто госпитализировали из-за прогрессирования заболевания и многочисленных жалоб на боли. Очаговая боль в передней стенке грудной клетки соответствовала метастазу в грудины по средней линии; на компьютерной томографии поражение размером 2,4 × 1,7 × 0,9 см располагалось на реберно-грудных суставах T2-3. Было выявлено корковое разрушение, переднее и заднее (рис. 1A – C).Соседние метастазы в манубриальные клетки не повредили корковый слой. При госпитализации пациенту вводили внутривенные анальгетики. Дома его поддерживали в основном на оксикодоне пролонгированного действия (80 мг) и гидрокодоне (60 мг) в разделенных суточных дозах. Помимо очаговой боли в грудной стенке, исчезли и другие болезненные участки.
Рисунок 1
(A) Компьютерная томография (КТ) переформатирована, реконструкция демонстрирует кавитирующие метастазы в грудины. (B) Осевая компьютерная томография, костное окно, демонстрирующее очаговые остеолитические метастазы.(C) КТ коронарной артерии, костное окно, демонстрирующее очаговые остеолитические метастазы.
Рисунок 1
(A) Компьютерная томография (КТ) переформатирована, реконструкция демонстрирует кавитирующие метастазы в грудины. (B) Осевая компьютерная томография, костное окно, демонстрирующее очаговые остеолитические метастазы. (C) КТ коронарной артерии, костное окно, демонстрирующее очаговые остеолитические метастазы.
Начата химиотерапия (гемзар, винорелбин). Он получил лучевую терапию грудины с карбоплатином в качестве радиосенсибилизатора. Всего 3750 сГр было введено фракционированным способом в течение 3 недель (24 месяца после операции).Через несколько недель после окончания лучевой терапии он был повторно госпитализирован.
Передняя грудная стенка сохранилась. Посоветовались с автором (интервенционное обезболивание). При осмотре он оказался истощенным и утомленным мужчиной с одышкой. У него были боли в покое, и он часто просыпался от сна. Он собрался с духом, когда кашлял. При осмотре была обнаружена точечная болезненность в средней части нижней части грудины. Была ощутимая костная депрессия. Манубриум, мечевидный и грудинно-реберный суставы были незначительно болезненными.Его исходная боль по числовой шкале оценки боли составляла 10/10, и он демонстрировал гримасу на лице и поведение избегания движений.
Автор выполнил местную инфильтрацию над метастатическим поражением с помощью 1% лидокаина и 40 мг Депо-Медрола. Пациент сообщил о временном уменьшении боли (80%) с улучшением способности делать глубокие вдохи. В связи с уникальным и локальным характером поражения автор объяснил риски, преимущества и альтернативы кифопластики грудины.Пациент понимал, что это было использование этой техники не по назначению. Пациент подписал засвидетельствованное информированное согласие.
Была произведена общая анестезия. Пациента поместили на спину, и грудную клетку подготовили стерильным образом. Шея помещена в небольшое удлинение. Вводили антибиотики внутривенно. Переднезаднее рентгеноскопическое изображение и прямая пальпация использовались для идентификации грудино-губного сустава, грудино-оксифоидного сустава и сагиттальной средней линии. Боковое рентгеноскопическое изображение использовалось для определения переднего кавитирующего края метастаза.
После локального волдыря на коже был нанесен колотый разрез на 3 см выше места поражения. Троакар со скошенной кромкой и стилетом продвигался под углом 45 ° с использованием доступа от верхнего до нижнего (рис. 2А). Троакары представляли собой канюли Kyphon® со стилетом, обычно канюли KyphExpress® (размер 11, диаметр наконечника 3,8 мм; Medtronic, Саннивейл, Калифорния, США). Ультразвуковой зонд помещали над опухолью каудальнее разреза. Преобразователь с прямой решеткой (5–10 МГц) был размещен в боковой (рис. 3A) и осевой ориентации.Стилет удален. Был вставлен баллон (рис. 2В) и наполнен примерно до 1,5 мл. Баллон представлял собой набивной баллон KyhpExpress® 10/2 (длина 10 мм, максимальный объем 4 мл, максимальное давление накачки 300 фунтов на квадратный дюйм). Давление было менее 200 фунтов / дюйм. 2 . Баллон находился в пределах передней и задней частей коры головного мозга (рис. 2С). Это было подтверждено рентгеноскопией и ультрасонографией. Сонография показала наличие баллона в переднем и заднем краях грудины на боковых и аксиальных изображениях (рис. 3B, C).Костная кора эхогенная и на сонографии выглядит как тонкие белые линии.
Рисунок 2
(A) Боковое рентгеноскопическое изображение демонстрирует скошенный кончик троакара в пределах метастатического поражения; обратите внимание на кавитацию передней коры. (B) Боковое рентгеноскопическое изображение, баллон вставлен. (C) Боковое рентгеноскопическое изображение, баллон надут и находится внутри грудины.
Рисунок 2
(A) Боковое рентгеноскопическое изображение демонстрирует скошенный кончик троакара в пределах метастатического поражения; обратите внимание на кавитацию передней коры.(B) Боковое рентгеноскопическое изображение, баллон вставлен. (C) Боковое рентгеноскопическое изображение, баллон надут и находится внутри грудины.
Рисунок 3
(A) Сагиттальное ультразвуковое изображение грудины, демонстрирующее кавитирующие метастазы в грудины. (B) Сагиттальное сонографическое изображение, демонстрирующее надутый баллон; обратите внимание на эхогенную переднюю и заднюю надкостницу / корку и их отношение к внешнему диаметру баллона. (C) Осевое сонографическое изображение, демонстрирующее надутый баллон; обратите внимание на эхогенную переднюю и заднюю надкостницу / корку и их отношение к внешнему диаметру баллона.
Рисунок 3
(A) Сагиттальный сонографический снимок грудины, демонстрирующий кавитирующие метастазы в грудины. (B) Сагиттальное сонографическое изображение, демонстрирующее надутый баллон; обратите внимание на эхогенную переднюю и заднюю надкостницу / корку и их отношение к внешнему диаметру баллона. (C) Осевое сонографическое изображение, демонстрирующее надутый баллон; обратите внимание на эхогенную переднюю и заднюю надкостницу / корку и их отношение к внешнему диаметру баллона.
Рентгеноконтрастный полимер ПММА высокой вязкости (KyphX® HV-R ™ Bone Cement; Medtronic) был смешан с мономером.Прошло примерно 2,5 минуты, прежде чем консистенция стала похожей на густую зубную пасту. Канюли, заполненные цементом, последовательно продвигались через троакар. Было доставлено примерно 2 мл цемента, прежде чем он достиг переднего и заднего кортикального края. Когда троакар был удален, кпереди от грудины был отмечен небольшой хвостик цемента. Рентгеноскопия и послеоперационная компьютерная томография подтвердили адекватное заполнение опухоли (рис. 4A – C). Пациент сообщил об уменьшении боли до 0/10 примерно через 1 и 24 часа после процедуры.За исключением некоторой боли в разрезе кефалина опухоли, прямая пальпация не выявила никакой боли. Он был выписан на 3-й день после операции. В конечном итоге он скончался от болезни, примерно через 4 недели после процедуры. Его семья сообщила, что пациент был благодарен за облегчение боли. Никаких неблагоприятных проблем с процедурой у него не было.
Рисунок 4
(A) Боковое рентгеноскопическое изображение, цементная пломба из полиметилметакрилата (ПММА) без задней экстравазации; обратите внимание на передний цементный хвост.(B) Боковая компьютерная томография (КТ), цементная пломба из ПММА без задней экстравазации; обратите внимание на передний цементный хвост. (C) КТ коронарной артерии, цементная пломба из ПММА без задней экстравазации; обратите внимание на передний цементный хвост.
Рисунок 4
(A) Боковое рентгеноскопическое изображение, цементная пломба из полиметилметакрилата (ПММА) без задней экстравазации; обратите внимание на передний цементный хвост. (B) Боковая компьютерная томография (КТ), цементная пломба из ПММА без задней экстравазации; обратите внимание на передний цементный хвост.(C) КТ коронарной артерии, цементная пломба из ПММА без задней экстравазации; обратите внимание на передний цементный хвост.
Обсуждение
Метастатическое заболевание скелета ложится огромным бременем на пациентов, вторичным по отношению к боли, функциональным нарушениям и ухудшению качества жизни. Агрессивное хирургическое лечение может привести к осложнениям и задержке выздоровления. Помимо лучевой и абляционной терапии, лечение боли при метастазах в скелете обычно неспецифично. Наружная лучевая терапия является современным стандартом лечения метастазов в скелете, но может не снимать боль у 20–30% пациентов [13].Лучевая терапия над грудиной затруднена из-за близости к грудным внутренностям. Сердечные осложнения из-за облучения средостения могут быть разрушительными [14]. У пациентов может развиться острый пневмонит и проблемы с пищеводом [14,15].
Минимально инвазивные процедуры были безопасными и эффективными в нескольких клинических исследованиях [7]. В недавнем систематическом обзоре были даны строгие рекомендации (умеренные доказательства) по безопасности и эффективности увеличения позвоночника при метастатическом поражении позвоночника [16].Сообщество интервенционной радиологии использует различные устройства доступа и литические агенты (химические и термические), чтобы помочь этой несчастной группе пациентов [17]. Недавно Arthrocare® Cavity SpineWand® (ArthroCare Corporation, Остин, Техас, США) получила одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 510K для удаления злокачественных новообразований в теле позвонка [18]. Эти методы являются целевыми и позволяют избежать сопутствующего повреждения мягких тканей, связанного с лучевой терапией.
Грудина всего 2–3 см в глубину.Неглубокая угловая траектория необходима для размещения троакара и последующего растяжения баллона. Это обеспечивает больший запас прочности по отношению к заполнению опухолью и предотвращению экстравазации. Рентгеноскопия позволяет планировать траекторию и постоянно визуализировать троакар, баллон и цемент. ПММА имеет ряд преимуществ по сравнению с другими нейролитическими методами. Этот цемент рентгеноконтрастный и вязкий. ПММА может быть доставлен контролируемым образом и остановлен при самых первых признаках экстравазации.Управление изображением упрощает установку инструмента, баллона и цемента. Точная костная полость может быть создана с помощью баллона, который ограничивает границы полости. Несмотря на стоимость и время рентгеноскопии, кифопластика грудины (баллонная цементопластика) имеет несколько преимуществ перед цементопластикой. Баллон представляет собой трехмерную рентгеноконтрастную структуру примерно сферической формы измеряемого объема и диаметра. Это важно при измерении глубины, ширины и объема при рентгеноскопии. Внешние границы надутого баллона ограничивают размер костной пустоты.Это необходимо для прогнозирования распределения и объема цемента. При медленной инсуффляции можно визуализировать периметр баллона, расширяющийся к коре головного мозга; это может помочь избежать или распознать нарушение кортикального слоя грудины. Рентгеноконтрастность позволяет визуализировать внешние сферические края баллона при рентгеноскопии. Контрастная эхогенность позволяет визуализировать баллон по отношению к окружающим мягким и костным тканям с помощью сонографии. Грудина находится рядом с несколькими жизненно важными структурами мягких тканей, и у этого пациента было кавитационное поражение.Кифопластика позволяет создавать полости и может снизить риск экстравазации цемента. В совокупности эти факторы повлияли на решение автора прибегнуть к кифопластике.
Рентгеноскопия и сонография дополняют друг друга: 1) визуализация в различных геометрических плоскостях (сагиттальная или аксиальная) и 2) визуализация различных структур (кости и мягкие ткани). Ультразвук четко определил кортикальные границы и близость к мягким тканям грудной клетки. При рентгеноскопии четко визуализировалась грудина в переднезадней и боковой проекциях.Это в совокупности облегчило все этапы процедуры: 1) локализация; 2) точка входа в скин; 3) выдвижение троакара; 4) стабилизация троакара; 5) инсуффляция баллона; 6) доставка цемента. Сочетание этих методов визуализации с минимально инвазивными устройствами доступа может повысить безопасность, направленность и эффективность этих процедур.
Хотя у этого пациента были множественные метастазы, размер этого остеолитического поражения относительно грудины и инвазия коры головного мозга вызывали сильную боль.Постоянные повторяющиеся движения грудной клетки из-за дыхания были болезненными. Опиоидная терапия была эффективной при лечении других поражений и боли, но не при метастазах в грудины. Лучевая терапия оказалась безуспешной — возможно, из-за стойкого воспаления. Значительное облегчение после кифопластики грудины у этого пациента согласуется с результатами после кифопластики при метастазах в позвоночник и абляционных процедур при метастазах в скелете. Остеопластика других плоских костей привела к значительному облегчению боли [8,11,12].Эти дела были выполнены за пределами США.
Учитывая трагические последствия скелетных метастазов, прямая паллиативная терапия с помощью кифопластики расширяет арсенал лечения. Этот отчет дополняет литературу, подтверждающую роль прямого паллиативного лечения в дополнение или вместо хирургической или лучевой терапии.
Заключение
Баллонная кифопластика с использованием рентгеноскопии и сонографии может быть полезным методом лечения болезненных метастазов в кости, не несущие нагрузку.Эту терапию следует учитывать при лечении пациентов с болезненными метастазами в скелете.
Благодарность
Автор хотел бы поблагодарить Эрика Диксона, RT, Мэри Хэтч, NP, и Луи Дюбуа, доктора медицины.
Список литературы
1
.
Статистика рака, 2010 г.
.
CA Cancer J Clin
2010
;
60
(
5
):
277
—
300
,2
и др.
Ранняя паллиативная помощь пациентам с метастатическим немелкоклеточным раком легкого
.
N Engl J Med
2010
;
363
(
8
):
733
—
42
,3
.
Заболевания скелета существенно влияют на заболеваемость и смертность пациентов с раком легких
.
Clin рака легких
2009
;
10
(
4
):
223
—
9
. Обзор 4
.
Удаление скелетных метастазов: Текущее состояние
.
J Vasc Interv Radiol
2010
;
21
(
8 доп.
):
S242
—
50
.5
et al.
Радиочастотная абляция костных метастазов для облегчения боли
.
Скелетный радиол
2008
;
37
(
3
):
189
—
94
,6
и др.
Лечение метастатических опухолей позвоночника с помощью чрескожной вертебропластики по сравнению с чрескожной вертебропластикой в сочетании с интерстициальной имплантацией семян 125I
.
Acta Radiol
2009
;
50
(
10
):
1142
—
8
.7
.
Клинические и рентгенологические результаты баллонной кифопластики при лечении метастазов тел позвонков и множественной миеломы
.
J Clin Neurosci
2010
;
17
(
2
):
219
—
24
,8
.
Скапулопластика облегчает боль в лопатке, вызванную метастазами рака легкого
.
Врач по обезболиванию
2010
;
13
(
5
):
485
—
91
.9
et al.
Измерение температуры во время полимеризации костного цемента при чрескожной вертебропластике: исследование in vivo на людях
.
Cardiovasc Intervent Radiol
2009
;
32
(
3
):
491
—
8
.10
.
Интрадискальная электротермальная терапия: предварительное гистологическое исследование
.
Arch Phys Med Rehabil
2001
;
82
(
9
):
1230
—
7
.11
.
Чрескожная остеопластика при болезненном поражении грудины вследствие множественной миеломы
.
Скелетный радиол
2009
;
38
(
3
):
281
—
5
. Epub 2008 Dec 3.12
et al.
Чрескожная комбинированная терапия болезненных метастазов в грудины: протокол радиочастотной термической абляции (RFTA) и цементопластики
.
Anticancer Res
2007
;
27
(
6C
):
4259
—
62
.13
et al.
Паллиативное лечение болезненных метастазов в кости с помощью МРТ — направленное сфокусированное ультразвуковое исследование
.
Радиология
2008
;
249
(
1
):
355
—
63
.14
.
Облучение средостения и его влияние на сердечно-сосудистую систему
.
Br J Hosp Med (Лондон)
2009
;
70
(
4
):
222
—
4
.15
.
Сердечно-сосудистые заболевания, связанные с облучением
.
Crit Rev Oncol Hematol
2003
;
45
(
1
):
55
—
75
,16
.
Чрескожные методы лечения опухолей позвоночника: каковы диагностические и терапевтические показания и результаты
.
Spine (Phila Pa 1976)
2009
;
34
(
22 доп.
):
S93
—
100
,17
и др.
Радиочастотная абляция костных метастазов вызывает длительное паллиативное лечение у пациентов с неизлечимым раком
.
Singapore Med J
2008
;
49
(
7
):
565
—
70
.
Wiley Periodicals, Inc.
Контрастное T1-взвешенное изображение метастазов в головной мозг может предсказать статус мутации EGFR при первичном раке легких
Wong, MCS, Lao, XQ, Ho, KF, Goggins, WB & Tse, SLA Заболеваемость и смертность легких рак: глобальные тенденции и связь с социально-экономическим статусом. Sci Rep 7 , 14300, https://doi.org/10.1038/s41598-017-14513-7 (2017).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ферли Дж. и др. . Заболеваемость и смертность от рака в Европе: оценки для 40 стран в 2012 г. евро J Cancer 49 , 1374–1403, https://doi.org/10.1016/j.ejca.2012.12.027 (2013).
CAS
Статья
Google Scholar
Nayak, L., Lee, E. Q. & Wen, P. Y. Эпидемиология метастазов в мозг. Curr Oncol Rep 14 , 48–54, https://doi.org/10.1007/s11912-011-0203-y (2012).
Артикул
PubMed
Google Scholar
Виллано, Дж. Л. и др. . Частота метастазов в мозг при первичном раке легких. Neuro Oncol 17 , 122–128, https://doi.org/10.1093/neuonc/nou099 (2015).
Артикул
PubMed
Google Scholar
Аль-Шами, Г. и Савайя, Р. Лечение метастазов в мозг: незаменимая роль хирургии. J Neurooncol 92 , 275–282, https://doi.org/10.1007/s11060-009-9839-y (2009).
Артикул
PubMed
Google Scholar
Бернардо, Г. и др. . Химиотерапия первой линии винорелбином, гемцитабином и карбоплатином при лечении метастазов в головной мозг немелкоклеточного рака легкого: исследование фазы II. Cancer Invest 20 , 293–302 (2002).
CAS
Статья
Google Scholar
Клос, К. Дж. И О’Нил, Б. П. Метастазы в мозг. Невролог 10 , 31–46, https://doi.org/10.1097/01.nrl.0000106922.83090.71 (2004).
Артикул
PubMed
Google Scholar
Ян, Х. и др. . Мутации IDh2 и IDh3 в глиомах. N Engl J Med 360 , 765–773, https://doi.org/10.1056/NEJMoa0808710 (2009).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Hegi, M. E. et al. . Корреляция метилирования промотора O6-метилгуанинметилтрансферазы (MGMT) с клиническими исходами при глиобластоме и клиническими стратегиями модуляции активности MGMT. J Clin Oncol 26 , 4189–4199, https: // doi.org / 10.1200 / JCO.2007.11.5964 (2008).
CAS
Статья
PubMed
Google Scholar
Вайгельт, Б., Бэнер, Ф. Л. и Рейс-Филхо, Дж. С. Вклад профилирования экспрессии генов в классификацию, прогнозирование и прогнозирование рака груди: ретроспектива последнего десятилетия. J Pathol 220 , 263–280, https://doi.org/10.1002/path.2648 (2010).
CAS
Статья
PubMed
Google Scholar
да Кунья Сантос, Г., Шеперд, Ф. А. и Цао, М. С. Мутации EGFR и рак легких. Анну Рев Патол 6 , 49–69, https://doi.org/10.1146/annurev-pathol-011110-130206 (2011).
CAS
Статья
PubMed
Google Scholar
Линч, Т. Дж. и др. . Активирующие мутации в рецепторе эпидермального фактора роста, лежащие в основе реакции немелкоклеточного рака легкого на гефитиниб. N Engl J Med 350 , 2129–2139, https://doi.org/10.1056/NEJMoa040938 (2004).
CAS
Статья
PubMed
Google Scholar
Mok, T. S. et al. . Гефитиниб или карбоплатин-паклитаксел при аденокарциноме легких. N Engl J Med 361 , 947–957, https://doi.org/10.1056/NEJMoa0810699 (2009).
CAS
Статья
PubMed
Google Scholar
Джонсон, М. Л. и др. . Связь мутаций KRAS и EGFR с выживаемостью у пациентов с распространенными аденокарциномами легких. Рак 119 , 356–362, https://doi.org/10.1002/cncr.27730 (2013).
CAS
Статья
PubMed
Google Scholar
Мастерс, Г. А. и др. . Системная терапия немелкоклеточного рака легкого стадии IV: Обновление клинических рекомендаций Американского общества клинической онкологии. J Clin Oncol 33 , 3488–3515, https://doi.org/10.1200/JCO.2015.62.1342 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Новелло, С. и др. . Метастатический немелкоклеточный рак легкого: Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Ann Oncol 27 , v1 – v27, https://doi.org/10.1093/annonc/mdw326 (2016).
CAS
Статья
PubMed
Google Scholar
Юнг, В. С., Парк, К. Х., Хонг, К. К., Сух, С. Х. и С. Дж. Диффузионно-взвешенная визуализация метастазов в мозг от рака легкого: корреляция параметров МРТ с гистологическим типом и статусом мутации гена. AJNR Am J Neuroradiol 39 , 273–279, https://doi.org/10.3174/ajnr.A5516 (2018).
CAS
Статья
PubMed
Google Scholar
Кикингередер, П. и др. . Широкомасштабное рентгенологическое профилирование рецидивирующей глиобластомы позволяет определить предиктор визуализации для стратификации ответа на антиангиогенное лечение. Clin Cancer Res 22 , 5765–5771, https://doi.org/10.1158/1078-0432.CCR-16-0702 (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Итакура, Х. и др. . Функции магнитно-резонансного изображения позволяют идентифицировать фенотипические подтипы глиобластомы с различными активностями молекулярных путей. Sci Transl Med 7 , 303ra138, https://doi.org/10.1126/scitranslmed.aaa7582 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Чжоу М. и др. . Рентгенологически определенная экологическая динамика и клинические исходы при мультиформной глиобластоме: предварительные результаты. Transl Oncol 7 , 5–13 (2014).
CAS
Статья
Google Scholar
Короллер, Т. П. и др. . Особенности радиомного фенотипа предсказывают патологический ответ при немелкоклеточном раке легкого. Radiother Oncol 119 , 480–486, https://doi.org/10.1016/j.radonc.2016.04.004 (2016).
Артикул
PubMed
PubMed Central
Google Scholar
Thawani, R. et al. . Радиомика и радиогеномика при раке легких: обзор для клинициста. Рак легких 115 , 34–41, https: // doi.org / 10.1016 / j.lungcan.2017.10.015 (2018).
Артикул
Google Scholar
Гиллис, Р. Дж., Кинахан, П. Э. и Хричак, Х. Радиомика: изображения — это больше, чем изображения, они — данные. Радиология 278 , 563–577, https://doi.org/10.1148/radiol.2015151169 (2016).
Артикул
PubMed
Google Scholar
Бхаргава Р. и Мадабхуши А.Новые темы в области информатики изображений и молекулярного анализа для цифровой патологии. Annu Rev Biomed Eng 18 , 387–412, https://doi.org/10.1146/annurev-bioeng-112415-114722 (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ву, Х. и др. . Комбинация рентгенологических и текстурных характеристик матрицы совместной встречаемости на уровне серого, используемая для распознавания одиночных легочных узелков с помощью компьютерной томографии. J Digit Imaging 26 , 797–802, https://doi.org/10.1007/s10278-012-9547-6 (2013).
Артикул
PubMed
PubMed Central
Google Scholar
Галлоуэй, М. М. Анализ текстуры с использованием длин уровней серого. Технический отчет NASA STI / Recon N 75 (1974).
Леунг Т. и Малик Дж. Представление и распознавание внешнего вида материалов с использованием трехмерных текстонов. Международный журнал компьютерного зрения 43 , 29–44 (2001).
Артикул
Google Scholar
Варма М. и Зиссерман А. Классификация изображений материалов: достижение независимости точки обзора и освещения на Европейской конференции по компьютерному зрению 255-271 (Springer, 2002).
Варма М. и Зиссерман А. Статистический подход к классификации текстур по отдельным изображениям. Международный журнал компьютерного зрения 62 , 61–81 (2005).
Артикул
Google Scholar
Лю, Г.-Х. И Ян, Ж.-Й. Поиск изображения на основе матрицы совпадения текстонов. Распознавание образов 41 , 3521–3527 (2008).
Артикул
Google Scholar
Гроссманн, П., Гроув, О. и Эль-Хашем, Н.Идентификация молекулярных фенотипов рака легких путем интеграции радиомики и геномики. Sci Transl Med .
Ларкин, Т. Дж. и др. . Анализ неоднородности изображения с использованием двумерных функционалов Минковского обнаруживает реакцию опухоли на лечение. Magn Reson Med 71 , 402–410, https://doi.org/10.1002/mrm.24644 (2014).
CAS
Статья
PubMed
Google Scholar
Тревор, Х., Роберт, Т. и Дж. Х., Ф. Элементы статистического обучения: интеллектуальный анализ данных, вывод и прогнозирование (Нью-Йорк, штат Нью-Йорк: Springer, 2009).
Брейман Л. Случайные леса. Машинное обучение 45 , 5–32 (2001).
Артикул
Google Scholar
Вестон Дж., Элиссефф А., Шёлкопф Б. и Типпинг М. Использование нулевой нормы в линейных моделях и методах ядра. Журнал исследований в области машинного обучения 3 , 1439–1461 (2003).
MathSciNet
МАТЕМАТИКА
Google Scholar
Роффо, Г., Мельци, С. и Кристани, М. Бесконечный выбор функций в материалах Международной конференции IEEE по компьютерному зрению 4202–4210 (2015).
Брэдли, П. С. и Мангасарян, О. Л. Выбор функций с помощью вогнутой минимизации и опорных векторных машин в ICML , Vol. 98 82–90 (1998).
Пэн, Х., Лонг, Ф. и Дин, С. Выбор характеристик на основе взаимной информации: критерии максимальной зависимости, максимальной релевантности и минимальной избыточности. транзакций IEEE по анализу шаблонов и машинному анализу , 1226–1238 (2005).
Робник-Шиконья М. и Кононенко И. Теоретический и эмпирический анализ ReliefF и RReliefF. Машинное обучение 53 , 23–69 (2003).
Артикул
Google Scholar
He, X., Cai, D. & Niyogi, P. Оценка лапласиана для выбора функций в Advances in neural processing systems 507–514 (2006).
Коциантис, С. Б., Захаракис, И. Д. и Пинтелас, П. Э. Машинное обучение: обзор методов классификации и комбинирования. Обзор искусственного интеллекта 26 , 159–190 (2006).
Артикул
Google Scholar
Чо, Б.С. и др. . Фаза II исследования эрлотиниба при запущенном немелкоклеточном раке легкого после неэффективности гефитиниба. J Clin Oncol 25 , 2528–2533, https://doi.org/10.1200/JCO.2006.10.4166 (2007).
CAS
Статья
PubMed
Google Scholar
Харалик Р. М. и Шанмугам К. Особенности текстуры для классификации изображений. IEEE Transactions по системам, человеку и кибернетике , 610–621 (1973).
Артикул
Google Scholar
Чу А., Сегал К. М. и Гринлиф Дж. Ф. Использование распределения значений серого для длин серий для анализа текстуры. Письма о распознавании образов 11 , 415–419 (1990).
Артикул
Google Scholar
Мартин Д. Р., Фаулкс К. и Малик Дж. Обучение обнаружению естественных границ изображения с использованием локальной яркости, цвета и текстурных реплик. IEEE Trans Pattern Anal Mach Intell 26 , 530–549, https://doi.org/10.1109/TPAMI.2004.1273918 (2004).
Артикул
PubMed
Google Scholar
Гейзебрук, Дж. М., Смелдерс, А. В. и Ван Де Вейер, Дж. Быстрая анизотропная гаусс-фильтрация. транзакций IEEE по обработке изображений 12 , 938–943 (2003).
ADS
MathSciNet
Статья
Google Scholar
Ганн, С. Р. Машины опорных векторов для классификации и регрессии. Технический отчет ISIS 14 , 5–16 (1998).
Google Scholar
Кикингередер, П. и др. . Радиогеномика глиобластомы: классификация молекулярных характеристик на основе машинного обучения с использованием функций многопараметрической и мультирегиональной МРТ. Радиология 281 , 907–918, https: // doi.org / 10.1148 / radiol.2016161382 (2016).
Артикул
PubMed
Google Scholar
Фройнд, Й. и Шапир, Р. Э. Теоретико-решающее обобщение онлайн-обучения и приложение для повышения квалификации. Журнал компьютерных и системных наук 55 , 119–139 (1997).
MathSciNet
Статья
Google Scholar
Тибширани, Р.Регрессионное сжатие и выбор с помощью лассо. Журнал Королевского статистического общества: серия B (методологическая) 58 , 267–288 (1996).
MathSciNet
МАТЕМАТИКА
Google Scholar
Молинаро, А. М., Саймон, Р. и Пфайффер, Р. М. Оценка ошибки предсказания: сравнение методов повторной выборки. Биоинформатика 21 , 3301–3307, https://doi.org/10.1093/bioinformatics/bti499 (2005).
CAS
Статья
PubMed
Google Scholar
Ояла М. и Гаррига Г. С. Перестановочные тесты для изучения производительности классификатора. Журнал исследований в области машинного обучения 11 , 1833–1863 (2010).
MathSciNet
МАТЕМАТИКА
Google Scholar
Николс Т. Э. и Холмс А. П. Непараметрические перестановочные тесты для функциональной нейровизуализации: учебник с примерами. Картирование человеческого мозга 15 , 1-25 (2002).
Артикул
Google Scholar
Lambin, P. et al. . Радиомика: извлечение дополнительной информации из медицинских изображений с помощью расширенного анализа функций. евро J Cancer 48 , 441–446, https://doi.org/10.1016/j.ejca.2011.11.036 (2012).
Артикул
PubMed
PubMed Central
Google Scholar
Эйхлер, А.Ф. и др. . Статус мутации EGFR и выживаемость после диагностики метастазов в головной мозг при немелкоклеточном раке легкого. Neuro Oncol 12 , 1193–1199, https://doi.org/10.1093/neuonc/noq076 (2010).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Ithapu, V. et al. . Выявление и обобщение гиперинтенсивности белого вещества с использованием методов контролируемой сегментации в исследованиях риска болезни Альцгеймера и старения. Картирование человеческого мозга 35 , 4219–4235 (2014).
Артикул
Google Scholar
Кегл, Б. Возвращение AdaBoost. MH: мультиклассовые деревья Хэмминга. arXiv препринт arXiv : 1312 . 6086 (2013).
Moradi, E. et al. . Фреймворк машинного обучения для раннего прогнозирования конверсии болезни Альцгеймера на основе МРТ в предметах MCI. Neuroimage 104 , 398–412, https: // doi.org / 10.1016 / j.neuroimage.2014.10.002 (2015).
Артикул
PubMed
Google Scholar
Кортес, К. и Вапник, В. Сети опорных векторов. Машинное обучение 20 , 273–297 (1995).
MATH
Google Scholar
Pekmezci, M. & Perry, A. Невропатология метастазов в головной мозг. Surg Neurol Int 4 , S245–255, https: // doi.org / 10.4103 / 2152-7806.111302 (2013).
Артикул
PubMed
PubMed Central
Google Scholar
Choi, Y. S. et al. . Дополнительная прогностическая ценность анализа гистограммы ADC в отношении статуса метилирования промотора MGMT у пациентов с глиобластомой. Радиология 281 , 175–184, https://doi.org/10.1148/radiol.2016151913 (2016).
Артикул
PubMed
Google Scholar
Йом, К. В. и др. . Артериальная спин-меченная перфузия опухолей головного мозга у детей. AJNR Am J Neuroradiol 35 , 395–401, https://doi.org/10.3174/ajnr.A3670 (2014).
CAS
Статья
PubMed
Google Scholar
Котроцу, А., Зинн, П. О. и Колен, Р. Р. Радиомика в опухолях головного мозга: новый метод для характеристики окружающей среды опухоли. Magn Reson Imaging Clin N Am 24 , 719–729, https: // doi.org / 10.1016 / j.mric.2016.06.006 (2016).
Артикул
PubMed
Google Scholar
Кикингередер, П. и др. . Радиомное профилирование глиобластомы: определение предиктора визуализации выживаемости пациентов с улучшенными характеристиками по сравнению с установленными клиническими и радиологическими моделями риска. Радиология 280 , 880–889, https://doi.org/10.1148/radiol.2016160845 (2016).
Артикул
PubMed
Google Scholar
Арлот С. и Селисс А. Обзор процедур перекрестной проверки для выбора модели. Статистические обзоры 4 , 40–79 (2010).
MathSciNet
Статья
Google Scholar
Сакурада А., Шеперд Ф. А. и Цао М. С. Ингибиторы тирозинкиназы рецептора эпидермального фактора роста при раке легких: влияние первичных или вторичных мутаций. Clin рака легких 7 (Приложение 4), S138–144, https: // doi.org / 10.3816 / clc.2006.s.005 (2006).
CAS
Статья
PubMed
Google Scholar
Шин Д. Ю. и др. . Мутация EGFR и метастазы в головной мозг при аденокарциномах легких. J Thorac Oncol 9 , 195–199, https://doi.org/10.1097/JTO.0000000000000069 (2014).
CAS
Статья
PubMed
Google Scholar
Italiano, A. и др. . Сравнение гена и белка рецептора эпидермального фактора роста при первичном немелкоклеточном раке легкого и участках метастазирования: значение для лечения ингибиторами EGFR. Ann Oncol 17 , 981–985, https://doi.org/10.1093/annonc/mdl038 (2006).
CAS
Статья
PubMed
Google Scholar
Рау К. М. и др. . Несоответствие мутационных статусов рецептора эпидермального фактора роста и K-ras между первичной аденокарциномой легкого и метастазами в мозг. Int J Mol Sci 17 , 524, https://doi.org/10.3390/ijms17040524 (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Han, H. S. et al. . Статус мутации EGFR в первичных аденокарциномах легких и соответствующих метастатических поражениях: несоответствие в плевральных метастазах. Clin рака легких 12 , 380–386, https://doi.org/10.1016/j.cllc.2011.02.006 (2011).
CAS
Статья
PubMed
Google Scholar
Гоу, К. Х. и др. . Сравнение мутаций рецептора эпидермального фактора роста между первичными и соответствующими метастатическими опухолями при немелкоклеточном раке легкого, не подвергающемся действию ингибиторов тирозинкиназы. Энн Онкол 20 , 696–702, https://doi.org/10.1093/annonc/mdn679 (2009).
Артикул
PubMed
Google Scholar
Мацумото, С. и др. . Частые мутации EGFR при метастазах аденокарциномы легкого в мозг. Int J Cancer 119 , 1491–1494, https://doi.org/10.1002/ijc.21940 (2006).
CAS
Статья
PubMed
Google Scholar
Kalikaki, A. et al. . Сравнение статуса генов EGFR и K-RAS между первичными опухолями и соответствующими метастазами при NSCLC. Br J Cancer 99 , 923–929, https: // doi.org / 10.1038 / sj.bjc.6604629 (2008).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Луо, Д. и др. . Статус мутации EGFR и его влияние на выживаемость китайских пациентов с немелкоклеточным раком легкого с метастазами в головной мозг. Tumor Biol 35 , 2437–2444, https://doi.org/10.1007/s13277-013-1323-9 (2014).
CAS
Статья
PubMed
Google Scholar
Ким, К. М. и др. . Несоответствие мутации рецептора эпидермального фактора роста между метастазами в мозг и первичным немелкоклеточным раком легкого. Лечение опухолей головного мозга 7 , 137–140, https://doi.org/10.14791/btrt.2019.7.e44 (2019).
Артикул
PubMed
PubMed Central
Google Scholar
Ли, К. К. и др. . Несоответствие мутации рецептора эпидермального фактора роста между первичной опухолью легкого и парными отдаленными метастазами при немелкоклеточном раке легкого: систематический обзор и метаанализ. PLoS One 14 , e0218414, https://doi.org/10.1371/journal.pone.0218414 (2019).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Wang, S. et al. . Прогнозирование статуса мутации EGFR в аденокарциноме легкого по изображению компьютерной томографии с использованием глубокого обучения. евро Respir J 53 , https://doi.org/10.1183/139.00986-2018 (2019).
Артикул
Google Scholar
Gevaert, О. и др. . Прогнозирующее радиогеномическое моделирование мутационного статуса EGFR при раке легкого. Sci Rep 7 , 41674, https://doi.org/10.1038/srep41674 (2017).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Визуализирующая диагностика метастатического рака груди | Insights into Imaging
Радионуклидное сканирование костей
Планарная сцинтиграфия кости (BS)
Планарная BS клинически проста для чтения, широко доступна и экономически эффективна [26], и была рекомендована в качестве основного метода для обнаружения метастазов в кости при бессимптомной высокой -риск рака груди у женщин [17].
Аномальное накопление 99m Tc-меченных дифосфонатов связано с усилением местного кровотока и остеобластической активностью, что, как следствие, приводит к метастатическому росту в костном мозге [17, 27, 28, 29, 30]. Чувствительность планарного BS, как сообщается, колеблется от 62 до 100% [17, 27, 28, 29, 30, 31]. Однако 99m Tc-меченные дифосфонаты являются неспецифическими маркерами остеобластической активности, которые также наблюдаются при доброкачественных переломах, болезни Педжета, дегенеративных заболеваниях суставов, травмах и воспалениях [31,32,33].Это объясняет более низкую специфичность планарного BS (0,75, 0,71–0,79), чем SPECT (0,85, 0,80–0,90) (таблица 2) [29, 34,35,36].
Таблица 2 Исследования, сравнивающие диагностические характеристики BS и SPECT
ОФЭКТ сканирование костей
Общее улучшение наблюдалось, когда BS была увеличена с помощью однофотонной эмиссионной компьютерной томографии (ОФЭКТ) в нижнем грудном и поясничном отделах позвоночника или по всему осевой скелет (ОФЭКТ всего тела) (рис. 1) [37, 39,40,41]. В расчете на одного пациента при раке молочной железы ОФЭКТ показала более высокую специфичность — 94% по сравнению с 74% при использовании BS [42].Хотя некоторые доклинические сканеры SPECT могут обеспечивать пространственное разрешение субмиллиметрового диапазона, клинические гамма-камеры дают томографическое разрешение около 10 мм [38]. Следовательно, как и в случае планарных БС, пространственное разрешение ОФЭКТ ограничено [41]. Соответственно, диагностическая эффективность ОФЭКТ подвергается сомнению, и пациенты с неопределенными результатами часто требуют других радиологических исследований для характеристики неопределенных результатов [43,44,45].
Рис. 1
Планарное сканирование кости в сравнении с ОФЭКТ. Изображения с плоского сканирования костей ( a ) и виды с однофотонной эмиссионной компьютерной томографии (SPECT) грудного ( b ) и шейного ( c ) позвоночника у 56-летней женщины с грудью рак.Незначительное аномальное скопление метки присутствует в корне левой шеи на плоском сканировании кости (черная стрелка) с нормальным накоплением в мочевыводящих путях и в месте инъекции ( a ). ОФЭКТ-КТ демонстрирует соответствующее поглощение в правом поперечном отростке С7 ( c белая стрелка), но дополнительное поглощение в левой лопатке ( b белая стрелка) не видно только на плоских изображениях
Объединение ОФЭКТ с КТ частично улучшает характеристики при метастатическом поражении костей — за счет уменьшения количества двусмысленных поражений, обнаруживаемых на плоской БС [26, 36, 46].Однако такой комбинированный метод может не быть широко доступным из-за более высокой стоимости оборудования, а качество изображения может снизиться из-за движений пациента и артефактов КТ [26].
CT
В клинической практике обычные рентгенограммы часто используются в качестве дополнения к BS для оценки симптоматической боли в костях. Результаты сканирования костей часто подтверждаются с помощью компьютерной томографии [17], которая показывает хорошую специфичность, хотя и низкую чувствительность (95% и 73% соответственно, согласно Heindel et al.) [47]. Метастазы появляются на КТ как участки просветления или склероза и редко как четко выраженная рентгеноплотность в костном мозге [21].
Что касается висцеральных метастазов, то локализация в печени довольно часто встречается у пациентов с раком груди (до 60–70% женщин имеют метастазы в печени при вскрытии) [48]. Чувствительность и специфичность для обнаружения метастазов в печени составили 73–75% и 94–96%, соответственно, в то время как для УЗИ, МРТ и ФДГ-ПЭТ были 61–65% и 96–98%, 80–82% и 96–98%. и 94–96% и 98–99% соответственно [49,50,51].
Как правило, рак молочной железы, экспрессирующий HER2, имеет тенденцию к метастазированию в печень чаще, чем ER / PR-положительный рак молочной железы [52, 53].Фаза воротной вены при КТ показывает метастазы в печени в виде нерегулярных гиподенсных поражений с усилением периферического контраста [54]. Тем не менее, метастазы в печень могут казаться изоденсными паренхиме печени (рис. 2), и их степень может быть недооценена или, в случае диффузии, полностью пропущена [21]. Не наблюдалось различий в появлении метастазов в печени на КТ в зависимости от статуса молекулярных гормональных рецепторов [55].
Рис. 2
Изоплотные метастазы в печень, не визуализированные на КТ, идентифицированные с помощью МРТ.Изображения КТ фазы воротной вены ( a ), артериальной ( b ) и воротной вены ( c ) фазы T1-W после контрастирования и МРТ с диффузионно-взвешенным b-750 ( d ) через печень у 46-летней женщины с раком груди и нарушением функции печени. Печень выглядит нормальной как на КТ, так и на постконтрастной МРТ T1-W, но по всей печени (белые стрелки) присутствуют множественные очаги с высоким уровнем сигнала на диффузионно-взвешенной последовательности, что соответствует диффузным метастазам в печень
Точно так же более высокий процент метастазов в мозг обнаруживаются при гормональном ER / PR-отрицательном раке молочной железы по сравнению с гормон-положительными подтипами [52].Более того, подтип тройного отрицательного рака груди показывает более высокий риск развития метастазов в головной мозг [56]. Проведение КТ головного мозга обычно вызвано такими клиническими симптомами, как изменение психического статуса, головная боль или рвота / тошнота. В этом случае предпочтение отдается МРТ, где и когда доступно, из-за его повышенной чувствительности [21]. С точки зрения радиолога, хотя инновационное лечение может продлить общую выживаемость, у таких пациентов отмечается более высокая частота церебральных метастазов, поскольку новые терапевтические препараты могут быть неэффективными через гематоэнцефалический барьер [57].
Метастазы в легких от рака груди могут быть обнаружены на КТ по ряду радиологических образцов: единичные или множественные легочные узелки, эндобронхиальная локализация, уплотнение воздушного пространства и лимфангитный карциноматоз, которые могут имитировать другие первичные проявления, такие как аденокарцинома легкого или лимфома [21] (Рис. 3). Плевральная локализация часто проявляется как односторонний (и ипсилатеральный по отношению к раку груди) плевральный выпот без каких-либо особенностей по сравнению с доброкачественными выпотами [21].
Рис. 3
Морфологические проявления метастазов в легких. Проекция максимальной интенсивности (MIP) КТ грудной клетки ( a ) и КТ воротной венозной фазы грудной клетки с использованием окон средостения ( b ) и КТ воротной венозной фазы на окнах легких ( c , d и e ) в 62-летняя женщина с разными морфологическими проявлениями метастатического рака груди в легкие. MIP CT демонстрирует множественные округлые метастазы в легких ( a ), массовое поражение, имитирующее рак легкого ( b ), нерегулярные спикулированные метастазы ( c ), эндо- и перибронхиальную инфильтрацию ( d ) и карциноматоз лимфангита (). e )
Обычная МРТ
При метастатическом раке молочной железы злокачественные клетки вытесняют и замещают нормальные жировые клетки костного мозга, вызывая снижение содержания жира, тогда как успешное лечение связано с возвращением здорового жира костного мозга [58].МРТ может отличить здоровый костный мозг от патологического, действуя как эффективный и неинвазивный тест для распознавания метастазов в кости [17, 28, 59, 60]. Последовательности МРТ, включая T1WI, диффузионно-взвешенную визуализацию (DWI) и визуализацию количественного химического сдвига Диксона (которая оценивает фракцию воды и жира), могут оценивать анатомические и функциональные особенности костного мозга [58, 61]. Следовательно, обученный радиолог может отличить метастазы в кости (которые проявляются узловыми очаговыми метастатическими поражениями или инфильтрацией / замещением костного мозга) от доброкачественных изменений костного мозга (таких как гиперплазия костного мозга, вызванная химиотерапией) [28].
Исследования оценивали МРТ как первичный метод скрининга для диагностики скелетных отложений, чтобы связать преимущества высокой чувствительности и специфичности с улучшенным пространственным разрешением, демонстрируя диагностическое превосходство МРТ над BS для выявления метастазов в кости [62, 63]. В частности, обновленный метаанализ показал совокупную чувствительность 97% для МРТ по сравнению с 79% для BS и совокупную специфичность 95% против 82% соответственно [29].
Кроме того, МРТ обычно используется для уточнения неоднозначных результатов BS [28] и для выявления осложнений, связанных с метастазами в кости (таких как компрессия спинного мозга или нервов), которые могут повлиять на решения о лечении [64].Altehoefer et al. [65] показали, как МРТ определяла необходимость местной терапии в участках, которые были отрицательными по BS; Kim et al. [66] подчеркнули важность МРТ для оценки единичных «горячих точек» на БС [67]. Однако интерпретация МРТ костей требует понимания эволюции нормального костного мозга с возрастом: действительно, у более молодых пациентов высококлеточный гематопоэтический мозг может затруднить диагностику небольших метастазов [68].
При 80–82% и 96–98% диапазонах чувствительности и специфичности, соответственно [49,50,51], МРТ является подходящим методом для обнаружения метастазов в печени [69].Метастазы рака груди в печень обычно гипо- или изоинтенсивны на T1WI, изо- или гиперинтенсивны на T2WI, и, поскольку метастазы в груди часто гиповаскулярны, они обычно показывают усиление перилезии [70] в артериальной фазе усиления контраста. Однако также могут возникать гиперваскулярные метастазы, которые могут быть связаны с прогрессированием заболевания (рис. 4). Кроме того, DWI может помочь в обнаружении небольших метастазов в печень, которые легко не заметить в других последовательностях [69]. Особенности усиления метастазов в печени на МРТ до лечения, такие как степень гиперваскуляризации края опухоли, также могут прогнозировать прогрессирование заболевания [71].
Рис. 4
Гиперваскулярные метастазы в печени на МРТ. МРТ печени у 52-летней женщины с раком груди демонстрирует множественные гиперинтенсивные поражения T1 в печени на изображении T1-W ( a ), которые показывают усиление в портовенозной фазе ( b ) и затрудненную диффузию на b750. DWI ( c)
Для обнаружения метастазов в головной мозг МРТ с контрастным усилением имеет более высокую чувствительность, чем КТ [72], из-за более высокого разрешения мягких тканей и лучшего обнаружения паренхиматозного и лептоменингеального поражения [21].Поражения обычно супратенториальные, они могут быть одиночными или множественными, возникая на стыке серого и белого вещества и в зонах водораздела основных артериальных территорий [73] (рис. 5). Более того, МРТ показала более высокую чувствительность и специфичность, чем ПЭТ-КТ для метастазов в головной мозг [74], поскольку высокая фоновая активность, присутствующая в коре и базальных ганглиях (из-за присущего этим структурам высокого потребления глюкозы), может существенно ухудшить отношение сигнал / шум. ПЭТ с ФДГ [72], поэтому отрицательно влияет на способность ПЭТ обнаруживать особенно небольшие метастатические поражения.
Рис. 5
Церебральные проявления рака груди. Постконтрастная T1-W МРТ у 58-летней женщины с раком молочной железы демонстрирует внутримозговые метастазы ( a ), метастазы в твердую мозговую оболочку ( b ) и лептоменингеальную болезнь ( c )
Тем не менее, согласно обновленным данным Согласно рекомендациям ASCO, клиницисты не должны выполнять рутинную МРТ для скрининга всех пациентов с раком груди на наличие метастазов в головной мозг, а только у пациентов с HER2-положительным распространенным раком груди из-за высокой частоты метастазов в мозг [75].
Легкие часто поражаются метастазами рака молочной железы: с помощью передовых методов МРТ метастазы в легких можно визуализировать как очаги высокого сигнала на DWI [10].
Расширенная визуализация
Среди различных методов визуализации, доступных в настоящее время для обнаружения отдаленных метастазов, гибридные методы, объединяющие морфологические и функциональные данные, являются наиболее чувствительными и специфическими, а ПЭТ-КТ и ПЭТ-МРТ, вероятно, будут продолжать развиваться и приобретать все большее значение. в этом поле.Для оптимального выявления метастазов в кости часто используются комбинации различных методов визуализации. Хотя обычная визуализация часто использовалась для определения стадии рака, было обнаружено, что эти методы менее чувствительны и менее специфичны в предоставлении точных данных в клинически значимых временных рамках. Благодаря недавним положительным достижениям в области расширенной визуализации, в настоящее время наблюдается тенденция к визуализации всего тела за один сеанс. Выбор метода обычно зависит от клинической ситуации и типа первичной опухоли.Необходимы дальнейшие исследования для дальнейшего изучения влияния этих дорогостоящих и трудоемких методов визуализации на стратегии лечения и течение болезни. Ниже мы обсуждаем последние данные о передовых методах визуализации, включая ПЭТ-КТ, ПЭТ-МРТ и WBMRI. Эти методы обычно показывают улучшение диагностической точности для обнаружения метастазов по сравнению с обычными методами визуализации, с возможностью количественной оценки биологических процессов, связанных с костным микроокружением, а также клеточностью опухоли.Сравнительные исследования традиционных и передовых методов визуализации также были проведены у субъектов, выбранных для дальнейшего исследования после сканирования костей, и сообщалось о вкладе гибридной визуализации и WBMRI для оценки костных / висцеральных поражений или подозрительных симптомов [67].
Гибридная визуализация
Использование гибридной визуализации (ПЭТ-КТ и ПЭТ-МРТ) расширилось благодаря расширенному доступу к коммерческим предприятиям по производству радиофармацевтических препаратов и широкой доступности сканеров [76].Чистый клиренс 18F-фторида натрия ( 18 F-NaF) в костных метастазах рака груди в 3–10 раз больше, чем в здоровой кости, что дает возможность обнаруживать как остеолитические, так и остеосклеротические метастазы [77]. Механизм захвата индикатора 18F-NaF костями аналогичен механизму 99m дифосфонатов Tc, он связан с местным кровотоком и остеобластической активностью, с быстрым начальным поглощением костным минералом в виде фторапатита. 18 ПЭТ-КТ с F-NaF имеет лучшие диагностические характеристики, чем ПЭТ-КТ с 18 только ПЭТФ с F-NaF [78].
В онкологическом стадировании 18F-флудезоксиглюкоза ( 18 F-FDG) является наиболее широко используемым радиоактивным индикатором [76]: предполагается, что его поглощение в скелетных метастазах происходит в основном в опухолевых клетках, действующих как специфический индикатор рака молочной железы, а не отражая изменения в костном микроокружении [79] (рис. 6).
Рис. 6
Сравнение ПЭТ-КТ с NaF и ФДГ У той же 65-летней женщины с метастатическим раком молочной железы КТ ( a ) показывает усиление склероза в левом крестце, повышенное поглощение метки ПЭТ NaF в левый крестец, а также обе подвздошные кости ( b ), но активность заболевания менее хорошо видна при ПЭТ с ФДГ ( c )
Королевский колледж радиологов (Великобритания) рекомендует рассмотреть возможность использования ПЭТ-КТ для определения стадии рака груди у пациентов с раком молочной железы. с мультифокальным заболеванием, подозрение на рецидив, когда МРТ молочной железы невозможна, и у пациентов с симптомами с сомнительной МРТ.Кроме того, пациенты с раком молочной железы в возрасте до 40 лет могут получить пользу от ПЭТ-КТ на ранних стадиях заболевания, поскольку это может привести к снижению системных последствий [19].
Основной гистологический подтип рака груди также может влиять на выбор изображения ПЭТ. При отсутствии лечения инвазивная дольчатая карцинома может иметь более низкий уровень поглощения 18 F-FDG остеобластными метастазами по сравнению с инвазивным протоковым или смешанным подтипом [80]. Точно так же важна предыдущая история лечения, поскольку 18 F-FDG-отрицательных скелетных метастазов могут показывать усиление склеротических поражений после успешной системной терапии, что делает опухолевые клетки нежизнеспособными даже при продолжающейся репаративной остеобластической активности, как обнаружено с помощью BS или 18 F- NaF ПЭТ может выдержать [81].
ПЭТ-СТ
Появляется все больше доказательств того, что ПЭТ-КТ обнаруживает отдаленные метастазы с более высокой чувствительностью, чем обычная визуализация [82], хотя в случаях рака долей и опухолей низкой степени злокачественности ПЭТ-КТ может быть менее чувствительной [83] .
В 2012 году Brennan и Houssami [84] опубликовали систематический обзор исследований, оценивающих точность визуализации для выявления бессимптомных метастазов у 14 824 пациентов с раком груди. Они показали распространенность дистанционных метастазов 7,0% (1,2–48,8%) и следующую диагностическую чувствительность / специфичность: комбинированная традиционная визуализация 78.0% / 91,4%; BS 98,0% / 93,5%; КТ груди / живота 100% / 93,1%; ФДГ-ПЭТ 100,0% / 96,5%; ПЭТ-КТ 100% / 98,1% соответственно. Соответственно, эффективность как традиционной, так и расширенной визуализации была очень высокой, но эти результаты могли быть искажены из-за выбора пациентов в каждой категории: в сравнительных исследованиях ПЭТ-КТ имела значительно более высокую чувствительность (98,7%, 78–100%), чем традиционные визуализация (70%, 37,5–85,9%).
Minamimoto et al. [85] проспективно оценили комбинацию 18 F-NaF и 18 F-FDG ПЭТ-КТ у 15 женщин с раком груди и 15 мужчин с раком простаты и сравнили результаты с результатами BS и WBMRI (включая DWI).Для метастазов в кости ПЭТ-КТ продемонстрировала лучшую чувствительность и точность, чем WBMRI (96,2% против 81,4%, 89,8% против 74,7%,) и BS (96,2% против 64,6%, 89,8% против 65,9%), в то время как , для висцеральных метастазов, 18 F-NaF / 18 F-FDG ПЭТ-КТ и WBMRI не имели статистически значимой разницы в чувствительности, PPV или точности.
Более высокий контраст легочной ткани при КТ и его более низкая восприимчивость к артефактам движения облегчают обнаружение повреждений легких [68], и некоторые авторы поддерживают ПЭТ-КТ как в настоящее время лучший передовой метод визуализации для обнаружения метастазов в легких с чувствительностью 89% для ПЭТ-КТ по сравнению с 82% для WBMRI и 74% для ПЭТ-МРТ [86, 87].
Кроме того, ПЭТ-КТ полезна для обнаружения метастатических средостенных и надключичных лимфатических узлов, а недавний метаанализ [88] показал чувствительность, специфичность, положительную прогностическую ценность, отрицательную прогностическую ценность и точность определения узлового распространения в 84%. , 92%, 74%, 82% и 81% соответственно. Согласно Schmidt et al. [89], ПЭТ-КТ, по-видимому, имеет повышенную специфичность для опухолевых подмышечных и средостенных лимфатических узлов по сравнению с WBMRI, а именно 90% против 86%.
ПЭТ-МРТ
Комбинация ПЭТ с МРТ может выиграть от высокого контраста мягких тканей при МРТ с дополнительным использованием многопараметрической МРТ. Более того, системы ПЭТ-МРТ преодолевают ловушки ПЭТ-КТ, такие как поглощение петлями кишечника и мочеточниками, что может привести к ложноположительным результатам [90].
Однако, хотя клаустрофобия не является проблемой при использовании ПЭТ-КТ, многие пациенты действительно испытывают ее при ПЭТ-МРТ из-за сочетания относительно более узкого и длинного отверстия, а также использования катушек для передней поверхности всего тела и катушки для головы. для части исследования МРТ [91].Более того, протоколы ПЭТ-КТ обычно выполняются в течение 30 минут, что быстрее, чем ПЭТ-МРТ, предназначенное для использования преимуществ многопоследовательной МРТ, что приводит к исследованиям, которые могут длиться более часа, что вызывает дискомфорт у многих онкологических больных. не может оставаться на спине и неподвижно в течение длительного времени из-за боли [91]. Хотя некоторые авторы предложили более быстрые и сокращенные протоколы ПЭТ-МРТ [92,93,94,95], которые позволяют ПЭТ-МРТ конкурировать с ПЭТ-КТ по скорости, такие протоколы часто не используют в полной мере преимущества ПЭТ-МРТ и могут не оправдать дополнительный расход ПЭТ-МРТ.
Опухоли, которые оцениваются с помощью ПЭТ-КТ и МРТ, могут быть перенесены на ПЭТ-МРТ [76], поскольку это позволяет объединить локальную стадию и стадию всего тела при раке молочной железы, обеспечивая улучшенное обнаружение поражений в головном мозге, груди, печени почки и кости. Действительно, МРТ может обеспечить анатомический коррелятор поражений, страдающих от ФДГ, и может обнаруживать метастазы в кости с низким поглощением ФДГ (которые не обнаруживаются на ПЭТ-КТ) [82, 96]. Согласно Melsaether et al. [87], ПЭТ-МРТ превзошла ПЭТ-КТ в обнаружении метастатического рака молочной железы и в то же время показала снижение дозы в среднем на 50%.Несмотря на то, что ПЭТ-КТ выявляет больше поражений легких, чем ПЭТ-МРТ, клиническое значение поражений легких, пропущенных при ПЭТ-МРТ, неясно [97]. С другой стороны, Riola-Parada et al. [98] в своем систематическом обзоре 57 статей, оценивающих ПЭТ-МРТ по сравнению с ПЭТ-КТ при обнаружении метастазов, показали схожую диагностическую эффективность этих двух методов, за исключением небольших метастазов в легкие, для которых ПЭТ-КТ была лучше.
Хотя ПЭТ-КТ имеет преимущество с точки зрения общего времени сбора данных из-за быстрого характера КТ-сканирования, ПЭТ-МРТ может получать изображения ПЭТ более высокого качества из-за более длительного времени, доступного для сбора данных, и возможности использовать информацию о дыхательных воротах МРТ улучшить данные ПЭТ [91].Обычно МРТ-исследования проводятся в анатомической мишени / интересующей области, и, следовательно, дополнительное время, проведенное в этом положении кровати, позволяет более длительное получение ПЭТ, обеспечивая увеличенное количество детекторов и улучшенное качество изображения. Более того, поскольку последовательности МРТ обычно получаются во время задержки дыхания или с использованием респираторного стробирования, данные ПЭТ могут быть реконструированы с выбранными данными в моменты времени без движения, что позволяет уменьшить артефакты движения [91].
В заключение, ПЭТ-КТ в настоящее время является признанной технологией, уже широко распространенной и принятой во всем мире, в то время как ПЭТ-МРТ имеет более высокую стоимость и большую сложность работы и интерпретации результатов.Однако ПЭТ-МРТ может снизить дозу облучения и улучшить коррекцию движения [91].
МРТ всего тела
Введение DWI и коэффициента кажущейся диффузии (ADC) повысило точность МРТ для обнаружения метастазов [99,100,101]. Использование DWI всего тела с подавлением жира STIR при свободном дыхании оптимизирует отношение сигнал / шум изображения и качество изображения [102, 103]. В дополнение к аксиально полученным изображениям DWI, T1WI, STIR и / или T2-взвешенные изображения с подавлением жира обычно также получаются [104].Что касается выбора значения b , предлагается по крайней мере два значения b : выбираемое более высокое значение b обычно находится в диапазоне от 600 до 1000 с / мм 2 , а нижнее значение b находится в диапазоне от 0 до 100 с. / мм 2 [102]. Протокол, используемый в настоящее время для WBMRI, осуществим, воспроизводим и может быть выполнен за относительно короткое время [10].
При метастатическом раке молочной железы DWI оказывается столь же чувствительным, но менее специфичным, чем 19F-FDG PET-CT при оценке костных метастазов, что указывает на то, что его следует рассматривать не изолированно, а в корреляции с морфологической визуализацией [105].В 2010 году проспективное исследование [106] с участием 36 пациентов с раком простаты или молочной железы показало лучшую эффективность WBMRI в обнаружении злокачественных поражений скелета (чувствительность 97% против 91%) по сравнению с BS (чувствительность 97% и 48% соответственно). . Недавнее исследование SKELETA [124] сравнило диагностическую точность BS, SPECT, SPECT-CT, 19 F-NaF, PET-CT и WBMRI для обнаружения метастазов в кости у 26 пациентов с раком груди и 27 пациентов с раком простаты, сообщая о следующей чувствительности значения 62%, 74%, 85%, 93% и 91% соответственно, что приводит к аналогичной диагностической точности для ПЭТ-КТ с 19F-NaF и превосходит ОФЭКТ-КТ и BS.
Ян и др. [128] выполнили метаанализ нескольких типов опухолей, включая рак груди, и показали, что WBMRI и PET-CT превосходят CT и BS с точки зрения как чувствительности, так и специфичности для обнаружения метастазов в кости. В частности, уровни чувствительности для ПЭТ-КТ, КТ, МРТ и БС составляли 89,7%, 72,9%, 90,6% и 86,0% соответственно, а уровни специфичности составляли 96,8%, 94,8%, 95,4% и 81,4% соответственно. Результаты единичных исследований представлены в таблице 3.
Таблица 3 Исследования, сравнивающие диагностические характеристики WBMRI и PET-CT
Причины ложноположительных результатов WBDWI включают отек костного мозга, вызванный доброкачественными заболеваниями, который можно преодолеть путем корреляции высокого значения DWI b с соответствующими картами ADC. и обычные последовательности МРТ на основе T1W.
В ряде исследований трансляционно анализировались различия между нормальным костным мозгом и метастатическими поражениями, коррелируя ADC с клеточностью и другими гистологическими характеристиками костных метастазов [58, 108, 109]: это важно для квалификации МРТ как прогностического биомаркера при метастазах. рак груди [17, 20, 21, 52].
Кроме того, WBMRI может играть роль в оценке висцеральных метастазов [62, 110], где WBMRI имеет лучшую чувствительность, чем PET-CT, для оценки небольших метастазов в печени и головном мозге (рис.7) [69, 89]. Также возрастает роль использования WBDWI для оценки терапевтического ответа метастатического заболевания костей на системную и таргетную терапию (рис. 8).
Рис. 7
Оценка активности костного заболевания при сканировании костей по сравнению с WB-MRI с диффузией. Сканирование костей ( a ), КТ ( b ) и WBMRI с диффузией ( c и d ) и T1-W ( e ) у 55-летней женщины с пост-лечением рака груди . Сканирование костей не показывает значительных отклонений от нормы ( a ), КТ показывает очаги склероза костей в тазу с видимым поражением в левой задней подвздошной кости ( b ).Поражения демонстрируют низкий сигнал на изображении T1-W ( e ) и высокий сигнал на DWI и промежуточном ADC в соответствии с заболеванием
Рис. 8
WBDWI при заболевании костей после химиотерапии. WB-MRI у 59-летней женщины с раком груди. 900 MIP до ( a ) и после ( b ) химиотерапии, а также карты b-900 и ADC до ( c и d ) и после ( e и f ) химиотерапии демонстрируют правильное Поражение 12-го ребра с высоким сигналом DWI и низким ADC при предварительном исследовании (белая стрелка d ) и полным ответом поражения после лечения ( e и f )
Перспективы на будущее
В настоящее время процессы Метастазы рака молочной железы были хорошо изучены на молекулярном уровне, и были обнаружены многочисленные биомаркеры агрессивности опухоли, которые готовы к тестированию в клиниках.Как мы уже обсуждали, молекулярная визуализация дает возможность изобразить специфические клеточные маркеры, имеющие отношение к агрессивности опухоли. Например, Harmon et al. [111] недавно провели перспективное сравнение 18 F-NaF PET-CT с 18 FN- [N — [(S) -1,3-дикарбоксипропил] карбамоил] -4-F-фторбензил-L- цистеин (DCFBC) ПЭТ-КТ у пациентов с раком простаты. Интересно, что это исследование, по-видимому, показывает, что такое поглощение индикатора зависит от течения заболевания и статуса лечения, что может указывать на функциональные различия в костных метастазах.Исследование показало, что 18 F-DCFBC ПЭТ-КТ выявляет значительно меньшее количество повреждений костей, особенно у пациентов с чувствительностью к кастратам. С другой стороны, при более поздних стадиях заболевания два радиоиндикатора хорошо согласовывались друг с другом. 18 F-DCFBC, однако, демонстрирует высокое поглощение пулом крови, и такой индикатор второго поколения может пролить больше функциональной информации о патофизиологии костных метастазов.
Хотя целевые зонды молекулярной визуализации для выявления инвазивности опухолей были разработаны для ПЭТ (т.е. протеазы, связанные с опухолевой инвазией, такие как специфические матриксные металлопротеиназы или катепсины, могут быть нацелены на « in vivo» с помощью ПЭТ), они еще не получили широкого распространения с МРТ [112]. Новые контрастные вещества для МРТ на основе наноматериалов оксида железа и дендримеров позволяют лучше охарактеризовать метастазы опухоли [112]. В частности, ультрамалые суперпарамагнитные частицы оксида железа (USPIO), полученные с помощью МРТ, не требуют ионизирующего излучения, но могут обнаруживать небольшие метастазы [113].Обоснование использования USPIO заключается в том, что после внутривенной инъекции наночастицы фагоцитируются циркулирующими макрофагами, которые затем попадают в интерстициальное пространство и поглощаются лимфатическими сосудами [114,115,116,117]. Поскольку оксид железа является суперпарамагнитным, он становится сильно магнитным в сильном магнитном поле МРТ, что приводит к дефазировке спина и эффектам восприимчивости, что приводит к потере сигнала. Следовательно, интенсивность сигнала заметно снижается в здоровых тканях из-за магнитной восприимчивости и эффектов сокращения T2WI частиц USPIO [114, 118].Напротив, в областях метастазов поглощение частиц USPIO намного меньше и, следовательно, эти части LN остаются неизменными в сигнале на T2WI через 24–48 часов после внутривенной инъекции USPIO [114,115,116,117]. Текущие ограничения использования USPIO включают сложность получения / интерпретации изображений и отсутствие самих одобренных USPIO, которые клинически доступны, что препятствует их принятию и более крупным исследованиям.
Органоспецифические контрастные вещества для МРТ также используются для выявления метастазов в печени.Суперпарамагнитные частицы оксида железа (SPIO) были одобрены для использования в клинической практике в качестве «отрицательного контрастного вещества» для нормальной паренхимы печени с целью визуализации доброкачественных и злокачественных опухолей печени [119]. Макромолекулярные контрастные вещества для МРТ на основе дендримеров, такие как дендримеры диаминобутана (DAB), которые отличаются от дендримеров полиамидоамина (PAMAM) тем, что они содержат чистый алифатический полиамин, гомогенно усиливают паренхиму печени и выводятся через печень и почки быстрее, чем аналог Дендример ПАМАМ схожего молекулярного размера [120].Кобаяши и др. смогли обнаружить небольшие метастатические поражения в печени от клеток рака толстой кишки с использованием дендримеров DAB [120]. Кроме того, этоксибензилдиэтилентриаминпентауксусная кислота гадолиния (Gd-EOB-DTPA) была разработана в качестве контрастного агента для печени путем небольшой модификации обычных хелатов на основе гадолиния. Поскольку Gd-EOB-DTPA поглощается гепатоцитами, нормальная паренхима печени может быть визуализирована по повышенной интенсивности сигнала на T 1WI, создавая положительное усиление контраста, где нормальная паренхима печени яркая на T1WI, а метастазы в печени показаны как очаги относительной гипоинтенсивности [121].
Наконец, гибридные методы визуализации, сочетающие WBMRI с 18 F-холиновый ПЭТ, недавно показали значительно более высокую чувствительность (93,5%) по сравнению с BS (63,6%) и WBMRI самостоятельно (72,7%) [122 ]. Результаты многообещающие, но из-за ограниченного доступа к ПЭТ-МРТ и ее высокой стоимости требуется определенная роль ПЭТ и новые передовые гибридные методы визуализации [113]. Стратификация пациентов в соответствии с течением болезни и статусом лечения может оказаться полезным в будущем.Тем не менее, гибридная роль функциональной визуализации, предоставляемой биомаркерами, с анатомическими деталями, предоставляемыми методами визуализации, даст ценную информацию о статусе заболевания.


 Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам.
Если на начальных этапах распространение онкоклеток происходит через лимфатическую систему, то к 4 стадии этот путь оказывается полностью пройден и метастазы через грудной проток начинают движение по кровеносным сосудам.
 Кожные метастазы при раке легкого: анализ 10-летнего опыта. Компания Oncol Rep . 2001; 8 (1): 57-61.
Кожные метастазы при раке легкого: анализ 10-летнего опыта. Компания Oncol Rep . 2001; 8 (1): 57-61. . 2011; 26 (2): 207-209. DOI: 10.3904 / kjim.2011.26.2.207.
. 2011; 26 (2): 207-209. DOI: 10.3904 / kjim.2011.26.2.207.