| 22. Клиническая лабораторная диагностика | ||
|---|---|---|
| 22.01 | Общий (клинический) анализ крови | 400 |
| 22.02 | Общий (клинический) анализ крови развернутый (5-diff) | 500 |
| 22.02.1 | Общий (клинический) анализ крови развернутый + микроскопия (5-diff) | 700 |
| 22.03 | Определение основных групп крови (А,В,0) и резус
-принадлежности | 400 |
| 22.04 | Аллоиммунные антитела (включая антитела к
Rh-антигену) | 400 |
| 22.05 | Общий (клинический анализ крови развернутый (5-diff) + подсчет числа тромбоцитов (по Фонио) | 600 |
| 22.06 | Длительность кровотечения по Дьюку | 100 |
| 22.07 | Свертываемость крови по Сухареву | 100 |
| 22.08 | Общий (клинический) анализ мочи | 300 |
| 22.09 | Общий анализ мочи (без микроскопии осадка) | 250 |
| 22.09.1 | Анализ мочи по Зимницкому | 700 |
| 22.09.2 | Трехстаканная проба мочи | 600 |
| 22.10 | Анализ мочи по Нечипоренко | 200 |
| 22.11 | Анализ эякулята с фоторегистрацией и MAR-тестом
(Спермограмма) | 1 800 |
| 22.13 | Антиспермальные антитела IgG в сперме (прямой
MAR-тест) | 800 |
| 22.14 | Определение фрагментации ДНК сперматозоидов | 5 400 |
22. 15 15 | Посткоитальный тест | 500 |
| 22.16 | Микроскопическое исследование осадка секрета простаты | 300 |
| 22.18 | Микроскопическое исследование на грибковые заболевания (кожа, ногти, волосы) | 300 |
| 22.19 | Микроскопическое исследование на демодекоз | 300 |
| 22.19.1 | Микроскопическое исследование соскоба пораженной кожи (выявление чесоточного клеща/ Sarcoptes scabiei) | 300 |
| 22.20 | Соскоб урогенитальный на флору | 350 |
| 22.22 | Системная красная волчанка. Определение LE-клеток (микроскопия) | 400 |
| 22.23 | Цитологическое исследование биоматериала | 500 |
| 22.24 | Цитологическое исследование соскоба шейки матки и
цервикального канала | 500 |
| 22.25 | Цитологическое исследование пунктата молочной железы (1
образование) | 1 000 |
| 22.26 | Цитологическое исследование отделяемого молочных желез
(мазок-отпечаток) | 500 |
| 22.27 | Цитологическое исследование пунктата молочной железы (2 и
более образований) | 3 000 |
| 22.28 | Гистологическое исследование (1 элемент) | 1 400 |
| 22.29 | Исследование на уреамикоплазмы с определением чувствительности к антибиотикам | 1 550 |
| 22.29.1 | Исследование на уреаплазму (Ureaplasma urealyticum) с определением чувствительности к антибиотикам | 750 |
22. 29.2 29.2 | Исследование на микоплазму (Mycoplasma hominis) с определением чувствительности к антибиотикам | 750 |
| 22.30 | Бактериологическое исследование на микрофлору | 1 150 |
| 22.31 | Бактериологическое исследование отделяемого половых органов | 1 150 |
| 22.32 | Бактериологическое исследование мочи | 1 150 |
| 22.33 | Соскоб со слизистой носа на эозинофилы (нозограмма) | 200 |
| 22.34 | Соскоб на яйца гельминтов/энтеробиоз | 300 |
| 22.35 | Исследование кала на яйца гельминтов и простейшие | 350 |
| 22.36 | Копрологическое исследование | 1 000 |
| 22.37 | Бактериологическое исследование секрета простаты/эякулята с определением чувствительности к антимикробным препаратам | 2 560 |
| 22.38 | Посев отделяемого из уха на микрофлору, определение чувствительности к антимикробным препаратам и бактериофагам (Eye Culture, Routine. Bacteria Identification. Antibiotic Susceptibility and Bacteriophage Efficiency testing) | 1 600 |
| 22.39 | Исследование уровня ретикулоцитов в крови | 195 |
| 22.40 | Исследование уровня эозинофильного катионного белка в крови | 675 |
| 23. ПЦР-диагностика показать | ||
| 23.01 | ПЦР-диагностика хламидии трахоматис (в соскобе) | 265 |
| 23.02 | ПЦР-диагностика хламидии трахоматис (в синовиальной
жидкости) | 380 |
23. 03 03 | ПЦР-диагностика уреаплазмы уреалитикум + парвум (в
соскобе) | 265 |
| 23.04 | ПЦР-диагностика микоплазмы хоминис (в соскобе) | 265 |
| 23.05 | ПЦР-диагностика микоплазмы гениталиум (в соскобе) | 265 |
| 23.06 | ПЦР-диагностика гонококка (в соскобе) | 265 |
| 23.07 | ПЦР-диагностика гонококка (в синовиальной жидкости) | 380 |
| 23.08 | ПЦР-диагностика вируса герпеса 1,2 типа (в соскобе) | 265 |
| 23.09 | ПЦР-диагностика вируса герпеса 6 типа в крови | 500 |
| 23.10 | ПЦР-диагностика вируса герпеса 6 типа в крови
(количественно) | 980 |
| 23.11 | ПЦР-диагностика цитомегаловируса (в соскобе) | 265 |
| 23.12 | ПЦР-диагностика трихомонады (в соскобе) | 265 |
| 23.13 | ПЦР-диагностика гарднереллы (в соскобе) | 265 |
| 23.14 | ПЦР-диагностика кандиды (в соскобе) | 265 |
| 23.15 | ПЦР-диагностика кандиды (в синовиальной жидкости) | 380 |
| 23.16 | ПЦР-диагностика кандиды — типирование (Candida
albicans/glabrata/krusei) | 610 |
23. 16.1 16.1 | Выявление и типирование возбудителей грибковых инфекций рода Candida,Malassezia, Saccharomyces b Debaryomyces (Микозоскрин) | 1 500 |
| 23.17 | ПЦР-диагностика папилломавируса 16 тип (в соскобе) | 300 |
| 23.18 | ПЦР-диагностика папилломавируса 18 тип (в соскобе) | 300 |
| 23.19 | ПЦР-диагностика папилломавирусной инфекции 16,18 тип
(количественно) | 700 |
| 23.20 | ПЦР-диагностика папилломавируса 6, 11 типы (в
соскобе) | 350 |
| 23.21 | ПЦР-диагностика папилломавирусов (КВАНТ-21) | 1 500 |
| 23.21.1 | ПЦР-диагностика ВПЧ (вирус папилломы человека,HPV) скрининг 15 типов:
16,18,31,33,35,39,45,51,52,56,58,59,6,11,68) | 650 |
| 23.21.2 | ПЦР-диагностика ВПЧ (вирус папилломы человека, НРV) скрининг 14 + определение интегрированных форм вируса | 900 |
| 23.22 | ПЦР-диагностика 1 инфекции в крови | 500 |
| 23.23 | ПЦР-диагностика 1 инфекции в эякуляте | 500 |
| 23.24 | ПЦР-диагностика биоценоза урогенитального тракта
(ФЕМОФЛОР 16) | 2 500 |
| 23.24.1 | Исследование микрофолоры урогенитального тракта женщин (ФЕМОФЛОР Скрин) | 1 800 |
23. 25 25 | ПЦР-диагностика биоценоза урогенитального тракта
(Андрофлор) | 3 000 |
| 23.25.1 | Исследование микрофлоры урогенитального тракта мужчин (Андрофлор Скрин) | 1 800 |
| 23.25.2 | Исследование микрофлоры урогенитального тракта мужчин — Вирафлор-А (АФ скрин +Квант 15) | 2 500 |
| 23.25.3 | Исследование микрофолоры урогенитального тракта женщин — Вирафлор-Ф (ФФ скрин +Квант 15) | 2 500 |
| 23.26 | Определение ДНК вируса гепатита B (Hepatitis B virus) в
крови методом ПЦР, качественное исследование | 700 |
| 23.27 | ПЦР-диагностика гепатита В (количественно) | 3 000 |
| 23.28 | Определение РНК вируса гепатита C (Hepatitis C virus) в
крови методом ПЦР, качественное исследование | 700 |
| 23.29 | Определение генотипа вируса гепатита C (Hepatitis C
virus) | 800 |
| 23.30 | ПЦР-диагностика гепатита С (количественно ) | 3 000 |
| 23.31 | ПЦР-диагностика гепатита D (качественно) | 550 |
| 23.32 | ПЦР-диагностика гепатита D+В (качественно) | 1 000 |
| 23.33 | ПЦР-диагностика ротавируса,норовируса, астровируса
(качественно) | 1 000 |
23. 33.1 33.1 | ПЦР-диагностика норовирусов 1,2 геногруппы (кал) | 800 |
| 23.33.2 | ПЦР-диагностика ротавируса, норовируса, астровируса, энтеровируса (качественно) | 1 200 |
| 23.34 | ПЦР-диагностика хеликобактера пилори (кал) | 600 |
| 23.35 | ПЦР-диагностика энтеровируса (кал) | 439 |
| 23.36 | ПЦР-диагностика энтеровируса (зев, нос) | 1 000 |
| 23.37 | ПЦР-диагностика ОКИ (острые кишечные инфекции)
Аденовирусы группы F, Ротавирусы группы А, Норовирусы 2 генотипа, Астровирусы, Энтеровирус, - Шигелла, Энтероинвазивные E. coli, Сальмонелла, Термофильные Кампилобактерии (кал) | 1 500 |
| 23.38 | ПЦР-диагностика вируса герпеса 4 типа (Эпштейна -Барр) | 350 |
| 23.39 | ПЦР-диагностика вируса герпеса 4 типа (Эпштейна -Барр) в
крови, качественное исследование | 500 |
| 23.40 | ПЦР-диагностика вируса герпеса 4 типа (Эпштейна -Барр) в
крови (количественно) | 980 |
| 23.41 | ПЦР-диагностика мононуклеоза (Вирус Эпштейна-Барр/
Цитомегаловирус/ Вирус герпеса 6 типа) (качественно) | 740 |
| 23.42 | ПЦР-диагностика мононуклеоза (Вирус Эпштейна-Барр/
Цитомегаловирус/ Вирус герпеса 6 типа) (количественно) | 1 330 |
23. 43 43 | ПЦР-диагностика токсоплазмы (кровь) | 500 |
| 23.44 | ПЦР-диагностика вируса краснухи (кровь) | 500 |
| 23.46 | ПЦР-диагностика вирусов гриппа А+В (Influenza А-В) | 1500 |
| 23.47 | ПЦР-диагностика ОРВИ-скрин (респираторно-синцитиальный вирус, метапневмовирус, вирус парагриппа 1,2,3,4, коронавирусы, риновирусы, аденовирусы В,С,Е, бокавирусы) | 1600 |
| 23.48 | ПЦР-диагностика вируса гриппа A h2N1 (свиной), h4N2 (Гонконг) | 1000 |
| 23.49 | ПЦР-диагностика хламидия пневмония (Chlamydophila pneumoniae) | 480 |
| 23.50 | ПЦР-диагностика вируса герпеса 3 типа (ветряная оспы и опоясывающий лишай) (Varicella-Zoster Virus) | 350 |
| 23.51 | Генетика тромбофилии (8 генов) с описанием | 3 600 |
| 23.52 | Генетика тромбофилии (2 гена) (для контрацепции) с
описанием | 2 300 |
| 23.53 | ПЦР-диагностика микоплазма пневмония (Mycoplasma pneumoniae) | 480 |
| 23.55 | Генетика нарушения обмена фолатов с описанием | 3 100 |
| 23.57 | Генетика тромбофилии, обмен фолатов с описанием | 5 600 |
| 23.59 | Генетическая предрасположенность к развитию рака молочной
железы и яичников (BRCA-1, BRCA-2) с описанием | 3 980 |
23. 61 61 | Генетический фактор мужского бесплодия (AZF) с
описанием | 3 980 |
| 23.62 | Типирование генов системы HLAII класса (DQB1 -
репродуктивные проблемы) 12 показателей | 3 080 |
| 23.62.1 | Типирование генов системы HLA II класса. Полная панель. Локусы DRB1, DQA1, DQB1. | 4 300 |
| 23.62.2 | Типирование генов системы HLA II класса. (DRB1 — трансплантация органов и тканей) 13 показателей. | 2 000 |
| 23.62.3 | Типирование генов системы HLA II класса. (DQA1 — риск развития сахарного диабета I типа) 8 показателей. | 2 000 |
| 23.64 | Кардиогенетика гипертонии (полная панель) с описанием | 3 960 |
| 23.65 | Описание результатов генетических исследований врачом-генетиком | 600 |
| 23.66 | ПЦР-диагностика золотистого стафилококка. Качественно, количественно и выявление метициллин-чувствительного Staphylococcus aureus. | 600 |
| 23.67 | ПЦР-диагностика возбудителей коклюша (Bordetella pertussis), паракоклюша (Bordetella parapertussis) и бронхисептикоза (Bordetella bronchiseptica) | 600 |
| 23.68 | ПЦР-диагностика коронавируса (SAR.S-CoV-2) (качественное определение) | 2 000 |
| 23.69 | ПЦР-диагностика коронавируса (SARS-CoV-2) (качественное определение) с выездом для забора биоматериала | 2 250 |
23. 70 70 | ПЦР-диагностика коронавируса (SARS-CoV-2) (качественное определение) (результат на английском языке) | 2 200 |
| 24. ИФА-диагностика показать | ||
| 24.01 | Экспресс-анализ крови на ВИЧ | 330 |
| 24.03 | Экспресс-анализ крови на сифилис | 330 |
| 24.04.1 | Сифилис РПГА (реакция пассивной гемагглютинации), качественно | 330 |
| 24.04.2 | Сифилис РПГА (реакция пассивной гемагглютинации), количественно (титр) | 660 |
| 24.05 | Экспресс-анализ крови на гепатит В | 330 |
| 24.08 | Экспресс-анализ крови на гепатит С | 330 |
| 24.10 | Исследование уровня 25-OH витамина Д в крови | 1 600 |
| 24.10.1 | Исследование уровня фолиевой кислоты (Folic Acid) в крови | 770 |
| 24.10.2 | Исследование уровня витамина В12 (цианокобаламин) в крови | 615 |
| 24.11 | Исследование уровня тиреотропного гормона (ТТГ) в
крови | 450 |
| 24.12 | Исследование уровня свободного тироксина (Т4) сыворотки
крови | 450 |
| 24.13 | Исследование уровня общего трийодтиронина (Т3) в
крови | 300 |
24. 14 14 | Исследование уровня антител к тиреоидной пероксидазе
(АТ-ТПО) в крови | 450 |
| 24.15 | Исследование уровня антител к рецептору тиреотропного
гормона (ТТГ) в крови | 1 200 |
| 24.16 | Исследование уровня антител к тиреоглобулину (АТ-ТГ) в
крови | 360 |
| 24.16.1 | Исследование уровня Тиреоглубина (Тиреоглобулин; Thyroglobulin, TG) | 550 |
| 24.17 | Исследование уровня адренокортикотропного (АКТГ) гормона
в крови | 570 |
| 24.17.1 | Исследование уровня соматотропного гормона в крови (соматотропин, СТГ) | 350 |
| 24.18 | Исследование уровня лютеинизирующего гормона (ЛГ) в
сыворотке крови | 450 |
| 24.19 | Исследование уровня фолликулостимулирующего гормона (ФСГ)
в сыворотке крови | 450 |
| 24.20 | Исследование уровня пролактина в крови | 450 |
| 24.21 | Исследование уровня общего кортизола в крови | 450 |
| 24.22 | Исследование уровня прогестерона в крови | 450 |
| 24.23 | Исследование уровня эстрадиола в крови | 650 |
| 24.25 | Исследование уровня хорионического гонадотропина
(бета-ХГЧ) в крови (срок выполнения 1 день) | 500 |
24. 26 26 | Исследование уровня паратиреоидного гормона в крови | 500 |
| 24.27 | Исследование уровня ферритина в крови | 500 |
| 24.28 | Исследование уровня общего тестостерона в крови | 450 |
| 24.28.1 | Исследование уровня свободного тестостерона в крови | 800 |
| 24.28.2 | Исследование уровня дигидротестостерона (Dihydrotestosterone) в крови | 1 100 |
| 24.29 | Исследование уровня глобулина, связывающего половые
гормоны (ССГ), в крови | 650 |
| 24.30 | Исследование уровня гормона
ДГЭА-С(дегидроэпиандростерон-сульфат) | 450 |
| 24.31 | Исследование уровня 17-гидроксипрогестерона (17-OH
прогестерон) в крови | 500 |
| 24.32 | Определение уровня антимюллерова гормона в крови | 1 200 |
| 24.33 | Исследование уровня Ингибина В, в крови | 1 000 |
| 24.34 | Исследование уровня C-пептида в крови | 600 |
| 24.35 | Исследование уровня инсулина крови | 600 |
| 24.36 | Определение антител класса M (IgM) к вирусу краснухи
(Rubella virus) в крови | 400 |
24. 37 37 | Определение антител класса G (IgG) к вирусу краснухи
(Rubella virus) в крови | 400 |
| 24.38 | Определение антител класса M (IgM) к токсоплазме
(Toxoplasma gondii) в крови | 400 |
| 24.39 | Определение антител класса G (IgG) к токсоплазме
(Toxoplasma gondii) в крови | 400 |
| 24.40 | Определение антител класса M (IgM) к вирусу простого
герпеса в крови | 400 |
| 24.41 | Определение антител класса G (IgG) к вирусу простого
герпеса в крови | 400 |
| 24.42 | Определение антител класса M (IgM) к цитомегаловирусу
(Cytomegalovirus) в крови | 400 |
| 24.43 | Определение антител класса G (IgG) к цитомегаловирусу
(Cytomegalovirus) в крови | 400 |
| 24.44 | Определение антител класса G (IgG) к возбудителю
описторхоза (Opisthorchis felineus) в крови | 400 |
| 24.48 | Определение антител класса G (Ig G) к антигенам
токсокар | 410 |
| 24.49 | Определение антител класса G (Ig G) к аскаридам | 760 |
| 24.50 | Определение антител к возбудителю брюшного тифа
Salmonella typhi (РПГА) | 470 |
| 24.51 | Определение суммарных антител (IgА, IgМ, Ig G) к антигену
CagA Helicobacter pilori | 580 |
24. 52 52 | Определение суммарных антител ( IgА, IgM, IgG) к антигену лямблий | 490 |
| 24.53 | Системная красная волчанка. Антитела ( IgG) к
двуспиральной (нативной) ДНК | 470 |
| 24.54 | Исследование уровня общего иммуноглобулина E в крови | 450 |
| 24.55 | Аллергопанель №1 – Смешанная (IgE к 20 респираторным и
пищевым аллергенам) | 4 000 |
| 24.56 | Аллергопанель №2 — Респираторная (IgE к 20 респираторным
аллергенам) | 4 000 |
| 24.57 | Аллергопанель №3 — Пищевая (IgE к 20 пищевым
аллергенам) | 4 000 |
| 24.58 | Аллергопанель №4 — Педиатрическая (IgE к 20
«педиатрическим» аллергенам) | 4 000 |
| 24.59 | Экспресс-анализ кала на скрытую кровь | 300 |
| 24.60 | Исследование уровня простатспецифического (ПСА) антигена
общего в крови | 450 |
| 24.61 | Экспресс-анализ крови на общий ПСА (простат-специфический
антиген) | 330 |
| 24.62 | Исследование уровня антигена плоскоклеточной карциномы (SCC) | 1 900 |
| 24.63 | Исследование уровня РЭА (раково-эмбриональный
антиген) | 510 |
24. 64 64 | Исследование уровня опухолеассоциированного маркера CA
15-3 в крови (углеводный антиген рака молочной железы) | 560 |
| 24.65 | Исследование уровня антигена аденогенных раков CA 19-9 в
крови | 510 |
| 24.66 | Исследование уровня антигена аденогенных раков CA 125 в
крови | 550 |
| 24.67 | Определение антифосфолипидного синдрома
(Бета-2-гликопротеин, Суммарная фракция фосфолипидов, ХГЧ, Ревматоидный фактор, Двуспиральная ДНК, Коллаген), полуколичественно | 3 500 |
| 24.69 | Исследование уровня Кальцитонина (Calcitonin) | 850 |
| 24.70 | Определение антител к циклическому цитруллинированному пептиду (АЦЦП) | 1 000 |
| 24.71 | Исследование уровня АФП (Альфа-фетопротеин) | 310 |
| 24.72 | Диагностика целиакии (Антитела к тканевой трансглутаминазе IgG: IgA) | 1 500 |
| 24.73 | Определение антител класса М (IgM) к коронавирусу (SARS-CoV, IgM) в крови | 750 |
| 24.74 | Определение антител класса G (IgG) к коронавирусу (SARS-CoV, IgG) в крови | 750 |
| 24.75 | Определение суммарных антител (IgM+IgG) к коронавирусу (SARS-CoV-2, IgM+IgG) в крови | 1 350 |
| 25. Биохимические исследования показать | ||
25. 01 01 | Исследование уровня глюкозы в крови | 150 |
| 25.02 | Глюкозотолерантный тест с определением глюкозы натощак и после нагрузки через 2 часа (включая взятие
биоматериала) | 600 |
| 25.03 | Глюкозотолерантный тест при беременности (включая взятие
биоматериала) | 750 |
| 25.04 | Исследование уровня гликированного гемоглобина в
крови | 450 |
| 25.05 | НОМА Оценка инсулинорезистентности: глюкоза (натощак),
инсулин (натощак), расчет индекса HOMA-IR | 700 |
| 25.06 | Проба Реберга (клиренс эндогенного креатинина, скорость
клубочковой фильтрации) (кровь,моча) | 300 |
| 25.07 | Исследование уровня общего билирубина в крови | 150 |
| 25.08 | Исследование уровня билирубина связанного
(конъюгированного) в крови | 150 |
| 25.09 | Определение активности аспартатаминотрансферазы (АСТ) в
крови | 150 |
| 25.10 | Определение активности аланинаминотрансферазы (АЛТ) в
крови | 150 |
| 25.11 | Определение активности гамма-глютамилтрансферазы (ГГТ) в
крови | 150 |
| 25.12 | Исследование уровня лактатдегидрогеназы (ЛДГ) в крови | 150 |
25. 13 13 | Исследование уровня С-реактивного белка (СРБ) | 300 |
| 25.14 | Исследование уровня гомоцистеина в крови | 1 100 |
| 25.15 | Исследование уровня общего белка в крови | 150 |
| 25.16 | Суточная потеря белка в моче | 160 |
| 25.17 | Исследование уровня альбумина в крови | 150 |
| 25.18 | Исследование уровня микроальбумина в моче | 250 |
| 25.19 | Исследование уровня мочевины в крови | 150 |
| 25.20 | Исследование уровня креатинина в крови | 150 |
| 25.21 | Исследование уровня холестерина в крови | 150 |
| 25.22 | Исследование уровня холестерина липопротеинов низкой
плотности (ЛПНП) | 250 |
| 25.23 | Исследование уровня холестерина липопротеинов высокой
плотности в крови (ЛПВП) | 250 |
| 25.24 | Исследование уровня липопротеинов в крови
(триглицериды) | 200 |
| 25.25 | Липидограмма (холестерин, ЛПВП, ЛПНП, триглицериды,
коэффициент атерогенности) | 800 |
| 25.26 | Исследование уровня общего магния в крови | 180 |
25. 27 27 | Исследование уровня неорганического фосфора в крови | 150 |
| 25.28 | Исследование уровня общего кальция в крови | 150 |
| 25.29 | Исследование уровня кальция в суточной моче | 160 |
| 25.30 | Исследование уровня железа сыворотки крови | 200 |
| 25.30.1 | Исследование уровня меди (Cu) сыворотки крови | 240 |
| 25.30.2 | Исследование уровня цинка (Zn) сыворотки крови | 240 |
| 25.31 | Исследование железосвязывающей способности в крови | 350 |
| 25.32 | Исследование уровня трансферрина в крови | 400 |
| 25.33 | Электролиты (К, Na,Ca, Cl) | 500 |
| 25.34 | Исследование уровня амилазы в крови | 150 |
| 25.35 | Исследование уровня мочевой кислоты в крови | 150 |
| 25.36 | Исследование уровня мочевой кислоты в моче | 150 |
| 25.37 | Исследование уровня АСЛО в крови (антистрептолизин О,
полуколичественно) | 250 |
| 25.38 | Исследование уровня ревматоидного фактора
(полуколичественно) | 250 |
25. 39 39 | Исследование уровня изоферментов креатинкиназы в
крови(Креатинфосфокиназа КФК) | 190 |
| 25.40 | Исследование уровня изоферментов креатинкиназы в крови
(Креатинфосфокиназа КФК -МВ) | 250 |
| 25.40.1 | Исследование уровня маркеров: Миоглобин/Креатинкиназа МВ/Тропонин-I | 850 |
| 25.41 | Исследование уровня иммуноглобулина G в крови | 200 |
| 25.42 | Исследование уровня щелочной фосфатазы в крови | 150 |
| 25.43 | Исследование уровня простатической кислой фосфатазы в
крови | 160 |
| 26. Коагулологические исследования(оценка системы гемостаза)показать | ||
| 26.01 | Активированное частичное тромбопластиновое время | 200 |
| 26.02 | Протромбиновый комплекс по Квику(протромбиновое время,
ПТИ, МНО) | 200 |
| 26.03 | Исследование уровня фибриногена в крови (по Клауссу) | 200 |
| 26.04 | Определение тромбинового времени в крови | 200 |
| 26.05 | Определение концентрации Д-димера в крови | 900 |
| 26.06 | Определение активности антитромбина III в крови | 300 |
Вирусный гепатит С (HCV), количественный
Вирусный гепатит С (HCV), количественный
Вирусный гепатит С (HCV), количественный-исследование для выявления возбудителя гепатита C (HCV), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется наличие генетического материала (РНК) вируса и его количество (вирусная нагрузка) в образце крови. Вирус гепатита С (HCV) – РНК-содержащий вирус из семейства Flaviviridae, который поражает печень. Он способен размножаться в клетках крови (нейтрофилах, моноцитах и макрофагах, В-лимфоцитах) и вызывать криоглобулинемию, болезнь Шегрена и В-клеточные лимфопролиферативные заболевания. HCV благодаря высокой мутационной активности способен избегать воздействия защитных механизмов иммунной системы. Существует 6 генотипов и множество субтипов вируса, которые имеют разные значения для прогноза развития заболевания и эффективности противовирусной терапии. Выявление РНК HCV свидетельствует о размножении вируса в организме и является методом диагностики заболевания. Генетический материал вируса можно обнаружить с помощью ПЦР через 10-12 дней после инфицирования – в этот период специфические антитела, которые образуются через несколько месяцев после заражения, отсутствуют и биохимические показатели функции печени находятся в пределах референсных значений.
Вирус гепатита С (HCV) – РНК-содержащий вирус из семейства Flaviviridae, который поражает печень. Он способен размножаться в клетках крови (нейтрофилах, моноцитах и макрофагах, В-лимфоцитах) и вызывать криоглобулинемию, болезнь Шегрена и В-клеточные лимфопролиферативные заболевания. HCV благодаря высокой мутационной активности способен избегать воздействия защитных механизмов иммунной системы. Существует 6 генотипов и множество субтипов вируса, которые имеют разные значения для прогноза развития заболевания и эффективности противовирусной терапии. Выявление РНК HCV свидетельствует о размножении вируса в организме и является методом диагностики заболевания. Генетический материал вируса можно обнаружить с помощью ПЦР через 10-12 дней после инфицирования – в этот период специфические антитела, которые образуются через несколько месяцев после заражения, отсутствуют и биохимические показатели функции печени находятся в пределах референсных значений.
Посредством ПЦР выявляют РНК вируса качественно или количественно. Благодаря качественному методу подтверждается присутствие вируса гепатита С и его активное размножение. Количественное определение вирусной нагрузки с учетом генотипа HCV позволяет контролировать проводимую терапию и прогнозировать течение болезни.
Эффективность лечения оценивается по количеству РНК до и во время терапии. Обычно вирусная нагрузка крови снижается в несколько раз за первые три месяца успешного лечения. При эффективной терапии виремия уменьшается на два порядка в первые 4-12 недель лечения и после окончания курса терапии генетический материал вируса в крови не обнаруживается. Отсутствие снижения виремии через 12 недель с начала лечения указывает на его неэффективность. Рекомендовано проводить анализ до начала терапии, на 4-й, 12-й и 24-й неделях лечения и через 24 недели после окончания курса. Длительность терапии и периодичность количественного определения РНК вируса гепатита С зависит от генотипа вируса и степени повреждения печени. 7 МЕ/мл).
7 МЕ/мл).
На результаты могут влиять
загрязнение биоматериала;
наличие в образце ингибиторов – химических и белковых субстанций, влияющих на различные компоненты ПЦР;
присутствие в крови гепарина.
Уровень вирусной нагрузки крови не указывает на степень повреждения печени и тяжесть заболевания. Для их оценки необходимо исследовать биохимические показатели и материалы биопсии.
При планировании лечения очень важно определить генотип вируса гепатита С.
Назначается в комплексе с
Anti-HCV, антитела
HCV – подтверждающий тест (антитела к структурным и неструктурным белкам вируса гепатита)
HCV, РНК [качетсвенный ПЦР]
HCV, генотипирование, РНК [ПЦР]
Биохимический анализ крови при заболеваниях ЖКТ
Коагулограмма базовая
Высокая вирусная нагрузка при гепатите С — ГепаГид
Поделиться статьей
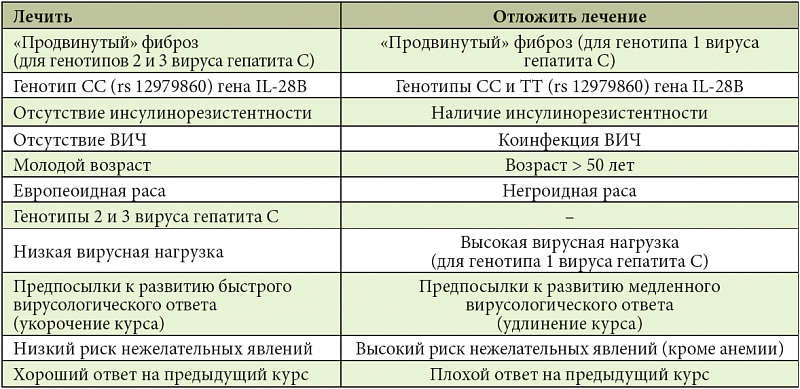
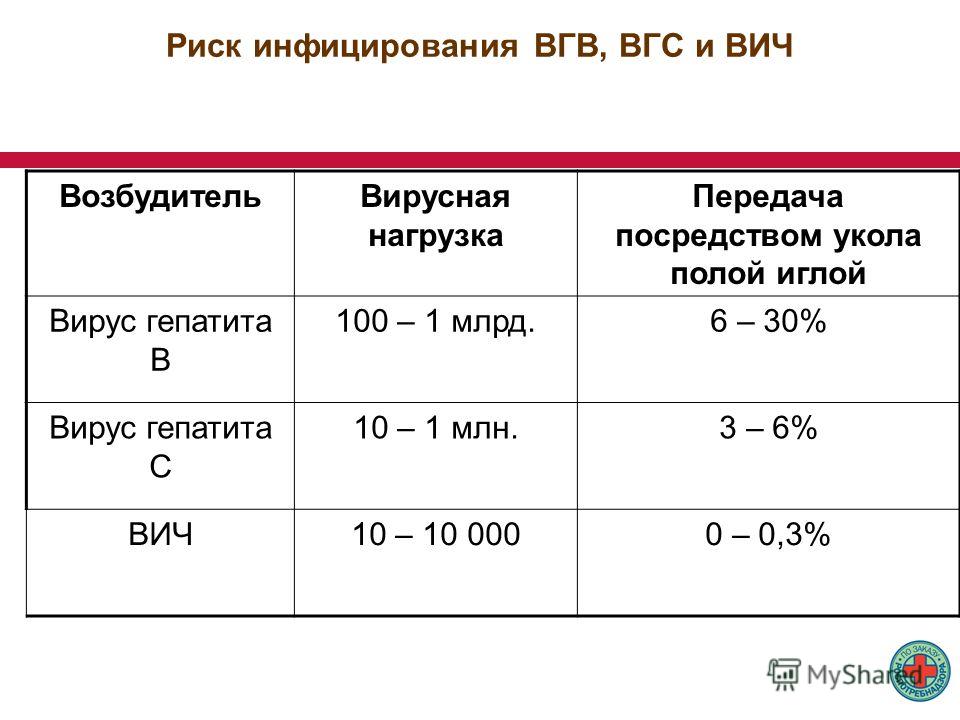
Вирусная нагрузка – это количество возбудителя инфекции в крови у пациента. Если говорить о гепатите С, то под вирусной нагрузкой имеется в виду общее число вирусной РНК самого вируса в венозной крови пациента. Определение количества вируса у больного является обязательной и очень важной процедурой, потому что в зависимости от количества вирусной РНК в крови гепатолог составляет лечение и подбирает препараты.
Когда пациенту ставят диагноз «вирусный гепатит С», ему необходимо пройти еще несколько проверок, чтобы выявить генотип заболевания и, соответственно, вирусную нагрузку. Как правило, оба эти показателя выявляются при помощи ПЦР-диагностики. Вирусная нагрузка оказывает влияние на течение заболевания, на его агрессивность и даже определяет дальнейший прогноз лечения. Высокая вирусная нагрузка показывает, что вирус содержится в крови в большом количестве. При этом значительно возрастает угроза возникновения фиброза печени высокой степени. В целом, высокая вирусная нагрузка является отрицательным показателем, негативно влияющим на прогноз лечения и значительно увеличивающим его продолжительность.
В целом, высокая вирусная нагрузка является отрицательным показателем, негативно влияющим на прогноз лечения и значительно увеличивающим его продолжительность.
Низкая вирусная нагрузка, наоборот, является хорошим прогнозом для пациентов, так как чем меньше вируса содержится в крови, тем легче и быстрее сможет выздороветь больной.
Уровень вирусной нагрузки необходимо постоянно отслеживать и контролировать, особенно во время лечения. Если в процессе терапии не наблюдается никаких изменений в уровне содержания гепатита С в крови, это говорит о том, что лечение не действует и его нужно изменить полностью, либо внести какие-то коррективы.
Самым эффективным способом определения количества вирусной РНК в крови человека является ПЦР-диагностика. При помощи данной методики можно выявить вирусный гепатит С даже при минимальном содержании возбудителя в крови. Методика ПЦР включает в себя три разных обследования, на определение вирусной нагрузки направлен качественный анализ. Если пациент не заражен, его результат: «не обнаружен», однако может быть и результат «ниже диапазона измерений» в том случае, когда вирусная РНК была найдена, но ее точное количество установить не удалось.
Расшифровкой результатов анализа занимается непосредственно лечащий врач. Как правило, результаты представлены на бланке в виде таблицы с указанными значениями по каждому показателю. Высокой вирусной нагрузкой считается более 800 000 МЕ/мл, а низкой вирусной нагрузкой принято считать до 400 000 МЕ/мл. При высокой вирусной нагрузке существует большая вероятность развития опасных заболеваний печени – цирроза, рака, поэтому начинать лечение необходимо как можно скорее. Если во время лечения не наблюдается снижение уровня РНК в крови, следует приостановить терапию, повторно сдать анализы и разрабатывать курс лечения, исходя из новых результатов.
Определение вирусной нагрузки у пациента играет очень важную роль. В случае, когда она минимальная, с лечением можно повременить, если, к примеру, у пациента нет возможности или желания лечиться. Что касается высокой вирусной нагрузки, то ее нужно лечить сразу, потому что вирус, присутствуя в организме в большем количестве, в несколько раз быстрее воздействует на клетки и ткани печени, провоцируя развитие различных патологий, которые в итоге могут стать причиной летального исхода у пациента.
В случае, когда она минимальная, с лечением можно повременить, если, к примеру, у пациента нет возможности или желания лечиться. Что касается высокой вирусной нагрузки, то ее нужно лечить сразу, потому что вирус, присутствуя в организме в большем количестве, в несколько раз быстрее воздействует на клетки и ткани печени, провоцируя развитие различных патологий, которые в итоге могут стать причиной летального исхода у пациента.
Влияние генотипа вируса гепатита с на уровень вирусной нагрузки и клинико-лабораторные особенности поражения печени Текст научной статьи по специальности «Клиническая медицина»
n
IT
U 5
Ef H
< I
s -c S d
ID т
x >
£ I
ВИРУСНОЙ НАГРУЗКИ И КЛИНИКО-ЛАБОРАТОРНЫЕ а
Ш 2 > Q.
Шулятьев И. С., Борунова Ж. В., Шапошникова Н. Н., Носкова К. К., Дроздов В. Н. ¡J
ГУ Центральный научно-исследовательский институт гастроэнтерологии ДЗ г. Москвы jj
Б
Шулятьев Илья Сергеевич |£
111123, Москва, шоссе Энтузиастов, д. 86
Тел.: 8 (495) 304 0070 £
E-mail: [email protected]
ш
г
ВЛИЯНИЕ ГЕНОТИПА ВИРУСА ГЕПАТИТА С НА УРОВЕНЬ ВИРУСНОЙ НАГРУЗКИ И КЛИНИКО-ЛА ОСОБЕННОСТИ ПОРАЖЕНИЯ ПЕЧЕНИ
РЕЗЮМЕ
Цель — изучить влияние генотипа ИСУ на клинические особенности течения хронического гепатита и цирроза печени.
Материал и методы. Было обследовано на наличие вируса гепатита С 9715 больных, находящихся на лечение в гастроэнтерологическом стационаре, у 365 больных обнаружена РНК вируса гепатита С. Генотипирование было выполнено 210 больным. Количественный анализ 193 больным. Определялись биохимические маркеры цитолитического синдрома (АЛТ, АСТ), холестаза (ЩФ, билирубин), активность ГГТП в крови больных.
Результаты и обсуждение. Частота вирусной инфекции, подтвержденной данными ПЦР-анализа у этой группы больных, составляет 3,7% (3,3 — 4,195% ДИ). Встречаемость генотипов вируса гепатита С составляет для 1-го генотипа 61,4% (54,7 — 68,1; 95% ДИ), для 2-го генотипа — 10,9% (6,7 — 15,2; 95% ДИ) и 3-го генотипа — у 27,6% (21,5 — 33,7; 95% ДИ). Вирусная нагрузка достоверно выше (р < 0,05) отмечалась при 3-м типе ВГС и составляла 8,08 ± 15,6 млн МЕ, по сравнению с больными с 1-м и 2-м генотипом: 4,5 ± 11,3 и 3,7 ± 10,3 млн МЕ. Также среди больных с 3-м генотипом ВГС высокая вирусная нагрузка (более 800 тыс. МЕ/мл) достоверно чаще встречалась у 50% больных, в то время как среди больных с 1-м генотипом ВГС таких больных было 22%, а со 2-м генотипом ВГС — 26% (%2 = 13,0; р = 0,001). Достоверно чаще среди больных с вирусной нагрузкой более 2,5 млн МЕ/л встречались мужчины (критерий Фишера р = 0,03), также у мужчин чаще встречался 3-й генотип гепатита С (р < 0,005).
Генотип достоверно не повлиял на показатели цитолитического и холестатического синдромов.
У больных с низкой вирусной нагрузкой (менее 800 тыс. МЕ/мл) достоверно слабее выражен цито-литический синдром, АЛТ был достоверно ниже (р < 0,05), по активности АСТ достоверной статистической разницы не отмечалось. Также достоверно при высокой вирусной нагрузке (более 800 тыс. МЕ/мл) была выше активность ГГТП (р < 0,05).
Выводы. Таким образом, по нашим данным, среди больных в нашем стационаре чаще выявляется 3-й генотип вируса гепатита С, чем среди популяции РФ. Установленные генедерные особенности встречаемости 3-го генотипа требуют дальнейшего изучения для уточнения роли пола или других факторов, сопутствующих увеличению его распространенности. Наличие 3-го генотипа вируса гепатита С сопровождается более высокой вирусной нагрузкой и, вероятно, дополнительным токсическим эффектом на гепатоциты.
№10/2010 ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ
SUMMARY
Aim of the work was to examine the influence of HCV genotype on the clinical features of chronic hepatitis and cirrhosis.
Materials and methods. Were examined 9.715 patients under treatment in hospital gastroenterological for the presence of hepatitis C virus. In 365 patients was found HCV RNA. At 210 patients was performed genotyping. Was performed a quantitative analysis of 193 patients. There were determined cytolytic syndrome (ALT, AST), cholestatic (alkaline phosphatase, bilirubin), the activity of GGT in the blood of patients by biochemical markers. Results and discussion. The frequency of virus infection, confirmed by PCR analysis of data from this group of patients was 3.7% (95% CI 3.3-4.1). Occurrence of genotypes of hepatitis C was for 1 genotype 61.4% (54.7-68.1, 95% CI) for the 2-th genotype — 10.9% (6.7-15.2; 95% CI) and the third genotype — at 27.6% (21.5-33.7, 95%
CI). Viral load was significantly higher (p <0.05) at 3-m type of HCV and was amounted to 8.08 ± 15.6 million IU, compared with patients with 1 st and 2 nd genotype: 4.5 ± 11.3 and 3.7 ± 10.3 MIU. Also among patients with genotype 3 HCV viral load was (more than 800 thousand IU/ml) significantly more frequent in 50% of patients, whereas among patients with genotype 1 HCV, such patients was 22% and from 2 th HCV genotype — 26%
(X2 = 13. 0, p = 0.001). Significantly more frequent among patients with viral load more than 2.5 million IU/l at men (Fisher’s test p = 0.03), as men often had the third genotype of hepatitis C (p <0.005).
0, p = 0.001). Significantly more frequent among patients with viral load more than 2.5 million IU/l at men (Fisher’s test p = 0.03), as men often had the third genotype of hepatitis C (p <0.005).
Genotype was not significantly affected the performance of cytolytic and cholestatic syndromes. In patients with low viral load (less than 800 thousand IU/ml) was significantly less pronounced cytolytic syndrome, ALT was significantly lower (p <0.05), the AST activity of reliable statistical difference was noted. Also significantly under high viral load (more than 800 thousand IU/ml) was higher than the activity of GGT (p <0.05). Conclusions. Thus, our data showed that among the patients in our hospital were more prevalent third genotype of hepatitis C virus than among the population of the Russian Federation. Gender particular occurrence of the third genotype require further study to clarify the role of gender or other factors, concomitant increase in its prevalence. The presence of the third genotype of hepatitis C virus was accompanied by a high viral load, and probably an additional toxic effect on hepatocytes.
В РФ, как и во всем мире, проблема хронического вирусного гепатита С остается одной из наиболее социально значимых. В развитых странах распространенность вирусного гепатита С (ВГС) составляет около 2%, а в во всем мире может достигать 130 — 200 млн [1; 2] человек. В РФ распространенность хронического вирусного гепатита С составляет 129,6 на 100 тыс. населения [3]. Однако точное представление об истинной эпидемиологии носительства этих вирусов в РФ получить практически невозможно в связи с большими различиями инфицированности в различных регионах и среди различных групп населения. Известно более 6 основных генотипов вируса гепатита С, в РФ более чем в 99% случаев встречаются генотипы 1, 2 и 3. В связи с тем что прогностически субтипы вирусов малозначимы, в настоящее время при исследовании достаточно ограничиваться только определением генотипов. По данным различных исследователей, в популяции преимущественно более 80% выявляется 1 генотип вируса гепатита С, реже — 2-й генотип (у 4,5 — 5%) и 3-й генотип (12 — 14%) [4; 5].
По данным различных исследователей, в популяции преимущественно более 80% выявляется 1 генотип вируса гепатита С, реже — 2-й генотип (у 4,5 — 5%) и 3-й генотип (12 — 14%) [4; 5].
Особую проблему в РФ составляет вопрос определения качественного и количественного содержания РНК вируса гепатита С в крови, а также генотипирование в связи с тем, что эти анализы в большинстве случаев выполняются на коммерческой основе и наиболее часто в случае планирующейся противовирусной терапии, которая назначается молодым людям с клинически значимыми изменениями в биохимических анализах крови.
В нашем исследовании мы проанализировали распространенность хронической инфекции,
вызванной вирусом гепатита С, во всех отделениях ЦНИИ гастроэнтерологии за 2009 год. Отсутствие специализированной госпитализации для обследования и лечения хронического вирусного гепатита позволяет экстраполировать полученные данные на гастроэнтерологические отделения стационаров Москвы для расчета ожидаемого количества больных с хроническим вирусным гепатитом С.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
За 2009 год в ЦНИИ гастроэнтерологии было проведено иммунологическое обследование на наличие антител к вирусу гепатита С у 9715 человек. В случае выявления у больных маркеров вирусных гепатитов или по клиническим показаниям кровь больных направлялась в ПЦР лабораторию для исследования на РНК ВГС. При необходимости больным проводилось определение генотипа вируса, а также количественное исследование РНК HCV. Исследование проводилось с помощью Realtime PCR на амплификаторе аппарате Smartsycler II фирмы Serphede. Использовались реактивы производства Интерлабсервис.
Статистическая обработка результатов исследования проводилась при помощи пакетов статистических программа Statistika 6. 0 и Biostat. Рассчитывались средние значения и сигма для количественных значений и доля в % для качественных характеристик. Для выявления разности параметрических критериев использовался критерий t, рассчитанный по методу Стьюдента или Ньюмена — Кейлса. Для непараметрическтх
0 и Biostat. Рассчитывались средние значения и сигма для количественных значений и доля в % для качественных характеристик. Для выявления разности параметрических критериев использовался критерий t, рассчитанный по методу Стьюдента или Ньюмена — Кейлса. Для непараметрическтх
со
критериев определялся хи-квадрат, критерии Фишера, критерий Крускала — Уолиса или Манна-Уитни. Достоверность разницы полученных значений принимали при р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Из 9715 больных проходивших обследование и лечение в ЦНИИГ, антитела к вирусу гепатита С (anti-HCV) оказались положительными у 653 (6,7%) больных. В лабораторию ПЦР в течении года была направлена кровь 410 больных: у 363 были выявлены апИ-НСУ и 47 больных были направлены на исследование по клиническим показаниям при отсутствии иммунологических маркеров для исключения острого вирусного гепатита. РНК ВГС выявлено у 263 (72%) больного, у 100 (28%) человек с антителами к ВГС маркеров репликации выявлено не было. Ни у одного из больных, направленных на исследование по клиническим показаниям при отсутствии иммунологических маркеров вирусной инфекции, маркеры репликации выявлены не были. Генотипирование было выполнено 210 больным. Распределение представлено следующим образом (рис. 1).
Как видно из представленной диаграммы, в структуре генотипов, как и по данным других исследователей, преобладает 1-й генотип вируса гепатита С. Вторым по частоте встречаемости оказался 3-й генотип — 27,7%, и наиболее редко встречался 2-й генотип — лишь в 10,9% случаев. Наши результаты в целом соответствовали литературным данным, но частота встречаемости генотипов 2 и 3 среди РНК-позитивных по ВГС была более чем в 2 раза выше.
Был проведен анализ вирусной нагрузки, возраста и гендерного состава больных в подгруппах, сформированных по генотипу ВГС (табл..gif) 1).
1).
Достоверной разницы в возрасте больных не отмечалось. В группе больных с 3-м генотипом ВГС достоверно чаще встречались мужчины (х2 = 8,3; р = 0,016). Вирусная нагрузка также достоверно выше (р < 0,05) отмечалась при 3-м типе ВГС, чем у больных с 1 и 2 генотипом, разницы вирусной нагрузки между 1 и 2 генотипом достоверно отмечено не было (р = 0.8). Среди больных с 3 генотипом ВГС высокая вирусная нагрузка (более 800 тыс. МЕ/мл) встречалась достоверно чаще у 50% больных, в то время как среди больных с 1 генотипом ВГС таких больных было 22%, а со 2 генотипом ВГС 26%
(X2 = 13,0; р = 0,001).
Показатели цитолитического (АЛТ и АСТ), а также холестатического синдрома (ЩФ, ГГТП, билирубин) у больных с различным генотипом ни по одному показателю достоверно не отличались.
При анализе вирусной нагрузки у мужчин и женщин независимо от генотипа была отмечена более высокая вирусная нагрузка у мужчин, но разница значений была недостоверной (табл. 2).
Достоверно различались лишь средние значения ГГТП, 135±149МЕ/л у мужчин и 54±45МЕ/л у женщин (р<0,05), что, вероятно, связано с большим риском сочетанного алкогольного поражения печени среди мужчин с ВГС.
Для уточнения роли вирусной нагрузки в клинических проявлениях больные были разделены нами на 2 классические группы (табл. 3). Первая группа —больные с низкой вирусной нагрузкой (до 800 тыс. МЕ/мл), вторая группа — с высокой вирусной нагрузкой (более 800 тыс. МЕ/мл).
У больных с низкой вирусной нагрузкой достоверно менее выражен цитолитический синдром — АЛТ была достоверно ниже (р<0,05), по активности
л у
1Г
ь °
и 5
Е!
§1
Б -с 5 С!
10 т
х >
Л £
£ I Е-
ш
2
>
а
н
и
X
Б
га
х
а
о
I-
га
а
ш
¡3
Таблица 1
ВИРУСНАЯ НАГРУЗКА И БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПЕЧЕНИ У БОЛЬНЫХ С РАЗЛИЧНЫМ ГЕНОТИПОМ ВГС. Билирубин (мкмоль / л) 23±15 20± 14
Билирубин (мкмоль / л) 23±15 20± 14
I Таблица 3
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПЕЧЕНИ У БОЛЬНЫХ ВГС С РАЗЛИЧНОЙ ВИРУСНОЙ НАГРУЗКОЙ
Показатели Менее 800 тыс. МЕ/ мл (п=138) Более 800 тыс. МЕ / мл (п=55)
М/Ж 74/64 37/18
Возраст 47± 15 47±12
Вирусная нагрузка (МЕ/мл) 843956±918905 13789657±18310785
АЛТ (МЕ/ л) 83±77* 128±125*
АСТ (МЕ/л) 77±61 100±92
ЩФ (МЕ/ л) 92±41 93±35
ГГТП (МЕ / л) 81±94* 153±228*
Билирубин (мкмоль / л) 22± 16 22±12
Таблица 4
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПЕЧЕНИ У БОЛЬНЫХ ВГС С ВИРУСНОЙ НАГРУЗКОЙ БОЛЕЕ 2,5 МЕ / МЛ.
800000 — 2,5 млн МЕ / мл (п=37) Более 2,5 МЕ / мл (п=18)
М/Ж 21/16 16 /2
Возраст 46±12 48±12
Вирусная нагрузка (МЕ/мл) 5410924±1798428 31012609±24316645
АЛТ (МЕ/ л) 130±133 124±111
АСТ (МЕ / л) 101±98 97±81
ЩФ (МЕ/ л) 93±29 93±45
ГГТП (МЕ / л) 151±248 156±192
Билирубин (мкмоль / л) 23± 14 18±8
сэ
ся
АСТ достоверной статистической разницы не отмечалось. Также достоверно при высокой вирусной нагрузке была выше активность ГГТП (р<0,05), что может свидетельствовать как о более выраженном собственно токсическом действии высоких концентраций вируса на печень, так и возможном проявлении сочетанного токсического эффекта вируса и алкоголя, так как нельзя исключить, что у больных с ХГС, употребляющих алкоголь, выявляется более
Также достоверно при высокой вирусной нагрузке была выше активность ГГТП (р<0,05), что может свидетельствовать как о более выраженном собственно токсическом действии высоких концентраций вируса на печень, так и возможном проявлении сочетанного токсического эффекта вируса и алкоголя, так как нельзя исключить, что у больных с ХГС, употребляющих алкоголь, выявляется более
высокая вирусная нагрузка, однако данный факт требует дальнейшего изучения.
В связи со значительной гетерогенностью данных о вирусной нагрузке во второй группе больных (с вирусной нагрузкой более 800 тыс. МЕ/мл) она была нами условна разделена на подгруппу больных со средней вирусной нагрузкой (800 тыс. — 2,5 млн МЕ/мл) и подгруппу больных с очень высокой вирусной нагрузкой (более 2,5 млн МЕ/мл).
Достоверно чаще среди больных с вирусной нагрузкой более 2,5 млн МЕ/л встречались мужчины (критерий Фишера р = 0,03). Достоверной разницы в биохимических показателях в этих подгруппах не обнаружено. На основании анализа этих данных можно с уверенностью сказать о нецелесообразности выделения из группы больных ВГС с очень высокой вирусной нагрузкой, так как клинической значимости это не имеет.
ЗАКЛЮЧЕНИЕ
По результатам проведенного исследования в гастроэнтерологическом стационаре положительные иммунологические маркеры гепатита С встречаются у 6,7% (6,1 — 7,3; 95% ДИ). Частота вирусной инфекции, подтвержденной данными ПЦР-анализа, у этой группы больных составляет 72% (67,3 — 76,7; 95% ДИ). Встречаемость генотипов вируса гепатита С составляет для 1-го генотипа 61,4% (54,7 — 68,1; 95%ДИ), для 2-го генотипа — 10,9% (6,7 — 15,2; 95% ДИ) и 3-й генотип — у 27,6% (21,5 — 33,7; 95% ДИ). Таким образом, по нашим данным, среди больных в ЦНИИ гастроэнтерологии чаще выявляется 3-м генотипом вируса гепатита С, чем среди популяции РФ.
LT
Ь ° U 5
Е!
§1 < i Б -с S с
10 т
х >
Л £ i i
i-
<u
2
>
a
i-
u
X
s
s
к
ID
X
a
о
i-
ID
a
UD
ЛИТЕРАТУРА
1. Mueller S., Millonig G., Seitz H.K. Alcoholic liver disease and hepatitis C: a frequently underestimated combination. Department of medicine and center for alcohol research, liver disease and nutrition, University of Heidelberg, Zeppelinstrasse, 11-33, 69121. Heidelberg, Germany // World J. Gastroenterol. — 2009. — Vol. 15, № 28. — P. 3462-3471. sebastian. mueller@urz. uni-heidelberg.de PMID: 19630099
uni-heidelberg.de PMID: 19630099
2. Armstrong G.L., Wasley A., Simard E.P. et al. The prevalence of hepatitis C virus infection in the United States, 1999 through 2002 // Ann. Intern. Med. — 2006. — Vol. 144. — P. 705-714.
3. Шаханина И.Л., Радуто О.И. Вирусные гепатиты в России: официальная статистика и экономические потери // Вирусные гепатиты. — 2001. — Т. 18, № 6. — С. 5-9.
4. Oliveira-Filho A.B., Pimenta A.S., Rojas M.F. et al. Prevalence and genotyping of hepatitis C virus in blood donors in the state of Para, Northern Brazil // Mem. Inst. Oswaldo Cruz. — 2010. — Vol. 105, № 1. — P. 103-106. PMID: 20209338.
5. Maieron A., Metz-Gercek S., Hackl F. et al. Chronic hepatitis C in Austria, 1992-2006: genotype distribution and demographic factors // Euro Surveill. — 2010. — Vol. 15, № 8. pii: 19492. PMID: 20197021.
6. Te H.S., Jensen D.M. Epidemiology of hepatitis B and C viruses: a global overview // Clin. Liver Dis. — 2010. — Vol. 14, № 1. — P. 1-21, vii. PMID: 20123436.
7. World health organization strategy for control of Hepatitis // Control of virus disease / Ed. E. Kurstan. — 2nd ed. — N.-Y. Ghendon Y. Z.: Marcel Dekker Inc., 1993. — P. 141-164.
Вирусная нагрузка гепатита С – количественный метод
Описание
Вирус гепатита С является РНК — содержащим вирусом семейства флавивирусов. Вирус поражает клетки печени, приводит к развитию острых и хронических гепатитов.
Заражение происходит от больного человека. Вирус передается через кровь, парентеральным путем:
- при употреблении наркотиков через совместно используемые иглы и шприцы,
- при переливании крови,
- при гемодиализе,
- при половых контактах,
- возможна передача вируса при беременности от матери к плоду, если у матери выявляется РНК вируса гепатита С, риск инфицирования плода составляет около 5%.

У большинства людей острая инфекция протекает бессимптомно. Острый гепатит с желтухой развивается не более чем у 10- 20%. Процент перехода заболевания в хроническую форму очень высок, до 50-85% инфицированных становятся хроническими носителями вируса. Хронический гепатит С со временем может приводить к развитию цирроза печени и злокачественной опухоли печени – гепатоцеллюлярной карциномы.
Хронический гепатит С зачастую протекает скрыто, с небольшими проявлениями заболевания, могут беспокоить слабость, утомляемость, снижение аппетита, нарушения стула, вздутие живота, боли в области печени, может появляться желтуха. Долгое время люди могут не подозревать о наличии вирусной инфекции, о заболевании узнают по результатам лабораторных анализов.
Как можно установить инфицирование вирусом гепатита С
Методы лабораторной диагностики инфицирования вирусом гепатита С делятся на прямые и косвенные.
- Прямые – методы определения самого вируса или его частиц, наиболее распространенным является метод ПЦР (полимеразная цепная реакция), определяющий участки генетического материала — РНК вируса гепатита С.
- Косвенные — методы исследования антител (иммуноглобулинов). Антитела к антигенам (структурам) вируса вырабатываются в ответ на проникновение вируса в организм и отражают реакцию организма на инфекцию. Наиболее распространенным методом определения антител является ИФА (иммуноферментный анализ).
Что показывает количественный анализ на вирус гепатита С
Методом количественного ПЦР в режиме реального времени определяют «вирусную нагрузку» — число копий РНК вируса гепатита С в 1 мл плазмы крови.
Метод ПЦР является прямым методом диагностики инфекции, он позволяет выявлять участки РНК вируса гепатита С в плазме крови уже на 7-21-й день после инфицирования, гораздо раньше появления первых антител.
Исследование «вирусной нагрузки» вируса гепатита С позволяет:
- установить факт инфицирования вирусом гепатита С,
- проводить раннюю диагностику острого гепатита С,
- судить об активности или скорости размножения вируса,
- выбрать схему и продолжительности лечения,
- прогнозировать эффективность противовирусной терапии, которая напрямую зависит от количества вируса в крови,
- оценивать эффективность лечения.

Кому показано количественное исследование на вирус гепатита С
Исследование «вирусной нагрузки» проводится пациентам с вирусным гепатитом С, имеющим положительный результат анализа на РНК вируса гепатита С в крови. Исследование проводится перед началом лечения и для контроля за эффективностью терапии.
Результата анализа
В результате анализа указывается количество вируса в 1 мл плазмы крови.
Для оценки количества вируса в крови могут быть использованы два типа единиц измерения: МЕ/мл и копии РНК/мл.
Чувствительность исследования составляет 10МЕ/мл.1МЕ = 4,5 копии РНК.
Полученный результат исследования обязательно должен интерпретировать лечащий врач с учетом всех данных о состоянии здоровья пациента, комплекса проведенных лабораторных анализов, принимаемых лекарственных средствах.
Правила подготовки
- Необходимо исключить факторы, влияющие на результаты исследований: физическую нагрузку (бег, подъем по лестнице, подъем тяжестей), тепловые процедуры (посещение бани, сауны), эмоциональное возбуждение.
- Перед забором крови следует отдохнуть 10-15 минут в приемной, успокоиться.
- Исключить прием алкоголя за 1-2 дня до исследования.
- За 1 час до исследования исключить курение.
- Кровь не следует сдавать после рентгенографии, физиотерапевтических воздействий, после проведения диагностических или лечебных процедур.
- Практически все анализы делают натощак. «Натощак» — это когда между последним приемом пищи и взятием крови проходит не менее 8 ч (желательно — не менее 12 ч). Можно только пить воду. Накануне исследования следует избегать пищевых перегрузок.
- При исследовании крови учитывают влияние принимаемых лекарственных препаратов. Если прием лекарственного средства обязателен и исследование проводится на фоне приема препарата, об этом необходимо делать отметку на направлении
Количественное определение РНК вируса гепатита С методом ПЦР [вирусная нагрузка] (HCV Viral Load, Hepatitis C Virus RNA (Quantitative test)) в сыворотке крови
Определение РНК вируса гепатита С в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Под наблюдением находились 200 больных в возрасте от 18 до 50 лет (мужчин и женщин) с подтвержденным диагнозом ХГС, репликативная фаза. Длительность инфицирования у лиц, включенных в исследование, колебалась от 2 до 10 лет. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ Как показали исследования, у пациентов всех групп до начала терапии с определенной частотой определялся умеренный астенический синдром, имели место гепатомегалия и умеренная диспепсическая симптоматика. С одинаковой частотой пациенты всех групп жаловались на слабость, снижение трудоспособности, общее ухудшение качества жизни.
ПЕРСОНАЛИЗИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ ИНГАРОНА В предыдущих исследованиях нами было показано, что индивидуальный подбор препаратов ИФН-а и их доз до лечения и в процессе терапии больных ХГС по их влиянию in Vitro на тиол-дисульфидное (SH/SS) соотношение крови позволяет значительно повысить эффективность противовирусной терапии и снизить частоту побочных эффектов 19, 10]. На основании полученных данных можно предположить, что индивидуальный подбор препаратов для комбинированной терапии ХГС с использованием Ингарона (ИФН-a + Ингарон, ПегИнтрон + Ингарон, ИФН-a + Ингарон + Рибавирин, ИФН-а + Ингарон + Циклоферон и др.) позволит сделать лечение еще более эффективным и безопасным. В качестве примера ниже приведены результаты обследования и лечения двух больных ХГС, у которых проводилось изучение индивидуальной чувствительности к комбинациям противовирусных препаратов с использованием Ингарона. Очевидно, что ИФН-у можно успешно комбинировать с разными отечественными и импортными препаратами ИФН-а (Интрон А, Инте-раль и др.), в том числе пегилированных ИФН (ПегИнтрон), индукторов ИФН (Циклоферон) и рибавиринов (Рибамидил, Ребетол и др.) в схемах двойной и тройной терапии ХГС.
ВЫВОДЫ Таким образом, представляется целесообразным включение в стандартную схему лечения больных ХГС препарата Ингарон, что значительно повышает эффективность терапии и снижает частоту развития нежелательных побочных реакций. Особенно эффективной оказалась тройная схема лечения, включающая ИФН-а, ИФН-у и Рибамидил. Достаточно эффективная схема лечения, включающая ИФН-у и Циклоферон. Литература
Ваша вирусная нагрузка — это количество вируса гепатита С (ВГС) в вашей крови. Ваш начальный уровень может дать ключ к разгадке ваших шансов на успех в лечении. Изменения вирусной нагрузки также могут сказать вашему врачу, продолжаете ли вы терапию и принимаете ли вы достаточно лекарств, чтобы контролировать свое заболевание. Но ваша вирусная нагрузка измеряет только то, что происходит в вашей крови, а не фактические клетки печени. Таким образом, он не может очень хорошо показать, насколько серьезен ваш гепатит С, как быстро он может ухудшиться или насколько эффективно ваше лечение.Он также ничего не говорит о количестве повреждений или рубцов в вашей печени. Они проверяют вашу кровь на генетические следы ВГС. Если они обнаружены, это означает, что у вас активный гепатит С и ваши вирусы размножаются. Тесты на вирусную нагрузку бывают двух типов: Качественный : Это может подтвердить, есть ли у вас гепатит С или нет. Положительный результат теста означает, что в вашей крови обнаружен генетический код HCV. Отрицательный означает, что вирус не обнаружен. Качественные тесты очень чувствительны, а это означает, что если у вас есть текущая инфекция гепатита С, они почти всегда ее обнаружат. Количественный анализ : это часто называют тестом на РНК гепатита С. Он измеряет, сколько ВГС содержится в капле крови. Большинство лабораторий теперь сообщают цифры в международных единицах на миллилитр (МЕ / мл). Цель терапии гепатита C — снизить количество вирусов до достаточно низкого уровня, чтобы их нельзя было обнаружить. Если это произойдет через 3 месяца после окончания лечения, вы выздоровели. Это происходит более чем у 90% людей, получающих рекомендованное лечение. Высокая вирусная нагрузка : Это когда ваше количество превышает 800 000 МЕ / мл. Если вначале у вас высокий уровень вируса, то для вашего лечения может быть трудно или невозможно полностью избавиться от вируса. Некоторые исследователи считают, что высокие уровни превышают 400 000 МЕ / мл. Низкая вирусная нагрузка : Это количество ниже 800000 МЕ / мл. Ваши шансы на то, что лечение заставит вас полностью или частично исчезнуть, выше, чем при высокой вирусной нагрузке. Неопределяемая вирусная нагрузка : Это не обязательно означает, что у вас нет вирусов.Неопределяемые уровни могут различаться в зависимости от того, насколько точен ваш тест, от лаборатории, которую вы используете, и от того, как она обрабатывала образец крови. У вас все еще могут быть вирусы, но их слишком мало, чтобы тесты могли уловить их. Два новых теста — транскрипционно-опосредованная амплификация (ТМА) и полимеразная цепная реакция (ПЦР) — позволяют измерять всего 5–10 МЕ / мл. Третья, называемая ДНК с разветвленной цепью (бДНК), может пропускать вирусную нагрузку ниже 615 МЕ / мл. Устойчивый вирусологический ответ : Это когда наиболее чувствительные тесты не обнаруживают следов ВГС в вашей крови через 12 недель после прекращения лечения.Это также называется лекарством от вирусов. Это означает, что ваше заболевание находится в стадии ремиссии, и ваш гепатит С больше не активен. Ваша печень может начать заживать, и ваши шансы на печеночную недостаточность и рак печени уменьшатся. Для подтверждения вам может потребоваться повторить тест или пройти качественный тест, который проверяет, отрицательны ли вы на какие-либо следы вирусного генетического материала. Проверка количества вирусов до, во время и после лечения покажет вашему врачу, действуют ли и насколько хорошо ваши лекарства.Рост вирусной нагрузки не всегда означает, что вам становится хуже, и снижение количества вирусов не является признаком того, что вы выздоравливаете. В отличие от ВИЧ, где более низкое количество вирусов обычно означает более долгую и здоровую жизнь, вирусная нагрузка ВГС мало что говорит о том, насколько быстро прогрессирует ваш гепатит С или чем может обернуться ваше заболевание. Для этого вашему врачу нужно будет проверить ферменты печени и ткани печени, а также провести другие тесты. Обычно лечение гепатита С будет одинаковым, независимо от того, насколько высока или низка ваша вирусная нагрузка.Ваш врач будет использовать ваши уровни вируса, чтобы контролировать вашу реакцию на лекарство. Назначенные вам лекарства будут зависеть не столько от количества вирусов, сколько от вашего общего состояния здоровья, генетической структуры вируса гепатита С и других факторов. Вирусная нагрузка — это просто измерение количества вируса в вашей крови. Измерения вирусной нагрузки обычно используются для мониторинга хронических вирусных заболеваний, таких как ВИЧ, гепатит B (HBV) и гепатит C (HCV). BSIP / UIG / Getty Images В случае ВГС для измерения генетического материала (РНК) вируса, обнаруженного в миллилитре крови, используется тест, называемый количественным анализом РНК ВГС.Другие технологии также могут использоваться для мониторинга вирусной активности, большинство из которых делает это путем обнаружения вирусной ДНК или РНК. Врачи используют вашу вирусную нагрузку, чтобы определить, насколько хорошо вы реагируете на противовирусное лечение. Обычно вашу вирусную нагрузку проверяют перед началом терапии (например, для гепатита С), а затем периодически повторяют, чтобы измерить вашу реакцию. Для оценки эффективности лечения необходимы не менее двух результатов вирусной нагрузки. Значительно сниженная вирусная нагрузка, например 100-кратное снижение вирусной активности, обычно означает, что лечение работает. В идеале человек должен достичь так называемой «неопределяемой» вирусной нагрузки, что означает, что современные технологии тестирования не могут найти никаких доказательств наличия вируса в образцах крови. Важно понимать, что, хотя тест полезен для прогнозирования результатов лечения, он ничего не говорит вам о серьезности вашего заболевания печени.Обычно для этого необходимы биопсия печени и визуализирующие исследования (например, УЗИ или МРТ). Что касается вирусного гепатита С, высокая вирусная нагрузка обычно составляет более 800 000 МЕ / л, а низкая вирусная нагрузка — менее 800 000 МЕ / л. Однако этот диапазон может значительно варьироваться в зависимости от того, что считается средним для конкретного региона или населения. Однако важно отметить, что вирусная нагрузка 800 000 МЕ / л не означает, что у вас в крови 800 000 реальных вирусов.Скорее, это означает, что лаборатория определила, что в литре крови содержится 800 000 международных единиц (МЕ). МЕ — это стандартное измерение, используемое патологами для обеспечения единообразия от лаборатории к лаборатории, и считается более точным, чем простой «подсчет количества вирусных РНК». Однако, как правило, 800000 МЕ / л соответствует примерно двум миллионам копий вирусной РНК. Период ремиссии (неопределяемая вирусная нагрузка) через 12 недель после завершения терапии гепатита С известен как устойчивый вирусологический ответ (УВО) или УВО12.Почти все люди, достигшие УВО12, продолжают достигать УВО24, что означает, что через 24 недели после лечения вирусная активность не обнаружена. Неопределяемая вирусная нагрузка не обязательно означает, что у вас нет вируса в крови или что вы излечились. Однако, если вы в состоянии поддерживать неопределяемую вирусную нагрузку в течение 24 недель (а теперь эксперты считают, что даже 12 недель), вероятность повторного появления вируса (восстановления) считается крайне низкой. Фактически, в этом случае человек технически считается излеченным.Взаимодействие с другими людьми Хотя тесты могут различаться по чувствительности, что означает их способность обнаруживать вирус, большинство современных тестов чрезвычайно точны. Хотя тесты, используемые для диагностики и лечения гепатита С, могут показаться сложными, постарайтесь не слишком увлекаться деталями. Если у вас есть гепатит С, сохраняйте активность в отношении здоровья своей печени, обращаясь к врачу, имеющему опыт лечения людей с гепатитом С. Принимайте лекарства в соответствии с инструкциями и поддерживайте тесный контакт с врачом.Хорошая новость заключается в том, что при надлежащем уходе вы можете избавиться от вируса из своего тела (и, по сути, «вылечиться»). Получите наше руководство для печати к следующему визиту к врачу, которое поможет вам задать правильные вопросы. Отправить руководство по электронной почте Отправить себе или любимому человеку. Зарегистрироваться Это руководство для обсуждения с доктором было отправлено на адрес {{form.email}}. Произошла ошибка. Пожалуйста, попробуйте еще раз. Лаборатория молекулярной биологии, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес, 1 107, Аргентина Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universidad de la República, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, Институт Санкт-Петербурга, 3 , Санкт-Петербург, Россия 4 Отделение вирусологии, Отделение микробиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия, 5 Отделение медицины A, Медицинский факультет, Имперский колледж, Лондон, Соединенное Королевство, 6 Отдел здоровья человека, Международный Агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес, Аргентина, 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Centro de Investigaciones Nucleares, Universida Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Секция вирусологии, Отдел микробиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия , 5 Кафедра медицины A, Медицинский факультет, Имперский колледж, Лондон, Великобритания, 6 Отделение здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular , Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, B Уэнос-Айрес, Аргентина, 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universidad de la República, 2 Laboratorio de Biología Molecular, Monte Asociación Española Primera10 de Socorros Mutis, 90, ул. Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Отделение вирусологии, Отделение микробиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия, 5 Отделение медицины А, Медицинский факультет, Имперский колледж, Лондон, Великобритания , 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес, , Аргентина, Аргентина 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universi dad de la República, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Секция вирусологии, Институт микробиологии, Все Индии медицинских наук, Нью-Дели, Индия, 5 Медицинский факультет А, Медицинский факультет, Имперский колледж, Лондон, Соединенное Королевство, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Лаборатория молекулярной биологии, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес, Аргентина, 1 Laboratorio de Virología Molecular, Centro de Investigaciones de la Nucleares, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, 901 07 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Отделение вирусологии, отделение микробиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия, 5 Отделение медицины A, медицинский факультет, Имперский колледж, Лондон, Соединенное Королевство, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэноса , Argentina, 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universidad de la República, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, 90, Санкт-Петербург, ул. Институт, Санкт-Петербург, Россия, 4 Отделение вирусологии, Отделение микробиологии, All Indi a Институт медицинских наук, Нью-Дели, Индия, 5 Медицинский факультет A, Медицинский факультет, Имперский колледж, Лондон, Соединенное Королевство, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес, Аргентина, 1 Laboratorio de Virología Molecular, Facility República, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Секция вирусологии, Отделение микробиологии Всеиндийского института медицинских наук , Нью-Дели, Индия, 5 Медицинский факультет А, Медицинский факультет Имперского колледжа, Ло ndon, United Kingdom, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Moleires , Argentina, 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universidad de la República, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, 90, Санкт-Петербург, ул. Институт, Санкт-Петербург, Россия, 4 Отделение вирусологии, Отделение микробиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия, 5 Отделение медицины A, Медицинский факультет, Имперский колледж, Лондон, Великобритания, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 9 0084 Baldip Khan Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес, Аргентина, 1 Laboratorio de Virología Molecular, Centro de Investigaciones de la Nucleares 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Секция вирусологии, Отдел микробиологии Всеиндийского института медицинских наук, Нью Дели, Индия, 5 Медицинский факультет А, Медицинский факультет, Имперский колледж, Лондон, Соединенное Королевство, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Bio logia Molecular, Буэнос-Айрес, Аргентина, 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universidad de la República, 2 Laboratorio de Biología Molecular, Asociación Españosideo, , Asociación Españosola 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Секция вирусологии, кафедра микробиологии, Всеиндийский институт медицинских наук, Нью-Дели, Индия, 5 Кафедра медицины А, медицинский факультет, Имперский колледж, Лондон , Соединенное Королевство, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Laboratorio de Biología Molecular, Grupo CentraLab, Instituto de Investigaciones en Ingenieria Genetica y Biologia Molecular, Буэнос-Айрес Аргентина, 1 Laboratorio de Virología Molecular, Centro de Investigaciones Nucleares, Facultad de Ciencias, Universidad de la República, 2 Laboratorio de Biología Molecular, Asociación Española Primera de Socorros Mutuos, Монтевидео, Уругвай, 3 Санкт-Петербургский институт Пастера, Санкт-Петербург, Россия, 4 Отделение вирусологии, Отделение вирусологии Индийский институт медицинских наук, Нью-Дели, Индия, 5 Медицинский факультет A, Медицинский факультет, Имперский колледж, Лондон, Соединенное Королевство, 6 Отдел здоровья человека, Международное агентство по атомной энергии, Вена, Австрия 7 Тестирование антигена вируса гепатита С (ВГС) дешевле, чем количественная полимеразная цепная реакция с обратной транскрипцией, но имеет более низкую чувствительность для очень низкой вирусной нагрузки (ЛНВП; РНК ВГС ≤3000 МЕ / мл).В настоящее время обсуждаются преимущества тестирования на антигены для скрининга, но данных о распространенности и исходах у лиц с VLVL немного. Мы оценили распространенность и предикторы VLVL с помощью логистической регрессии у участников Швейцарского когортного исследования гепатита C, не получавших лечения. Мы проанализировали, была ли последняя вирусная нагрузка после VLVL низкой, сравнили цирроз и смертность у людей с VLVL и без них и оценили количество образцов с VLVL, которые были реактивными, с помощью тестирования антигена. Мы включили 2533 человека, не получавших лечения, с доступными количественными результатами тестирования на РНК ВГС. В целом 133 человека (5,3%) имели VLVL. Возраст 18-40 лет, женский пол и коинфекция вирусом иммунодефицита человека были связаны с VLVL. Из 72 человек с вирусной нагрузкой, доступной после VLVL, 14% имели VLVL и 17% имели спонтанный вирусный клиренс. Распространенность и частота цирроза печени и смертность были сопоставимы у людей с и без VLVL; все 24 человека с VLVL и циррозом имели чрезмерное потребление алкоголя или иммуносупрессию.В целом, 33% образцов с VLVL были реактивными при тестировании на антиген. Частота VLVL была низкой. Среди людей, которых, вероятно, не заметили при скрининге на антигены, у некоторых было благоприятное течение болезни, но у некоторых наблюдались иммуносупрессия и цирроз печени. Польза тестирования на антиген ВГС для скрининга может быть ограничена риском пропуска пациентов с тяжелым заболеванием печени. антиген; цирроз печени; гепатит С; скрининг; очень низкая вирусная нагрузка. Рекомендации по лечению Европейской ассоциации по изучению печени (EASL) of Hepatitis C 2018, опубликованные в журнале Journal of Hepatology , указывают, что рекомендации «в первую очередь основаны на доказательствах из существующих публикаций и презентаций на международных встречах» (1).Мы считаем, что этот подход является подходящим, поскольку он отдает приоритет опубликованным данным рандомизированных клинических испытаний, а не личному опыту или доклинической информации. Что касается скрининга на инфекцию вирусом гепатита С (ВГС), рекомендации заключаются в следующем: скрининг групп населения, подверженных риску заражения, тестирование когорт при рождении и тестирование населения в целом в районах со средней и высокой серологичностью (≥2%). Важно подчеркнуть, что руководящие принципы EASL рекомендуют, чтобы скрининг на инфекцию ВГС основывался на обнаружении антител к ВГС в сыворотке или плазме с помощью иммуноферментного анализа.Если обнаружены антитела к HCV, РНК HCV следует определять чувствительным молекулярным методом с нижним пределом обнаружения ≤15 МЕ / мл. В странах с высоким уровнем доходов этот диагностический алгоритм иногда трудно применить среди тех, кто сталкивается с препятствиями при доступе к услугам здравоохранения, как это было бы в случае людей, употребляющих инъекционные наркотики, или иммигрантов. Тем не менее, одна из рекомендаций руководства заключается в том, что качественные анализы РНК ВГС с нижним пределом обнаружения ≤1000 МЕ / мл (3,0 log 10 МЕ / мл) могут использоваться для обеспечения широкого доступного доступа к диагностике и лечению ВГС в условиях низкого в странах со средним уровнем доходов и в особых условиях в странах с высоким уровнем доходов (которые, как мы понимаем, относятся к группам людей, которые сталкиваются с препятствиями при получении доступа к услугам здравоохранения).Эта рекомендация степени B2 основана на результатах двух наблюдательных исследований с участием участников клинических испытаний (2, 3) и пациентов, получавших лечение в частной практике (2). Кроме того, исследование, в котором анализировались пациенты клинических испытаний, не обнаружило никаких доказательств других хронических заболеваний печени или инфекции ВИЧ-1, вирусом гепатита А или вирусом гепатита В (3). Поэтому мы считаем, что результаты этих двух исследований нельзя экстраполировать на людей, употребляющих инъекционные наркотики. Клинические лаборатории университетской больницы Vall d’Hebron в Барселоне, Испания, обслуживают 1 население.2 миллиона граждан, в дополнение к 12 наркологическим и реабилитационным центрам и женской тюрьме. В апреле 2018 года в больнице была внедрена одноэтапная стратегия скрининга и диагностики виремической инфекции HCV (рефлекторное тестирование). Другими словами, скрининг основан на обнаружении антител против HCV; если антитела положительные, на том же образце проводится чувствительный анализ РНК HCV. Однако антитела могут быть отрицательными при раннем остром гепатите С, но это можно заподозрить, если клинические признаки и симптомы совместимы с острым гепатитом (уровень аланинаминотрансферазы> 10 раз выше верхнего предела нормы и / или желтухи).В этих случаях анализ РНК HCV также выполняется как часть первоначальной оценки. Мы ретроспективно проанализировали результаты тестов за период с апреля 2018 г. по май 2019 г. и обнаружили, что 1,1% (7/619, 95% доверительный интервал [ДИ] = 0,5–2,3) пациентов с вирусом гепатита С, 3,7% (11/295, 95%). ДИ = 1,9–6,6) инфицированных потребителей наркотиков и 25,0% (5/20, 95% ДИ = 8,7–49,1%) инфицированных заключенных имели уровень РНК ВГС <1000 МЕ / мл. Поэтому мы считаем, что анализы РНК HCV с нижним пределом обнаружения ≤1000 МЕ / мл (3.0 log 10 МЕ / мл) не подходят для диагностики инфекции ВГС у нынешних или бывших потребителей инъекционных наркотиков и, вероятно, также не подходят для заключенных (небольшая выборка) из-за высокого риска получения ложноотрицательных результатов. Потребители инъекционных наркотиков составляют ядро эпидемии гепатита С, и эффективные стратегии диагностики и лечения имеют важное значение для сдерживания эпидемии (4). Уход за наркопотребителями является особенно сложной задачей для медицинских бригад и требует терпения, опыта и терпимости (4).Ликвидация гепатита С среди потребителей инъекционных наркотиков требует тесного сотрудничества между экспертами по гепатиту (включая клиницистов) и экспертами по уходу за наркозависимыми, в дополнение к надежным, высококачественным диагностическим тестам (4) и стратегиям планирования здравоохранения для выявления и лечения всех инфицированных людей. . Хотя элиминация ВГС имеет свою цену, и некоторые пациенты обязательно будут пропущены, чтобы позволить найти и лечить других, этот факт следует свести к минимуму путем использования максимально чувствительных тестов на вирусную нагрузку ВГС, подобных тем, которые используются в центральных лабораториях. (е.г., система Cobas 6800 [Roche]). Однако, если это невозможно, доступны высокочувствительные системы тестирования на месте (например, GenXpert [Cepheid]). Руководства по ведению ВГС предоставлены Американской ассоциацией по изучению заболеваний печени (AASLD) и Американским обществом инфекционных заболеваний (IDSA). 1 Эти организации публикуют в Интернете совместные, основанные на фактах рекомендации для быстрого формулирования и распространения.Для получения дополнительной информации посетите http://www.hcvguidelines.org. Целевая группа профилактических услуг США (USPSTF) и CDC рекомендуют однократный скрининг на инфекцию ВГС для взрослых, родившихся с 1945 по 1965 год. 2,3 Одноразовый скрининг также рекомендуется для взрослых с высоким риском из-за: Скрининг также рекомендуется детям, рожденным от ВГС-положительных матерей. 3,4 Тест на ВГС рекомендуется для людей со стойко аномальными уровнями аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) или билирубина. 3,4 См. Https://www.cdc.gov/hepatitis/hcv/pdfs/hcv_flow.pdf. Результат теста на реактивные антитела к вирусу гепатита C в сочетании с результатом отсутствия РНК вируса гепатита C указывает на отсутствие лабораторных доказательств наличия активной инфекции вируса гепатита C. в большинстве случаев никаких дальнейших действий не требуется. Если желательно провести различие между истинно положительным и биологическим ложноположительным результатом на антитела к ВГС, CDC предлагает рассмотреть возможность тестирования с помощью другого анализа антител к ВГС.Если есть сомнения относительно обращения или хранения исследуемого образца, получите новый образец для повторного тестирования. 6 да. Среди лиц с нереактивным тестом на антитела к ВГС, у которых есть подозрение на заболевание печени или у которых высок риск острой инфекции, рекомендуется тестирование на РНК ВГС или последующее тестирование на антитела к ВГС, если контакт с ВГС с высоким риском произошел в пределах последние 6 месяцев.Кроме того, тестирование на РНК ВГС также может быть рассмотрено у лиц с ослабленным иммунитетом (например, лиц, находящихся на длительном гемодиализе или инфицированных ВИЧ). Среди образцов с реактивными антителами к ВГС примерно 52% имеют определяемую РНК ВГС на уровне > 15 МЕ / мл при рефлекторном тестировании. Однако частота заметно варьируется в зависимости от силы сигнала теста на антитела или отношения сигнал / порог (S / C).Образцы с соотношением S / C не менее 1,0 считаются реактивными в отношении антител к HCV 7 и, таким образом, проходят рефлекторное тестирование на РНК HCV. Анализ примерно 200000 образцов, представленных в Quest Diagnostics для тестирования антител к ВГС с тестированием рефлекса на РНК ВГС, показывает, что частота положительных результатов рефлекса увеличивается с увеличением отношения S / C: <15 МЕ / мл обнаружено» или «<15 МЕ / мл не обнаружено»? Результат «Обнаружено <15 МЕ / мл» означает, что РНК HCV обнаружена, хотя на уровне (<15 МЕ / мл), который слишком низок для количественной оценки.Этот результат может указывать на текущую активную инфекцию ВГС, если согласуется с другими клиническими и лабораторными данными. ПРИМЕЧАНИЕ. Если этот тест выполняется для диагностики ВГС, то этот результат <15 МЕ / мл должен быть подтвержден с помощью второй пробы, взятой у пациента. Напротив, результат «<15 МЕ / мл, не обнаружен» означает, что РНК вируса гепатита С не обнаружена и нет свидетельств текущей активной инфекции. Quest Diagnostics измеряет вирусную нагрузку РНК HCV с помощью методологии Roche cobas ® HCV.Это количественный анализ ПЦР в реальном времени с нижним пределом количественного определения (LOQ) 15 МЕ / мл; предел обнаружения (LOD) немного ниже, от 10 до 13 МЕ / мл. Если вирусная нагрузка не превышает этого значения LOD, но менее 15 МЕ / мл, анализ может определить присутствие РНК HCV, но не может обеспечить надежный количественный результат. В таких случаях предоставляется качественный результат «<15 МЕ / мл, обнаружено». Результаты по РНК ВГС выражаются в МЕ / мл, что является сокращением международных единиц на миллилитр.Результаты представлены в МЕ / мл, чтобы облегчить сравнение результатов, полученных с помощью различных методов испытаний. Это важно, потому что различные методы, используемые разными лабораториями, не стандартизированы относительно друг друга. Использование отчетных единиц МЕ / мл помогает сделать сравнение результатов вирусной нагрузки с помощью различных методов более надежным. Результаты по РНК HCV также представлены в логарифмах МЕ / мл, что является логарифмом МЕ / мл. Результаты в этом формате помогают понять, имеет ли изменение вирусной нагрузки клиническое значение. Воспроизведение результатов теста ПЦР с использованием одного и того же образца может аналитически отличаться на 0,5 log МЕ / мл; таким образом, только изменения, превышающие 0,5 log МЕ / мл от одного измерения к другому (или по нескольким измерениям), считаются отражающими истинные изменения вирусной нагрузки. 8 Сообщение результатов вирусной нагрузки в единицах log МЕ / мл помогает врачу точно интерпретировать изменения вирусной нагрузки и лучше оценить реакцию пациента на противовирусное лечение. Если РНК ВГС обнаруживается на 4-й неделе лечения, согласно рекомендациям AASLD, рекомендуется повторить количественное определение вирусной нагрузки РНК ВГС после 2 дополнительных недель лечения. Если количественный анализ РНК ВГС на 6 неделе лечения показывает увеличение более чем в 10 раз (> 1 log10 МЕ / мл), рекомендуется прекратить лечение ВГС.Причина положительного результата теста на РНК ВГС на 4-й неделе с понижением уровня на 6-й или 8-й неделе неизвестна. Рекомендации по прекращению или продлению терапии для таких пациентов отсутствуют. 9 Список литературы Этот FAQ предоставлен только в информационных целях и не предназначен для использования в качестве медицинской консультации. Выбор и интерпретация тестов, постановка диагноза и ведение пациента врачом-клиницистом должны основываться на его / ее образовании, клиническом опыте и оценке пациента. Для отбора пациентов с ВИЧ, которым была бы полезна текущая терапия ВГС.В период с июня 1996 г. по март 2000 г. уровни РНК ВГС были количественно определены у 1279 пациентов в Центре медицинских наук Университета штата Луизиана; 28 из этих пациентов были инфицированы ВИЧ. Нагрузки HCV количественно оценивали с помощью анализа разветвленной ДНК Байера с нижним пределом обнаружения 0,2 мэкв / мл. Мы сравнили медианные уровни РНК HCV для пациентов с коинфекцией ВИЧ и HCV и пациентов, инфицированных только HCV, которые находились в том же возрастном диапазоне (от 23 до 55 лет). Средняя нагрузка ВГС для 28 пациентов с коинфекцией ВГС и ВИЧ (17.8 мэкв / мл) было значительно больше ( P <0,05), чем у пациентов того же возраста, инфицированных только HCV (6,1 мэкв / мл). Нагрузка ВГС не коррелировала с возрастом или полом ни в одной из групп пациентов. Значимая ( R = -0,4; P <0,05) наблюдалась отрицательная корреляция между нагрузкой ВГС и количеством CD4 в группе с коинфекцией, для которой количество CD4 во время анализа нагрузки ВГС варьировалось от 6 до 1773 / мм. 3 . Повышенная нагрузка ВГС у пациентов с коинфекцией ВГС и ВИЧ по сравнению с пациентами, инфицированными только ВГС, и обратная зависимость нагрузки ВГС от количества CD4 указывают на то, что иммуносупрессия приводит к снижению контроля репликации ВГС.Кроме того, мы сообщаем о значительно более высоких нагрузках ВГС среди афроамериканцев с коинфекцией, чем среди европеоидов. Многие пациенты, инфицированные вирусом иммунодефицита человека (ВИЧ), также инфицированы вирусом гепатита С (ВГС) из-за общих путей передачи, а именно переливания продуктов крови и внутривенного употребления наркотиков (IVDU). Распространенность коинфекции ВГС-ВИЧ составляет от 4 до 90% в зависимости от процента IVDU в популяции (10). С повышением показателей выживаемости ВИЧ-инфицированных пациентов после начала высокоактивной антиретровирусной терапии (ВААРТ), влияние ВГС и других хронических заболеваний на качество жизни и выживаемость вызывает озабоченность (33; V.Сориано, Э. Валенсия, Ф. Лагуна и Х. Гонсалес-Лахос, Письмо, Генитурин. Med. 70: 355–356, 1994), так что Национальные институты здравоохранения рекомендовали лечение инфекции ВГС у пациентов с коинфекцией ВИЧ (23). Недавний отчет показывает, что все больше пациентов с ВИЧ умирают от печеночной недостаточности. Эти смерти не связаны с ВИЧ, так как более половины этих пациентов имеют неопределяемую РНК ВИЧ и количество Т-лимфоцитов CD4> 200 / мм 3 (B.H. McGovern, I. Bica, D.Стоун, Д. Снидман, Тез. 37-я инфекция. Дис. Soc. Am., Abstr. 205, 1999). Таким образом, необходимо лучше понять, как ВИЧ влияет на течение гепатита С и реакцию на терапию против ВГС, чтобы определить пациентов, которым терапия против ВГС принесет наибольшую пользу. У пациентов с коинфекцией ВИЧ ускоряется течение хронической инфекции HCV (12, 13, 30, 32, 35, 37, 41). В печени пациентов с коинфекцией наблюдается более выраженный фиброз и более тяжелые некровоспалительные изменения (1, 3, 5, 14, 27).Частота цирроза (5, 27, 32, 35) и декомпенсации печени (12, 22, 29, 37) выше среди пациентов с коинфекцией по сравнению с таковыми среди пациентов, инфицированных только HCV. Причина ускоренного развития ВГС на фоне ВИЧ-инфекции неизвестна, но в нескольких исследованиях сообщается, что повышенные уровни РНК ВГС обнаруживаются у пациентов с двойными инфекциями ВГС и ВИЧ (7, 13, 35, 40). В некоторых исследованиях (13, 36) более высокие уровни ферментов печени соответствуют более высоким уровням РНК HCV, предполагая, что ускоренное и более агрессивное течение инфекции HCV связано с цитопатическими эффектами более высокой вирусной нагрузки.Однако прямая связь между уровнем виремии ВГС и тяжестью заболевания печени или уровнями трансаминаз не является общепризнанной (9, 16, 18, 19, 20, 24). Кроме того, роль ВИЧ-опосредованного иммунодефицита в ускоренном развитии ВГС четко не определена. Одно исследование предполагает, что снижение количества CD4-лимфоцитов связано со снижением портального воспаления и частичного некроза (17). Напротив, другие (1, 3, 11, 29) сообщают об ухудшении гистопатологии и увеличении частоты печеночной декомпенсации со снижением количества CD4.Кроме того, некоторые исследователи сообщают об обратной корреляции между нагрузкой РНК ВГС и количеством Т-лимфоцитов CD4 (2, 11, 13, 15), тогда как другие не обнаружили такой корреляции (4, 6, 7, 26, 33, 38, 39, 40). Дополнительные потенциальные корреляты нагрузки ВГС, например, уровень аланинаминотрансферазы (АЛТ), уровень аспартатаминотрансферазы (АСТ), возраст, раса, пол, генотип ВГС, положительность поверхностного антигена гепатита В (HBsAg), продолжительность инфекции, способ заражения , и нагрузка ВИЧ, были исследованы с различными результатами (4, 8, 15, 18, 25, 36, 39, 40).Эти противоречивые данные отражают сложность понимания болезни, для которой как начальный период инфицирования часто неизвестен, так и течение которого характеризуется длительным бессимптомным периодом. Лучшее понимание патогенеза ВГС в условиях ВИЧ имеет решающее значение, поскольку мы вступаем в эру лечения инфекции ВГС у пациентов с коинфекцией ВГС и ВИЧ. Мы исследовали, имеют ли пациенты с коинфекцией ВГС и ВИЧ более высокие нагрузки ВГС, чем пациенты, не инфицированные ВИЧ, и, если да, может ли это быть коррелировано с их ослабленным иммунитетом, как измерено по количеству Т-лимфоцитов CD4 + .Мы также исследовали влияние других демографических характеристик, таких как возраст, пол и раса, на нагрузку ВГС, поскольку эти демографические факторы могут иметь значение при выявлении тех, кто должен быть нацелен на лечение против ВГС. Сбор данных о пациентах. С июня 1996 по март 2000 года в лаборатории диагностической вирусологии Центра медицинских наук при Университете штата Луизиана (LSUHSC) была оценена вирусная нагрузка РНК HCV у 1279 пациентов. определено с помощью твердофазного иммуноферментного анализа на коинфекцию ВИЧ.Скорее всего, это заниженная оценка числа пациентов с коинфекцией ВГС и ВИЧ, поскольку мы не смогли проверить ВИЧ-статус для всех образцов, протестированных на ВГС. В LSUHSC все пациенты, идентифицированные как ВИЧ-положительные, направляются в Клинику вирусных заболеваний для последующего наблюдения. Однако мы не можем определить, сколько из них не подлежат дальнейшему лечению. Образцы для испытаний были отправлены различными клиниками первичной медико-санитарной помощи в рамках системы LSUHSC. Выборка, скорее всего, относится к взрослым пациентам, поскольку дети не получают лечения от хронической инфекции ВГС.Критерии для тестирования РНК ВГС отсутствуют; тем не менее, этот тест рекомендуется для пациентов, которые, как известно, имеют антитела к ВГС. Поскольку статус антител к ВГС не мог быть подтвержден для 1251 пациента, инфицированного только ВГС, те (n = 327) с уровнями РНК ВГС ниже предела обнаружения <0,2 Мэкв (1 Мэкв составляет 10 6 эквивалентов генома) / мл, были исключены из нашего анализа. Среди пациентов в группе с коинфекцией у трех пациентов нагрузка РНК HCV была <0,2 мэкв / мл. Поскольку у этих трех пациентов было зарегистрировано наличие антител к ВГС, они были включены в анализ, и им была присвоена нулевая вирусная нагрузка.Возрастной диапазон всех пациентов, инфицированных только ВГС и с нагрузкой РНК ВГС> 0,2 мэкв / мл, составлял от 4 месяцев до 89 лет. Чтобы исключить вариации из-за возраста в нашем сравнении группы, инфицированной только HCV, с группой с коинфекцией, мы использовали подгруппу пациентов, инфицированных только HCV (n = 819), которые были в той же возрастной группе, что и пациенты с коинфекцией ( От 23 до 55 лет). Возрастные распределения в этих двух группах были нормально распределены. Статистической разницы между средним возрастом группы, инфицированной только ВГС, не было (41.2 года; стандартное отклонение — 6,8 года) и группа с коинфекцией (39,4 года; стандартное отклонение — 8,1 года). Возраст и пол всех пациентов были получены из журналов регистрации пациентов Лаборатории диагностической вирусологии. Другая информация, такая как количество CD4, уровень АЛТ, уровень AST и раса, для пациентов с коинфекцией ВГС и ВИЧ была собрана с помощью обзора диаграммы. Все 28 пациентов с коинфекцией находились под наблюдением в клинике вирусных заболеваний LSUHSC. Если было выполнено более одного анализа вирусной нагрузки, наивысшее значение было выбрано для анализа только для пациентов с положительным результатом на ВГС, поскольку более низкие значения могли быть результатом терапии против ВГС.Напротив, в группе с коинфекцией был выбран более низкий уровень РНК HCV, поскольку ни один из этих пациентов не лечился от HCV. Поступая таким образом, мы полагали, что мы склонны скорее против, чем в пользу нашей гипотезы. Во всех случаях уровни РНК HCV> 120 мэкв / мл принимают значение 120 мэкв / мл. Определение нагрузки HCV. Нагрузки РНК HCV измеряли с помощью анализа разветвленной ДНК Quantiplex (версия 2.0; Bayer Corporation, Норвуд, Массачусетс) в соответствии с инструкциями производителя. Нижний и верхний пределы обнаружения этого анализа составляли 0.2 и 120 мэкв / мл соответственно. Статистический анализ. Из-за наблюдаемой ненормальности данных о нагрузках на ВГС и количестве CD4 в нашем исследовании для анализа этих двух переменных использовались непараметрические методы. Медианы для двух групп сравнивали с помощью теста Вилкоксона. Связь между нагрузкой ВГС и количеством Т-лимфоцитов CD4 + , а также между нагрузкой ВГС и возрастом определялась с помощью коэффициента ранговой корреляции Спирмена. Поскольку преобразование log 10 нагрузки HCV, возраста и количества CD4 привело к их нормализации, коэффициенты корреляции Пирсона также были рассчитаны для определения значимой связи log 10 нагрузки РНК HCV с возрастом и log 10 количества CD4.Оба метода дали эквивалентные результаты. Ковариационный анализ рангов уровня РНК ВГС и количества CD4 был использован для оценки связи нагрузки ВГС с расой и количеством CD4 среди пациентов с коинфекцией. Для всех статистических тестов использовался уровень значимости 0,05. Чтобы проверить нашу гипотезу о том, что пациенты с коинфекцией ВГС и ВИЧ имеют более высокие уровни РНК ВГС, чем пациенты, инфицированные только ВГС, мы сравнили медианные уровни РНК ВГС для этих пациентов в нашем исследовании (Таблица 1).Средний уровень РНК HCV для пациентов с коинфекцией (17,8 мэкв / мл) был примерно в шесть раз выше, чем средний уровень для всех пациентов, инфицированных только HCV (2,8 мэкв / мл) (P <0,05). Чтобы исключить из нашего анализа любого пациента, который может не быть действительно инфицированным ВГС, мы сравнили средний уровень РНК ВГС для пациентов с коинфекцией со средним уровнем РНК ВГС для тех, кто инфицирован только ВГС и с детектируемой РНК. Средний уровень РНК HCV для пациентов с коинфекцией (17,8 мэкв / мл) был примерно в три раза выше, чем медиана для этой подгруппы пациентов, инфицированных только HCV (6.0 мэкв / мл) (P <0,05) (таблица 1). Чтобы исключить влияние возраста, мы сравнили средний уровень РНК HCV для пациентов с коинфекцией с таковым для подгруппы пациентов, которые были инфицированы только HCV и находились в той же возрастной группе, что и пациенты с коинфекцией (в возрасте от 23 до 55 лет). Мы также обнаружили в три раза большую разницу в нагрузке РНК HCV для пациентов с коинфекцией. Более высокие межквартильные диапазоны (таблица 1), отражающие изменчивость данных, уровней РНК ВГС в группе с коинфекцией, скорее всего, связаны с меньшим размером выборки. Таблица 1. Средний возраст и нагрузка ВГС для каждой группы пациентов Мы также исследовали такие факторы, как пол и возраст, как потенциальные корреляты уровня РНК ВГС. По сравнению с пациентами, инфицированными только HCV, у пациентов с коинфекцией преобладали мужчины (75 против 52-55%; Таблица 1). Средний возраст был одинаковым как для групп, инфицированных ВГС, так и для групп с коинфекцией (таблица 1). Не было обнаружено значимой корреляции между уровнем РНК ВГС и возрастом или полом в группе, инфицированной ВГС, или в группе с коинфекцией (таблица 1 и рис.1 и 2). Рис. 1. 924 пациента, инфицированных только ВГС и с определяемыми уровнями РНК ВГС (больше или равными 0,2 мэкв / мл), были разделены на возрастные группы с пятилетним шагом. Их средние уровни РНК HCV были нанесены на график для каждой возрастной группы с разбивкой по полу. Не было обнаружено значимой связи между возрастом или полом и нагрузкой ВГС. Рис. 2. Уровни РНК ВГС у пациентов с коинфекцией ВГС и ВИЧ сравнивались с их возрастом. Не было обнаружено корреляции (P = 0,2) между возрастом и нагрузкой РНК HCV. Чтобы определить потенциальные детерминанты уровней РНК ВГС у пациентов с коинфекцией, мы исследовали ее связь с уровнем AST, уровнем АЛТ, количеством Т-лимфоцитов CD4 + и расой (Таблица 2). Образцы биопсии печени для сравнения отсутствовали. Уровни АСТ и АЛТ, часто используемые в качестве маркеров заболевания печени, не имели значительной связи с нагрузкой ВГС (R = 0,3) [P = 0,1] и R = 0,14 [P = 0,5], соответственно). Количество CD4 + Т-клеток во время сбора образцов для определения нагрузки ВГС варьировалось от 6 до 1773 / мм 3 .Одиннадцать пациентов имели количество CD4> 500 / мм 3 , 8 имели количество CD4 от 200 до 500 / мм 3 и 9 имели количество CD4 <200 / мм 3 . Мы наблюдали значительную обратную зависимость между нагрузкой РНК ВГС и количеством Т-лимфоцитов CD4 + (R = -0,4 [P <0,05]), как показано на рис. 3. Таблица 2. Демографические и клинические характеристики пациентов с коинфекцией. с ВГС и ВИЧ Рис. 3. Уровни РНК ВГС у пациентов с коинфекцией ВГС и ВИЧ сравнивали с количеством CD4 + Т-клеток в периферической крови.Количество CD4 было получено одновременно с количественным определением РНК HCV. Значимая обратная зависимость (P <0,05) была обнаружена между нагрузкой HCV и количеством CD4 + Т-лимфоцитов. В дополнение к количеству CD4, раса также имела значительную связь с уровнем РНК HCV в группе с коинфекцией. Пятнадцать афроамериканцев и 13 пациентов европеоидной расы были инфицированы ВГС и ВИЧ (таблица 2). Средний уровень РНК ВГС для пациентов афроамериканского происхождения (21,2 мэкв / мл) был значительно выше, чем средний уровень РНК ВГС для пациентов европеоидной расы (10.0 мэкв / мл; Таблица 2). Большинство пациентов с коинфекцией заразились ВИЧ и гепатитом С через IVDU (16 из 28; 57%), гомосексуальные отношения с мужчинами (12 из 28; 43%) или и то, и другое (10 из 28; 36%). Равное количество афроамериканцев и европеоидов признались в IVDU и мужском гомосексуализме, и только один пациент, европеоид, был гемофиликом. Только у одного пациента, афроамериканца, был обнаруживаемый HBsAg, хотя у 12 пациентов (7 из которых были афроамериканцами) были обнаружены антитела к ядру гепатита B. Мы также исследовали, связана ли более высокая медианная нагрузка РНК HCV среди афроамериканцев с более низким количеством CD4 при первоначальном диагнозе ВИЧ-инфекции.Мы обнаружили, что среднее количество CD4 для пациентов с коинфекцией из Америки и Африки составляло 248 / мм 3 , тогда как оно составляло 554 / мм 3 для пациентов европеоидной расы (P <0,05). Однако при контроле количества CD4 разница в среднем уровне РНК HCV между двумя расовыми группами больше не является значимой при уровне P , равном 0,05, вероятно, из-за меньшего размера выборки. В исследовании, описанном в этом отчете, мы подтвердили предыдущие выводы о том, что уровни РНК ВГС у пациентов с коинфекцией ВГС и ВИЧ выше, чем у пациентов, инфицированных только ВГС (7, 13, 35, 39, 40).Как сообщают другие исследователи, этот более высокий уровень РНК HCV не коррелирует с возрастом или полом (21, 39, 40). Недавнее исследование (39) детерминант уровней РНК ВГС среди когорты IVDU обнаружило сильную корреляцию уровня РНК ВГС с возрастом для группы, инфицированной только ВГС (n = 501), но такой корреляции среди группы с коинфекцией нет (n = 468). Это несоответствие во взаимосвязи нагрузки РНК ВГС с возрастом по группам пациентов не имеет должного объяснения. В нашем исследовании мы не обнаружили корреляции между возрастом и уровнем РНК ВГС ни у моноинфицированных, ни у коинфицированных пациентов (рис.1 и 2). Мы также исследовали возможные корреляты уровня РНК HCV в нашей группе пациентов с коинфекцией. Как и другие исследователи (4, 15, 39), мы не обнаружили значимой корреляции между нагрузкой РНК HCV и уровнем AST или ALT. Мы считаем, что это связано с тем, что изменения уровней AST и ALT не коррелируют со степенью поражения печени (18). Мы, как и другие исследователи (2, 11, 13, 15), обнаружили, что уровни РНК ВГС обратно пропорциональны количеству Т-лимфоцитов CD4 + (P <0,05), что позволяет предположить, что иммунный статус действительно играет роль в контроле репликации ВГС.Приводят ли более высокая нагрузка ВГС и более низкое количество CD4 к более серьезному заболеванию печени. (1, 3, 11, 29) или менее тяжелая гистопатология печени (17) требует дальнейшего изучения, чтобы помочь прояснить механизм поражения печени у лиц с хронической инфекцией ВГС. Уникальным открытием нашего исследования является связь расы с уровнем РНК ВГС среди нашей коинфицированной популяции. Более высокий средний уровень РНК ВГС среди афроамериканских пациентов не может быть отнесен на счет способа заражения ВГС, поскольку равное количество афроамериканцев и европеоидов признались, что являются мужчинами-гомосексуалистами и наркоманами внутривенно.Хотя обнаружение HBsAg связано с более низкими уровнями РНК ВГС (39), статус инфицирования вирусом гепатита В не объясняет более высокий уровень РНК ВГС среди афроамериканцев в нашем исследовании. На основании наблюдаемой значимой отрицательной корреляции между нагрузкой ВГС и количеством CD4 мы подозреваем, что более высокие уровни РНК ВГС среди афроамериканцев, скорее всего, вторичны по сравнению с их более низким количеством CD4. Однако небольшой размер выборки не позволяет подтвердить эту связь с помощью ковариационного анализа.Основным неконтролируемым фактором является продолжительность инфекции HCV. Более низкое количество CD4 среди афроамериканских пациентов предполагает более позднюю стадию ВИЧ-инфекции и, возможно, более длительную продолжительность инфицирования ВИЧ и ВГС на момент обращения в нашу клинику. Кроме того, также могут быть неопределенные генетические и иммунологические факторы, которые приводят к различиям в контроле репликации ВГС, поскольку у афроамериканцев и европеоидов были сообщения о дифференциальных ответах на комбинированную терапию против ВГС (J.W. King, A. Shakashiro, D. R. Favrot, K. Kennedy, L. A. Balart, J. A. Kirkikis, W. E. Lyles, J. Hollier, D. Srinivas, J. Achord, Abstract, 36th Infect. Дис. Soc. Am., Abstr. 292, 1998). Мы также предполагаем, что различия в генотипах HCV могут потенциально способствовать более высокому уровню РНК HCV среди наших коинфицированных пациентов афроамериканского происхождения. Сообщалось о более высоких уровнях РНК HCV у пациентов, инфицированных штаммом генотипа 1 (4). С момента появления ВААРТ у ВИЧ-инфицированных пациентов повысилась выживаемость, но повысились показатели заболеваемости и смертности от других хронических заболеваний, таких как гепатит С.Лучшее понимание влияния коинфекции ВИЧ, детерминант повышенных уровней РНК ВГС и значения высоких уровней РНК ВГС для ускоренного течения инфекции ВГС необходимо для лучшего выявления пациентов, которым лечение против ВГС принесет наибольшую пользу. В исследовании, описанном в этом отчете, мы показали, что количество CD4 + Т-клеток и раса, но не возраст или пол, являются важными детерминантами нагрузки РНК HCV. В свете недавних сообщений, предполагающих, что ВААРТ приводит к временному обострению инфекции ВГС (28, 31), также необходима дальнейшая оценка влияния ВААРТ на течение инфекции ВГС и ответ на лечение инфекции ВГС.Дальнейшее внимание следует сосредоточить на расовых различиях в преобладании генотипа ВГС, течении инфекции ВГС и ответах на терапию против ВГС.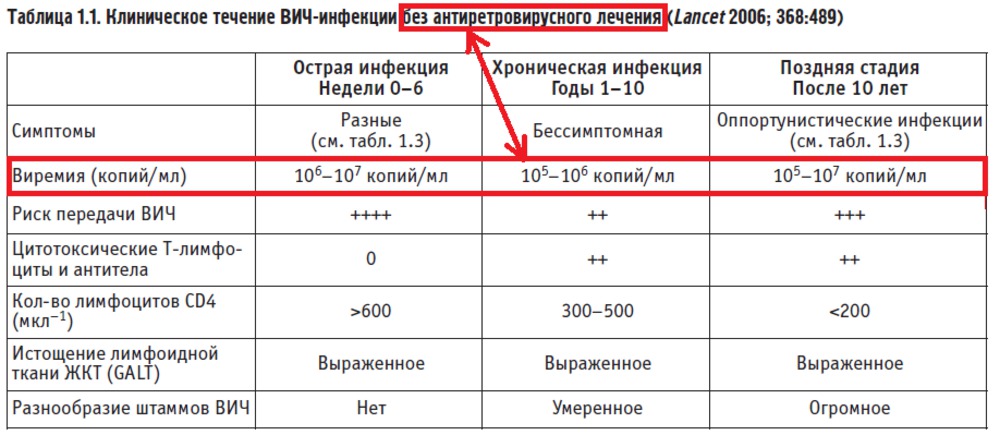 8 МЕ/мл.
8 МЕ/мл.
Обращаем внимание, что сроки выполнения ПЦР-исследований могут быть увеличены при проведении подтверждающих тестов.Возможности использования Ингарона в лечении больных хроническим гепатитом С
Возможности использования Ингарона в лечении больных хроническим гепатитом С
Т.В. Сологуб, доктор медицинских наук; М.Г. Романцов, доктор медицинских наук; Е.В. Эсауленко, доктор медицинских наук; И.В. Волчек, кандидат медицинских наук
Традиционно для лечения больных хроническим гепатитом С (ХГС) применяются ИФН-а., так
называемые интерфероны первого тина. Вместе с тем, по данным различных авторов, в режиме моно-герапии интерферонами полный ответ удается получить лишь у 15-16%, а при комбинации с химиопре-паратами — у 40-55% пациентов [1]. Более того, длительное использование ИФН первого типа сопровождается формированием у 40% больных резистентных штаммов вируса, что делает терапию практически неэффективной.
С 2001 г. в России широко используются пролонгированные (пегилированные) ИФН, которые более удобны в применении, а по Эффективности превосходит короткоживущие аналоги. Однако применение даже этих чрезвычайно дорогих и высокоэффективных препаратов в ряде случаев не позволяет добиться полной элиминации возбудители из организма. К тому же их использование сопровождается формированием нежелательных побочных реакций, которые максимально выражены при использовании комбинаций ИФН и Рибавирина.
Нежелательные побочные реакции не только ухудшают качество жизни пациента, по и формируют состояния, которые порой делают невозможным выполнение обычных функциональных обязанностей, что сопряжено с дополнительными сложностями и затрудняют продолжение терапии. В этой связи приоритетной задачей ученых всего мира является поиск новых, наиболее эффективных и безопасных препаратов, которые не имели бы столь выраженных побочных эффектов.
В настоящее время не существует препаратов и схем для лечения больных ХГС, которые могли бы быть признаны абсолютно эффективными, приводящими к достижению 100% гарантированного стойкого вирусологического ответа. Поэтому появление на фармацевтическом рынке препаратов с принципиально иным механизмом действия открывает новые перспективы в лечении этого далеко не простого, но, к сожалению, широко распространенного заболевания.
Перспективной в данном аспекте представляется разработка отечественными авторами нового рекомбинантного ИФН-у под названием Ингарон, который прошел широкие клинические испытания, хорошо зарекомендовал себя как препарат выбора при лечении больных гриппом, ВИЧ-инфекцией и туберкулезом легких, гепатитом [2. 3].
Препарат Ингарон является ИФН 2-го типа, который не только зарегистрирован и разрешен к применению при лечении онкологических больных, пациентов с этиологически различными формами вирусных гепатитов, но и включен в стандарты лечения больных гриппом, вирусными гепатитами, туберкулезом легких, ВИЧ-инфекцией и больных с онкологической патологией.
В зарубежной литературе имеются сведения о применении препаратов ИФН-у при лечении вирусных инфекций, в том числе хронических вирусных гепатитов [4-6|, ВИЧ-инфекции и ее осложнений. Так, в 1989 г. Н. С. Lane и соавт. [7] провели клиническое испытание по определению эффективности использования различных доз (от 0.001 до 1 мг/м2) рекомбинантного ИФН-у у больных ВИЧ-инфекцией с саркомой Капоши.
Исследования показали, что на фоне терапии у пациентов возникает лейкопения (со снижением уровня как гранулоцитов, так и лимфоцитов), а также развиваются нежелательные явления в виде гриппоподобного синдрома, тошноты и рвоты.
В следующем году W. Неаgу и соавт. [8] применили у больных ВИЧ-инфекцией, осложненной развитием саркомы Капоши, новый высокоочищенный препарат рекомбинантного ИФН-у. Препарат вводился внутривенно 2 раза в неделю в течение 8 недель в дозе 0. 03-3 мг/м2. Исследователи не отмечали выраженной токсичности препарата. У 3 из 17 пациентов, получавших препарат в дозе Змг/м2, отмечалось обратное развитие опухоли.
03-3 мг/м2. Исследователи не отмечали выраженной токсичности препарата. У 3 из 17 пациентов, получавших препарат в дозе Змг/м2, отмечалось обратное развитие опухоли.
В 2001 г. в ходе клинического исследования рекомбинантного ИФН-у (III фаза) L. А. Riddell и соавт. отмечали эффективность препарата в отношении снижения риска оппортунистических инфекций у пациентов с ВИЧ-инфекцией (кандидоз, простой герпес, ЦМВ), а также в отношении трехлетней выживаемости пациентов.
Отечественный человеческий ИФН-у — препарат Ингарон — получен микробиологическим синтезом в рекомбинантном штамме Escherichia coli и очищен колоночной хроматографией. Удельная противовирусная активность на клетках (фибробласты человека), инфицированных вирусом везикулярного стоматита, составляет 2 • 107 ЕД на мг белка. В эксперименте доказана высокая его противовирусная активность в отношении вируса гриппа Н5N1.
Проведенные в НИИ гриппа РАМН и НИИЭМ им. Н. Ф. Гамалеи исследования (Ф. И. Ершов, О. И. Киселев) позволили заключить, что препарат Ингарон обладает выраженной противовирусной активностью в отношении РНК-содержащих вирусов. Данная предпосылка и послужила основанием для выполнения настоящего исследования.
Целью работы являлось изучение терапевтической эффективности и безопасности препарата Ингарон в комплексной противовирусной терапии больных хроническим гепатитом С.
У всех пациентов на момент включения в исследование присутствовали серологические маркеры вируса гепатита С (положительная реакция при иммуноферментном определении (ELISA) суммарных антител к ВНС), определялась РНК ВГС в сыворотке крови, отмечалось повышение активности АлАТ в сыворотке крови в 1,5-2 и более раз (табл. 1, 2), уровень ТТГ и антител к тиреоглобулину соответствовали нормальным показателям.
Все больные были разделены на 4 группы, по 50 человек в каждой. Каждая группа пациентов получала ту или иную схему терапии, которая определялась методом случайной выборки.
1-я группа пациентов получала Ингарон внутримышечно в дозе 500 000 МЕ через день 3 раза в неделю в сочетании с ИФН-а (Альфарона), который вводился внутримышечно в дозе 3 000 000 МЕ в дни введения Ингарона.
2-я группа больных получала препарат Ингарон в дозе 500 000 МЕ внутримышечно и ИФН-а (Альфарона) в дозе 3 000 000 МЕ внутримышечно ежедневно.
3-я группа пациентов получала 3 раза в неделю препараты Ингарон по 500 000 МЕ, ИФН-а (Альфарона) по 3 000 000 МЕ и ежедневно — Рибамидил, доза которого зависела от массы тела больного.
4-я группа больных получала препараты через день: Ингарон внутримышечно в дозе 500 000 МЕ и 4,0 мл 12,5% раствора Циклоферона внутримышечно.
Включение в одну из схем лечения иммуномодулятора с противовирусной активностью Циклоферона базировалось на многочисленных исследованиях, в результате которых установлено, что этот препарат не только обладает противовирусной активностью, но и стимулирует продукцию ИФН-у, следовательно, сочетанное использование этих препаратов теоретически оправданно.
Длительность лечения составила 90 дней. Препараты вводились в одно и то же время суток, лиофилизированный порошок интерферонов растворялся в 2,0 мл бидистиллированной воды.
Все больные, независимо от группы, во время исследования в соответствии с графиком, были обследованы клинически, биохимически и вирусологически. Перед стартом и в конце терапии у всех пациентов методом количественного анализа в сыворотке крови исследовалась РНК ВГС. Оценка переносимости препаратов производилась исследователем на основании анализа дневника наблюдения и жалоб пациента, а эффективность — на основании использования трех показателей:
1. Положительный эффект — нормализация показателя АлАТ, уменьшение уровня РНК ВГС в сыворотке крови более чем на 2lg и отсутствие клинической симптоматики заболевания.
2.Отсутствие эффекта — уровень активности АлАТ сохранялся выше нормальных значений, в сыворотке крови определялась РНК ВГС.
3.Частичный эффект — происходила нормализация одного из оцениваемых показателей.
Проведенное фено-генотипирование позволило установить однотипность распределения больных по генотипам в изучаемых группах.
При определении вирусной нагрузки установлено, что она колебалась от 360 000 до 1 500 000 МЕ. Средние значения показателей вирусной нагрузки у больных различных групп до начала терапии приведены в табл. 1.
Таким образом, группы пациентов, включенных в исследование, не различались по возрасту, полу, активности трансаминаз, уровню вирусной нагрузки и были сопоставимы по количеству пациентов с генотипом 1. Если активность АлАТ до начала терапии у пациентов всех групп превышала значения у здоро¬вых лиц в 2-5 раз, то уровень билирубина мало отличался от нормальных значений и был максимальным у пациентов 1-й группы. Грубых нарушений белковоинтетической функции печени не было выявлено ни у одного из обследуемых, не было и нарушений в системе свертывания крови.
Оценка эффективности и безопасности включала в себя выявление нежелательных побочных эффектов, которые могли быть связаны с приемом препаратов. Как показали исследования, нежелательные побочные явления в виде гриппоподобного синдрома, умеренной депрессивной реакции, бессонницы, диспепсических расстройств чаше наблюдались у пациентов 3-й группы и практически отсутствовали у больных 4-й группы.
У больных, получавших ИФН-a и ИФН-у в режиме ежедневного введения, нежелательные явления регистрировались только в первые 2-3 дня терапии, а их интенсивность была не столь выраженной и менее продолжительной. У больных 1-й группы максимальная выраженность побочного действия препаратов наблюдалась после двухдневного перерыва (суббота и воскресенье).
Следует отметить, что нежелательные побочные реакции, как правило, были кратковременными и не требовали серьезной медикаментозной коррекции.
Выраженные побочные реакции имели месте лишь у больных, получавших Рибамидил. Так, у одного пациента наблюдалась сильная головная боль, которая сохранялась в течение всего периода терапии; у трех больных отмечались кожный зуд, сухость кожиого покрова, полиморфная сыпь на коже. Вместе с тем никто из пациентов 4-й группы в период терапии не предъявлял существенных жалоб на нарушение самочувствия. Напротив, больше половины больных отметили значительное улучшение общего самочувствия уже после 3-4 инъекций.
Ежемесячное изучение динамики биохимических показателей позволило установить, что через месяц от начала терапии у абсолютного большинства больных всех групп происходила нормализация активности АлАТ и уровня билирубина. Повышения уровня глюкозы в крови не было зарегистрирована ни.у одного пациента (табл. 2).
При анализе динамики вирусной нагрузки (до лечения и через 3 месяца от начала лечения) установлено, что ее уровень у абсолютного большинства больных снижался независимо от варианта терапевтического режима. Однако выявлен различный уровень снижения вирусной нагрузки в сравниваемых группах.
При анализе средних величин показателя вирусной нагрузки установлено, что у пациентов 1-й и 3-й групп в среднем показатель вирусной нагрузки был ниже, чем у больных 2-й и 4-й групп,
К окончанию курса терапии РНК ВГС в сыворотке крови не определилась (<1000 МЕ в мл) у 96% пациентов 3-й группы, 56% пациентов 4-й группы. 34% пациентов 1-й группы и 26% пациентов 2-й группы (табл. 3).
Тройная схема лечения, включающая ИФН-a, ИФН-у и Рибамидил, имела существенные преимущества, так как после терапии только у двух больных в сыворотке крови по-прежнему определялся вирус гепатита С.
Достаточно эффективной оказалась схема лечения, включающая ИФН-у и Циклоферон. При ее применении практически не наблюдалось нежелательных побочных эффектов, более того, данное сочетание позитивно сказывалось иа качестве жизни больных и повышало резистентность в отношении острых респираторных вирусов.
Таким образом, выполненное исследование пс определению оптимальной схемы лечения больных ХГС позволило прийти к выводу о целесообразности включения препарата Ингарон в терапию этих пациентов. Использование даже короткого 3-месячного курса лечения сопровождалось снижением вирусной нагрузки до неопределяемого уровня у большинства больных.
Вместе с тем установлено, что ежедневное использование ИФН-а и ИФН-у не имело преимуществ перед стандартным способом введения, так как эффективность терапии у пациентов данной группы не только не повышалась, но даже были несколько ниже, чем у аналогичной группы больных, получавших препарат через день.
Пример 1. Больной Н., 29 лет, 54 кг, ХГС Зг вирусная нагрузка 1,0-10*6МЕ. Получал лечени Интроном А в дозе 3 млн МЕ в комбинации с Ингароном 500 000 МЕ 3 раза в неделю в течение 2 месяцев, вирусная нагрузка снизилась, но ПЦР ВГС оставалась положительной.
Пациенту было назначено лечение Интроном А в дозе 3 млн МЕ в комбинации с Рибамидилом в течение 1,5 месяцев, после чего вирусная нагрузка СНОЕ повысилась до 1,0 • 10*6МЕ.
Больной был протестирован на чувствител: ность к противовирусным препаратам в разных доза и в разных комбинациях по методу, описанному нам ранее [9, 10]. Как видно на рис. 1, больной был нечуствителен ко всем противовирусным препаратам, за исключением Интрона А в дозе 1 млн МЕ. При этом отмечалась высокая чувствительность к комбинациям, включающим Ингарон: ПегИнтрон 100 мкг + Ингарон 500 000 МЕ, Интрон А 3 млн МЕ + Рибамидил 800 мг + Ингарон 500 000 МЕ, и некоторым другим (рис. 2).
На основании этих данных пациенту были последовательно назначены комбинации, включающие Ингарон, в результате чего достигнута стабильная ремиссия хронического гепатита С, которая продолжается более 9 месяцев.
Пример 2. Больной Г., 45 лет, 68 кг. ХГС 1Ь,
вирусная нагрузка 1,5 • 10*6МЕ. До проведения исследования безуспешно лечился препаратами интерферонов, в том числе в сочетании с Рибавирином. Больной был также протестирован на чувствительность к противовирусным препаратам в разных дозах и в разных комбинациях (табл. 4).
Наряду с отрицательной реакцией на исследованные препараты ИФН-а (Интрон А. Интераль), отмечалась положительная реакция на ПегИнтрон и комбинации с Ингароном.
Перспективным представляется также определ ние индивидуальной чувствительности больных хроническим гепатитом С к комбинированной терапии с использованием Ингарона с целью повышения эс фективности лечения данного заболевания и снижения частоты возникновения побочных эффектов.
Что это может вам сказать?
Тесты на вирусную нагрузку
Чтение результатов
Продолжение
Продолжение
Вирусные нагрузки во время лечения
Продолжение
Что такое вирусная нагрузка при гепатите С?
Почему важна вирусная нагрузка
Высокая и низкая вирусная нагрузка
Неопределяемая вирусная нагрузка
Слово Verywell
Руководство для обсуждения с врачом по гепатиту С
Сравнение вирусной нагрузки гепатита С у пациентов с коинфекцией или без нее с разными генотипами
Алехандро Шиджман
Родни Колина 9 0085
Сергей Мукомолов
Ольга Калинина
Лаура Гарсия
Shobha Broor
Ajoy Varma Bhupatiraju
Peter Karayiannis
Кристина Могдаси
Хуан Кристина
Очень низкая вирусная нагрузка гепатита С у лиц, не получавших лечение: ставят ли они под угрозу тестирование антигена вируса гепатита С?
Фон:
Методы:
Полученные результаты:
Выводы:
Ключевые слова:
Измерение вирусной нагрузки у лиц, инфицированных вирусом гепатита С: о Европейской ассоциации по изучению рекомендаций по лечению гепатита С для печени, 2018
ПИСЬМО
Тестирование на антитела к вирусу гепатита С и РНК
Вопрос 1. Где я могу найти последние рекомендации по ведению ВГС?
Вопрос 2. Для кого рекомендуется скрининг на ВГС?
Вопрос 3. Для кого рекомендуется тестирование на ВГС (выявление случаев)?
Вопрос 4. Каков алгоритм диагностики ВГС, рекомендованный CDC?
Вопрос 5.Как вы интерпретируете результаты «реактивные» антитела к ВГС и «не обнаруженные» РНК ВГС?
Вопрос 6. Возможно ли иметь инфекцию ВГС и получить нереактивный результат теста на антитела к ВГС?
Вопрос 7. Какая часть образцов с реактивными антителами к ВГС содержит РНК ВГС при рефлекторном тестировании того же образца?
Вопрос 8. Что означают следующие результаты РНК HCV: «
Вопрос 9. Почему результаты по РНК HCV указываются в МЕ / мл? Что означает log МЕ / мл?
Вопрос 10.Я лечу своего пациента, инфицированного ВГС, противовирусными препаратами прямого действия. У пациента обнаруживается низкий уровень РНК HCV до завершения лечения. Как мне интерпретировать эти результаты и что будет лучшим следующим шагом для тестирования?
www.uspreventiveservicestaskforce.org/Page/Document/RecommendationStatementFinal/hepatitis-c-screening. Сравнение вирусной нагрузки гепатита С у пациентов с вирусом иммунодефицита человека или без него
РЕЗЮМЕ
МАТЕРИАЛЫ И МЕТОДЫ
РЕЗУЛЬТАТЫ
ОБСУЖДЕНИЕ


